Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Поддержание нормальной организации тканей
Обновление с помощью плюрипотентных стволовых клеток. Пример: образование клеток крови
Кровь содержит много типов клеток, выполняющих совершенно различные функции - от транспорта кислорода до выработки антител. Некоторые из этих клеток функционируют исключительно в пределах кровеносной системы, а другие используют ее только для транспорта, а свои функции выполняют в других местах. Однако жизненный цикл всех клеток крови до некоторой степени сходен. У всех у них время существования ограниченно, и они непрерывно образуются в течение всей жизни животного. И наконец, что весьма примечательно, все они восходят к одному и тому же типу стволовых клеток костного мозга. Таким образом, эта гемопоэтическая, или кроветворная, стволовая клетка плюрипотентна, т.е. дает начало всем видам терминально дифференцированных клеток крови.
Клетки крови (рис. 17-26) можно разделить на красные и белые-эритроциты и лейкоциты. Эритроциты остаются в пределах кровеносных сосудов и переносят О2 и СО2, связанные с гемоглобином. Лейкоциты борются с инфекцией, а также поглощают и переваривают остатки разрушенных клеток и т. п., выходя для этого через стенки небольших кровеносных сосудов в ткани. Кроме того, в крови в большом количестве содержатся тромбоциты, представляющие собой не обычные целые клетки, а мелкие клеточные фрагменты, или «мини-клетки», отделившиеся от кортикальной цитоплазмы крупных клеток, называемых мегакариоцитами. Тромбоциты специфически прилипают к эндотелиальной выстилке поврежденных кровеносных сосудов, где помогают восстанавливать их стенку и участвуют в процессе свертывания крови.
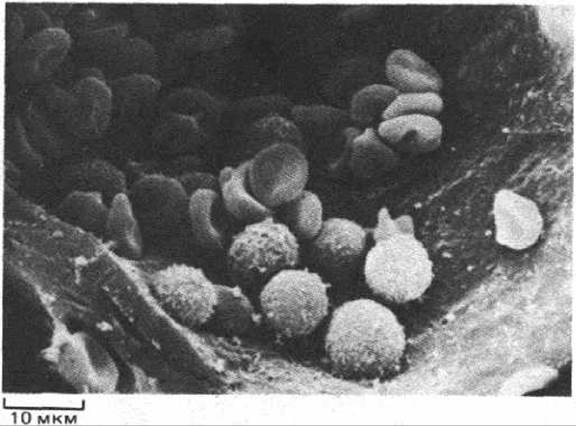
Рис. 17-26. Клетки крови млекопитающего в малом кровеносном сосуде (микрофотография, полученная с помощью сканирующего электронного микроскопа). Более крупные, почти шарообразные клетки с шероховатой поверхностью - это лейкоциты, а клетки меньшей величины, более гладкие и уплощенные - эритроциты. (R. G. Kessel, R. H. Kardon, Tissues and Organs: A Text-Atlas of Scanning Electron Microscopy. San Francisco: Freeman, 1979.)
17.5.1. Существуют три категории лейкоцитов: гранулоциты, моноциты и лимфоциты [23, 24]
В то время как каждый эритроцит похож на всякий другой эритроцит, а тромбоцит - на другой тромбоцит, лейкоциты делятся на ряд различных классов. На основе морфологических особенностей, видимых в световой микроскоп, их традиционно подразделяют на три главные группы: гранулоциты, моноциты и лимфоциты.
Все гранулоциты содержат многочисленные лизосомы и секреторные пагоцитов содержат специализированные органеллы, которые сливаются с новообразованными фагоцитозными пузырьками (фагосомами) и атакуют поглощенные микроорганизмы с помощью высокореактивных молекул супероксида (О-2) и гипохлорита (НОСl; это действующий компонент отбеливателей), а также концентрированной смеси лизосомных гидролаз. Маузырьки, или гранулы, и получили свои названия за различный характер окрашивания этих гранул (рис. 17-27). Различие в окрашивании отражает важные химические и функциональные особенности. Нейтрофилы (называемые также полиморфно ядерными лейкоцитами из-за многодольчатых ядер), самые многочисленные из гранулоцитов, захватывают, убивают и переваривают микроскопические организмы, в особенности бактерии. Базофилы выделяют гистамин (а у некоторых животных серотонин), который участвует в воспалительных реакциях. Эозинофилы помогают в разрушении паразитов и влияют на аллергические реакции.
Моноциты, выходя из кровяного русла (рис. 17-27, Г), становятся макрофагами, которые наряду с нейтрофилами являются главными «профессиональными фагоцитами» (разд. 6.5.14). Оба типа фкрофаги, однако, значительно больше по размерам и дольше живут, чем нейтрофилы, а к тому же обладают уникальной способностью переваривать крупные микроорганизмы, такие как простейшие.
Лимфоциты участвуют в иммунном ответе и представлены двумя главными классами: В-лимфоциты производят антитела, а Т-лимфоциты убивают клетки, инфицированные вирусом, и регулируют активность других лейкоцитов (см. гл. 18). Кроме того, существуют лимфоцитоподобные клетки, называемые природными киллерами, способные убивать некоторые виды опухолевых и инфицированных вирусом клеток. Образование лимфоцитов - это особая тема, которая будет подробно обсуждаться в гл. 18. Здесь мы будем рассматривать в основном развитие других клеток крови, часто объединяемых под названием миелоидных клеток.
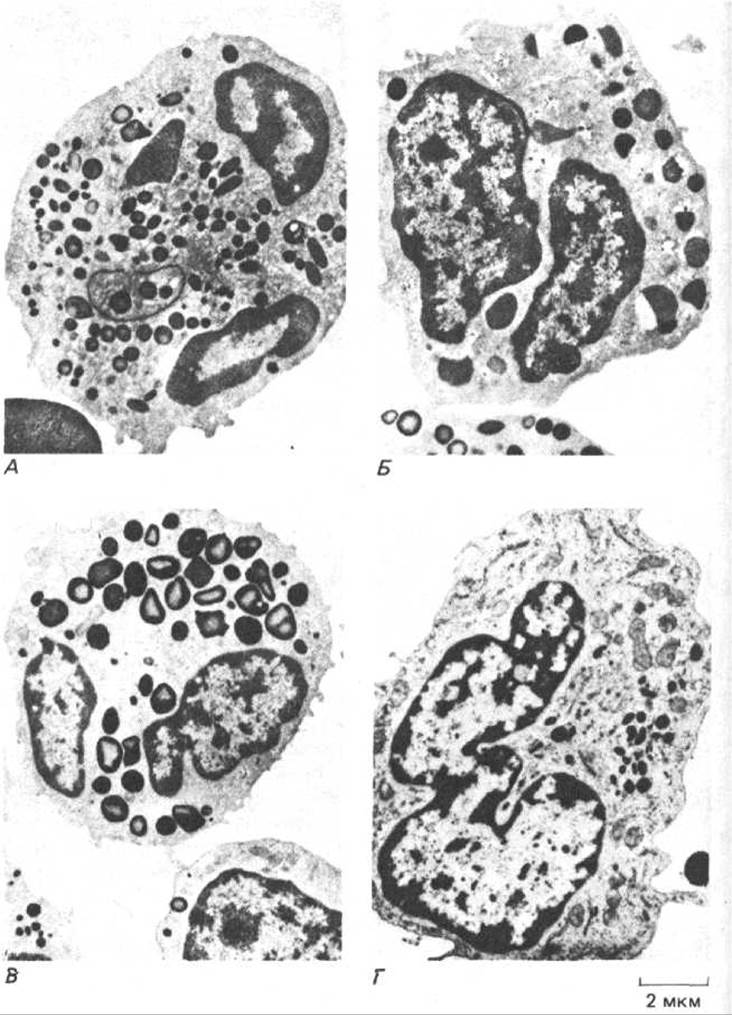
Рис. 17-27. Электронные микрофотографии лейкоцитов четырех типов: А-нейтрофил; Б-базофил; В-эозинофил; Г-моноцит. Электронные микрофотографии лимфоцитов представлены на рис. 18-4. Клетки каждого типа выполняют особую функцию, что отражается в различиях их секреторных гранул и лизосом. В каждой клетке только по одному ядру, но оно имеет неправильную дольчатую форму, так что на фото А, Б и В места соединения долей не попали в плоскость среза. (С любезного разрешения Dorothy Bainton.)
Различные типы кровяных клеток и их функции приведены в табл. 17-1.
Таблица 17-1. Клетки крови
|
Тип клетки |
Главные функции |
Обычное содержание в крови человека (в 1 л) |
|
Эритроциты Лейкоциты |
Транспортируют О2 и СО2 |
5-1012 |
|
Гранулоцити |
||
|
Нейтрофилы (полиморфноядерные лейкоциты |
Фагоцитируют и разрушают внедрившиеся бактерии |
5-109 |
|
Эозинофилы |
Разрушают более крупные паразитические организмы и влияют на аллергические воспалительные реакции |
2-108 |
|
Базофилы |
Выделяют гистамин и серотонин при некоторых иммунных реакциях |
4-107 |
|
Моноцити |
Становятся макрофагами в тканях, где фагоцитируют и переваривают внедрившиеся бактерии, инородные тела и стареющие клетки |
4-108 |
|
Лимфоциты |
||
|
В-клетки |
Вырабатывают антитела |
2-109 |
|
Т-клетки |
Убивают клетки, инфицированные вирусом, и регулируют активность других лейкоцитов |
1-109 |
|
Клетки-киллеры (NK - клетки) |
Убивают клетки, инфицированные вирусом, и клетки некоторых опухолей |
1-108 |
|
Тромбоциты (фрагменты клеток, образующиеся в костном мозге из мегакариоцитов) |
Инициируют свертывание крови |
3-1011 |
17.5.2. Образование каждого типа клеток в костном мозге регулируется отдельно [23, 25]
Большинство лейкоцитов функционирует не в крови, а в других тканях, а кровь просто переносит их туда, где они нужны. Местная инфекция или повреждение любой ткани, например, быстро привлекает лейкоциты, и это составляет часть воспалительной реакции, помогающей в борьбе с инфекцией при заживлении раны. Воспалительная реакция - сложный процесс, в котором участвуют разнообразные сигнальные молекулы, выделяемые местными тучными клетками, нервными окончаниями, тромбоцитами и лейкоцитами, а также комплемент (разд. 18.5). Некоторые из этих сигнальных молекул воздействуют на ближайшие капилляры таким образом, что адгезия между эндотелиальными клетками уменьшается, но зато их поверхность становится более адгезивной для передвигающихся рядом лейкоцитов. Так лейкоциты ловятся, как мухи на липкую бумагу, а затем могут выйти из сосуда, протискиваясь между эндотелиальными клетками и «проедая» путь через базальную мембрану с помощью переваривающих ферментов. Другие молекулы действуют как хемоаттрактанты для определенных видов лейкоцитов; под их воздействием эти клетки поляризуются и начинают ползти по направлению к источнику аттрактанта. В результате большое количество лейкоцитов переходит в пораженную ткань (рис. 17-28).
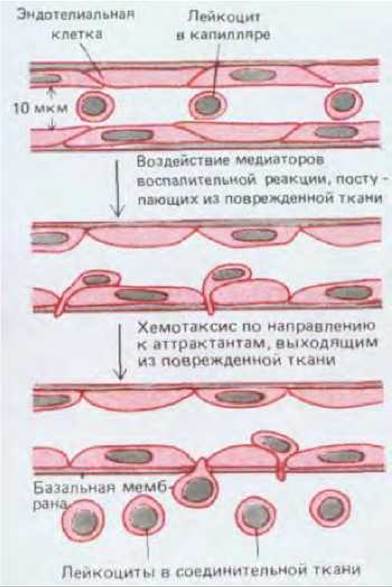
Рис. 17-28. Миграция лейкоцитов из кровотока в поврежденную или инфицированную ткань при воспалительной реакции. Эту реакцию запускают различные сигнальные молекулы, локально выделяемые клетками (главным образом в соединительной ткани) или образующиеся при активации комплемента. Некоторые из таких медиаторов воздействуют на эндотелиальные клетки капилляров, ослабляя их соединение с соседними клетками, в результате чего капилляры становятся более проницаемыми. Изменение поверхности эндотелиальных клеток ведет также к прилипанию крови. Другие медиаторы действуют как хемоаттрактанты, заставляя связавшиеся лейкоциты пробираться между эндотелиальными клетками капилляров в ткань.
Другие сигнальные молекулы, образовавшиеся в ходе воспалительной реакции, уходят в кровь и побуждают костный мозг к усиленной выработке лейкоцитов и их выбросу в кровяное русло. Костный мозг служит главной мишенью для такой регуляции, так как у взрослых млекопитающих клетки крови, за исключением лимфоцитов и некоторых макрофагов, образуются только в костном мозге. Эта регуляция более или менее специфична в отношении клеток определенного типа: например, некоторые бактериальные инфекции приводят к избирательному увеличению числа нейтрофилов, а заражение простейшими и другими паразитами - к накоплению эозинофилов (именно поэтому врачи обычно используют подсчет лейкоцитов разного типа при диагностике инфекционных и иных воспалительных заболеваний).
В других случаях избирательно возрастает число эритроцитов, как, например, у человека в условиях больших высот, где кислорода недостаточно. Таким образом, образование кровяных клеток (гемопоэз) по необходимости подвергается сложному контролю, при котором количество клеток каждого типа регулируется индивидуально, в соответствии с меняющимися потребностями. Понять, как работают эти регуляторные механизмы - задача огромной важности для медицины.
У интактных животных гемопоэз изучать труднее, чем превращения клеток таких тканей, как эпидермис. В эпидермисе существует простая, регулярная пространственная организация, при которой легко следить за процессом обновления и находить стволовые клетки. В кроветворных тканях это не так просто. Но, с другой стороны, кроветворные клетки живут как кочевники, и это делает их удобным объектом для экспериментов иного рода. Диспергированные кроветворные клетки можно легко, не повреждая их, переносить из одного организма в другой; кроме того, пролиферацию и дифференцировку отдельных клеток и их потомства можно наблюдать и изучать в условиях культуры. По этой причине о молекулах, регулирующих образование клеток крови, известно больше, чем об аналогичных регуляторных молекулах в других тканях млекопитающих. Но и о клетках крови эти знания еще весьма недостаточны.
17.5.3. Костный мозг содержит кроветворные стволовые клетки [23, 26]
Различные типы кровяных клеток и их ближайших предшественников в костном мозге можно узнать по внешнему виду (рис. 17-29). Они перемешаны друг с другом, а также с жировыми клетками и фибробластами, образующими нежную опорную сеть коллагеновых волокон и другие компоненты внеклеточного матрикса. Кроме того, вся ткань пронизана тонкостенными кровеносными сосудами (кровяными синусами), в которые переходят новообразованные клетки крови. Имеются также мегакариоциты; в отличие от других кровяных клеток они остаются в костном мозге и после созревания, составляя одну из самых заметных гистологических особенностей этой ткани; они необычайно велики (до 60 мкм в диаметре) и имеют высокополиплоидное ядро. В нормальных условиях мегакариоциты облепляют стенки кровяных синусов и протягивают свои отростки сквозь отверстия в их эндотелиальной выстилке; от этих отростков отделяются тромбоциты, которые затем уносит кровь (рис. 17-30).
Отсутствие видимой упорядоченности в расположении различных клеток костного мозга затрудняет идентификацию каких-либо предшественников зрелых кровяных клеток, кроме самых ближайших. На очень ранних стадиях развития, когда явная дифференцировка еще не началась, все клетки-предшественницы внешне весьма сходны между собой, а у первичных стволовых клеток вообще нет видимых признаков, по которым их можно было бы распознать. Чтобы идентифицировать и охарактеризовать стволовые клетки, нужен функциональный тест, позволяющий прослеживать судьбу потомства отдельных клеток. Как мы увидим, с этой целью можно просто изучать колонии, образуемые отдельными клетками в культуре. В случае кроветворной системы, однако, такие клеточные клоны можно распознавать и в интактном животном.
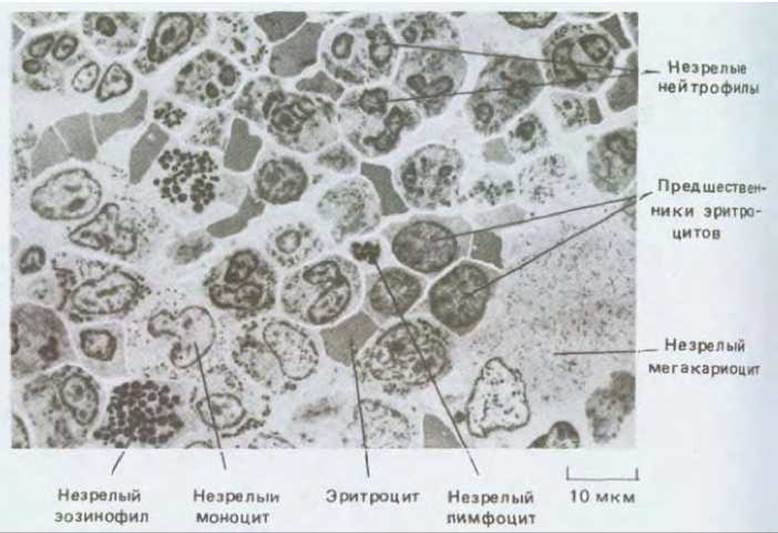
Рис. 17-29. Срез участка костного мозга (электронная микрофотография при небольшом увеличении). Эта ткань - главный источник новых клеток крови (кроме Т-лимфоцитов). Обратите внимание на то, что незрелые клетки крови определенного типа имеют тенденцию собираться «семейными группами». (J.A.G. Rhodin, Histology: A Text and Atlas. New York: Oxford Univ. Press, 1974.)
Если животное подвергнуть рентгеновскому облучению в большой дозе, кроветворные клетки у него будут разрушены, и через несколько дней оно погибнет из-за неспособности организма восполнять утрату клеток крови. Облученное животное можно, однако, спасти путем инъекции клеток, взятых из костного мозга здорового иммунологически совместимого донора. Среди этих клеток, очевидно, есть такие, которые смогут образовать колонии в организме облученного реципиента и таким образом снабдить его кроветворной тканью. Такие колонии развиваются, в частности, в селезенке; она служит у нормальных мышей важным дополнительным очагом кроветворения. Если исследовать селезенку облученной мыши через неделю или две после введения клеток от здорового донора, в ней можно увидеть обособленные узелки, каждый из которых содержит колонию миелоидных клеток (рис. 17-31); через две недели в некоторых колониях может быть больше миллиона клеток. Раздельность узелков позволяет предполагать, что каждый из них, подобно колонии бактерий на культуральной чашке, образован клоном, происходящим от одной исходной клетки, и это подтверждают эксперименты с использованием генетических маркеров.
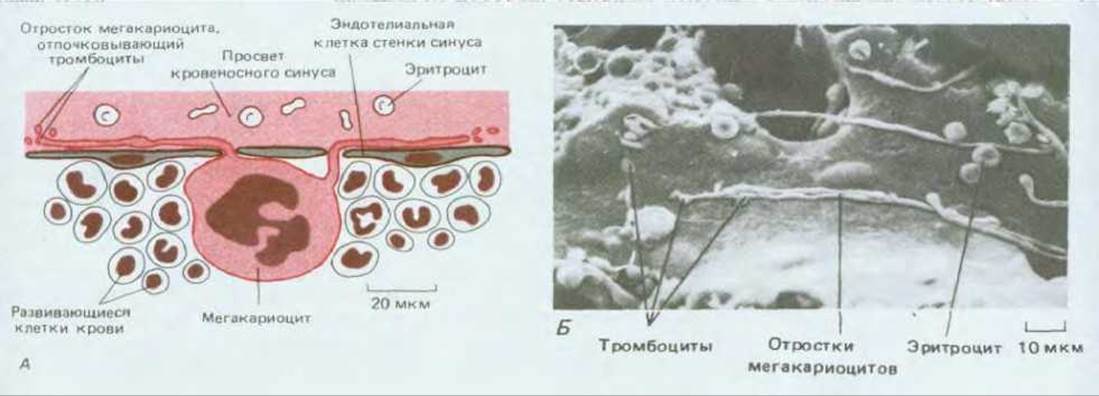
Рис. 17-30. А. Мегакариоцит среди других клеток в костном мозге (схема). Огромные размеры мегакариоцита связаны с тем, что он имеет высокополиплоидное ядро. Один мегакариоцит образует около 10000 тромбоцитов, отщепляющихся от длинных отростков, которые проходят через отверстия в стенках соседних кровеносных синусов. Б. Внутренность такого синуса в костном мозге (микрофотография, полученная с помощью сканирующего электронного микроскопа). Видны отростки мегакариоцитов. (Б - из R. G. Kessel, R.H. Kardon, Tissues and Organs: A Text-Atlas of Scanning Electron Microscopy. San Francisco: Freeman, 1979.)
Клетку - родоначальницу такой колонии называют колониеобразующей единицей (КОЕ). Колониеобразующие клетки гетерогенны. Одни дают начало только одному типу миелоидных клеток, а другие - нескольким типам. Некоторые клетки проходят много циклов деления и образуют большие колонии, тогда как другие меньше делятся и образуют маленькие колонии. Большинство колоний гибнет, произведя какое-то ограниченное количество терминально дифференцированных кровяных клеток. Однако встречаются также колонии, способные к интенсивному самообновлению, и они производят наряду с терминально дифференцированными клетками крови новые колониеобразующие клетки. Как полагают, родоначальницами таких самообновляющихся колоний являются стволовые кроветворные клетки из пересаженного костного мозга.
17.5.4. Плюрипотентная стволовая клетка дает начало всем классам клеток крови [27]
Зачастую в одной селезеночной колонии, образовавшейся из одной стволовой клетки, можно найти миелоидные клетки всех типов. Таким образом, кроветворная стволовая клетка плюрипотентна: она может давать начало многим различающимся типам клеток. Хотя селезеночные колонии, по-видимому, не содержат лимфоцитов, другие эксперименты показывают, что и лимфоциты происходят от той же самой стволовой клетки, которая порождает все миелоидные клетки. Это эксперименты с генетическими маркерами, с помощью которых можно идентифицировать клетки одного клона даже после их выхода в кровяное русло. Было использовано несколько клональных маркеров, но лучшими оказались специально сконструированные ретровирусы. Маркерный вирус, как и все ретровирусы, может включить свой геном в хромосому инфицируемой клетки, но у него удалены гены, необходимые для образования инфекционных вирусных частиц. Поэтому маркер присутствует только в колонии клеток, которые были первоначально инфицированы. Потомство одной из таких клеток отличается от потомства другой только тем, что у них различны хромосомные сайты интеграции вируса. Для анализа потомства кроветворных клеток сначала инфицируют клетки костного мозга ретровирусом (разд. 5.5.8) in vitro, а затем вводят их летально облученным реципиентам; после этого можно использовать ДНК-зонды, чтобы прослеживать потомство отдельных инфицированных клеток в различных кроветворных и лимфоидных тканях.
Эти опыты не только подтверждают, что все классы клеток крови - и миелоидных, и лимфоидных - происходят от общей стволовой клетки (рис. 17-32), но и позволяют прослеживать «родословные» этих клеток крови в течение долгого времени. Через 1-2 месяца после пересадки костного мозга большинство клеток крови облученной мыши-реципиента - это потомки не более чем полудюжины плюрипотентных стволовых клеток; так же обстоит дело и спустя несколько недель, но тогда уже клетки крови - это потомство другой группы стволовых клеток. Эти наблюдения заставляют думать, что отдельная стволовая клетка в данный отрезок времени только с очень низкой вероятностью может начать образование клона дифференцированного потомства и что между начальным этапом и конечной дифференцировкой происходит множество клеточных делений, так что в конце концов клон потомства будет очень большим - до нескольких миллионов клеток. Несмотря на относительную редкость и «квантовый» характер начальных событий, дифференцированные клетки образуются в целом непрерывно и с постоянной скоростью; это связано с работой регуляторных механизмов, которые действуют на промежуточных этапах дифференцировки и помогают регулировать конечную численность клеток каждого типа.
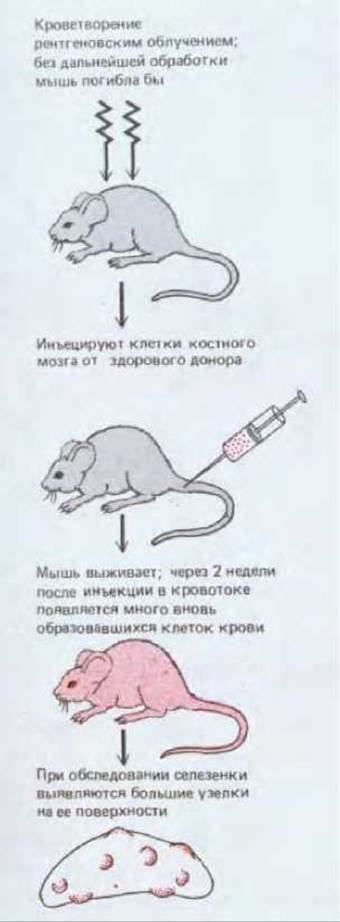
Каждый узелок содержит клон кроветворных клеток, происходящих от одной из инъецированных клеток костного мозга
Рис. 17-31. Схема опыта, в котором селезенку сильно облученного животного заселяют кроветворными клетками костного мозга, взятыми от здорового донора. Такой эксперимент впервые позволил анализировать индивидуальные миелоидныеклетки-предшественники, что необычайно расширило возможности изучения гемопоэза.
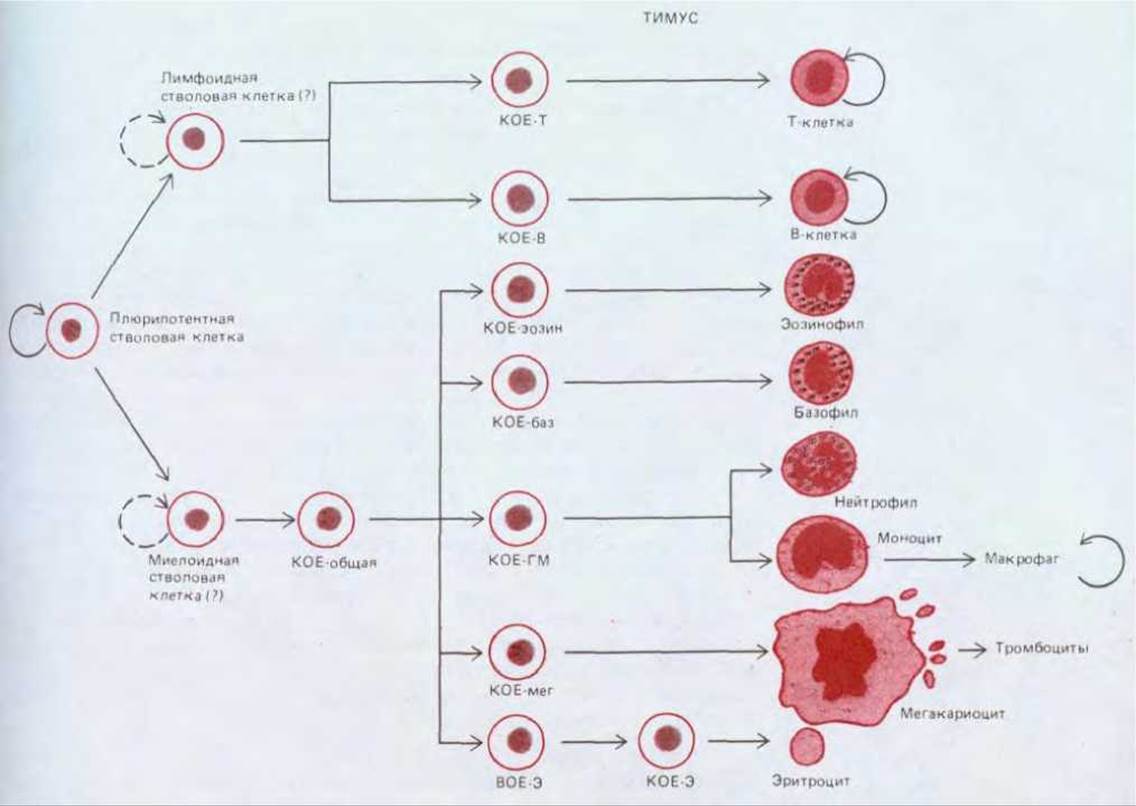
Рис. 17-32. Предполагаемая схема кроветворения. В норме плюрипотентная стволовая клетка изредка делится, образуя или такие же плюрипотентные стволовые клетки (самообновление), или коммитированные клетки-предшественники (КОЕ - колониеобразующие клетки), которые необратимо детерминированы на образование только ограниченного числа типов кровяных клеток. Пролиферацию клеток-предшественников стимулируют специфические факторы роста, но постепенно эти клетки утрачивают способность делиться и превращаются в терминально дифференцированные клетки крови, которые обычно живут лишь несколько дней или недель. У взрослых млекопитающих все показанные здесь клетки развиваются главным образом в костном мозге. Исключение составляют Т-лимфоциты, развивающиеся в тимусе, и макрофаги, образующиеся в большинстве тканей из моноцитов. Наиболее спорной в этой схеме является точка первого разветвления: не выяснено, существуют ли стволовые клетки, способные превращаться только в Т- и В-лимфоциты, и стволовые клетки, дающие начало клеткам всех других типов (миелоидным). Вполне возможно, что первичные плюрипотентные стволовые клетки могут превращаться также в различные тканевые клетки, не показанные на этой схеме, такие как клетки NC (киллеры), тучные клетки, остеокласты и разнообразные клетки, представляющие антитены (разд. 18.6.10), но пути этих превращений точно не установлены.
17.5.5. Число различных клеток крови увеличивается в результате деления коммитированных клеток- предшественниц [23, 28]
Если клетка уже дифференцировалась как эритроцит, гранулоцит и т. д., обратный путь для нее закрыт: состояние дифференцировки необратимо. Поэтому на какой-то стадии своего развития потомство плюрипотентной стволовой клетки должно окончательно и бесповоротно вступить на какой-то определенный путь дифференцировки. Из простого исследования костного мозга под микроскопом ясно, что это происходит задолго до последнего цикла деления, приводящего к формированию зрелых дифференцированных клеток: можно распознать специализированные клетки-предшественницы, которые еще делятся, но уже проявляют признаки начавшейся дифференцировки. Таким образом, после вступления клетки на определенный путь следует серия делений, увеличивающих число клеток данного специализированного типа.
Из сказанного видно, что кроветворную систему можно рассматривать как иерархию клеток. Плюрипотентные стволовые клетки дают начало коммитированным клеткам-предшественницам, которые уже необратимо определились как предки кровяных клеток одного или нескольких типов. Полагают, что коммитированные клетки делятся быстро, но ограниченное число раз. В конце такой серии делений они становятся терминально дифференцированными клетками, которые обычно больше не делятся и погибают через несколько дней или недель. Исследования in vitro дают возможность узнать, как регулируются эти клеточные процессы.
17.5.6. Факторы, регулирующие гемопоэз, можно исследовать на культурах клеток [29]
Кроветворные клетки будут выживать, размножаться и дифференцироваться в культуре только в том случае, если снабдить их специфическими факторами роста или выращивать вместе с клетками, вырабатывающими эти факторы. Длительная пролиферация плюрипотентных стволовых клеток возможна, например, при росте их в диспергированном состоянии поверх слоя клеток костномозговой стромы, предположительно имитирующего среду в неповрежденном костном мозге; в таких культурах могут образовываться миелоидные клетки всех типов. Диспергированные кроветворные клетки костного мозга можно также выращивать в полутвердой среде из агара или метилцеллюлозы с добавлением факторов, выделенных из других клеток. В такой полутвердой среде потомство каждой отдельной клетки остается на месте, образуя легко распознаваемую колонию. Отдельная коммитированная клетка, например предшественник нейтрофилов, может дать начало клону из тысяч нейтрофилов. Такая система культуры позволяет испытывать активность факторов, поддерживающих гемопоэз, и таким образом выделять их и изучать их действие. Эти вещества оказались гликопротеинами; их обычно называют колониестимулирующими факторами, или КСФ. Из все возрастающего числа КСФ, которые были идентифицированы и подвергнуты очистке, одни циркулируют в крови и действуют как гормоны, в то время как другие играют роль локальных химических медиаторов (разд. 12.1). Из КСФ гормонального типа лучше всего изучен гликопротеин эритропоэтин, который вырабатывается в почках и регулирует эритропоэз (образование эритроцитов).
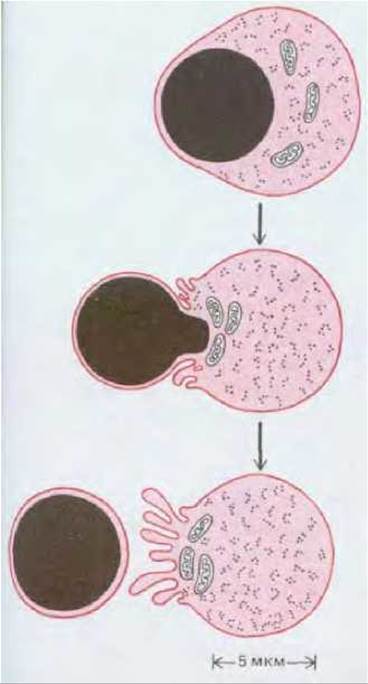
Рис. 17-33. Схема развития эритробласта (предшественника эритроцита). Эритробласт выталкивает ядро и становится незрелым эритроцитом (ретикулоцитом) незадолго до выхода клетки из костного мозга в кровоток. Спустя 1-2 дня ретикулоцит потеряет свои митохондрии и рибосомы и станет зрелым эритроцитом. Клоны эритроцитов развиваются в костном мозге на поверхности макрофага, который фагоцитирует и переваривает ядра, выбрасываемые эритробластами.
17.5.7 Эритропоэз зависит от гормона эритропоэтина [30]
Эритроциты составляют основную массу клеток, циркулирующих в крови (см. табл. 17-1). Зрелый эритроцит плотно заполнен гемоглобином и практически не содержит никаких обычных клеточных органелл. В эритроците взрослого млекопитающего отсутствуют даже ядро, эндоплазматический ретикулум, митохондрии и рибосомы - они выталкиваются из клетки в процессе развития (рис. 17-33). Поэтому эритроцит не может расти или делиться; единственный возможный источник образования новых эритроцитов - стволовые клетки. При этом продолжительность жизни эритроцитов невелика - около 120 дней у человека и 55 дней у мыши. Изношенные эритроциты поглощаются и перевариваются макрофагами в печени и селезенке.
Недостаток кислорода или нехватка эритроцитов побуждает клетки почек синтезировать и выделять в кровь повышенное количество эритропоэтина, а эритропоэтин в свою очередь стимулирует образование эритроцитов. Поскольку усиленный выброс новых эритроцитов в кровоток отмечается уже через один или два дня после повышения концентрации эритропоэтина в крови, гормон должен действовать на клетки, являющиеся очень близкими предшественниками зрелых эритроцитов.
Клетки, реагирующие на эритропоэтин, можно идентифицировать, добавляя эритропоэтин в культуры клеток костного мозга на полутвердой среде. Через несколько дней появляются колонии примерно из 60 эритроцитов, каждая из которых происходит от одной коммитированной эритроидной клетки-предшественницы. Такую клетку называют колониеобразующей единицей эритроидного ряда, или КОЕ-Э, и она дает начало зрелым эритроцитам приблизительно после шести или даже меньшего числа циклов деления. КОЕ-Э еще не содержат гемоглобина; они образуются из клеток-предшественниц более раннего типа, пролиферация которых не зависит от эритропоэтина.
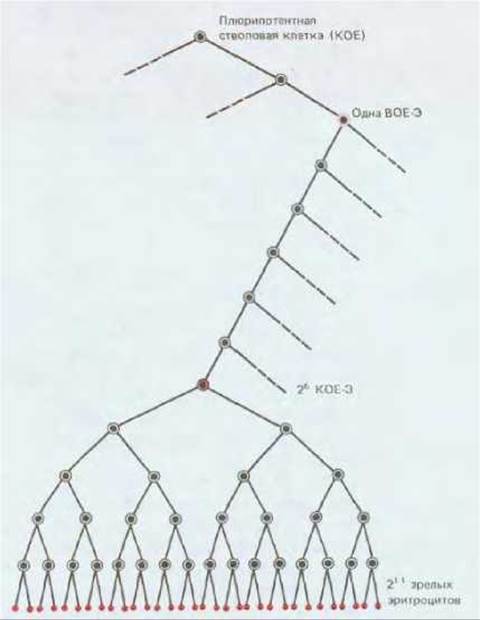
Рис. 17-34. Родословная, показывающая отношения между плюрипотентной стволовой клеткой, ВОЕ-Э, КОЕ-Э и зрелыми эритроцитами. Клетки ВОЕ-Э и КОЕ-Э являются коммитированными клетками-предшественниками эритроидного ряда. Клетки ВОЕ-Э реагируют на интерлейкин 3, но не реагируют на эритропоэтин, а клетки КОЕ-Э хорошо отвечают на эритропоэтин. Серия клеточных делений, происходящих под влиянием эритропоэтина, - это эффективный способ регулирования эритропоэза без нарушения образования других клеток крови.
Второй колониестимулирующий фактор - интерлейкин 3 (ИЛ-3) - ответствен за выживание и пролиферацию плюрипотентных стволовых клеток и большинства типов их коммитированных потомков. В его присутствии из культивируемых клеток костного мозга развиваются гораздо более крупные эритроидные колонии примерно из 5000 эритроцитов каждая. Эти колонии возникают из эритроидных клеток, называемых взрывообразующими единицами эритроидного ряда (ВОЕ-Э). ВОЕ-Э отличается от плюрипотентной стволовой клетки тем, что имеет ограниченную способность к пролиферации и дает начало колониям, содержащим только эритроциты, даже при таких условиях культивирования, при которых другие клетки могут порождать и иные виды дифференцированных клеток крови. Отличие от КОЕ-Э состоит в том, что ВОЕ-Э нечувствительны к эритропоэтину и от зрелых эритроцитов их отделяют целых 12 клеточных делений, для которых уже необходим эритропоэтин. (Эти клетки отличаются от КОЕ-Э еще и по размерам, и их можно отделить от последних центрифугированием.) Таким образом, ВОЕ-Э считают клетками-предшественницами, коммитированными для дифференцировки в эритроциты, и ранними предками КОЕ-Э (рис. 17-34).
17.5.8. На образование нейтрофилов и макрофагов влияет несколько колониестимулирующих факторов (КСФ) [29,31]
Два типа «профессиональных фагоцитов» - нейтрофилы и макрофагиразвиваются из одних и тех же клеток, называемых предшественниками гранулоцитов и макрофагов (ГМ). Подобно другим гранулоцитам (эозинофилам и базофилам), нейтрофилы лишь несколько часов циркулируют в крови, а затем переходят из капилляров в соединительные ткани или другие специфические места, где они живут несколько дней, а потом гибнут. В отличие от этого макрофаги могут месяцами, а возможно, и годами находиться вне кровяного русла, где способны возобновлять пролиферацию под воздействием местных сигналов.
Было выявлено четыре различных КСФ, стимулирующих в культуре формирование колоний нейтрофилов и макрофагов. Полагают, что in vivo они действуют в различных сочетаниях, регулируя избирательное образование определенных клеток. Эти КСФ синтезируются клетками разного типа, в том числе эндотелиальными клетками, фибробластами, макрофагами и лимфоцитами; при бактериальной инфекции в какой-либо ткани их концентрация в крови быстро повышается, что ведет к ускоренному переходу фагоцитирующих клеток из костного мозга в кровоток. Из этих четырех факторов наименее специфичен ИЛ-3: он действует на плюрипотентные стволовые клетки и на большинство коммитированных клеток, включая предшественников ГМ. Три других фактора воздействуют более избирательно на коммитированных предшественников ГМ и их дифференцированное потомство (табл. 17-2), хотя в высокой концентрации некоторые из них влияют и на другие линии.
Так же как и эритропоэтин, все эти КСФ являются гликопротеинами, действующими в низких концентрациях (10-12 М) путем связывания со специальными рецепторами клеточной поверхности. Их воздействие на клетки-предшественники заключается не только в запуске механизма образования дифференцированных колоний, но и в активации специализированных функций (таких, как фагоцитоз и убивание клеток-мишеней) у клеток с законченной дифференцировкой. Белки, синтезированные с помощью клонированных генов для этих факторов, служат мощными стимуляторами кроветворения у экспериментальных животных, что позволяет думать об их применении в клинике для стимуляции восстановления кроветворной ткани и при лечении инфекций.
Таблица 17-2. Некоторые колониестимулирующие факторы (КСФ), влияющие на образование клеток крови
|
Фактор |
Мол. масса |
Клетки-мишени |
Места образования |
|
Эритропоэтин |
51000 |
КОЕ-Э |
Клетки почек |
|
Интерлейкин |
25000 |
Плюрипотентные стволовые клетки, большинство клеток-предшественников, многие терминально дифференцированные клетки |
Т-лимфоциты, эпидермальные клетки |
|
ГМ-КСФ 1 |
23000 |
ГМ -предшественники 4 |
Т-лимфоциты, эндотелиальные клетки, фибробласты |
|
Г-КСФ 2 |
25000 |
ГМ-предшественники 4 и нейтрофилы |
Макрофаги, фибробласты |
|
М-КСФ 3 |
70000(димер) |
ГМ-предшественники 4 и макрофаги |
Фибробласты, макрофаги, эндотелиальные клетки |
1 КСФ для гранулоцитов и макрофагов (GM-CSF).
2 КСФ для гранулоцитов (G-CSF).
3 КСФ для макрофагов (M-CSF).
4 Предшественники гранулоцитов и макрофагов.
Описаны также факторы, которые специфически стимулируют развитие других видов миелоидных клеток, таких как мегакариоциты, базофилы и эозинофилы, но они не так хорошо охарактеризованы, как обсуждавшиеся выше КСФ. Есть данные о том, что наряду с растворимыми КСФ, среди которых есть локально секретируемые продукты клеток костномозговой стромы, в регуляции кроветворения участвуют также сигнальные молекулы, связанные с клетками и с межклеточным матриксом.
17.5.9. Поведение кроветворной клетки частично зависит от случая [29, 32]
КСФ определяют как факторы, способствующие образованию колоний дифференцированных клеток крови. Трудно точно установить, какое влияние оказывает КСФ на отдельную кроветворную клетку. Этот фактор мог бы повышать вероятность выживания клетки; мог бы регулировать скорость клеточного деления или число делений, необходимых клетке-предшественнице перед дифференцировкой. Он мог бы действовать на поздних этапах дифференцировки и облегчать ее; и мог бы, напротив, действовать на ранних этапах и влиять на коммитирование (рис. 17-35). Прослеживая судьбу отдельных изолированных кроветворных клеток в культуре, можно установить, как определенный КСФ, например ГМ-КСФ, может давать все эти различные эффекты. Тем не менее до сих пор не ясно, какие эффекты существенны in vivo. Особенно непонятным остается поведение плюрипотентных стволовых клеток: эти важнейшие клетки разбросаны и малочисленны - меньше одной на тысячу клеток костного мозга, - и их очень трудно идентифицировать с полной уверенностью.
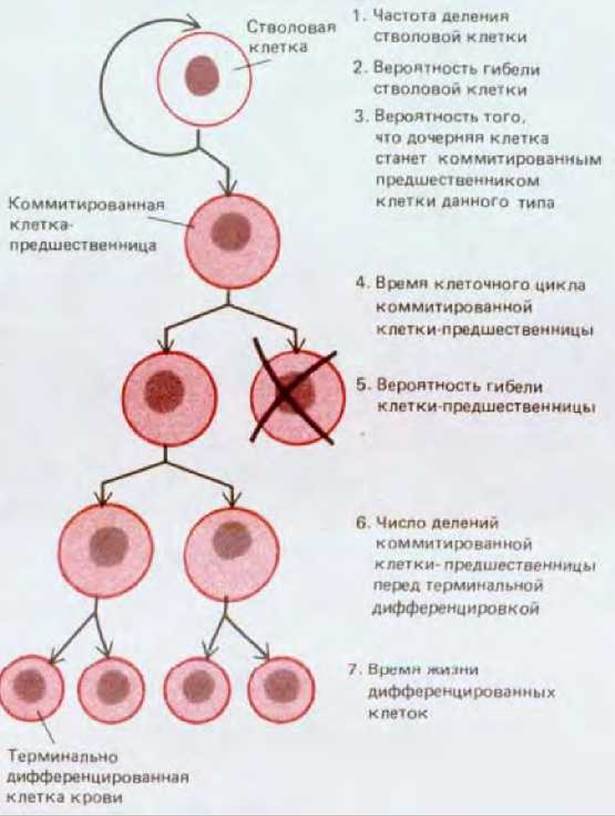
Рис. 17-35. Параметры, с помощью которых могло бы регулироваться образование клеток крови определенного типа. Исследования in vitro показывают, что колониестимулирующие факторы (КСФ) могут влиять на все эти аспекты кроветворения.
Кроме того, исследования in vitro показывают, что существует большой элемент случайности в выборе пути кроветворной клеткой. КСФ не диктуют прямо, что клетка должна делать, а изменяют вероятность того или иного поведения. В культурах кроветворных клеток, даже если эти клетки были подвергнуты отбору на максимальную гомогенность популяции, они сильно различаются по размерам, а часто и по характеру образующихся из них колоний. И если взять две сестринские клетки сразу после деления и культивировать по отдельности в идентичных условиях, они будут часто давать колонии, содержащие клетки разного типа или же клетки тех же типов, но в разных количествах. Таким образом, и программирование клеточных делений, и выведение клеток на определенный путь дифференцировки (коммитирование), видимо, включают случайные события на уровне индивидуальной клетки, даже если поведение многоклеточной системы в целом надежно регулируется. Вопрос о молекулярных механизмах, лежащих в основе этих процессов, - самая фундаментальная из нерешенных проблем кроветворения.
Заключение
Все многочисленные типы кровяных клеток ведут свое происхождение от общей плюрипотентной стволовой клетки. Во взрослом организме стволовые клетки находятся главным образом в костном мозге, где они в норме довольно редко делятся, производя новые стволовые клетки (самообновление) или различные коммитированные клетки-предшественницы, каждая из которых способна давать начало клеткам одного или нескольких типов. Коммитированные клетки усиленно делятся под воздействием сигнальных гликопротеиновых молекул (называемых колониестимулирующими факторами, КСФ) и затем дифференцируются в зрелые клетки крови, которые обычно живут лишь несколько дней или недель. Изучению кроветворения существенно помогают опыты на культурах in vitro, где стволовые клетки или коммитированные клетки- предшественницы при росте в полутвердой среде образуют клональные колонии. Однако плюрипотентные стволовые клетки малочисленны, их трудно распознавать и пока еще не ясно, как они выбирают свой путь среди разных вариантов развития.