Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Иммунная система
Система комплемента
Комплемент, получивший свое название благодаря тому, что он комплементирует (дополняет) и усиливает действие антител, представляет собой главное орудие, с помощью которого антитела защищают организм позвоночного от большинства бактериальных инфекций. Он представляет собой систему сывороточных белков, которые могут активироваться комплексами антигенантитело или микроорганизмами и претерпевать каскад протеолитических реакций, конечный результат которого - сборка комплексов, атакующих мембраны. Такие комплексы проделывают в мембране микроорганизма отверстия, тем самым убивая его. В то же время протеолитические фрагменты, освобождаемые в процессе активации, усиливают защитную реакцию путем расширения кровеносных сосудов и привлечения фагоцитирующих клеток к местам инфекции. Кроме того, комплемент повышает способность фагоцитирующих клеток связывать, поглощать и разрушать атакуемые ими микроорганизмы.
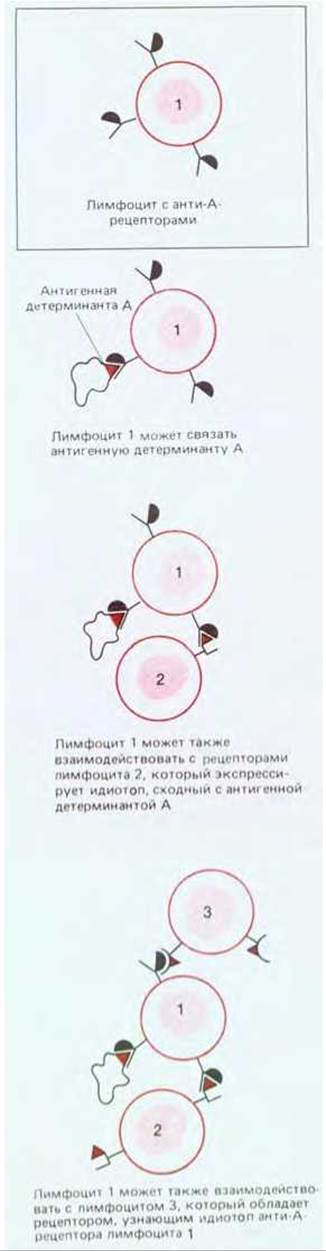
Рис. 18-39. Отдельный лимфоцит может быть функционально связан с другими лимфоцитами через взаимодействия идиотоп - антиидиотоп. Размеры такой идиотопической сети в принципе могут быть огромными, так как каждый лимфоцит, взаимодействующий, как показано на рисунке, с анти-А-лимфоцитом, может сходным образом реагировать и с другими лимфоцитами. Пока не ясно, насколько взаимодействия антиидиотопического типа важны для регуляции иммунных ответов.
Лица с недостаточностью одного из главных компонентов комплемента (СЗ) подвержены частым бактериальным инфекциям, точно так же как и лица с недостаточностью самих антител. У комплемент-дефицитных индивидуумов возможны также болезни, связанные с осаждением иммунных комплексов (комплексов антиген-антитело) в небольших кровеносных сосудах кожи, суставов, почек и мозга, где эти комплексы вызывают воспаление и разрушение ткани. Поэтому можно думать, что комплемент в норме способствует растворению таких комплексов, когда они образуются в процессе иммунного ответа.
18.5.1. Активация комплемента представляет собой усилительный механизм в форме каскада протеолитических реакций; центральную роль играет расщепление белка СЗ [27]
Комплемент состоит примерно из 20 взаимодействующих белков; часть из них - реагирующие компоненты (С1-С9, фактор В и фактор D), а остальные - регуляторные. Все это растворимые белки. Они образуются главным образом в печени и циркулируют в крови и тканевой жидкости. Большинство из них неактивно до тех пор, пока не будет приведено в действие либо непосредственно внедрившимся микроорганизмом, либо через посредство иммунного ответа. Окончательный результат активации комплемента - объединение поздних компонентов комплемента (С5, С6, С7, С8 и С9) в большой комплекс, атакующий мембраны, который вызывает лизис микробной клетки.
Поскольку главная функция комплемента - атака на мембраны микробных клеток, его активация в основном происходит на клеточной мембране микроорганизма, где она запускается либо антителом, связавшимся с микробной клеткой, либо полисахаридами ее оболочки. В обоих случаях активируются ранние компоненты комплемента. Существуют два набора ранних компонентов, принадлежащие двум разным путям активации комплемента: С1, С2 и С4 относятся к классическому пути, который приводится в действие связыванием антитела; фактор В и фактор D относятся к альтернативному пути, который запускается микробными полисахаридами. Ранние компоненты обоих путей действуют в конце концов на СЗ - наиболее важный компонент комплемента (рис. 18-40). Ранние компоненты и СЗ - проферменты, последовательно активируемые путем ограниченного протеолиза. Когда какой-либо из них специфическим образом расщепляется, он становится активной сериновой протеазой, способной расщеплять следующий профермент, и т. д. Многие из этих актов протеолиза приводят к отделению малого пептидного фрагмента и обнажению участка связывания с мембраной на большом фрагменте. Большой фрагмент прочно присоединяется к мембране клетки-мишени с помощью этого участка и способствует протеканию следующего этапа в цепи реакций. Таким образом, процесс активации комплемента ограничен главным образом той клеточной поверхностью, где он начался. Малый фрагмент нередко действует независимо - как способная к диффузии сигнальная молекула, стимулирующая воспалительную реакцию (разд. 18.5.4).
Активация СЗ путем его расщепления - главная реакция цепи активации комплемента; именно здесь сходятся классический и альтернативный пути (см. рис. 18-40). В обоих случаях СЗ расщепляется ферментным комплексом, называемым СЗ-конвертазой. Два разных пути приводят к образованию разных СЗ-конвертаз, которые получаются в результате спонтанного объединения двух компонентов комплемента, активированных на более раннем этапе. Обе конвертазы расщепляют СЗ на два фрагмента. Больший из них (С3b) ковалентно связывается с мембраной клетки- мишени и присоединяет С5. Будучи связанным, белок С5 расщепляется СЗ-конвертазой (которая теперь действует как С5-конвертаза) и в результате инициирует спонтанную сборку комплекса, атакующего мембраны, из поздних компонентов - от С5 до С9.
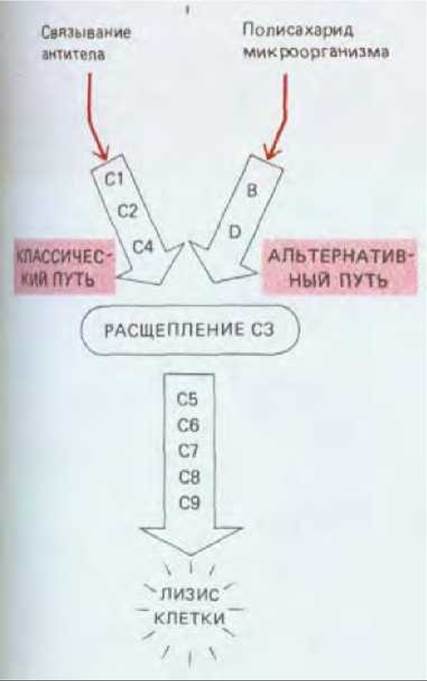
Рис. 18-40. Основные этапы активации комплемента по классическому и альтернативному пути. Реакции активации комплемента в обоих случаях обычно происходят на поверхности внедрившегося микроорганизма, например бактерии.
Поскольку каждый активированный фермент расщепляет много молекул следующего профермента, протеолитический каскад активации ранних компонентов действует как усилитель: каждая молекула, активированная в начале всей цепи, вызывает образование множества комплексов, атакующих мембраны.
18.5.2. Классический путь активируется комплексами антиген-антитело [27, 28]
Классический путь обычно активируется, когда антитела IgG или IgM связываются с антигенами на поверхности микроорганизма. Связывание антигена с антителами в свою очередь приводит к тому, что константные области антител связывают первый компонент классического пути, С1, который представляет собой большой комплекс, состоящий из трех субкомпонентов - Clq, Clr и Cls (рис. 18-41). Связывание глобулярной «головки» Clq с антителом IgM или IgM, присоединенным к антигену, активирует Clq, и в результате запускается ранний протеолитический каскад классического пути. Однако прежде чем произойдет активация, таким способом должна быть связана более чем одна «головка»; поэтому для включения классического пути нужна целая группа чужеродных антигенных детерминант (рис. 18-41, Б). Это тоже служит для концентрирования процессов активации комплемента на поверхности микроорганизмов, где антигенные детерминанты обычно расположены тесными группами. Активация субкомпонента Clq комплекса Сl активирует Clr, который приобретает протеолитическую активность и в свою очередь расщепляет и активирует Cls. Активированный Cls затем расщепляет С4 на два фрагмента, С4а и С4b (образующийся в результате такого рода протеолиза больший фрагмент принято обозначать b, а меньший фрагмент -а); С4b сразу же ковалентно пришивается к мембране и затем связывает С2. Будучи связанным, С2 также расщепляется активированным ds; больший фрагмент, С2b, остается связанным с С4b, образуя комплекс C4b,2b, который представляет собой С3-конвертазу классического пути. Как показано на рис. 18-42, C4b,2b расщепляет СЗ на два фрагмента - С3а и С3b. Фрагмент С3b быстро связывается с мембраной-мишенью и присоединяет к себе С5. Связанный С5 расщепляется комплексом C4b,2b на С5а и С5b (вспомним, что С3-конвертаза - это также и С5-конвертаза). Фрагмент С5b соединяется с С6, в результате чего инициируется сборка поздних компонентов с образованием комплекса, атакующего мембраны.
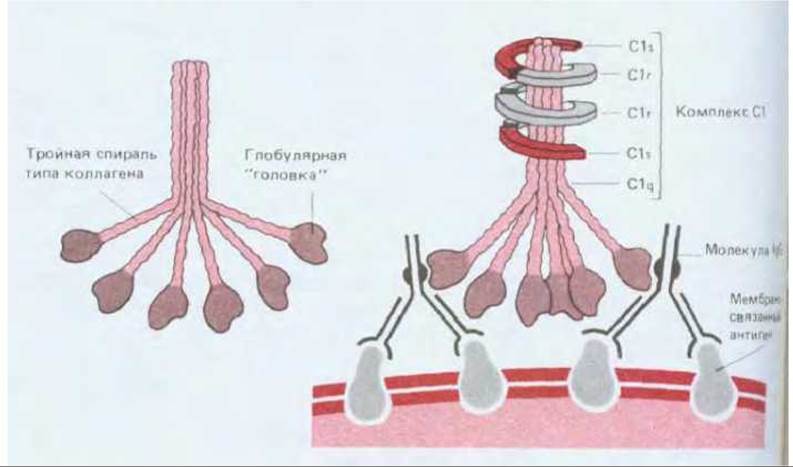
Рис. 18-41. А. Необычная структура Clq. Это большой белок (мол. масса около 450000). состоящий из шести идентичных субъединиц, каждая из которых в свою очередь построена из трех разных полипептидных цепей. С-концевые половины всех трех цепей каждой субъединицы образуют глобулярную структуру; N-концевые половины имеют аминокислотную последовательность, типичную для коллагена, и скручены в тройную спираль коллагенового типа (см. разд. 14.2.6). Все шесть субъединиц сшиты друг с другом дисульфидными связями между трехспиральными «хвостами» и образуют структуру, напоминающую пучок тюльпанов. К глобулярным «головкам» этой структуры могут присоединяться антитела IgG или IgM. Таким образом, каждая молекула Clq имеет шесть участков связывания антител. Б. Связывание Сl с двумя молекулами IgG, присоединенными к группе антигенных детерминант на поверхности клетки-мишени. Каждый комплекс Сl состоит из одной молекулы Clq, непрочно связанной с тетрамером, который составлен из двух молекул Clr и двух молекул Cls (тетрамер показан схематично).
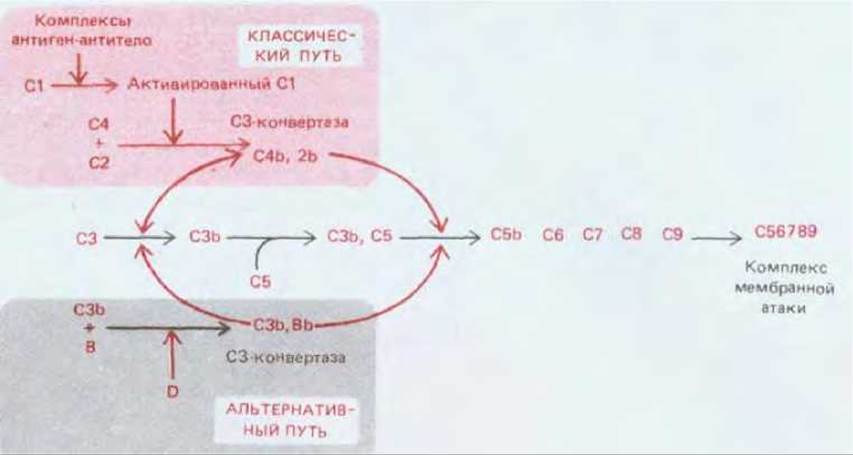
Рис. 18-42. Образование С3-конвертазы при классическом и при альтернативном пути. В обоих случаях С3-конвертаза образуется в результате соединения двух компонентов комплемента, активированных ранее в цепи протеолитического каскада. Белки С3 и С5 гомологичны. Связав С3b, С5 становится похожим на С3 и расщепляется С3-конвертазой (работающей как С5-конвертаза) с образованием С5b, который инициирует сборку комплекса, атакующего мембраны. Активированные компоненты комплемента часто обозначают с помощью верхней черты (например, активированный С1 - как С1); чтобы упростить текст, мы не пользовались этим обозначением.
18.5.3. Альтернативный путь может прямо активироваться микроорганизмами [27, 29]
Полисахариды клеточных стенок микроорганизмов даже в отсутствие антител могут прямо активировать альтернативный путь. Активация классического пути тоже активирует альтернативный путь с помощью положительной обратной связи. Таким образом, альтернативный путь обеспечивает первую линию обороны от инфекции, пока не сформировался иммунный ответ, и усиливает действие классического пути после начала иммунного ответа.
Хотя мы говорим, что полисахариды микробов прямо активируют альтернативный путь, однако это лишь упрощенная схема. На самом деле этот путь активируется фрагментом С3b, а роль полисахаридов состоит в том, чтобы предохранить С3b от быстрой инактивации под действием механизма, который защищает окружающие нормальные клетки от атаки активированного комплемента (см. ниже). С3b, приводящий в действие альтернативный путь, образуется либо классическим путем (отсюда петля положительной обратной связи), либо путем спонтанного протеолиза СЗ, который происходит с малой скоростью даже тогда, когда каскад комплемента не запущен.
Следующий этап активации альтернативного пути - присоединение фактора В к мембраносвязанному С3b. Затем циркулирующий в крови в активной форме фактор D расщепляет связанный фактор В с образованием активного фрагмента ВЬ, и в результате получается С3b, Вb - С3-конвертаза альтернативного пути, под действием которой образуются дополнительные молекулы СЗb; некоторые из них связывают С5. Как и в классическом пути, С3-конвертаза может служить и С3-конвертазой. С3-конвертаза расщепляет мембраносвязанные молекулы С3 и таким образом инициирует сборку комплекса, атакующего мембраны (см. ниже, рис. 18-43).
Повреждение мембран нормальных клеток собственного организма комплементом, активированным по классическому пути, предотвращается тем, что для активации С1 нужны связанные антитела. Альтернативный путь, однако, активируется фрагментом С3b, который может связаться с любой мембраной и, как уже говорилось, с небольшой скоростью образуется спонтанно. Поэтому необходимы специальные механизмы защиты собственных нормальных клеток от такого рода атаки. В отличие от больших скоплений С3b, формирующихся по классическому пути, большая часть спонтанно образующегося С3b связывается с мембранами в виде одиночных молекул. Здесь они быстро инактивируются специфическим белком-ингибитором - фактором Н, который конкурирует с фактором В за связывающий участок на С3b; С3b, связанный с микробными мембранами, защищен от этого ингибиторного белка (механизм защиты неизвестен) полисахаридами клеточной стенки микробов. Поэтому такие молекулы С3b могут связывать фактор В и таким образом активировать альтернативный путь.
18.5.4. Активация комплемента способствует фагоцитозу и воспалению [27]
Фрагмент С3b образующийся как при классическом, так и при альтернативном пути, обладает рядом важных свойств. Как мы уже видели, он активирует альтернативный путь с образованием добавочных количеств СЗЬ и связывает С5, обеспечивая расщепление его С3-конвертазой. Однако комплемент работает не только на образование комплексов, атакующих мембраны; С3b играет еще и третью важную роль: он присоединяется к специфическим рецепторным белкам на макрофагах и нейтрофилах и повышает способность этих клеток фагоцитировать ту микробную клетку, к которой уже присоединился С3b. Таким образом, С3b вносит решающий вклад в защиту от бактерий, независимую от лизиса клеток под действием комплемента.
В ходе каскадной протеолитической активации комплемента образуется несколько небольших биологически активных белковых фрагментов. Из них наиболее важны С3а и С5а. Оба этих фрагмента представляют собой пептиды с сильными основными свойствами, отщепляемые от N-концов исходных белков; оба вызывают сокращение гладкой мускулатуры и стимулируют секрецию гистамина тучными клетками и базофилами. Гистамин местно увеличивает проницаемость кровеносных сосудов, что позволяет лейкоцитам и дополнительным количествам антител и комплемента проникать в места инфекции. С5 служит также мощным хемоаттрактантом для нейтрофилов и усиливает механизмы, с помощью которых эти клетки уничтожают поглощенные бактерии. Именно эти два пептида в основном ответственны за местную воспалительную реакцию, которой обычно сопровождается активация комплемента.
18.5.5. В результате сборки поздних компонентов комплемента образуется гигантский комплекс, атакующий мембраны [27, 30]
Сборка поздних компонентов начинается с того, что С5 (уже слабо связанный с С3b на мембране клетки-мишени) расщепляется С3-конвертазой классического или альтернативного пути с образованием C5a и С5b. Как мы только что видели, С5а освобождается и способствует воспалительной реакции. С5Ь остается связанным с С3b и временно имеет способность присоединять С6 с образованием С56, а потом С7 с образованием С567. Затем комплекс С567 через С7 прочно связывается с мембраной. К этому комплексу добавляется одна молекула С8, и образующийся С5678 связывает от 8 до 18 молекул С9, которые частично разворачиваются и полимеризуются, формируя трансмембранный канал (рис. 18-43). Изученные последовательности ДНК позволяют предполагать, что белки С6, С7, С8 и С9 эволюционно родственны между собой.
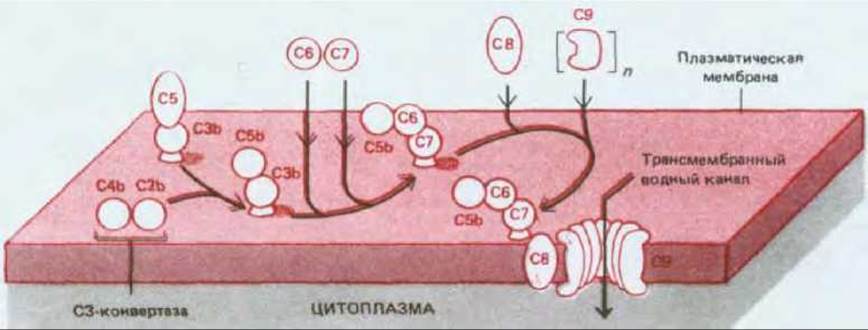
Рис. 18-43. Сборка поздних компонентов комплемента с образованием комплекса, атакующего мембраны. Связывание молекулы С9 с С5678 индуцирует в С9 конформационное изменение, которое приводит к обнажению гидрофобной области и встраиванию С9 в липидный бислой клетки-мишени рядом с С8. Это инициирует цепную реакцию: измененный С9 связывает вторую молекулу С9, которая претерпевает конформационное изменение и встраивается в бислой, где может связать следующую молекулу С9, и так далее. Таким образом цепь молекул С9 формирует широкий трансмембранный канал. Конечный комплекс С5678(9) может содержать до 18 молекул С9 и иметь мол. массу около 2 млн. (каждая молекула С9 содержит 537 аминокислотных остатков). Комплексы С5678 сами по себе образуют небольшие трансмембранные поры.
Комплексы, атакующие мембраны, после негативного контрастирования имеют на электронных микрофотографиях характерный вид: они образуют водные поры, пронизывающие мембрану (рис. 18-44). По этой причине, а также благодаря нарушению структуры близлежащего липидного бислоя мембрана становится легко проницаемой. Поскольку малые молекулы могут проходить сквозь мембрану около комплексов и через них, а макромолекулы остаются в клетке, нарушается нормальный клеточный механизм контроля водного баланса (см. схему 6-1, т. 1). Поэтому клетка путем осмоса поглощает воду и в результате набухает и лопается. Этот процесс настолько эффективен, что очень небольшое число комплексов, атакующих мембраны (возможно, даже один), может убить эритроцит. Комплексы могут разрушать даже вирус, имеющий оболочку, для которого не характерна большая разность осмотического давления по обе стороны мембраны и который поэтому не подвержен осмотическому лизису; вероятно, это происходит из-за дезорганизации мембраны вируса.
18.5.6. Каскад комплемента точно регулируется [27, 31]
Поскольку каскад комплемента действует как усилитель и может приводить к разрушению клеток, необходимо, чтобы ключевые активные компоненты инактивировались вскоре после их появления и атака не распространялась на близлежащие клетки собственного организма. Это достигается по меньшей мере двумя способами. Прежде всего, специфические белки-ингибиторы, содержащиеся в крови, останавливают каскад путем связывания или расщепления определенных компонентов, стоит им только активироваться в результате протеолиза. Например, некоторые белки-ингибиторы присоединяются к активированным компонентам комплекса С1 и прекращают их действие, в то время как другие расщепляют и тем самым инактивируют С3b. Без этих ингибиторов весь сывороточный С3 мог бы быть израсходован из-за положительной обратной связи в цепи реакций альтернативного пути.
Второй важный механизм регуляции основан на нестабильности многих активированных компонентов каскада: если они не связываются тотчас же с определенным другим компонентом или с близлежащей мембраной, они быстро инактивируются. Особенно ярким примером служат активированные С4b и С3b. Когда любой из них образуется путем расщепления предшественника, он претерпевает ряд быстрых конформационных изменений, приводящих к короткоживущей активной форме. Такая активная форма имеет гидрофобный участок, а также боковую цепь глутамина с высокой реакционной способностью, образующуюся при механическом разрыве необычной тиоэфирной связи в белке (рис. 18-45). В результате глутамин образует ковалентную связь с белком или полисахаридом на близлежащей мембране. Поскольку время полужизни активных форм С4b и СЗb очень мало (менее 0,1 мс), они обычно успевают связаться только с тем участком мембраны, который находится совсем близко к месту активации компонентов комплемента. Поэтому атака комплемента ограничивается лишь поверхностной мембраной микроба и не распространяется на окружающие нормальные клетки собственного организма.
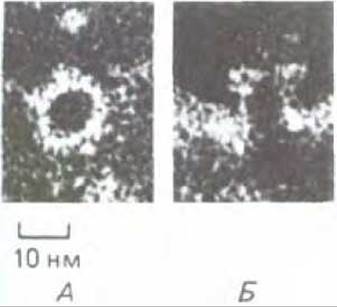
Рис. 18-44. Отверстия в плазматической мембране эритроцита - результат воздействия комплемента. Электронные микрофотографии (негативный контраст). На фото А отверстие видно сверху, на фото Б-сбоку. Контрастирующее вещество заполняет отдельные каналы, и поэтому они выглядят темными. (R. Dourmashkin, Immunology, 35, 205-212, 1978.)
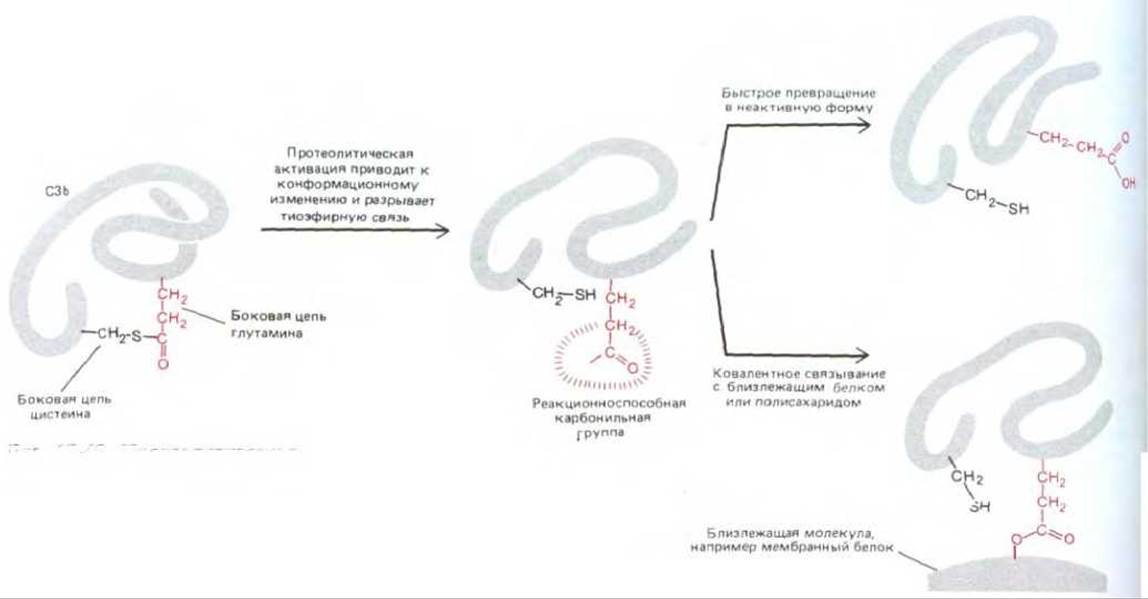
Рис. 18-45. Протеолитическая активация СЗ или С4 ведет к изменению конформации белка. При этом разрывается показанная на рисунке необычная внутримолекулярная ковалентная связь. В результате разрыва этой тиоэфирной связи между боковыми цепями белка образуется весьма реакционноспособная карбонильная группа, которая ковалентно присоединяется к другой макромолекуле, образуя с ней эфирную или амидную связь. Однако способность белка реагировать таким образом падает со временем полужизни около 60 мкс; поэтому он связывается только с мембранами, расположенными очень близко к тому месту, где началась активация комплемента. Как С3, так и С4 состоят более чем из одной полипептидной цепи; показанные на рисунке реакции претерпевает в каждом из белков цепь наибольшего размера.
Как в процессе эволюции могла выработаться столь сложная система? Можно предполагать, что это происходило путем последовательных шагов. При этом, видимо, многие из самых сложных компонентов, таких как комплекс, атакующий мембраны, появились сравнительно поздно. Кажется вероятным, что система первоначально формировалась вокруг компонента С3 и обеспечивала образование ковалентного комплекса между С3b и мембранами чужеродных клеток. Этот комплекс сам по себе значительно усиливает способность макрофагов и нейтрофилов поглощать и разрушать микроорганизмы. Однако люди, у которых отсутствует один из поздних компонентов и поэтому не может быть собран атакующий комплекс, защищены тем не менее от большинства бактериальных инфекций. Исключение составляют лишь немногие бактерии, способные выживать внутри фагоцитирующей клетки; поэтому для защиты от них особенно важен лизис, осуществляемый комплементом. Полагают, что и альтернативный, и классический пуп ведут свою эволюцию от такой примитивной системы комплемента. Вероятно, вначале возник альтернативный путь как механизм врожденной неспецифической защиты от инфекции, и лишь значительно позже выработался классический путь, в котором активация С3 сопряжена со связыванием антител и тем самым - со специфическими приспособительными иммунными реакциями. Представление об эволюционном родстве двух путей согласуется с тем, что многие из их компонентов гомологичны, включая сериновые протеиназы С1r, C1s, С2, фактор В и фактор D.
Заключение
Система комплемента действует сама по себе и совместно с антителами, защищая организм позвоночного от инфекции. Ранние компоненты комплемента представляют собой проферменты крови, которые последовательно активируются в усилительном каскаде реакций ограниченного протеолиза. Этот процесс может протекать либо по классическому пути, который запускается связыванием антител IgG или IgM с антигеном, либо по альтернативному пути, который может запускаться непосредственно клеточными стенками внедрившихся микроорганизмов. Наиболее важный компонент комплемента - белок ИСЗ, активируемый в результате протеолитического расщепления и затем ковалентно связывающийся с близлежащими мембранами. Микроорганизмы, несущие на своей поверхности активированный С3 (С3b), легко поглощаются и уничтожаются фагоцитирующими клетками. Кроме того, С3b помогает инициировать сборку поздних компонентов, которые образуют большой комплекс мембранной атаки, вызывающий лизис внедряющихся микроорганизмов. При активации комплемента освобождается также ряд небольших растворимых пептидных фрагментов, привлекающих и активирующих нейтрофилы и стимулирующих секрецию гистамина тучными клетками; это приводит к воспалительной реакции в местах активации комплемента. Протеолитический каскад комплемента остается «привязанным» к мембранам внедрившихся микроорганизмов, активировавших этот каскад, главным образом благодаря тому, что некоторые из компонентов, включая С3b, остаются активными менее 0,1 миллисекунды и поэтому не могут распространить атаку на близлежащие собственные клетки организма.