Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Иммунная система
Т-лимфоциты и клеточный иммунитет
Разнообразные реакции Т-клеток в совокупности называют иммунным ответом клеточного типа. Как и образование антител, эти реакции играют у позвоночных важную роль в защите от инфекции, особенно от некоторых вирусов и грибов. Так же как и ответы, связанные с выработкой антител, они высокоспецифичны в отношении антигена.
Существует, однако, несколько важных особенностей, отличающих Т-клетки от В-клеток.
1) Некоторые Т-клетки прямо сражаются с инфекцией путем уничтожения клеток, инфицированных вирусом, но большинство Т-клеток регулирует активность других эффекторных клеток, таких как В-клетки и макрофаги.
2) Как эффекторные, так и регуляторные Т-клетки действуют в основном на коротких расстояниях, прямо взаимодействуя с клетками, которые они убивают или активность которых регулируют. В-клетки, напротив, выделяют антитела, распространяющиеся очень далеко от места их образования.
3) Вероятно, по этой причине Т-клетки связывают чужеродный антиген только тогда, когда он находится на поверхности другой клетки собственного организма; антиген узнается в ассоциации с особым классом гликопротеинов клеточной поверхности, называемых МНС; эти молекулы названы так потому, что они кодируются комплексом генов, получивших название главного комплекса гистосовместимости (major histocompatibility complex, MHC) (см. разд. 18.6.5). В результате активация Т-клеток происходит только при их контакте с другой собственной клеткой; это наиболее важное различие между процессами узнавания антигена Т- и В-клетками.
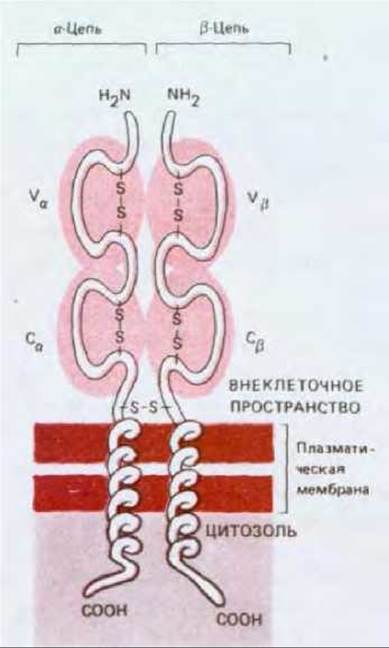
Рис. 18-46. Т-клеточный рецептор-гетеродимер, состоящий из полипептидных цепей а и ß обе цепи гликозилированы (не показано). Каждая из цепей имеет длину в 280 аминокислот; большая внеклеточная часть каждой цепи свернута в два Ig-подобных домена - один вариабельный (V) и один константный (С). Исходя из анализа аминокислотных последовательностей (выведенных из последовательностей клонированных кДНК), полагают, что антиген-связывающий участок, образуемый доменами Va и Vß, по общим размерам и геометрии сходен с антиген-связывающим участком молекулы антитела. Однако в отличие от антител, имеющих два участка для связывания антигена, Т-клеточные рецепторы имеют лишь один такой участок (вероятно, потому, что они всегда связаны с плазматической мембраной, где могут действовать кооперативно). Показанный здесь a/ß-гетеродимер нековалентно ассоциирован с инвариантным набором мембранных белков - так называемым комплексом CD3 (не показан).
Типичная Т-клетка имеет на своей поверхности от 20000 до 40000 a/ß-белков.
18.6.1. Т-клеточные рецепторы представляют собой антителоподобные гетеродимеры [32]
Поскольку Т-клетки активируются только в результате тесного контакта с другими клетками, их рецепторы для антигенов существуют только в мембраносвязанной форме. Поэтому такие рецепторы было трудно выделить - в отличие от антител, которые секретируются (но могут быть и мембраносвязанными), и значительно больше времени потребовалось на то, чтобы идентифицировать эти молекулы и кодирующие их гены, Первые рецепторные белки были выделены в 1983 г., после того как стало возможным выращивать в культуре чистые клоны антигенспецифических Т-клеток (разд. 18.6.11), что позволило иметь большие количества Т-клеток с идентичными рецепторами. Затем могли быть получены моноклональные антитела против клонированных клеток, и те из них, которые узнают Т-клеточный рецептор, были идентифицированы по их способности блокировать вызванные антигеном ответы исходных клеток, но не ответы других Т-клеточных клонов. Эти антитела были затем использованы для очистки молекул рецепторов; оказалось, что рецептор состоит из двух полипептидных цепей а и ß, соединенных дисульфидными связями. Каждая из этих цепей имеет отличительную особенность, общую у них с антителами, - наличие вариабельной N-концевой и константной С-концевой областей (рис. 18-46).
Примерно год спустя эти черты сходства с антителами стали важным элементом остроумного способа выделения генов, кодирующих Т-клеточные рецепторы. Т- и В-лимфоциты близко родственны, поэтому большинство генов транскрибируется у них одновременно, и, значит, они содержат в основном одни и те же мРНК; однако мРНК для Т-клеточного рецептора содержат только Т-клетки. Исследователи взяли суммарную мРНК Т-клеточных клонов, гибридизацией на истощение удалили мРНК, содержащуюся также и в В-клетках (разд. 5.6.4), и получили небольшую популяцию мРНК, свойственную только Т-клеткам. Затем из этой мРНК приготовили библиотеку кДНК (разд. 5.6.3) и использовали индивидуальные клоны кДНК из этой библиотеки дм получения радиоактивных ДНК-зондов. Предполагая, что вариабельность N-концов Т-клеточных рецепторных белков (как и V-областей антител) создается путем перестроек ДНК, каждый из ДНК-зондов использовали затем для анализа соответствующих геномных ДНК в попытке выявить перестройки в процессе развития Т-клеток. Таким путем в конце концов были локализованы (на разных хромосомах) генные пулы, кодирующие а- и ß-цепи. Было показано, что эти пулы, та же как и генные пулы для антител, содержат отдельные V-, D-, J- и С-сегменты, которые объединяются путем сайт-специфической рекомбинации в процессе развития Т-клеток в тимусе.
За одним исключением, все механизмы, используемые В-клетками для создания разнообразия антител, используются также и Т-клетками для создания разнообразия Т-клеточных рецепторов. Полагают, однако, что у Т-клеток особенно важную роль играют механизмы, связанные с выпадением и вставкой нуклеотидов при соединении генных сегментов. Но зато здесь, по-видимому, не используется механизм соматического гипермутирования, приводимый в действие антигеном (разд. 18.4,4).
Причина этого, возможно, состоит в том, что при гипермутировании могли бы возникать Т-клетки, реагирующие со «своими» молекулами. Такого рода проблема гораздо менее существенна для В-клеток, так как большая часть В-клеток, реагирующих на «свое», не могла бы активироваться без помощи реагирующих на «свое» Т-клеток-хелперов (разд. 18.6.12).
Недавно были обнаружены Т-клеточные рецепторы второго типа-гетеродимеры, состоящие из у- и δ-цепей. Эти рецепторы экспрессируются на субпопуляциях клеток с неизвестными функциями в тимусе, эпидермисе и кишечном эпителии.
Как a/ß-, так и y/δ-Т-клеточные рецепторы физически ассоциированы на поверхности клетки с одним и тем же набором полипептидных цепей - так называемым комплексом ТЗ (или CD3). Этот комплекс имеется на поверхности всех зрелых Т-клеток. Полагают, что он участвует в передаче сигнала от активированного антигеном Т-клеточного рецептора внутрь клетки.
18.6.2. Различные ответы Т-лимфоцитов опосредуются разными классами этих клеток [33]
Т-лимфоциты убивают клетки, инфицированные вирусами, а также способствуют или противодействуют ответам других лейкоцитов. Эти три функции осуществляются разными классами Т-лимфоцитов - цитотоксическими Т-клетками, Т-клетками-хелперами (или индукторами) и Т-клетками-супрессорами соответственно. Цитотоксические Т-клетки вместе с В-клетками - это главные эффекторные клетки иммунной системы; Т-хелперы и Т-супрессоры вместе называют Т-клетками-регуляторами.
Из трех основных классов Т-клеток мы меньше всего знаем о Т-супрессорах. Известно, например, что Т-хелперы и цитотоксические Т-клетки используют для узнавания антигена одни и те же рецепторы (a/ß-гетеродимеры), тогда как природа рецепторов, используемых Т-супрессорами, пока неясна (хотя по крайней мере некоторые из них, видимо, тоже используют a/ß-гетеродимеры). Одна из причин ограниченности наших знаний о Т-супрессорах состоит в том, что было чрезвычайно трудно получить в культуре клоны этих клеток, в то время как получать антиген-специфичные клоны цитотоксических Т-клеток и Т-хелперов сравнительно легко (разд. 18.6.11).
Хотя цитотоксические Т-клетки и Т-хелперы используют антигенные рецепторы, кодируемые одними и теми же пулами генных сегментов, они не могут узнавать одни и те же молекулы МНС на поверхности клеток. Такое различие отражает разные функции клеток этих двух типов.
18.6.3. Цитотоксические Т-лимфоциты убивают клетки, инфицированные вирусами [34]
Вирусы воспроизводятся внутри клеток, где они укрыты от воздействия антител; поэтому наиболее эффективный способ предотвратить их распространение на другие клетки состоит в том, чтобы убить инфицированную клетку еще до начала сборки вируса. Это и есть основная функция цитотоксических Т-клеток. Ввиду высокого разрушительного потенциала этих лимфоцитов чрезвычайно важно, чтобы их атака была ограничена только инфицированными клетками. Как показала микрокиносъемка, цитотоксическая Т-клетка в каждый данный момент может сосредоточить свою атаку лишь на одной клетке-мишени, даже если с нею связалось несколько клеток-мишеней. Каким же образом цитотоксическая клетка так точно направляет свою атаку?
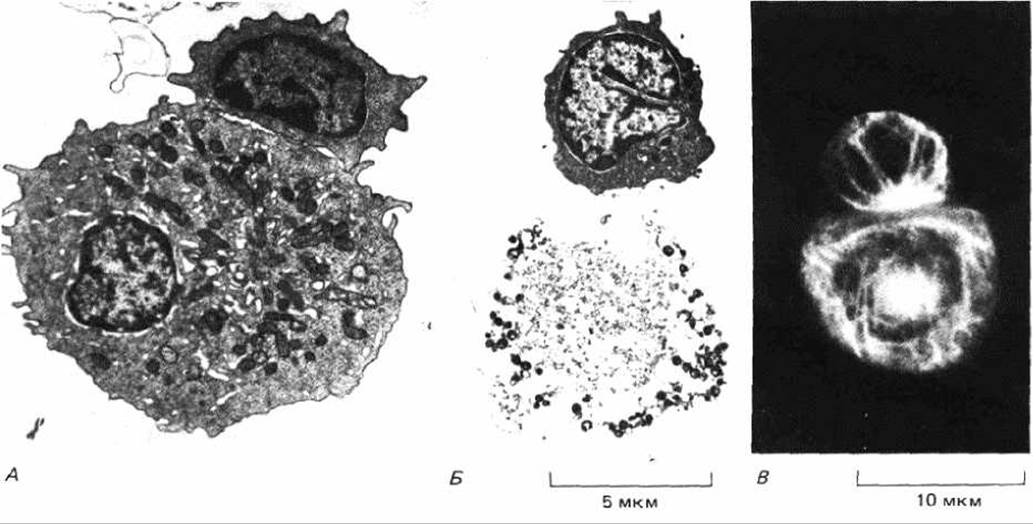
Рис. 18-47. Цитотоксическая Т-клетка (меньшая из двух) и убиваемая ею в культуре клетка-мишень. А и Б электронные микрофотографии; В- картина иммунофлуоресценции после окрашивания антителами к тубулину. Цитотоксические Т-клетки были взяты у мышей, иммунизированных клетками-мишенями -чужеродными опухолевыми клетками. Показано, как Т-клетка и клетка-мишень связываются друг с другом (А, В); на фото Б- Т-клетка после того, как она убила клетку-мишень. Обратите внимание, что у Т-клетки, но не у клетки-мишени центросома и расходящиеся от нее микротрубочки ориентированы в точку межклеточного контакта (А и Б из D. Zagury et al., Eur. J. Immunol., 5, 818-822, 1975; В из В. Geiger et al., J. Cell Biol., 95, 137-143, 1982. Copyright permission of the Rockefeller Univ. Press.)
По-видимому, направляющий механизм зависит от перестройки цитоскелета цитотоксической клетки в результате специфического контакта с поверхностью клетки-мишени. Если цитотоксическую Т-клетку во время ее взаимодействия с атакуемой мишенью пометить антителами к тубулину, то можно увидеть, что ее центросома ориентирована в точку контакта с клеткой-мишенью (рис. 18-47). Кроме того, если клетку пометить антителами к талину - белку, участвующему, видимо, в соединении рецепторов клеточной поверхности с кортикальными актиновыми филаментами (разд. 11.2.8), то окажется, что талин сконцентрирован в кортексе цитотоксической клетки в месте контакта. Имеются данные в пользу того, что агрегация Т-клеточных рецепторов в участке контакта приводит к локальному талин-зависимому скоплению актиновых филаментов; затем механизм, зависимый от микротрубочек, ориентирует центросому и связанный с нею аппарат Гольджи к участку контакта, направляя воздействие убивающего аппарата на клетку-мишень. Аналогичную поляризацию цитоскелета можно наблюдать и при функциональном взаимодействии Т-хелпера с клеткой, которой он «помогает».
18.6.4. Как цитотоксические Т-клетки убивают свои мишени? [35]
Цитотоксические клетки защищают нас не только от обычных вирусных инфекций, но и от опухолей вирусного происхождения. Однако такие опухоли составляют, вероятно, менее 20% всех злокачественных опухолей человека. Кроме того, имеющиеся данные никак не свидетельствуют в пользу того, что иммунные ответы защищают нас и от большинства других видов рака: в условиях иммуносупрессии люди и экспериментальные животные более подвержены вирусным опухолям (а также опухолям предполагаемой вирусной природы), но этого нельзя сказать о спонтанных и химически индуцированных опухолях. Большой интерес вызывает, однако, возможная роль неиммунологических механизмов в защите от рака. Опухолевые клетки могли бы уничтожаться макрофагами или естественными клетками-киллерами (NK, natural killer cells). NK-клетки представляют собой лимфоцитоподобные клетки, вероятно, такого же рода, что и К-клетки, которые убивают эукариотические клетки, покрытые антителами (разд. 18.2.5). Но в отличие от К-клеток NK-клетки могут также спонтанно и относительно неспецифически убивать многие опухолевые и инфицированные вирусами клетки в культуре в отсутствие антител. Как они в этих случаях отличают аномальные клетки от нормальных, не известно.
Мы не знаем, каким образом цитотоксические Т-клетки и NK-клетки убивают свои мишени. Некоторые линии NK-клеток и цитотоксических Т-клеток, которые можно неопределенно долго поддерживать в культуре, используют для этого механизм, вероятно, сходный с действием системы комплемента. Связывание с мишенями ведет к высвобождению этими клетками порообразующих белков, называемых перфоринами, которые полимеризуются в плазматической мембране клетки-мишени, превращаясь в трансмембранные каналы. Как полагают, эти каналы делают мембрану проницаемой, что способствует гибели клетки. Перфорины, которые гомологичны компоненту комплемента С9, хранятся в секреторных пузырьках и освобождаются путем локального экзоцитоза в месте контакта с клеткой-мишенью. В секреторных пузырьках содержатся также сериновые эстеразы, однако играют ли они какую-либо роль в гибели клетки-мишени, неизвестно. На электронных микрофотографиях перфориновые каналы в мембране клеток-мишеней выглядят очень сходно с каналами, образуемыми компонентом С9, и это подкрепляет мысль о сходстве механизмов действия цитотоксических клеток и комплемента. Однако обычные цитотоксические Т-лимфоциты и NK-клетки могут убивать клетки-мишени и без участия перфоринов, с помощью какого-то механизма, молекулярная основа которого не известна. Одна из возможностей состоит в том, что эти клетки активируют в клетке-мишени некий внутренний механизм саморазрушения, который приводит ее к «самоубийству».
Какие молекулы узнают NK-клетки на убиваемых ими мишенях, неизвестно. Между тем выяснено, что цитотоксические Т-клетки узнают вирусные молекулы, связанные с гликопротеинами МНС на поверхности клеток, инфицированных вирусами. Однако лишь недавно установлена решающая роль молекул МНС в «представлении» антигена Т-клеткам.
18.6.5. Молекулы МНС определяют отторжение трансплантата [36]
О молекулах МНС было известно задолго до того, как стала понятна их нормальная функция. Они были первоначально определены как главные антигены-мишени в реакциях на трансплантат. Пересадка ткани взрослого донора особи того же вида (аллотрансплантация) или иного вида (ксенотрансплантация) приводит обычно к ее отторжению. Эксперименты по пересадке кожи между разными линиями мышей, проведенные в 50-х годах, показали, что отторжение трансплантата обусловлено иммунной реакцией на чужеродные антигены, находящиеся на поверхности его клеток. Позднее было показано, что в этих реакциях участвуют главным образом Т-клетки и что они направлены против генетически «чужеродных» вариантов гликопротеинов клеточной поверхности, получивших название молекул гистосовместимости (т.е. совместимости тканей). Из них особенно большое значение имеют главные молекулы гистосовместимости - семейство гликопротеинов, кодируемое генами, составляющими главный комплекс гистосовместимости (МНС). Молекулы МНС имеются на поверхности клеток всех высших позвоночных. Впервые они были найдены у мышей и названы антигенами Н-2 (histocompatibility-2). У человека они носят название HLA (human-leucocyte-associated), так как были первоначально обнаружены на лейкоцитах.
Три удивительных свойства молекул МНС в течение многих лет ставили иммунологов в тупик. Во-первых, эти молекулы занимают совершенно особое место среди антигенов-мишеней по своему значению при Т-клеточных трансплантационных реакциях. Во-вторых, узнавать чужеродные молекулы МНС может необычно большая доля Т-лимфоцитов: если на типичный вирусный антиген отвечает менее 0,001% Т-клеток организма, то на одиночный чужеродный МНС-антиген реагирует уже более 0,1% Т-клеток. В-третьих, многие из локусов, кодирующих молекулы МНС, более полиморфны, чем какие-либо другие у высших позвоночных. Это означает, что в пределах данного вида каждый локус представлен необычно большим числом аллелей (альтернативных форм одного и того же гена) - их может быть более 100, и каждый аллель встречается в популяции с относительно высокой частотой. По этой причине, а также потому, что каждый индивидуум имеет семь или больше локусов, кодирующих молекулы МНС (см. ниже), очень редко можно встретить два организма, имеющих идентичный набор гликопротеинов МНС. Это делает весьма трудным подбор доноров и реципиентов при трансплантации органов людям (за исключением генетически идентичных близнецов).
Однако позвоночным не нужна защита от вторжения чужеродных клеток других позвоночных. Поэтому наблюдаемая «одержимость» Т- клеток чужеродными молекулами МНС и исключительный полиморфизм этих молекул были не только препятствием для пересадки органов, но и загадкой для иммунологов. Загадка была решена только после того, как выяснилось, что молекулы МНС направляют Т-лимфоциты на те клетки собственного организма, на поверхности которых имеются чужеродные антигены, например на клетки, инфицированные вирусом, Позже мы увидим, как это открытие помогло в значительной степени разрешить загадку МНС (разд. 18.6.8).
18.6.6. Существуют два основных класса молекул МНС [37]
Существуют два основных класса молекул МНС-класс I и класс 11, каждый из которых представляет собой набор гликопротеинов клеточной поверхности, кодируемых двумя сцепленными группами генов, вместе составляющих главный комплекс гистосовместимости (рис. 1848). Гликопротеины обоих классов - гетеродимеры с гомологичной общей структурой. Их N-концевые домены предназначены, по-видимому, для связывания антигена и его представления Т-клеткам.
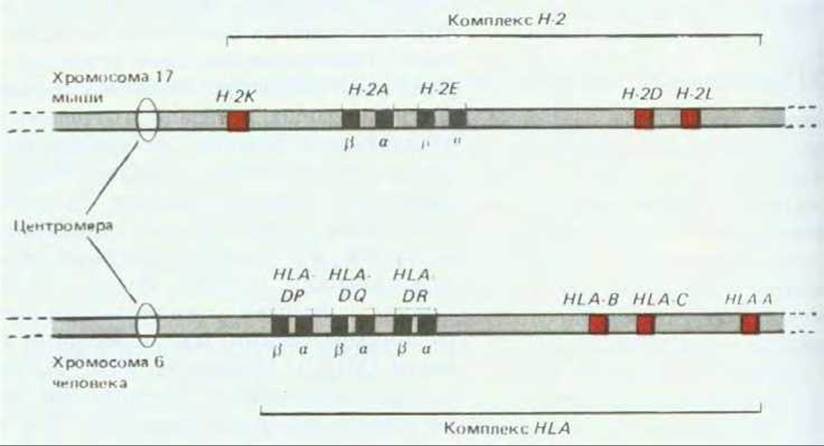
Рис. 18-48. Схема генных комплексов Н-2 и HLA; показано расположение локусов, кодирующих гликопротеины МНС класса I (красные участки) и класса II (черные участки). Существуют три типа гликопротеинов класса I (Н-2К, H-2D и H-2L у мыши; HLA-A, HLA-B и HLA-C у человека); каждый гликопротеин состоит из a-цепи, кодируемой одним из показанных здесь локусов, и цепи ß2-микроглобулина, кодируемой геном в другой хромосоме. У мыши имеются два типа гликопротеинов МНС класса II-H-2A и Н-2Е; каждый из них состоит из a-цепи и ß-цепи. Показаны только три типа молекул класса II человека -HLA-DP, HLA-DQ и HLA-DR (каждая состоит из a- и ß-цепи), хотя имеются еще по меньшей мере один или два других типа. Молекулы DP и DR человека гомологичны Н-2Е мыши, a DQ человека Н-2А мыши. Все эти локусы сильно полиморфны, за, исключением H-2Fa и его гомологов DPa и DRa у человека, полиморфизм которых значительно меньше. В генном комплексе есть и много других локусов, продукты которых сходны с молекулами МНС класса I, однако их функции не известны.
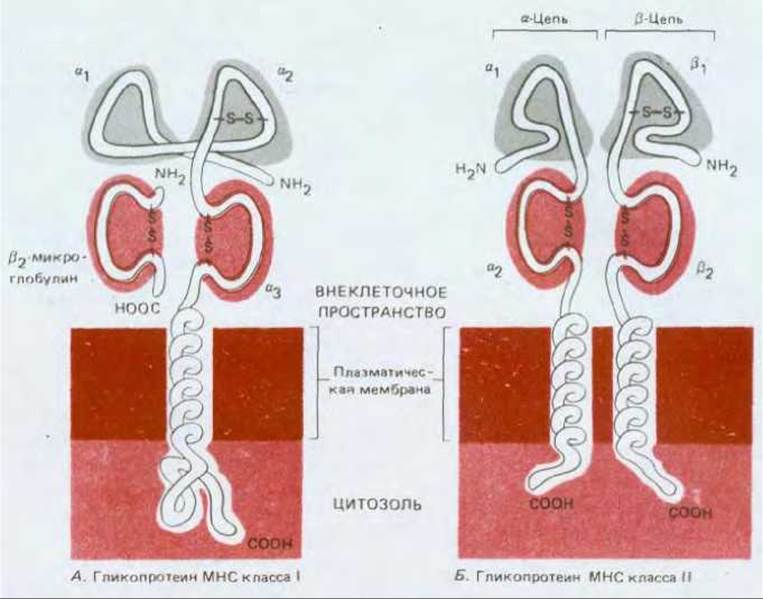
Рис. 18-49. Молекулы гликопротеинов МНС класса I (А) и класса II (Б). a-цепь молекулы класса I длиной около 345 аминокислотных остатков имеет три внеклеточных домена, a1, a2 и а3, кодируемых отдельными экзонами. Молекула нековалентно связана с полипептидной цепью меньших размеров - ß2 микроглобулином (96 аминокислот), который не кодируется в МНС. Домен аз и ß2-микроглобулин гомологичны доменам иммуноглобулинов. ß2- Микроглобулин инвариантен, однако a-цепь чрезвычайно полиморфна - главным образом это относится к доменам a1 и а2. Путем создания (методами генетической инженерии) гибридных генов, содержащих в одном локусе смесь экзонов a1, a2 и a3 из разных аллелей, и последующей трансфекции этими генами культивируемых фибробластов было показано, что антигенные детерминанты, узнаваемые Т-клетками, формируются путем взаимодействия доменов a1 и a2
В составе молекул МНС класса II полиморфны обе цепи (3 в большей степени, чем а), главным образом за счет доменов a1 и ß1. Домены a2 и ß2 гомологичны доменам иммуноглобулинов. Эксперименты с трансфекцией, аналогичные описанным выше для молекул МНС пасса I, показывают, что антигенные детерминанты молекул класса II, узнаваемые Т-клетками, формируются совместно доменами a1 и ß1.
Таким образом, гликопротеины МНС классов I и II во многом поразительно сходны. У тех и других имеются четыре внеклеточных домена, из которых три содержат внутрицепочечные дисульфидные связи. Два ближайших к мембране домена подобны иммуноглобулиновым. Другие два домена взаимодействуют, образуя сложную трехмерную поверхность; в дальнейшем мы увидим, что эта поверхность, по-видимому, связывает чужеродный антиген и представляет его Т-клеткам. Все цепи, за исключением ß2-микроглобулина, гликозилированы (на схеме не показано).
Каждый ген молекулы МНС класса I кодирует одну трансмембранную полипептидную цепь (обозначаемую a), большая часть которой свернута в три внеклеточных глобулярных домена (a1, a2, a3). Каждая a-цепь нековалентно ассоциирована с небольшим внеклеточным негликолизированным белком - ß2-микроглобулином, который не связан непосредственно с мембраной и кодируется отдельным геном, находящимся в другой хромосоме (рис. 18-49, А). Как ß2-микроглобулин, так и домен a3, расположенные ближе к мембране, гомологичны отдельному домену иммуноглобулинов. Два N-концевых домена a-цепи, наиболее удаленные от мембраны, содержат полиморфные (вариабельные) остатки, которые узнаются Т-клетками при трансплантационных реакциях.
Молекулы МНС класса II тоже представляют собой гетеродимеры с двумя консервативными иммуноглобулиноподобными доменами вблизи мембраны и двумя полиморфными (вариабельными) N-концевыми доменами, расположенными дальше от мембраны. Однако в этих молекулах обе цепи кодируются в пределах МНС и обе проходят насквозь через мембрану (рис. 18-49, Б). Наличие Іg-подобных доменов в гликопротеинах классов I и II позволяет предположить, что молекулы МНС и антитела имеют общую эволюционную историю (разд. 18.6.20).
Есть веские данные в пользу того, что полиморфные области молекул МНС обоих классов взаимодействуют с чужеродным антигеном и что именно комплекс молекул МНС с чужеродным антигеном узнается Т-клеточным рецептором. Однако прежде чем обсуждать эти данные, мы рассмотрим ту различную роль, которую играют молекулы класса I и класса II, направляя цитотоксические Т-лимфоциты и Т-хелперы к соответствующим клеткам-мишеням.
Главное функциональное различие между молекулами МНС класса I и класса II находит отражение в их распределении по тканям. Молекулы МНС класса I экспрессируются практически на всех клетках, содержащих ядро, тогда как распространение молекул класса II ограничено в основном клетками, участвующими в иммунных ответах.
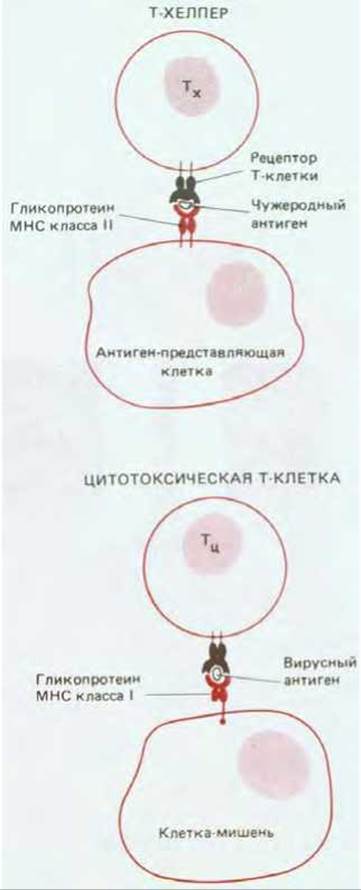
Рис. 18-50. Цитотоксические Т-клетки узнают чужеродные вирусные антигены в ассоциации с гликопротеинами МНС класса I на поверхности любой клетки-хозяина, тогда как Т-хелперы узнают чужеродные антигены в ассоциации с гликопротеинами МНС класса II на поверхности антиген-представляющей клетки. При трансплантационных реакциях клетки- хелперы тоже реагируют против чужеродных гликопротеинов класса II, а цитотоксические клетки - против чужеродных гликопротеинов класса I.
Причиной такого распределения может быть то, что молекулы класса I узнаются цитотоксическими Т-клетками, которые должны иметь возможность взаимодействовать с любой клеткой организма, оказавшейся зараженной вирусом, тогда как молекулы класса II узнаются Т-хелперами, которые взаимодействуют в основном с другими клетками, участвующими в иммунных ответах, такими как В-клетки и антиген-представляющие клетки (рис. 18-50, см. также разд. 18.6.10). Важнейшие свойства гликопротеинов МНС двух классов суммированы в табл. 18-2.
18.6.7. Цитотоксические Т-клетки узнают чужеродные антигены, ассоциированные с молекулами МНС класса 1 [38]
То, что молекулы МНС представляют чужеродные антигены Т-клеткам, было впервые четко показано в 1974 г. в эксперименте с цитотоксическими Т-клетками. Мышей линии X заражали вирусом А. Через семь дней в селезенке у этих мышей были активные цитотоксические Т-клетки, которые в клеточной культуре могли за несколько часов убить зараженные вирусом фибробласты линии X. Как и следовало ожидать, они убивали фибробласты, инфицированные только вирусом А, но не вирусом В; следовательно, цитотоксические Т-клетки были вирус-специфичны. Однако неожиданно оказалось, что те же самые Т-клетки не убивают фибробластов, инфицированных тем же вирусом А, если эти фибробласты взяты от мышей линии Y (рис. 18-51). Значит, цитотоксические Т-лимфоциты узнавали не один только вирус, но и какое-то различие между двумя типами фибробластов. Используя специальные линии мышей (так называемые конгенные линии), которые были либо генетически идентичны, за исключением локусов МНС класса I, либо генетически различны, за исключением тех же локусов, удалось показать, что инфицированные клетки-мишени могли быть убиты только в том случае, если они экспрессировали хотя бы одну такую же молекулу МНС класса I, что и первоначально инфицированная мышь. Это показывало, что гликопротеины МНС класса I необходимы для представления вирусных антигенов, связанных с клеточной поверхностью, цитотоксическим Т-клеткам. Поскольку Т-клетки данной особи узнают антиген лишь тогда, когда он ассоциирован с собственными молекулами МНС этой особи, такое совместное узнавание часто называют рестрикцией МНС. Только спустя 10 лет в серии экспериментов с цитотоксическими Т-клетками, реагирующими на вирус гриппа, удалось выяснить химическую природу вирусных антигенов, узнаваемых этими клетками.
18.6.8. Цитотоксические Т-клетки узнают фрагменты вирусных белков на поверхности клеток, инфицированных вирусами [39]
С 60-х годов известно, что Т-клетки, в отличие от В-клеток (и антител). обычно не узнают антигенные детерминанты в белке, образующем третичную структуру (см. рис. 18-23, А), но узнают детерминанты развернутой полипептидной цепи. Причины этого стали понятны, когда накопились данные о том, что антигены, различаемые Т-клетками, обычно расщепляются внутри клетки-хозяина, прежде чем их фрагменты будут представлены на ее поверхности (вначале это были данные о том, как Т-хелперы узнают антиген - см. ниже, разд. 18.6.10). Первыми прямыми данными о таком механизме представления антигена цитотоксическим Т-клеткам было сообщение о том, что некоторые цитотоксические Т- клетки, активированные вирусом гриппа, специфически узнают внутренние белки вируса, которые не могли быть доступны в интактной вирусной частице. Затем были получены данные в пользу того, что Т-клетки узнают фрагменты внутренних вирусных белков. Вирусы - внутриклеточные паразиты, и их белки синтезируются путем экспрессии вирусных генов внутри инфицированной клетки (разд. 5.5). Поэтому можно предположить, что некоторые фрагменты образующихся вирусных белков «просачиваются» на поверхность зараженной клетки и связываются с молекулами МНС либо на поверхности, либо где-то внутри клетки (рис. 18-52).
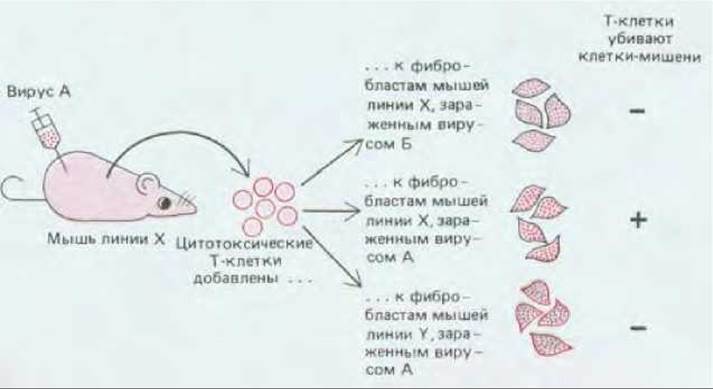
Рис. 18-51. Классический эксперимент, который показал, что цитотоксическая Т-клетка помимо вирусного антигена узнаёт и какой-то компонент поверхности клетки, инфицированной вирусом. Путем повторения этого опыта с клетками-мишенями, отличающимися от клеток инфицированной мыши только по ограниченным участкам генома, было показано, что компонент клеточной поверхности, узнаваемый цитотоксической Т-клеткой, представляет собой гликопротеин МНС класса I. Убивающую способность активных цитотоксических Т-клеток удобнее всего оценивать, используя радиоактивный изотоп 51Сг, который поглощается живыми клетками и освобождается только после их гибели. Поэтому стандартный метод оценки активности цитотоксических Т-клеток включает их инкубацию в течение нескольких часов с клетками-мишенями, содержащими 51Сг, а затем измерение количества 51Сг, освобожденного из убитых клеток-мишеней.
Такую точку зрения подкрепляют экспериментальные данные двоякого рода. Во-первых, если нормальные фибробласты в культуре на короткое время привести в соприкосновение с фрагментами внутреннего белка вируса гриппа (нуклеопротеина, НП на рис. 18-52), то эти клетки будут узнаваться и убиваться цитотоксическими Т-клетками, которые первоначально были активированы фибробластами, зараженными вирусом гриппа, но только в том случае, если те и другие фибробласты экспрессируют одни и те же гликопротеины МНС класса I. Во-вторых, если в нормальные фибробласты ввести последовательность ДНК, кодирующую фрагмент нуклеопротеина вируса гриппа, то трансфецированные клетки будут убиваться такими же цитотоксическими Т-клетками, как и в первом эксперименте. Эти и другие эксперименты позволяют предполагать, что фрагменты вирусных белков могут попадать на поверхность клетки и связываться там с молекулами МНС класса I.
Таблица 18-2. Свойства молекул МНС класса 1 и класса II
|
Класс I |
Класс II |
|
|
Генетические локусы |
Н-2К, H-2D, H-2L у мыши; HLA-A, HLA-B, HLA-C у человека |
Группы І-A и 1-Е у мыши; DP, DQ, DR и одна или две другие группы у человека |
|
Субъединичная структура |
а-Цепь (~ 45000 Да) + ß2-микроглобулин (11500 Да) |
а-Цепь (29000-34000 Да) + ß-цепь (25000 28000 Да) |
|
Распределение между клетками |
На поверхности почти всех клеток, содержащих ядро |
На поверхности В-клеток, антиген-представляющих клеток, эпителиальных клеток тимуса и некоторых других клеток |
|
Участие в представлении антигена |
Главным образом цитотоксическим Т-клеткам |
Главным образом Т-хелперам |
|
Полиморфные домены, участвующие в узнавании Т-клеток и связывании антигена |
а1 +а2 |
а1 + ß1 |
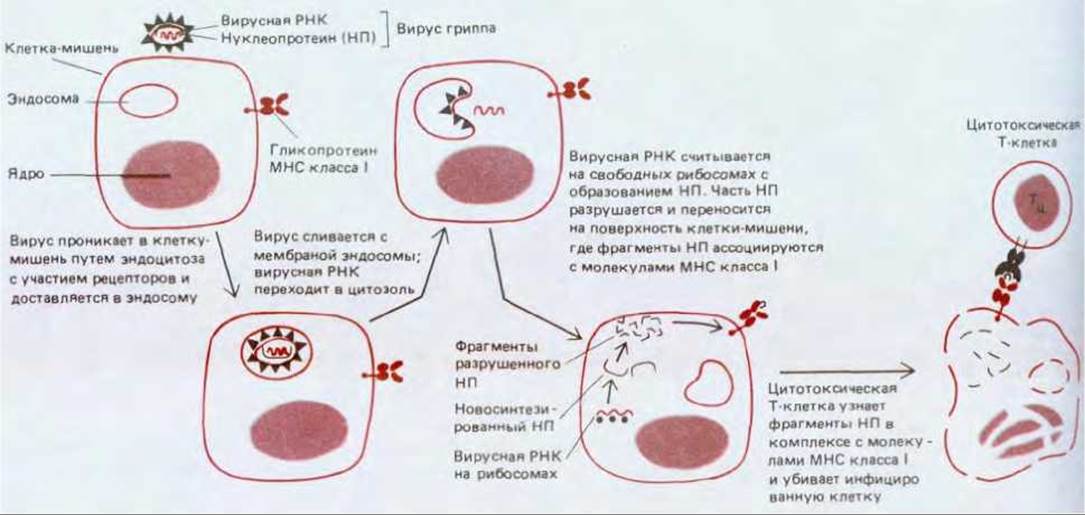
Рис. 18-52. Цитотоксическая Т-клетка убивает клетку, инфицированную вирусом, в том случае, если она узнает фрагменты вирусных белков, связанные с молекулами МНС класса I на поверхности зараженной клетки. В представленном на схеме случае пептидные фрагменты образуются из нуклеопротеина (НП) вируса гриппа; для простоты показан только этот внутренний вирусный белок. Разрушается лишь очень малая доля вирусных белков, синтезируемых в клетке-мишени. Как происходит их расщепление и как образующиеся пептидные фрагменты достигают поверхности клетки, не известно; неясно также, где эти фрагменты первоначально ассоциируются с гликопротеинами МНС.
Нетрудно себе представить, как может происходить расщепление вирусных белков в инфицированных клетках, так как известно, что почти все клеточные белки непрерывно разрушаются (разд. 8.2.4). Труднее понять, как фрагменты вирусного нуклеопротеина попадают на поверхность клетки, поскольку вирусные белки синтезируются на цитоплазматических рибосомах и в обычных условиях не имеют доступа к полости эндоплазматического ретикулума, где обычно начинают свой путь белки, предназначенные для клеточной поверхности (разд. 8.1.4). Однако для узнавания Т-клетками требуются, вероятно, очень небольшие количества антигена. Поэтому случайный выход даже небольшой доли фрагментов нуклеопротеина на клеточную поверхность может привести к образованию клетки-мишени, которую мог бы узнать цитотоксический Т-лимфоцит.
18.6.9. Рентгеноструктурный анализ позволяет выявить антиген-связывающий участок гликопротеина МНС класса I [40]
Понимание того, каким образом молекулы МНС представляют антиген Т-клеткам, сильно продвинулось в 1987 г., когда методом рентгеноструктурного анализа была изучена трехмерная структура гликопротеина МНС класса I человека. Как показано на рис. 18-53, А, этот белок имеет единственный предполагаемый антиген-связывающий участок, находящийся на одном из концов молекулы. Он состоит из глубокой бороздки между двумя длинными а-спиралями, принадлежащими доменам a1 и а2; основание бороздки образуют восемь тяжей ß-структуры в составе тех же доменов. Размеры бороздки - примерно 2,5 нм в ширину и 10 нм в длину. Этого достаточно для того, чтобы разместить пептид из 10-20 аминокислотных остатков в зависимости от того, насколько плотно уложена его цепь путем сворачивания или изгибания. Интересно, что в кристаллизованном белке бороздка не была пустой: она содержала небольшую молекулу неизвестного происхождения. Предполагают, что это пептид, который очищается и кристаллизуется вместе с гликопротеином МНС (рис. 18-53, Б). Эти данные заставляют заподозрить в бороздке антиген-связывающий участок и указывают на то, что пептид, будучи однажды связан с этим участком, диссоциирует очень медленно. В пользу этого говорит и то, что фибробласты, короткое время соприкасавшиеся с фрагментами нуклеопротеина вируса гриппа, не менее трех дней остаются мишенями для цитотоксических Т-клеток, специфичных в отношении этого вируса.
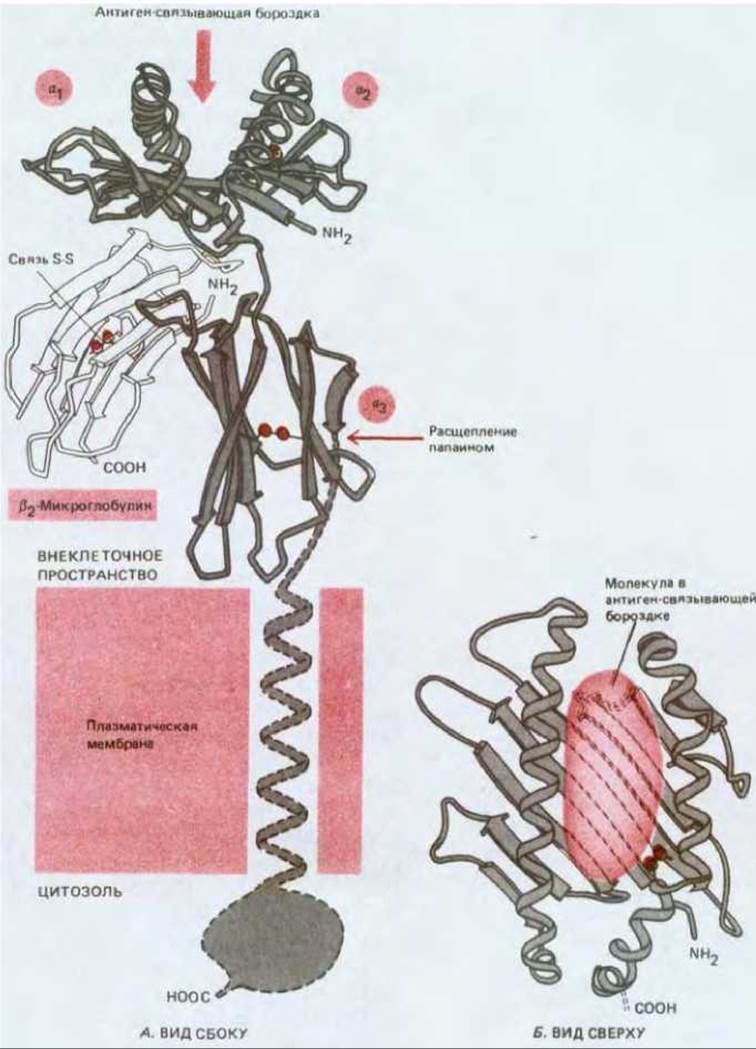
Рис. 18-53. А. Структура гликопротеина МНС класса I человека, основанная на данных рентгеноструктурного анализа кристаллов внеклеточной части молекулы. Путем расщепления протеолитическим ферментом папаином внеклеточная часть молекулы была отделена от трансмембранного сегмента. Оба домена, расположенные ближе всего к плазматической мембране (а3- и ß2-микроглобулины), сходны с типичным доменом иммуноглобулинов (см. рис. 10-28, Б). Два домена, наиболее удаленные от мембраны (а1 и а2), очень сходны между собой и образуют в верхней части молекулы бороздку - предполагаемый антиген-связывающий участок. Полагают, что молекулы МНС класса II имеют весьма сходную структуру. Б. Вид сверху на предполагаемую антиген-связывающую бороздку, содержащую небольшую молекулу (вероятно, пептид), которая очищалась вместе с белком МНС. Именно эта часть молекулы МНС взаимодействует с Т-клеточным рецептором. (По P. J. Biorkman et al., Nature, 329, 506-512, 1987.)
Полиморфные аминокислотные остатки гликопротеина МНС (т. е. те остатки, которые варьируют в зависимости от аллельной формы молекул этого типа) локализованы большей частью либо внутри бороздки, где они могли бы связывать антиген, либо на ее краях, где были бы доступны для узнавания рецепторами Т-клеток. Полагают, что вариабельность молекул МНС класса I-результат отбора, приведшего к тому, что у них появилась способность связывать и представлять множество различных пептидов вирусного происхождения. Тем не менее продолжает удивлять то, что малое число различных антиген-связывающих участков у молекул МНС класса I данного организма (максимум шесть у человека) может связывать весьма разнообразные вирусные пептиды, специфически узнаваемые Т-клетками. Еще более загадочны в этом отношении гликопротеины МНС класса II, трехмерная структура которых, по-видимому, очень сходна со структурой молекул класса I. Хотя у индивидуума вырабатывается всего лишь примерно от 10 до 20 видов молекул класса II (каждая со своим собственным антиген-связывающим участком), эти молекулы, видимо, способны связывать практически неограниченное множество чужеродных пептидов и представлять их Т-хелперам, которые играют решающую роль почти во всех иммунных ответах.
18.6.10. Т-хелперы узнают фрагменты чужеродных антигенов в ассоциации с гликопротеинами МНС класса II на поверхности антиген-представляющих клеток [41]
Т-хелперы необходимы лимфоцитам большинства других типов для оптимального ответа на антиген. Решающую роль Т-хелперов в иммунитете драматически демонстрирует опустошительная эпидемия синдрома приобретенного иммунодефицита (СПИД). Заболевание вызывается ретровирусом (вирусом иммунодефицита человека, ВИЧ), который убивает Т-хелперы и тем самым приводит в негодность иммунную систему: больной становится восприимчивым к. заражению микроорганизмами, которые редко инфицируют здоровых людей. В результате большинство больных СПИДом умирает в течение нескольких лет после появления симптомов болезни.
Прежде чем Т-хелперы смогут помогать другим лимфоцитам отвечать на антиген, они должны быть сначала активированы сами. Эта активация происходит тогда, когда Т-хелпер узнает чужеродный антиген, связанный с гликопротеином МНС класса II на поверхности специализированной антиген-представляющей клетки. Такие клетки имеются в большинстве тканей. Они происходят из костного мозга и составляют гетерогенную популяцию, включающую дендритные клетки лимфоидных органов, клетки Лангерганса в коже и определенные типы макрофагов. Все эти специализированные антиген-представляющие клетки вместе с В-клетками, которые тоже могут представлять антиген Т- хелперам (см. ниже), и эпителиальными клетками тимуса (разд. 18.6.17) - это главные типы клеток, в норме экспрессирующих молекулы МНС класса II (см. табл. 18-2).
Разнообразные эксперименты демонстрируют центральную роль молекул МНС класса II в представлении чужеродных антигенов Т-хелперам. Например, связывание антител с этими молекулами блокирует способность клеток представлять антиген. И наоборот, фибробласты, которые не вырабатывают молекул МНС класса II и не могут представлять чужеродые антигены Т-хелперам, можно превратить в эффективные антиген-представляющие клетки путем их трансфекции геном, кодирующим молекулу МНС класса П.
Так же как и вирусные антигены, представляемые цитотоксическим Т-клеткам, антигены, представляемые Т-хелперам, - это обычно фрагменты разрушенных чужеродных белков. Полагают, что эти пептиды связаны с молекулами МНС класса II таким же способом, как пептиды вирусного происхождения с молекулами МНС класса I (см. рис. 18-53). Однако в отличие от инфицированной вирусом мишени для цитотоксической Т-клетки антиген-представляющая клетка не синтезирует чужеродный белок. Вместо этого чужеродные белки, по-видимому, поглощаются путем эндоцитоза и частично расщепляются в кислой среде эндосом или эндолизосом (разд. 6.5.9), после чего отдельные их фрагменты возвращаются на клеточную поверхность - последовательность событий, называемая в совокупности процессингом антигена (рис. 18-54). Если блокировать эндоцитоз путем слабой фиксации антиген-представляющих клеток (например, формальдегидом) или ингибировать протеолиз в эндолизосомах и лизосомах (например, хлорохином), эти клетки уже не могут осуществлять процессинг чужеродного белка и представлять его Т-хелперам. Однако обработанные таким образом клетки еще способны представлять белок, если перед добавлением к клеткам расщепить его на небольшие пептиды (длиной 10-15 аминокислот).
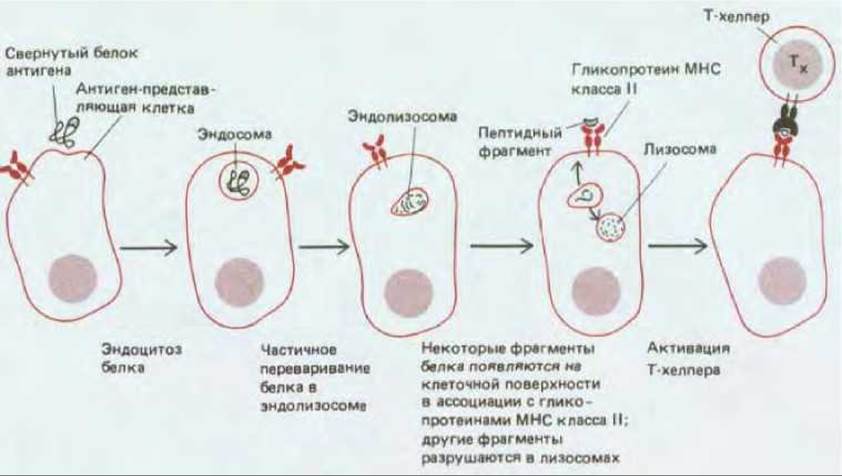
Рис. 18-54. Гипотетическая схема «обработки» белковых антигенов и их представления антиген-представляющими клетками. Было показано, что гликопротеины МНС рециркулируют (т. е. совершают кругооборот) через эндосомный компартмент; поэтому они могли бы сначала ассоциироваться с пептидными фрагментами в эндолизосомном компартменте, а затем возвращаться на клеточную поверхность со связанным пептидом (на схеме не показано).
Поразительное свойство антиген-представляющей клетки состоит в том, что она может подвергать процессингу и представлять соответствующему Т-хелперу практически любой антиген. Такое отсутствие антигенной специфичности указывает на то, что антиген- представляющие клетки, видимо, поглощают антиген путем жидкофазного, а не опосредованного рецепторами эндоцитоза (разд. 6.5.7). Если это так, тогда большинство поглощенных и разрушенных белков будут «своими» белками, пептидные фрагменты которых займут связывающие участки многих молекул МНС класса II. Как полагают, для активации Т-хелпера достаточно того, чтобы чужеродные пептиды присоединились к небольшой доле молекул МНС.
18.6.11. Т-хелперы стимулируют пролиферацию Т-лимфоцитов путем секреции интерлейкина-2 [42]
Активация Т-хелпера - сложный процесс, в нем участвуют различные секретируемые белки, которые носят название интерлейкинов и действуют как локальные химические медиаторы. Активация, видимо, начинается с того, что Т-клетка каким-то неизвестным образом побуждает антиген-представляющую клетку секретировать один или несколько интерлейкинов. Наиболее изученный из этих медиаторов интерлейкин-1 (IL- 1). Комбинированное воздействие IL-1 (и, возможно, других интерлейкинов) и связывания антигена, однако, не стимулирует прямо пролиферацию Т-хелперов. Вместо этого оно приводит к стимуляции Т-клеткой ее собственной пролиферации - заставляет Т-клетку секретировать фактор роста, называемый интерлейкином-2 (IL-2), и синтезировать для него рецепторы, которые будут находиться на клеточной поверхности. Именно связывание IL-2 с этими рецепторами стимулирует пролиферацию Т-клетки. Таким путем Т-хелпер может продолжать пролиферировать при участии аутокринного механизма (разд. 12.1.7), после того как он отойдет от поверхности антиген-представляющей клетки (рис. 18-55). Т-хелперы могут также помогать стимулировать пролиферацию любых других Т-клеток, включая цитотоксические Т-клетки, в которых была ранее индуцирована экспрессия рецепторов IL-2. Но, поскольку экспрессия рецепторов IL-2 строго зависит от стимуляции антигеном, это приводит к пролиферации не всех Т-клеток, а только тех, которые уже встретились с антигеном.
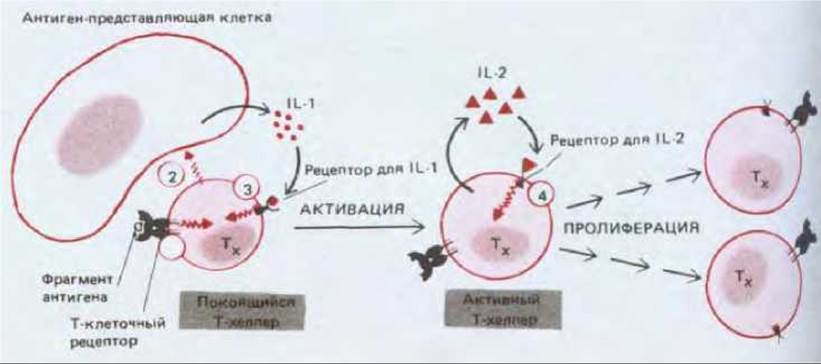
Рис. 18-55. Предполагаемая последовательность событий при стимуляции Т-хелперов антигеном, побуждающей эти клетки к пролиферации.
Связывание Т-клетки с антигеном на поверхности антиген-представляющей клетки заставляет Т-клеточный рецептор запустить инозитолфосфолипидный сигнальный путь (разд. 12.3.9) (сигнал 1). В результате Т-клетка каким-то образом стимулирует антиген-представляющую клетку (сигнал 2). Тогда антиген-представляющая клетка секретирует интерлейкины, в частности интерлейкин-1 (IL-1), которые способствуют активации Т-клетки (сигнал 3). Активированная Т-клетка синтезирует рецепторы для интер-лейкина-2 (IL-2) и секретирует IL-2; связывание IL-2 с IL-2-рецепторами (сигнал 4) стимулирует рост и деление клетки. После устранения антигена прекращается в конце концов и образование IL-2 и IL-2-рецепторов; в результате пролиферация клеток останавливается.
Стоило лишь выявить необходимые для пролиферации Т-клеток условия, как появилась возможность получать неограниченно пролиферирующие антиген-специфические линии Т-клеток в культуре путем непрерывного добавления IL-2 и периодической стимуляции клеток антигеном с целью поддерживать экспрессию рецепторов IL-2. Из таких линий можно было затем выделять одиночные клетки и получать клоны Т-клеток. Как мы уже видели, такие клоны сыграли решающую роль в исследовании Т-клеток. Например, они позволили выделить Т-клеточные рецепторы и их гены; кроме того, они широко использовались для изучения механизмов активации Т-клеток и роли Т-хелперов в стимуляции ответов других лимфоцитов.
18.6.12. Т-хелперы необходимы большинству В-лимфоцитов для ответа на антиген [43]
Т-хелперы нужны для выработки В-клетками антител к большинству антигенов. Это было впервые установлено в середине 60-х годов в экспериментах, в которых облученным мышам вместе с антигеном вводили клетки тимуса или костного мозга. Мыши, получившие только клетки костного мозга или только клетки тимуса, были неспособны вырабатывать антитела; однако, если вводилась смесь тех и других клеток образовывались большие количества антител. Позднее было показано что тимус поставляет Т-клетки, а костный мозг - В-клетки (рис. 18-56) Используя специфический хромосомный маркер для различения введенных Т- и В-клеток, удалось показать, что лимфоциты, секретирующие антитела, - это В-клетки. Был сделан вывод, что Т-клетки, вероятно. помогают В-клеткам реагировать на антиген.
Однако существуют антигены, в том числе многие полисахариды микроорганизмов, которые могут стимулировать пролиферацию созревание В-лимфоцитов без помощи Т-клеток. Такие независимые от Т-клеток антигены - это обычно высокомолекулярные полимеры с повторяющимися идентичными антигенными детерминантами. Много центровое связывание таких антигенов с мембраносвязанными молекулами антител - антигенными рецепторами В-клеток - может давать сигнал, достаточно сильный для прямой активации В-клеток. Имеются данные о том, что клетки, отвечающие таким образом на мультимерные антигены, составляют большей частью отдельную субпопуляцию В-клеток, которые эволюционировали в направлении реакции против микробных полисахаридов без помощи Т-клеток.
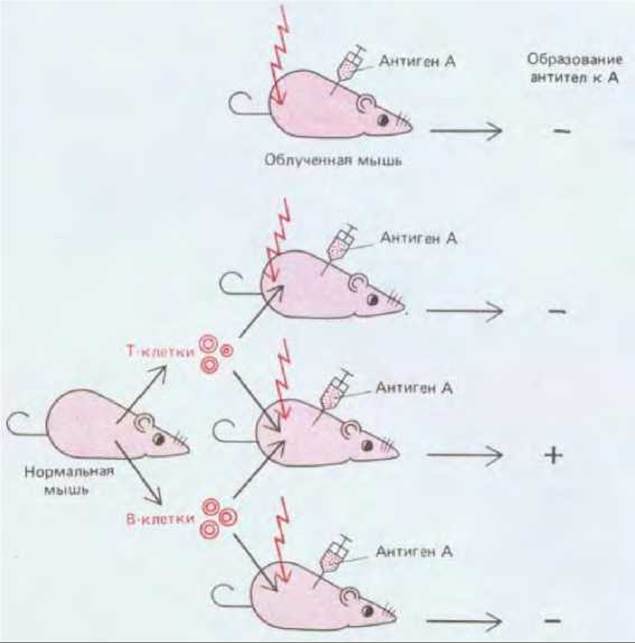
Рис. 18-56. Эксперимент, впервые показавший, что для образования антител животному, вероятно, необходимы как Т-, так и В-клетки. При использованных дозах облучения у мыши погибают те и другие.
18.6.13. Т-хелперы помогают активировать В-клетки путем секреции интерлейкинов [44]
Будучи активирован чужеродным антигеном на поверхности специализированной антиген-представляющей клетки, соответствующий Т- хелпер может помогать активации В-клетки путем связывания с тем же самым чужеродным антигеном на ее поверхности. Антиген-представляющая клетка захватывает и представляет антигены неспецифически (см. выше), но В-клетка, как правило, представляет только тот антиген, который она специфически узнает. Антиген отбирается в результате его присоединения к специфическим мембраносвязанным антителам (антигенным рецепторам) на поверхности В-клетки; он поглощается с помощью опосредованного рецепторами эндоцитоза (разд. 6.5.7), а затем разрушается и вновь появляется на клеточной поверхности в виде пептидов, связанных с гликопротеинами МНС класса II для узнавания Т- хелпером. Таким образом, Т-хелпер узнает на В-клетке, которой он помогает, те же самые комплексы антиген-МНС, что и на антиген-представляющей клетке, первоначально активировавшей Т-клетку.
Специфический контакт между Т-хелпером и В-клеткой вызывает в цитоплазме хелпера внутреннюю перестройку, в результате которой центросома и аппарат Гольджи ориентируются в направлении В-клетки, как это происходит в цитотоксической Т-клетке при контакте с клеткой- мишенью (см. выше, рис. 18-47). В данном случае, однако, ориентация, по-видимому, дает возможность Т-хелперу направлять секрецию интерлейкинов на поверхность В-клетки (а также, возможно, сосредоточивать здесь мембраносвязанные сигнальные молекулы). Эти интерлейкины включают IL-4, который инициирует активацию В-клетки, IL-5, который стимулирует пролиферацию активированных В-клеток, и IL-6, вызывающий созревание активированных В-клеток и превращение их в клетки, секретирующие антитела. Некоторые из этих и другие интерлейкины могут переключать В-клетки с выработки одного класса антител на выработку другого (разд. 18.4.7). Некоторые из сигналов, вероятно, участвующих в начальной активации В-клетки, показаны на рис. 18-57.
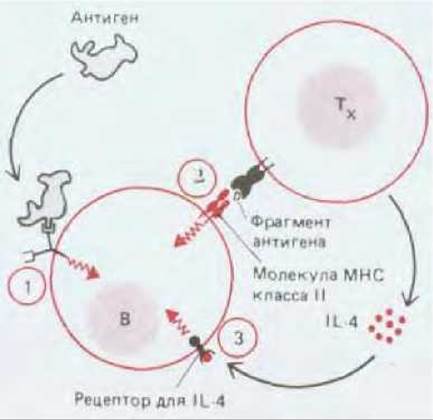
Рис. 18-57. В активации В-клеток на ранних ее этапах участвуют по меньшей мере три типа сигналов. Относительное значение этих сигналов не известно; оно может варьировать в зависимости от типа В-клеток и антигена. Сигнал 1 возникает при связывании антигена; в его передаче, по- видимому, участвуют инозитолфосфолипидный сигнальный путь (разд. 12.3.9). Этот сигнал активирует В-клетку и может индуцировать экспрессию рецепторов для некоторых интерлейкинов, вырабатываемых Т-хелперами. Затем В-клетка поглощает и разрушает антиген (на схеме не показано) и представляет небольшие фрагменты антигена в ассоциации с молекулами МНС класса II Т-хелперу. Дает ли связывание Т-клетки сигнал В-клетке (это показано на рисунке как сигнал 2) или служит лишь для того, чтобы направить секрецию интерлейкина-4 (IL-4) и других интерлейкинов (не показано) на поверхность В-клетки (сигнал 3), не ясно. Кроме активации В-клетки, сигнал 3 также стимулирует образование клеткой большего количества гликопротеинов МНС класса II, тем самым усиливая способность В-клеток воспринимать помощь Т-клеток. После того как В-клетка оказалась активированной, другие интерлейкины, вырабатываемые Т-хелперами (в частности, IL-5, IL-6 и у-интерферон), помогают индуцировать пролиферацию В-клетки и ее созревание в клетку, секретирующую антитела (не показано).
Каким образом сигналы передаются от активированных рецепторов клеточной поверхности внутрь клетки при стимуляции В- или Т-клеток антигеном или интерлейкинами? В отношении рецепторов для интерлейкинов ответ неизвестен. Однако есть веские данные в пользу того, что антигенные рецепторы и на В-, и на Т-клетках подают клетке сигнал. активируя инозитолфосфолипидный путь, который был рассмотрен в гл. 12 (разд. 12.3.9).
18.6.14. Некоторые Т-хелперы активируют макрофаги путем секреции интерферона [45]
Помощь Т-хелперов не ограничивается лимфоцитами. Те Т-хелперы, которые секретируют IL-2 при стимуляции антигеном, выделяют также и другие интерлейкины, например у-интерферон, привлекающий и активирующий макрофаги, которые начинают более эффективно фагоцитировать и разрушать внедрившиеся микроорганизмы. Способность Т-клеток привлекать и активировать макрофаги особенно важна для защиты от некоторых микроорганизмов, способных оставаться живыми после поглощения их неактивированными макрофагами. Таков, например, возбудитель туберкулеза.
Инициируемая антигеном секреция у-интерферона и других активирующих макрофаги интерлейкинов Т-хелперами лежит в основе обычной кожной туберкулиновой пробы. Если туберкулин (экстракт туберкулезных бактерий) ввести в кожу человеку, который был иммунизирован против туберкулеза или болел туберкулезом, в коже развивается характерный иммунный ответ. Его запускает в месте инъекции секреция интерлейкинов Т-хелперами памяти, реагирующими на туберкулин. Привлеченные интерлейкинами, в этом участке кожи собираются макрофаги и лимфоциты, что вызывает характерное припухание - положительную реакцию на туберкулин.
Другое важное действие у-интерферона - индукция экспрессии гликопротеинов МНС класса II на поверхности некоторых клеток (таких, как клетки эндотелия), которые в обычных условиях их не экспрессируют. Это придает таким клеткам способность представлять антиген Т-хелперам. Таким способом Т-хелперы при необходимости могут мобилизовать дополнительные антиген-представляющие клетки.
Есть данные о том, что существуют по меньшей мере два подкласса Т-хелперов. Один из них, видимо, помогает главным образом В- клеткам и секретирует IL-4 и IL-5, а второй помогает другим Т-хелперам и макрофагам и выделяет IL-2 и у-интерферон. Сведения о некоторых интерлейкинах, секретируемых Т-хелперами (или антиген-представляющими клетками), приведены в табл. 18-3.
18.6.15. Белки межклеточной адгезии стабилизируют взаимодействия между Т-клетками и их мишенями [46]
Специфическое связывание комплексов антиген-МНС на поверхности клетки-мишени с a/ß-рецепторами антигена на поверхности Т- клетки часто бывает недостаточно сильным для того, чтобы произошло функциональное взаимодействие между этими двумя клетками. Различные белки межклеточной адгезии (см. разд. 14.3) на Т-клетках помогают стабилизировать такие взаимодействия, увеличивая общую силу связывания клеток между собой. Ранее (разд. 14.2.17) мы уже обсуждали роль белка, асоциированного с функцией лимфоцитов (LFA-1), в том, чтобы помогать Т- и В-клеткам (а также другим лейкоцитам) приклепляться к другим клеткам и к внеклеточному матриксу. Т-клетки экспрессируют также белок клеточной поверхности CD2, который помогает им прикрепляться к соответствующим клеткам-мишеням, связываясь с комплементарным ему гликопротеином на поверхности клетки-мишени, называемым LFA-3.
Таблица 18-3. Свойства некоторых интерлейкинов
|
Интерлейкин |
Другое название |
Приблизительный мол. вес |
Источник |
Мишени Действие |
|
|
L-1 |
15000 |
Антиген-представляющие клетки |
Т-хелперы |
Способствует активации |
|
|
IL-2 |
Фактор роста Т- клеток |
15000 |
Некоторые Т-хелперы |
Все активированные Т- клетки |
Стимулирует пролиферацию |
|
IL-3 |
Мульти-CSF (см. разд. 17.5.8) |
25000 |
Некоторые Т-хелперы |
Разные кроветворные клетки (см. разд. 17.5.8) |
Стимулирует пролиферацию |
|
IL-4 |
Фактор-1 , стимулирующий В- клетки (BSF-1) |
20000 |
Некоторые Т-хелперы |
В-клетки, Т-клетки, тучные клетки |
Способствует активации и стимулирует пролиферацию; увеличивает число молекул МНС класса II на В- клетках |
|
IL-5 |
Фактор-2 роста В-клеток (BCGF-2) |
50000 (димер) |
Некоторые Т-хелперы, образующие IL-4 |
В-клетки, эозинофилы |
Стимулирует пролиферацию и созревание |
|
IL-6 |
Фактор-2, стимулирующий В-клетки |
25000 |
Некоторые Т-хелперы и макрофаги |
Активированные В-клетки, Т-клетки |
Стимулирует созревание В-клеток в Ig-секретирующие клетки; способствует активации Т-клеток |
|
Y-Интерферон |
25000 (димер) |
Некоторые Т-хелперы, образующие IL-2 |
В-клетки, макрофаги, эндотелиальные клетки |
Индуцирует молекулы МНС класса II и активирует макрофаги |
|
* Интерлейкины представляют собой секретируемые пептиды и белки, с помощью которых осуществляются локальные взаимодействия между лейкоцитами; они, однако, не связывают антиген. Интерлейкины, выделяемые лимфоцитами, называют также лимфокинами. Для всех перечисленных здесь белков известна последовательность аминокислот. Приведенные в таблице источники, клетки-мишени в способы действия относятся главным образом к иммунной системе; для большинства интерлейкинов имеется много других источников, мишеней и способов действия, поэтому более точное их название - цитокины.
К наиболее изученным белкам межклеточной адгезии Т-клеток относятся гликопротеины CD4 и CD8, которые экспрессируются на поверхности соответственно Т-хелперов и цитотоксических Т-клеток. У обоих гликопротеинов имеются внеклеточные домены, гомологичные доменам иммуноглобулинов; как полагают, они связываются с инвариантными частями молекул МНС: CD4 с гликопротеинами МНС класса II, a CD8-C гликопротеинами класса I (рис. 18-58).
Некоторые из вспомогательных гликопротеинов, находящихся на поверхности Т-лимфоцитов, представлены в табл. 18-4.
18.6.16. Т-супрессоры главным образом подавляют функцию Т-хелперов [47]
Через несколько лет после того, как была открыта способность Т-лимфоцитов помогать В-клеткам в выработке антител, выяснилось, что Т-клетки могут также подавлять (супрессировать) ответ В-клеток или других Т-клеток на антигены. Такая супрессия была впервые продемонстрирована у мышей: их можно было сделать ареактивными (толерантными) по отношению к бараньим эритроцитам путем повторных инъекций больших количеств таких эритроцитов. Когда Т-клетки от толерантных мышей вводили нормальным мышам, те тоже становились специфически толерантными к антигенам бараньих эритроцитов. Это означает, что толерантное состояние обусловлено в данном случае супрессией иммунного ответа Т-клетками. Последующие эксперимента с использованием поверхностных антигенных маркеров показали, что клетки, ответственные за этот эффект, представляют собой специализированный класс Т-лимфоцитов - так называемые Т-супрессоры. Но, как мы увидим позже, не все формы иммунологической толерантности обусловлены Т-супрессорами.
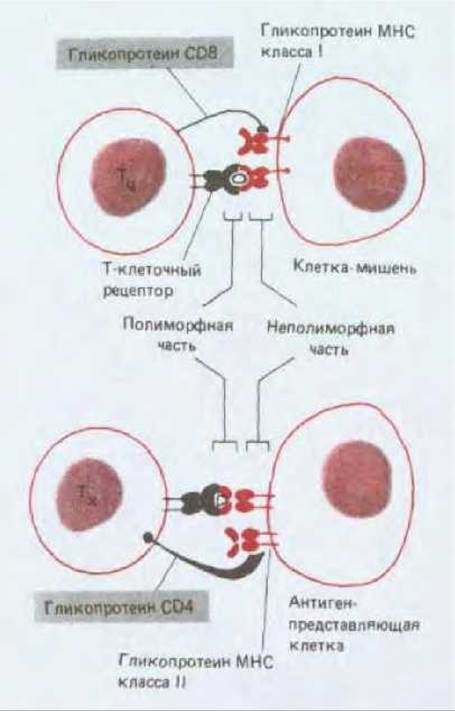
Рис. 18-58. Роль двух вспомогательных рецепторных белков, расположенных на поверхности Т-клеток. Гликопротеин CD8 на цитотоксических Т- клетках связывается, по-видимому, с молекулами МНС класса I, а гликопротеин CD4 на Т-хелперах - с молекулами МНС класса II. Полагают, что в обоих случаях происходит связывание с невариабельными частями молекул МНС. Эти белки межклеточной адгезии помогают стабилизировать связывание Т-клеточных рецепторов с комплексами антиген-МНС на поверхности клетки-мишени, особенно когда связывание слабое. В этих случаях антитела против вспомогательных рецепторных белков CD8 и CD4 ингибируют активацию Т-клеток. Антитела против CD4 и CD8 широко используются для того, чтобы различать Т-хелперы и цитотоксические Т-клетки соответственно. Вирус, вызывающий СПИД (HIV), инфицирует Т-хелперы, связываясь первоначально с молекулами CD4 на поверхности этих клеток.
Таблица 18-4. Вспомогательные гликопротеины на поверхности Т-клеток
|
Белок* |
Другие обозначения |
Приблизительный мол. вес |
На каких клетках экспрессируется |
Предполагаемая функция |
|
CD2 |
Т11 |
50000 |
На всех Т-клетках |
Стимулирует адгезию между Т-клетками и клетками-мишенями путем связывания на клетках мишенях |
|
CD3 |
ТЗ |
у-Цепь-25000 δ-Цепь-20000 ε-Цепь-20000 ζ-Цепь-16000 |
На всех Т-клетках |
Способствует передаче сигнала при связывании комплекса антиген-МНС с рецепторам Т-клеток |
|
CD4 |
Т4 у человека, L3T4 у мыши |
50000 |
На Т-хелперах |
Стимулирует адгезию к антиген- представляющим клеткам и В-клеткам, вероятно путем связывания с молекулами МНС класса II |
|
CD8 |
Т8 у человека, Lyt2 и Lyt3 у мыши |
60000 (гомодимер) 70 000 (гетеродимер) |
На цитотоксических Т-клетках |
Стимулирует адгезию к клеткам-мишеням, инфицированным вирусами, вероятно путем связывания с молекулами МНС класса I |
|
LFA-1 |
а-Цепь-190000 ß-Цепь- 95000 |
На большинстве лейкоцитов |
Способствует межклеточной адгезии и aдгезии клеток к матриксу |
|
|
* CD означает кластер дифференцировки (cluster of differentiation), поскольку каждый из белков CD был первоначально определен как «антиген дифференцировки» Т-клеток, который узнается рядом моноклональных антител. Их идентификация явилась результатом крупномасштабной совместной работы, в которой было проведено сравнение сотен видов таких антител, полученных во многих лабораториях. Было найдено, что антитела составляют относительно немного групп (или «кластеров»), каждая из которых ; один-единственный белок клеточной поверхности. |
||||
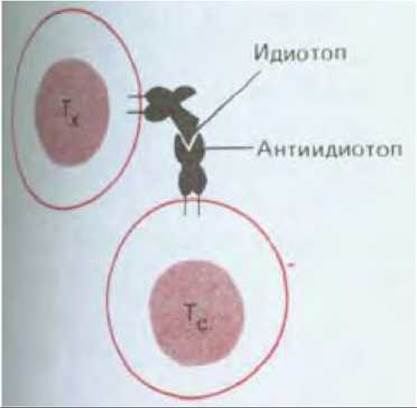
Рис. 18-59. Взаимодействие между Т-хелпером (Th) и Т-супрессором (Ts), при котором рецептор одной I D клеток узнает идиотоп (антигенную детерминанту, ассоциированную с антиген-связывающим участком) рецептора другой клетки. Другая возможность состоит в том, что супрессорная клетка узнает идиотоп фрагмента рецептора хелперной клетки, экспонированного на поверхности этой клетки в ассоциации с молекулой МНС (не показано). В обоих случаях супрессорная клетка ингибирует функцию хелперной клетки; механизм ингибирования неизвестен.
Т-хелперы и Т-супрессоры, по-видимому, совместно контролируют активность В-клеток и цитотоксических Т-клеток - главных эффекторных клеток иммунной системы. Т-хелперы воздействуют на эти эффекторные клетки прямо, а Т-супрессоры, как полагают, косвенно - путем подавления функции Т-хелперов, от которых зависят эффекторные клетки, хотя механизм такого подавления неизвестен. Как Т-супрессоры узнают Т-хелперы, которые они супрессируют? В свете того, что нам известно о механизме узнавания чужеродных антигенов хелперами (разд. 18.6.10), кажется маловероятным, что на поверхности Т-хелперов будет достаточное количество чужеродного антигена (или фрагментов антигена) для его узнавания Т-супрессорами. Вместо этого можно полагать, что Т-супрессоры часто взаимодействуют с Т-хелперами путем узнавания антигенных детерминант, ассоциированных с антиген-связывающими участками Т-хелперного рецептора - так называемыми идиотопами (разд. 18.4.8), как показано на рис. 18-59.
В связи с открытием Т-супрессоров возник вопрос о том, участвуют ли они в естественной толерантности, супрессируя лимфоциты, реагирующие на «свое». Имеющиеся данные пока противоречивы, однако они позволяют предположить, что естественная толерантность обусловлена главным образом элиминацией таких лимфоцитов (так называемая клональная делеция) и не зависит от Т-супрессоров. Поскольку для ответа на антиген большинству В-клеток требуются Т-хелперы, в принципе для того, чтобы избежать ответов В-клеток на собственные макромолекулы, достаточно элиминировать реагирующие на «свое» Т-хелперы. Именно такая стратегия используется для многих «своих» антигенов. Например, у нормальных мышей не вырабатываются антитела к своему собственному компоненту комплемента С5. Однако образование таких антител В-клетками можно индуцировать, если нормальным мышам ввести Т-хелперы от мутантных мышей, не имеющих С 5 (но идентичных нормальным во всем остальном). Таким образом, единственная причина, по которой нормальные мыши не образуют антител против этого обычного сывороточного белка, состоит в том, что у них отсутствуют или инактивированы Т-хелперы, узнающие С5.
Тем не менее такой механизм не может работать для всех собственных антигенов. Например, те собственные макромолекулы, которые могут активировать В-клетки без помощи Т-клеток, по-видимому, элиминируют узнающие их В-клетки; так же, видимо, действуют и «свои» макромолекулы, присутствующие в высокой концентрации. Аналогичным образом должны элиминироваться цитотоксические Т-клетки, которые могли бы реагировать против нормальных молекул на поверхности «своих» клеток, поскольку цитотоксические Т-лимфоциты могут в некоторой степени активироваться антигеном без Т-хелперов (хотя с помощью Т-хелперов они отвечают гораздо сильнее). Похоже, что Т-супрессоры играют главным образом поддерживающую роль в естественной толерантности и привлекаются к делу только в тех случаях, когда терпит неудачу первичный механизм клональной делеции.
18.6.17. Развивающиеся Т-клетки, которые сильно реагируют с собственными молекулами МНС, элиминируются в тимусе [48]
Как мы видели, первые данные о том, что гликопротеины МНС участвуют в узнавании антигена Т-клетками, были получены в экспериментах, показавших, что Т-клетки могут отвечать на антиген, ассоциированный с собственными молекулами МНС, но не с чужеродными молекулами МНС, т. е. здесь проявляется рестрикция МНС (разд. 18.6.7), Вскоре после этого эксперименты с пересадкой тимуса показали, что Т-клетки в процессе своего развития в тимусе, по-видимому, «обучаются видеть» антиген в ассоциации с собственными, но не с чужеродными молекулами МНС. Один из экспериментов состоял в следующем. Мышь линии X облучали, чтобы убить все Т-клетки, и вводили ей свежий костный мозг как источник новых Т-клеток. Если затем такой мыши пересадить тимус от мыши линии Y, то в нем будут развиваться Т-клетки линии X. Оказалось, что в большинстве случаев образующиеся зрелые Т-клетки линии X узнают чежеродный антиген в ассоциации с гликопротеинами МНС линии Y, но не линии X. Простейшая интерпретация этих результатов состоит в том, что каким-то образом отбираются и пролиферируют те из развивающихся в тимусе Т-клеток, у которых имеются рецепторы, узнающие антиген в ассоциации с молекулами МНС, экспрессируемыми в тимусе. Из этой гипотезы следует, что в ходе такой положительной селекции происходит отбор цитотоксических клеток на узнавание молекул МНС класса I, а хелперных клеток - на узнавание молекул класса II. В пользу этого говорит и тот факт, что антитела к молекулам МНС класса II специфически блокируют развитие Т-хелперов, а антитела к молекулам класса I-развитие цитотоксических Т-клеток.
Такая интерпретация, однако, не вполне удовлетворительна, так как не объясняет, каким образом происходит селекция в. отсутствие тех чужеродных антигенов, которые позднее будут узнаваться Т-клетками. Одна из возможностей состоит в том, что для выживания и созревания Т- клеток им необходимо слабо связаться с собственными молекулами МНС, и поэтому происходит отбор Т-клеток на слабое узнавание собственных МНС, недостаточное само по себе для активации зрелых Т-клеток; активация могла бы происходить только в том случае, когда объединение чужеродного антигена с собственной молекулой МНС дает структуру, с которой Т-клеточный рецептор может связаться прочно.
Данные в пользу положительной селекции на слабое узнавание собственных МНС в тимусе менее убедительны, чем данные об отрицательной селекции, элиминирующей в тимусе те клетки, которые слишком сильно связываются с собственными молекулами МНС или с собственными МНС в ассоциации с другими собственными молекулами. Наиболее убедительные доказательства того, что сильно реагирующие с собственными МНС Т-клетки элиминируются в тимусе, были получены в генетических исследованиях на мышах. К одному из таких исследований привело случайное наблюдение: один из V-сегментов, кодирующих в геноме вариабельную область ß-цепи Т-клеточного рецептора, придает любой экспрессирующей его Т-клетке способность к «сильному» узнаванию специфических молекул МНС класса II (обозначаемых Н-2Е) независимо от D- и J-областей ß-цепи и от V-области a-цепи. (Это позволяет предположить, что V-сегменты для Т-клеточных рецепторов могли быть отобраны в ходе эволюции на способность кодировать рецепторы, связывающие молекулы МНС.) Не все линии мышей, однако, экспрессируют Н-2Е. У линий, не имеющих Н-2Е, Т-клетки со специфическим V-сегментом ß-цепи выявляются как среди незрелых, так и среди зрелых лимфоцитов тимуса, а у линий, экспрессирующие Н-2Е, - только в популяции незрелых лимфоцитов. По-видимому, Т-клетки такого типа элиминируются еще до их созревания в тимусе.
Эксперименты с трансплантацией тимуса позволяют предполагать, что положительная селекция, с помощью которой объясняют рестрикцию МНС, и отрицательная селекция, придающая толерантность к собственным МНС, - это два независимых процесса. Положительная селекция происходит, видимо, на поверхности собственных эпителиальных клеток тимуса, а отрицательная - вероятно, на поверхности клеток, мигрирующих в тимус из костного мозга. Оба типа клеток экспрессируют на своей поверхности молекулы МНС как класса I, так и класса II.
Механизмы, ответственные за селекцию Т-клеток в тимусе, неизвестны. Положительная селекция происходит, возможно, через посредство сигналов для роста или выживания, которым эпителий тимуса снабжает слабо связывающие Т-клетки. В случае отрицательной селекции клетки, происходящие из костного мозга, могут действовать как «извращенные» антиген-представляющие клетки, которые не активируют, а убивают любую узнающую их Т-клетку. Обладающие таким свойством клетки, названные клетками вето, были выявлены в опытах in vitro.
Удивительная особенность развития Т-клеток в тимусе состоит в том, что более 95% клеток погибает, не покидая тимуса. Столь большие потери обусловлены, по-видимому, жесткой селекцией в ходе развития Т-клеток.
18.6.18. Некоторые аллельные формы молекул МНС неэффективны в представлении специфических антигенов Т-клеткам; это зависит от генов иммунного ответа (Ir) [49]
В отличие от генов МНС класса I, впервые обнаруженных благодаря их влиянию на отторжение трансплантатов, гены МНС класса II были открыты в связи с их ролью в Т-клеточных иммунных ответах на специфические растворимые антигены. Когда животных иммунизировали простым антигеном, некоторые из них давали очень сильный Т-клеточный ответ, другие же вообще не реагировали. Генетические исследования показали, что способность отвечать на данный антиген контролируется одним геном-геном иммунного ответа (Ir); ответы на разные антигены часто определялись разными генами Ir. Первыми были картированы гены Ir, контролирующие ответ Т-хелперов на антиген, они составили локусы МНС класса П. Гены Ir, контролирующие ответ цитотоксических клеток на антиген, были позднее картированы в области тех или иных локусов МНС класса I.
Эти наблюдения казались в высшей степени загадочными, пока не была открыта решающая роль гликопротеинов МНС в представлении антигенов Т-клеткам. Теперь их можно объяснить, просто предполагая, что у особей, генетически «не отвечающих» на какой-либо простой антиген (обычно с одной антигенной детерминантой), нет такой молекулы МНС, которая могла бы связать антигенную детерминанту и эффективно представить ее соответствующей Т-клетке. Это предположение получило сильную поддержку в результате исследований in vitro, показавших, что очищенные молекулы МНС класса II «отвечающего» животного могут связать соответствующий антигенный пептид, а генетически «не отвечающего» - не могут. В дальнейших исследованиях было установлено, что у молекул класса II имеется лишь один антиген-связывающий участок (как и у молекул МНС класса I-см. рис. 18-57), который может связывать весьма разнообразные пептиды со средней константой сродства (Ка) около 106 л/моль (∆G = - 8,5 ккал/моль, что эквивалентно энергии образования примерно восьми водородных связей; см. разд. 3.1.1). При этом скорость связывания невелика (примерно в 105 раз меньше, чем при типичной реакции антитело-антиген), а будучи связанным, пептид освобождается со временем полужизни более суток. Возможно, что для освобождения пептида необходимо медленное конформационное изменение молекулы МНС.
В некоторых случаях генетической неспособности к ответу на специфические антигены действует, по-видимому, иной механизм. Определенные комбинации собственных молекул МНС с чужеродными пептидами могут оказаться похожими на другие молекулы МНС собственного организма. Поскольку Т-хелперы, реагирующие с такими комбинациями, будут элиминироваться в процессе развития Т-клеток в тимусе путем отрицательной селекции (разд. 18.6.17), животное окажется генетически неспособным отвечать на такие чужеродные пептиды.
18.6.19. Гипотеза совместного узнавания МНС позволяет объяснить трансплантационные реакции и полиморфизм МНС
Гипотеза совместного узнавания МНС объясняет, почему столь многие Т-клетки отвечают на чужеродные молекулы МНС и тем самым вызывают отторжение трансплантата. Т-клетки могут так сильно реагировать с чужеродными гликопротеинами МНС потому, что эти молекулы (либо сами по себе, либо в виде комплекса с другими молекулами на поверхности чужеродной клетки) похожи на различные комбинации собственных молекул МНС с чужеродными пептидами. Так, например, некоторые клоны Т-клеток, реагирующие с вирусным антигеном, ассоциированным с собственной молекулой МНС класса I, реагируют также и с чужеродной молекулой МНС класса Г в отсутствие вирусного антигена.
Гипотеза совместного узнавания МНС позволяет также объяснить необычайный полиморфизм молекул МНС. В эволюционном противоборстве между микробами и иммунной системой позвоночных микробы будут проявлять тенденцию к изменению своих антигенов, чтобы избежать ассоциации с молекулами МНС. Если какое-нибудь изменение окажется в этом смысле эффективным, новая форма сможет широко распространиться и вызвать эпидемию или эпизоотию. При таких обстоятельствах те немногие особи вида-хозяина, у которых окажется новая молекула МНС, способная связываться с измененным антигеном микроорганизма, получат большое селективное преимущество. Кроме того, у особей, имеющих два разных аллеля для каждой молекулы МНС (т. е. у гетерозигот), будет больше шансов противостоять инфекции, чем у особей с идентичными аллелями в каждом данном локусе МНС. Таким образом, отбор будет способствовать усилению и поддержанию большого разнообразия молекул МНС в популяции.
Гипотеза совместного узнавания МНС дала по меньшей мере возможные ответы на многие вопросы, первоначально возникшие в связи с экспериментами по трансплантации органов, однако она породила новую проблему: каким образом весьма небольшое число разных молекул МНС данного животного (менее двух десятков) может связываться с набором разных пептидов, достаточно широким для того, чтобы обеспечить ответ Т-клеток практически на любой белковой антиген? Взаимодействия антигена с антителом и с гликопротеинами МНС класса I стали понятны в результате рентгеноструктурного анализа этих молекул. Такие исследования необходимо теперь распространить на взаимодействие между комплексом МНС-антиген и Т-клеточным рецептором. Технология рекомбинантных ДНК должна в скором времени обеспечить достаточные количества Т-клеточных рецепторов в растворимой форме, что сделает проекты такого рода реальными, В результате работ с использованием рекомбинантных ДНК уже было показано, что все эти белки - молекулы МНС, Т-клеточные рецепторы и антитела - имеют давнюю общую историю.
18.6.20. Молекулы, участвующие в иммунном узнавании, принадлежат к древнему «суперсемейству» [50]
Большинство гликопротеинов, при участии которых в иммунной системе происходит узнавание одной клетки другой или узнавание антигена, содержит родственные структурные элементы, и это позволяет предполагать, что кодирующие их гены имеют общую эволюционную историю. Это «суперсемейство» Ig включает антитела, Т-клеточные рецепторы, гликопротеины МНС, белки межклеточной адгезии CD2, CD4 и CD8, некоторые из полипептидных цепей комплекса CD3, ассоциированного с Т-клеточными рецепторами, и различные Fc-рецепторы на лимфоцитах и других лейкоцитах. Все эти белки содержат один или большее число Ig-подобных доменов (гомологичных Ig-единиц). Пептидная цепь каждого из таких доменов обычно содержит около 100 аминокислот и, как полагают, свернута в характерную структуру, похожую на «сэндвич» из двух антипараллельных ß-слоев, обычно стабилизированных консервативной дисульфидной связью (разд. 18.3.4). Многие из этих молекул представляют собой димеры или олигомеры большей величины, в которых гомологичные Ig-единицы разных цепей взаимодействуют между собой (рис. 18-60).
Каждая Ig-единица обычно кодируется отдельным экзоном. Кажется вероятным, что все сверхсемейство генов ведет свое происхождение от гена, кодирующего одну гомологичную Ig-единицу и сходного с генами, кодирующими Thy-1 или ß2-микроглобулин (см. рис. 18-53). Возможно, что эти белки участвовали в осуществлении межклеточных взаимодействий. Молекулы, сходные с Thy-1, были выделены из мозга кальмара, поэтому вполне вероятно, что соответствующий ген-предшественник возник еще до того, как позвоночные отделились от своих предков- беспозвоночных около 400 млн. лет назад. По-видимому, новые члены семейства возникали путем дупликаций экзонов и генов; аналогичные дупликации могли дать начало и множественным генным сегментам, кодирующим антитела и Т-клеточные рецепторы.
Поразительная способность к узнаванию делает иммунную систему почти уникальной среди клеточных систем; более сложной оказывается только нервная система. Обе системы состоят из очень большого числа фенотипически различающихся клеток, организованных в сложные сети. В пределах такой сети между отдельными клетками возможны как положительные, так и отрицательные взаимодействия, причем ответ одной клетки распространяется в системе и сказывается на многих других клетках. В отличие от сети нейронов, относительно жестко фиксированной в пространстве, клетки, составляющие иммунологическую сеть, непрерывно перемещаются и лишь кратковременно взаимодействуют друг с другом. В следующей главе мы рассмотрим клети нервной системы позвоночных, которая особенно выделяется среди других клеточных систем своей сложной и хитроумной организацией.
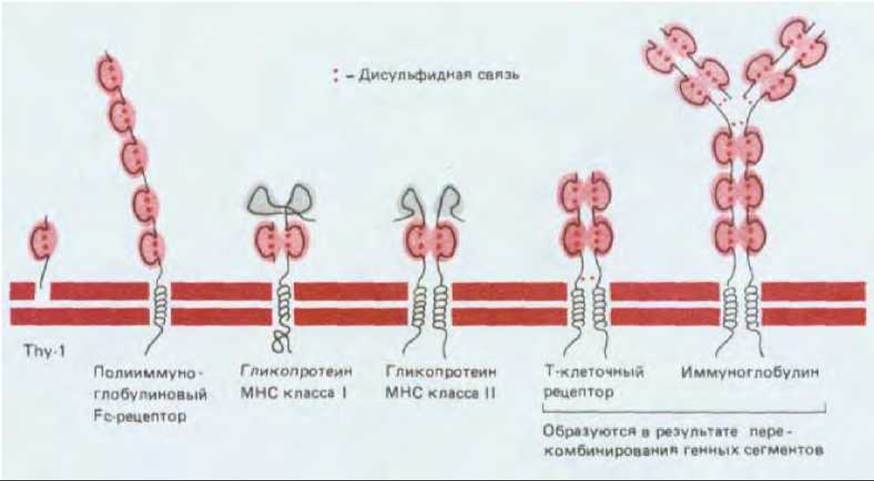
Рис. 18-60. Некоторые из мембранных белков, принадлежащих к иммупоглобулиновому суперсемейству. Гомологичные иммуноглобулиновые и иммуноглобулиноподобные домены выделены цветом; обратите внимание, что юнцы каждой из петель, образующих такой домен, соединены дасульфидными связями. Большинство доменов взаимодействует с гомологичными доменами ассоциированной полипептидной цепи. Кроме того, некоторые из доменов полипептидной цепи полииммуноглобулинового Fc-рецептора взаимодействуют друг с другом (не показано); этот рецептор связывает и димерный (см. разд. 18.2.5), и полимерный IgM, отсюда его название. Гликопротеин Thy-1 ковалентно связан с молекулой гликоизилированного фосфолипида, расположенной в мембране (см. разд. 8.6.13.). На рисунке не изображены вспомогательные белки CD4 и CD8 Т-хелперов и цитотоксических Т-клеток соответственно, белковый комплекс CD3, ассоциированный с Т-клеточными рецепторами, и CD2 (см. табл. 18-4). Все эти белки тоже содержат иммуноглобулиноподобные домены. Иммуноглобулиновое суперсемейство включает, кроме перечисленных белков, также и белки клеточной поверхности, участвующие в межклеточных взаимодействиях вне иммунной системы, например молекулы адгезии нервных клеток (N-CAM-neural cell adhesion molecules, см. разд. 14.3.6).
Заключение
Существуют по меньшей мере три функционально различных подкласса Т-лимфоцитов: 1) цитотоксические Т-клетки, способные непосредственно убивать клетки, инфицированные вирусами; 2) Т-хелперы, выделяющие целый ряд локальных химических медиаторов (интерлейкинов), которые помогают В-клеткам в осуществлении гуморального иммунного ответ (образовании антител), стимулируют размножение активированных Т-клеток и активируют макрофаги; 3) Т-супрессоры, которые, по-видимому, в основном подавляют реакцию Т-хелперов. Т-хелперы и Т-супрессоры - главные регуляторы иммунных ответов.
Рецептор Т-клеток представляет собой антителоподобный гетеродимер, кодируемый генами, которые собираются из нескольких генных сегментов в процессе развития Т-клеток в тимусе. Активация Т-клеток происходит, когда эти рецепторы связываются с фрагментами чужеродных антигенов, ассоциированными с гликопротеинами МНС на поверхности других клеток собственного организма. Такой процесс совместного узнавания МНС гарантирует, что Т-клетки узнают чужеродный антиген только в том случае, если он связан с соответствующей клеткой-мишенью. Существуют два основных класса молекул МНС: 1) молекулы класса I, имеющиеся на поверхности почти всех соматических клеток с ядрами, - они представляют фрагменты вирусных белков цитотоксическим Т-клеткам; 2) молекулы класса II, имеющиеся на поверхности В-клеток и специализированных антиген-представляющих клеток, - они представляют фрагменты чужеродных антигенов Т-хелперам. Тот факт, что определенные аллельные формы молекул МНС классов I и II неспособны представлять Т-клеткам определенные антигенные детерминанты, позволяет объяснить, почему эти молекулы столь полиморфны
Литература
Общая
Golub Е. S. Immunology: A Synthesis. Sunderland, MA; Sinauer, 1987.
HoodL. E., Weissman I. L., Wood W. В., Wilson J. H. Immunology, 2nd ed. Menlo Park CA; Benjamin-Cummings, 1984.
Male D., Champion W., Cooke A. Advanced Immunology. London. Gower, 1987. Paul WE., ed. Fundamental Immunology. New York. Raven, 1984. (Есть русский перевод: Пол У., ред. Иммунология, в трех томах. М.: Мир, 1987-1989.) Roitt I. M., Brostoff J., Male D.K. Immunology. London; Gower, 1985.
Цитированная
1. Gowans J.L., McGregor D.D. The immunological activities of lymphocytes. Pro] Allergy, 9, 1-78, 1965.
2. Greaves M. F., Owen J. J. Т., Raff M. С. Т and В Lymphocytes: Origins, Propertie and Roles in Immune Responses. Amsterdam, Excerpta Medica, 1973.
3. Cooper M., Lawton A. The development of the immune system. Sci. Am., 231(5) 59-72, 1974.
Owen J. J. T. Ontogenesis of lymphocytes. In: В and Т Cells in Immune Recognition (F.Loor, G.E. Roelants, eds.), pp. 21-34. New York, Wiley, 1977.
4. Möller G., ed. Functional Т Cell Subsets Defined by Monoclonal Antibodie Immunol. Rev., Vol. 74, 1983.
Raff M.C. Cell-surface immunology. Sci. Am., 234(5), 30-39, 1976. Reinherz E.L., Schlossman S. F. The differentiation and function of human lymphocytes. Cell, 19, 821-827, 1980.
5. Ada G. L. Antigen binding cells in tolerance and immunity. Transplant. Rev., 5, 105-129, 1970.
Ada G.L., Nossal G. The clonal selection theory. Sci. Am., 257(2), 62 69, 1987.
Burnet F. M. The Clonal Selection Theory of Acquired Immunity. Nashville, TN, Vanderbilt University Press, 1959.
Wigzell H. Specific fractionation of immunocompetent cells. Transplant. Rev., 5, 76-104, 1970.
6. Pink J. R. L., Askonas B. A. Diversity of antibodies to cross-reacting nitrophenyl haptens in inbred mice. Eur. J. Immunol., 4, 426 429, 1974.
7. Butcher E. C., Weissman I. L. Lymphoid Tissues and Organs. In: Fundamental Immunology (W.F.Paul, ed.), pp. 109-127, New York, Raven, 1984. (Есть русский перевод: Батчер Э. С., Байссман И. Л. Лимфоидные органы и ткани. В кн: Иммунология (У. Пол, ред.), т. 1, с. 173-203. М.: Мир, 1987.)
Gallatin M., et al. Lymphocyte homing receptors. Cell, 44, 673 680, 1986.
Gowans J. L., Knight E. J. The route of re-circulation of lymphocytes in the rat. Proc. R. Soc. Lond. (Biol.), 159, 257-282, 1964.
Sprent J. Mirgation and lifespan of lymphocytes. In: В and Т Cells in Immune Recognition (F. Loor, G.E. Roelants, eds.), pp. 59-82. New York, Wiley, 1977.
Woodruff J. J., Clarke L.M., Chin Y.H, Specific cell-adhesion mechanisms determining migration pathways of recirculating lymphocytes. Ann. Rev. Immunol., 5, 201-222, 1987.
8. Greaves M. F., Owen J. J. Т., Raff M. С. Т and В Lymphocytes: Origins, Properties and Roles in Immune Responses, pp. 117-186. Amsterdam, Excerpta Medica, 1973.
Rajewsky K., Forster I., Cumano A. Evolutionary and somatic selection of the antibody repertoire in the mouse. Science, 238, 1088-1094, 1987.
9. Billingham R. E., Brent L., Medawar P. B. Quantitative studies on tissue transplantation immunity. III. Activity acquired tolerance. Philos. Trans.
R. Soc. Lond. (Biol.), 239, 357-414, 1956.
Harris D. E., Cairns L., Rosen F. S., Borel Y. A natural model of immunologic tolerance. Tolerance to murine C5 is mediated by Т cells and antigen is required to maintain unresponsiveness. J. Exp. Med., 156, 567-584, 1982.
Lindstrom J. Immunobiology of myasthenia gravis, experimental autoimmune myasthenia gravis and Lambert-Eaton syndrome. Annu. Rev. Immunol., 3, 109-132, 1985.
Nossal G. J. V. Cellular mechanisms of immunologic tolerance. Annu. Rev. Immunol., 1, 33-62, 1983.
Owen R.D. Immunogenetic consequence of vascular anastomoses between bovine twins. Science, 102, 400-401, 1945.
10. Howard J.G., Mitchison N.A. Immunological tolerance. Prog. Allergy, 18, 43-96, 1975.
11. Davies D.R., Metzger H. Structural basis of antibody function. Annu. Rev. Immunol., 1, 87-118, 1983.
Kabat E. A. Structural Concepts in Immunology and Immunochemistry, 2nd ed. New York, Holt, Rinehart and Winston, 1976.
Nisonoff A., Hopper J. E., Spring S. B. The Antibody Molecule. New York, Academic Press, 1975.
12. Möller G., ed. Lymphocyte Immunoglobulin: Synthesis and Surface Representation. Transplant. Rev., Vol. 14, 1973.
13. Dutton R.W., Mishell R.I. Cellular events in the immune response. The in vitro response of normal spleen cells to erythrocyte antigens. Cold Spring Harbor Symp. Quant. Biol., 32, 407-414, 1967.
Jerne N.K., et al. Plaque forming cells: methodology and theory. Transplant. Rev., 18, 130-191, 1974.
14. Edelman G.M. The structure and function of antibodies. Sci. Am., 223(2), 34-42, 1970. Porter R. R. Structural studies of immunoglobulins. Science, 180, 713-716, 1973.
15. Ishizaka Т., Ishizaka K. Biology of immunoglobin E. Prog. Allergy, 19, 60-121, 1975.
Koshland M. E. The coming of age of the immunoglobulin J chain. Annu. Rev. Immunol., 3, 425-454, 1985.
Morgan E. L., Weigle W. O. Biological activities residing in the Fc region of immunoglobulin. Adv. Immunol., 40, 61-134, 1987.
Solari R., Kraehenbuhl J.-P. The biosynthesis of secretory component and ist role in the transepithelial transport of IgA dimer. Immunol. Today, 6, 17-20, 1985.
Underdown B.J., Schiff J.M. Immunoglobulin A: strategic defense initiative at the mucosal surface. Annu. Rev. Immunol., 4, 389-418, 1986. Unkeless J. C., Scigliano E., Freedman V. Structure and function of human and murine receptors for IgG. Annu. Rev. Immunol., 6, 251-282, 1988.
16. Berzofsky J.A., Berkover I.J. Antigen-antibody interactions. In Fundamental Immunology (W.E.Paul, ed.), pp. 595-644. New York, Raven, 1984. (Есть русский перевод: Берзофски Д.; Берковер А. Д. Взаимодействие антиген-антитело. В кн.: Иммунология (У. Пол, ред.), т. 3, с. 5-88. М.: Мир, 1989.)
17. Capra J. D., Edmundson А. В. The antibody combining site. Sci. Am., 236(1), 50-59, 1977.
Wu Т. Т., Kabat E. A. An analysis of the sequences of the variable regions of Bence Jones proteins and myeloma light chains and their implications for antibody complementarity. J. Exp. Med., 132, 211-250, 1970.
18. Sakano H., et al. Domains and the hinge region of an immunoglobulin heavy chain are encoded in separate DNA segments. Nature, 277, 627633, 1979.
19. Alzari P. M., Lascombe M.-B., Poljak R. J. Three-dimentional structure of antibodies. Annu. Rev. Immunol., 6, 555-580, 1988.
Capra J.D., Edmundson A.B. The antibody combining site. Sci. Am., 236(1), 50-59, 1977.
20. Dreyer W. J., Bennett J. C. The molecular basis of antibody formation: a paradox Proc. Natl. Acad. Sci. USA, 54, 864-869, 1965.
Hozumi N., Tonegawa S. Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. Proc. Natl. Acad. Sci. USA, 73, 3628-3632, 1976.
21. AltF. W., Blackwell Т.К., Yancopoulos G.D. Development of the primary antibody repertoire. Science, 238, 1079-1087, 1987.
Leder P. The genetics of antibody diversity. Sci. Am., 246(5), 72-83, 1982. Tonegawa S. The molecules of the immune system. Sci. Am., 253(4), 122-131, 1985.
22. Gearhart P. J., Johnson N. D., Douglas R., Hood L. IgG antibodies to phosphorylcholine exhibit more diversity than their IgM counterparts. Nature, 291, 29-34, 1981.
Griffiths G. M., Berek C., Kaartinen M., Milstein C. Somatic mutation and the maturation of immune response to 2-phenyl oxazolone. Nature, 312, 271-275, 1984. Möller G., ed. Role of Somatic Mutation in the Generation of Lymphocyte Diversity. Immunol. Rev., Vol. 96, 1987.
Rajewsky K., Forster I., Cumano A. Evolutionary and somatic selection of the antibody repertoire in the mouse. Science, 238, 1088-1094, 1987.
23. Alt F. W., et al. Ordered rearrangement of immunoglobulin heavy chain variable region segments. EMBO J., 3, 1209-1219, 1984.
Yancopoulos G. D., Alt F. W. Regulation of the assembly and expression of variable region genes. Annu. Rev. Immunol., 4, 339-368, 1986.
24. Early P., et al. Two mRNAs can be produced from a single immunoglobulin μ gene by alternative RNA processing pathways. Cell, 20, 313319, 1980.
25. Cebra J.J., Komisar J.L., Schweitzer P. A. CН isotype switching during normal B-lymphocyte development. Annu. Rev. Immunol., 2, 493-548, 1984.
Shimizu A., Honjo T. Immunoglobulin class switching. Cell, 36, 801-803, 1984.
26. JerneN.K. The immune system. Sci. Am., 229(1), 52-60, 1973.
Jerne N. K. Toward a network theory of the immune system. Ann. Immunol. Inst. Pasteur (Paris), 125C, 378-389, 1974.
Möller G., ed. Idiotype Networks Immunol. Rev., Vol. 79, 1984. Rajewsky K., Takemori T. Genetics, expression and function of idiotypes. Annu. Rev. Immunol., 1, 569-608, 1983.
27. Lachmann P. J. Complement. In Clinical Aspects of Immunology, 4th ed. (P.J. Lachmann, D. Peters, eds.), pp. 18-49, Oxford U.K., Blackwell, 1982,
Müller-Eberhard H. J. Molecular organization and function of the complement system. Annu. Rev. Biochem., 57, 321-348, 1988.
Reid K. B. M., Porter R. R. The proteolytic activation systems of complement. Annu. Rev. Biochem., 50, 433-464, 1981.
28. Cooper N. R. The classical complement pathway: activation and requlation of the first complement component. Adv. Immunol., 37, 151-216, 1985.
29. Muller-Eberhard H.J., Schreiber R.D. Molecular biology and chemistry of the alternative pathway of complement. Adv. Immunol., 29, 1-53, 1980.
30. Müller-Eberhard H. J. The membrane attack complex of complement. Annu. Rev. Immunol., 4, 503-528, 1986.
31. Campbell R.D., Carroll M. C., Porter R.R. The molecular genetics of components of complement. Adv. Immunol., 38, 203-244, 1980. Lachmann P.J., Hobart M.J. Genetics of complement. Trends Genet., 1, 145-149, 1985.
Reid К. В. Activation and control of the complement system. Essays Biochem., 22, 27-68, 1986.
32. Allison J. P., Lanier L. L. The structure, function and serology of the T cell antigen receptor complex. Annu. Rev. Immunol., 5, 503-540, 1987. Clevers H., Alarcon В., Wileman Т., Terhorst C. The T cell receptor/CD3 complex: a dynamic ensemble. Annu. Rev. Immunol., 6, 629-662, 1988. Davis M.M., Bjorkman P.J. T-cell antigen receptor genes and T-cell recignition. Nature, 334, 395-402, 1988.
Hedrick S. M., Cohen D., Nielsen E. A., Davis M. M. Isolation of cDNA clones marrow cells - a model for the two-cell theory of immunocompetence. Transplant. Rev., 1, 92-113, 1969.
Davies A.J.S. The thymus and the cellular basis of immunity. Transplant. Rev.,1, 43-91, 1969.
44. Chesnut R. W., Grey H. M. Antigen presentation by В cells and its significance in T-B interactions. Adv. Immunol., 39, 51-94, 1986.
DeFranco A. L. Molecular aspects of B-lymphocyte activation. Annu. Rev. Cell Biol, 3, 143-178, 1987. Kishimoto Т., Hirano T. Molecular
regulation of В lymphocyte response. Annu. Rev. Immunol., 6, 485-512, 1988.
Möller G., ed. 1L-4 and 1L-5: Biology and Genetics. Immunol. Rev., Vol. 102, 1988.
Paul W. E., Ohara J. B-cell stimulating factor-1/Interleukin 4. Annu. Rev. Immunol, 5, 429-460, 1987. Cambier J.C., Ransom J. T. Molecular mechanisms of transmembrane signaling in В lymphocytes. Annu. Rev. Immunol., 5, 175200, 1987.
45. Möller G., ed. Gamma Interferon. Immunol. Rev., Vol. 97, 1987.
Mosmann T. R., Coffman R. L. Two types of mouse helper T-cell clone implications for immune regulation. Immunol. Today, 8, 223-227, 1987. Powrce F., Mason D. Phenotypic and functional heterogeneity of CD4+ T cells. Immunol. Today, 9, 274-277, 1988.
46. Littman D. R. The structure of the CD4 and CD8 genes. Annu. Rev. Immunol., 5, 561-584, 1987.
Springer T.A., Dustin M.L., Kishimoto Т.К., Marlin S.D. The lymphocyte-function associated LFA-1, CD2 and LFA-3 molecules: cell adhesion receptors of the immune system. Annu. Rev. Immunol., 5, 223-252, 1987.
47. Asherson G. L., Colizzi V., Zembala M. An overview of T suppressor cell circuits. Annu. Rev. Immunol., 4, 37-68, 1986.
Dorf M.E., Benacerraf B. Suppressor cells and immunoregulation. Annu. Rev. Immunol., 2, 127-158, 1984.
Gershon R. K. T-cell control of antibody production. Contemp. Top. Immunobiol, 3, 1-40, 1974.
Harris D. E., Cairns L., Rosen F. S., Borel Y. A natural model of immunologic tolerance. Tolerance to murine C5 is mediated by T cells and antigen is required to maintain unresponsiveness. J. Exp. Med., 156, 567-584, 1982.
Mitchison N. A., Griffiths J. A., Oliveira D. B. G. Immunogenetics of suppression. Br. J. Clin. Pract, 40, 225-229, 1986.
48. Bevan M. In a radiation chimera, host H-2 antigens determine the immune responsiveness of donor cytotoxic cells. Nature, 269, 417-419, 1977. Kappler J. W., Roehm N., Marrack P. T cell tolerance by clonal elimination in the thymus. Cell, 49, 273-280, 1987.
Sprent J., Lo D., Gao E.-K., Ron Y. T cell selection in the thymus. Immunol. Rev., 101, 5-19, 1988.
Sprent J., Webb S. Function and specificity of T cell subsets in the mouse. Adv. Immunol., 41, 39-133, 1987. von Boehmer H. The developmental biology of T lymphocytes. Annu. Rev. Immunol., 6, 309-326, 1988.
49. Alien P.M., Babbitt B. R., Unanue E.R. T cell recognition of lysozyme: the biochemical basis of presentation. Immunol. Rev., 98, 171-187, 1987.
Buus S., Sette A., Grey H. M. The interaction between protein-derived immunogenic peptides and Ia. Immunol. Rev., 98, 115-142, 1987. Mengle-Gaw L., McDevitt H. 0. Genetics and expression of murine Ia antigens Annu. Rev. Immunol., 3, 367-396, 1985.
SchwartzR. H. Immune response (Ir) genes in the murine major histocompatibiliy complex. Adv. Immunol., 39, 31-201, 1986.
50. Williams A. F., Barclay A. N. The immunoglobulin superfamily - domains for cell surface recognition. Annu. Rev. Immunol., 6, 381-406, 1988.