Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Нервная система
Лиганд-зависимые ионные каналы и быстрая синаптическая передача
Самый простой способ передачи сигнала от нейрона к нейрону - это прямое электрическое сопряжение через щелевые контакты. Главное преимущество таких электрических синапсов состоит в том, что сигналы передаются без задержки. С другой стороны, эти синапсы гораздо меньше приспособлены для регулирования и адаптации, чем химические синапсы, с помощью которых осуществляется большинство связей между нейронами. Электрическая связь через щелевые контакты была рассмотрена в гл. 14 (разд. 14.1.5-14.1.8), здесь же речь пойдет только о химических синапсах.
Химическая передача в синапсах основана на тех же принципах, что и химическая сигнализация с помощью водорастворимых гормонов (гл. 12). И в том и в другом случае клетка высвобождает вещество-посредник, которое воздействует на другую клетку или группу клеток, связываясь с мембранными белками-рецепторами. Однако в отличие от гормона химический посредник в синапсе - нейромедиатор - воздействует лишь на очень малых расстояниях.
В результате электрической стимуляции пресинаптическая клетка высвобождает путем экзоцитоза нейромедиатор (см. рис. 19-4). После того как нейромедиатор пересекает щель между пре- и постсинаптической клетками шириной обычно в долю микрометра, химический сигнал должен быть снова преобразован в электрический. Это преобразование осуществляют рецепторы, находящиеся в плазматической мембране постсинаптической клетки. Бывают рецепторы двух типов - связанные с каналами и не связанные с каналами (рис. 19-15). Рецепторы, связанные с каналами, - это фактически лиганд-зависимые каналы. Конформация таких рецепторов сразу же после связывания нейромедиатора изменяется таким образом, что в мембране образуется открытый канал для определенных ионов и в результате проницаемость мембраны изменяется. Рецепторы этого типа служат основой самого обычного и наиболее изученного способа передачи сигналов в химических синапсах, при котором передача осуществляется очень быстро.
Рецепторы, не связанные с каналами, запускают такие же процессы, что и при воздействии водорастворимых гормонов и локальных химических медиаторов повсюду в организме (разд. 12.3). В таких рецепторах участки связывания нейромедиатора функционально сопряжены с ферментом, который в присутствии нейромедиатора обычно катализирует образование внутриклеточного посредника, например сАМР. В свою очередь этот посредник вызывает изменения в постсинаптической клетке, в том числе модификацию ионных каналов в клеточной мембране. В отличие от рецепторов, связанных с каналами, эти рецепторы, как правило, опосредуют относительно замедленные, но более продолжительные эффекты нейромедиаторов. Полагают, что активация таких рецепторов вызывает в нейронах изменения, которые сохраняются длительное время и лежат в основе научения и памяти (разд. 19.5.3).
В этом разделе будет рассмотрена быстрая синаптическая передача, использующая лиганд-зависимые ионные каналы. Специфические особенности синаптической передачи с участием рецепторов, не связанных с каналами, и роль таких рецепторов в долговременных синаптических изменениях будут обсуждаться в разд. 19.5.
19.3.1. Нервно-мышечное соединение - наиболее изученный синапс [14]
Плотность расположения нейронов в мозгу настолько высока, что экспериментировать на отдельных мозговых синапсах чрезвычайно трудно. Поэтому функции синапса были детально изучены главным образом на соединениях между нервом и скелетной мышцей лягушки и, в меньшей степени, на синапсах между гигантскими нейронами кальмара и других моллюсков.
Скелетные мышечные волокна позвоночных, подобно нервным клеткам, способны возбуждаться под действием электрического тока, и поэтому нервно-мышечное соединение (рис. 19-16) оказалось хорошей моделью химического синапса вообще. Двигательный нерв и иннервируемую им мышцу можно отделить от окружающей ткани и поддерживать в функционально активном состоянии в питательной среде определенного состава. Стимулируя нерв через наружные электроды, можно с помощью внутриклеточного микроэлектрода регистрировать ответ одиночной мышечной клетки (рис. 19-17). На рис. 19-18 сравнивается тонкая структура нервно-мышечного соединения и типичного синапса между двумя нейронами центральной нервной системы.
Нервно-мышечное соединение было главным объектом ряда продолжительных и плодотворных исследований, начатых в 50-х годах нашего века. Основой для первых экспериментов послужило открытие в начале 20-х годов того факта, что ацетилхолин, выделяемый при стимуляции блуждающего нерва, воздействует на сердце, замедляя его сокращения. Это явилось первым несомненным доказательством химической природы нервно-мышечной передачи, а вскоре после этого, в 30-х годах, было показано, что стимуляция двигательного нерва, иннервирующего скелетную мышцу, тоже приводит к высвобождению ацетилхолина, а ацетил-холин в свою очередь заставляет скелетную мышцу сокращаться. Таким образом, ацетилхолин был идентифицирован как нейромедиатор в нервномышечном соединении. Но как же происходит высвобождение ацетилхолина и как он воздействует на мышцу?
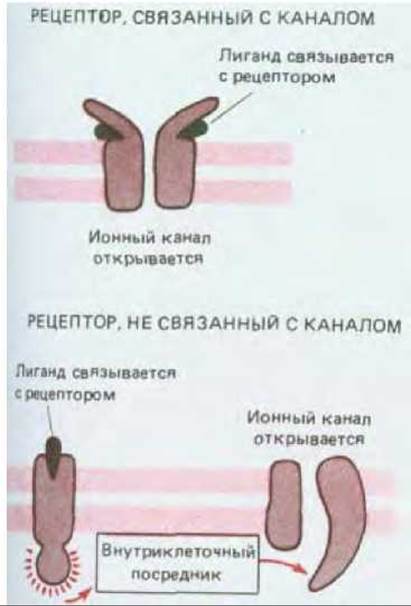
Рис. 19-15. Воздействие нейромедиатора на постсинаптическую клетку может осуществляться при посредстве рецепторных белков двух фундаментально различных типов: рецепторов, связанных с каналами, и рецепторов, не связанных с каналами. Связанные с каналами рецепторы называют также лиганд-зависимыми каналами.
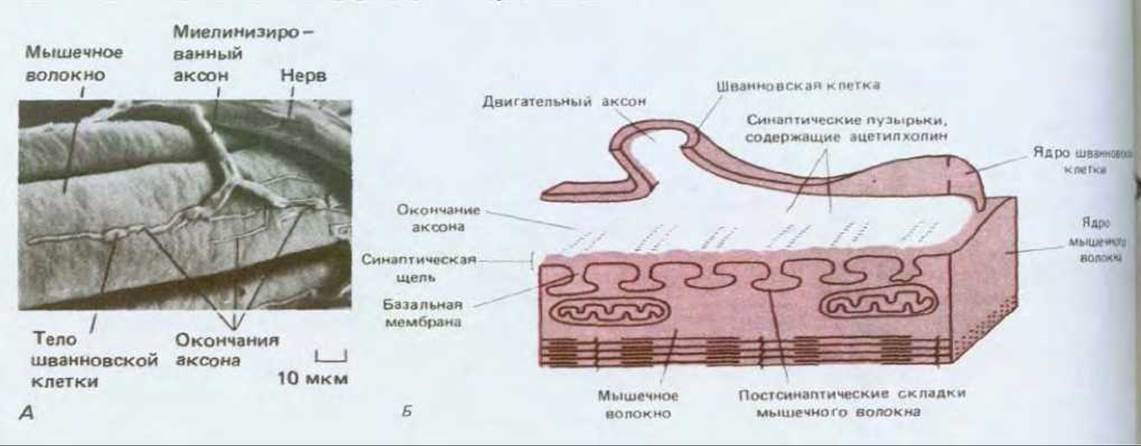
Рис. 19-16. Нервно-мышечное соединение у лягушки. А. Окончание одного аксона на клетке скелетной мышцы при малом увеличении. Электронная микрофотография, полученная с помощью сканирующего электронного микроскопа. Б. Схематическое изображение участка, помеченного на рисунке А красным прямоугольником. Показаны основные детали, видимые в трансмиссионный электронный микроскоп. Характер ветвления небольших окончаний аксона в области синапса варьирует в зависимости от вида животного и типа мышечного волокна. Из-за своеобразной формы окончаний аксона у млекопитающих нервно-мышечное соединение часто называют концевой пластинкой. (A-J. Desaki, Y. Uehara, J. Neurocytol, 10, 101-110, 1981, с разрешения Chapman & Hall.)
19.3.2. За сопряжение потенциалов действия с высвобождением медиатора ответственны потенциал-зависимые кальциевые каналы [15]
В результате открытия и закрытия натриевых каналов нервный импульс распространяется вдоль аксона, пока не достигнет места контакта с мышечной клеткой. Здесь под его воздействием открываются потенциал-зависимые каналы, находящиеся в плазматической мембране окончания аксона, и ионы Са2+ входят в аксон, в результате чего выделяется; ацетилхолин (рис. 19-19).
Как показали три простых наблюдения, для синаптической передачи необходим приток ионов кальция в окончание аксона. Во-первых, если в момент прибытия нервного импульса во внеклеточной среде вокруг окончания аксона эти ионы отсутствуют, то медиатор не высвобождается и передачи сигнала не происходит. Во-вторых, если через микропипетку искусственно ввести Са2+ в цитоплазму нервного окончания, выход нейромедиатора происходит тотчас даже без электрической стимуляции аксона (это трудно осуществить на нервно-мышечном соединении из-за малых размеров окончания аксона, поэтому такой эксперимент был проведен на синапсе между гигантскими нейронами кальмара) В-третьих, искусственная деполяризация окончания аксона (тоже в синапсе между гигантскими нейронами) без нервного импульса и в условиях блокады натриевых и калиевых каналов специфическими токсинами вызывает переход Са2+ внутрь окончания и высвобождение нейромедиатора. Но если деполяризация вызывает такой сдвиг мембранного потенциала, что электрохимическая сила, заставляющая Са2+ входить внутрь, уменьшается до нуля, то высвобождения нейромедиатора не происходит.
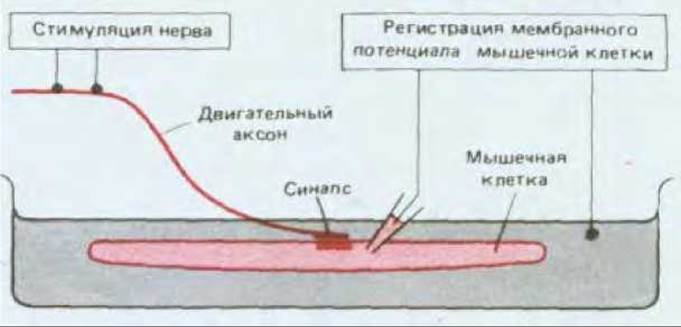
Рис. 19-17. Схема постановки эксперимента для изучения синаптической передачи в нервно-мышечном соединении.
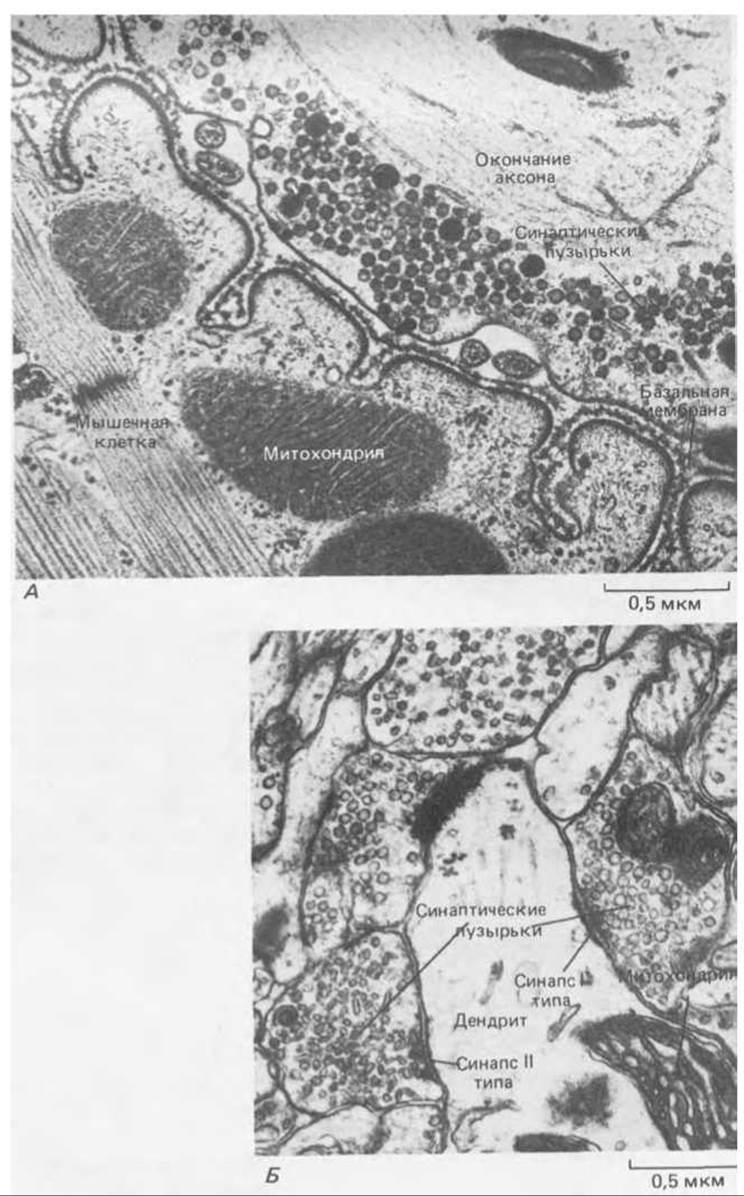
Рис. 19-18. А. Электронная микрофотография части нервно-мышечного соединения. Б. Электронная микрофотография небольшого участка мозга крысы. Здесь хорошо юны два синапса, где можно различить пре- и постсинаптические мембраны, синаптическую щель между ними и синаптические пузырьки в окончаниях аксонов, как 1 на фото А. Эти два синапса, показанные на фото Б, различаются величиной и формой синаптических пузырьков: в синапсе типа I пузырьки круглые, тогда как в синапсе типа II они уплощенные и, как полагают, содержат другой медиатор. Обратите внимание на характерное утолщение как постсинаптической, так (в меньшей степени) и пресинаптической мембраны; оно видно на обоих снимках. В мозговых синапсах между пре- и постсинаптическими мембранами нет базальной мембраны, хотя и здесь можно заметить некоторое количество внеклеточного материала. Отсутствие базальной мембраны - это главная структурная особенность, отличающая синапсы центральной нервной системы от нервно-мышечных соединений. (С любезного разрешения John Heuser (A) и i. Campbell, A. R. Lieberman (Б).)
Белок, образующий канал для перехода Са2+ в клетку, - потенциал-зависимый кальциевый канал - играет исключительно важную роль. Он обеспечивает единственный известный способ преобразования электрических сигналов - кратковременных деполяризаций мембраны - в химические изменения внутри нейрона. Как видно из пояснений на схеме 19-1, потенциал-зависимые каналы для Na+, K+ или Сl- с этой целью использоваться не могут: в результате одиночного нервного импульса через эти каналы проходят настолько малые ионные токи, что они лишь незначительно изменяют концентрацию ионов в цитозоле. Сам по себе поток ионов через кальциевые каналы тоже невелик, и обычно его вклад в электрический ток через мембрану мал. Но этот поток имеет весьма значительную величину относительно внутриклеточной концентрации свободного кальция, которая в норме поддерживается на уровне около 10-7 М, что соответствует менее 100 ионам Са2+ в мкм3. Благодаря мембранному потенциалу и сравнительно высокой внеклеточной концентрации кальция (обычно ~1-2 мМ) через один открытый кальциевый канал проходит несколько сотен ионов Са2+ за 1 мс. Таким образом, когда в пресинаптическом окончании под влиянием нервного импульса открывается небольшое число потенциал-зависимых кальциевых каналов, внутриклеточная концентрация свободного кальция легко может повыситься в 10-100 раз. Поступающие свободные ионы Са2+ действуют как внутриклеточные посредники и вызывают выделение нейромедиатора со скоростью, резко возрастающей по мере повышения концентрации Са2+.
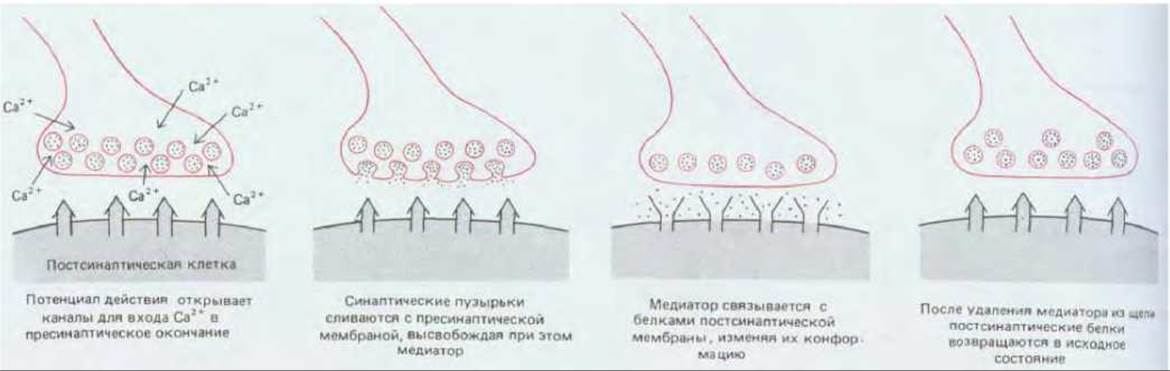
Рис. 19-19. Важнейшие события, происходящие в химическом синапсе после прибытия импульса в окончание аксона.
Концентрация свободных ионов кальция возрастает лишь на короткое время, так как Са2+-связывающие белки, Са2+-изолирующие пузырьки и митохондрии быстро поглощают ионы Са2+, перешедшие в окончание аксона, а находящиеся в плазматической мембране кальциевые насосы, использующие энергию гидролиза АТР или натриевого электрохимического градиента, откачивают ионы кальция из клетки (см. разд. 6.4.7 и 12.3.7). Благодаря этому окончание аксона способно передать следующий сигнал сразу же, как только по аксону сможет прийти следующий нервный импульс.
19.3.3. Нейромедиатор быстро высвобождается путем экзоцитоза [16]
Окончание аксона в нервно-мышечном соединении заполнено тысячами одинаковых (~40 нм в диаметре) секреторных пузырьков, называемых синаптическими пузырьками, каждый из которых содержит ацетилхолин (см. рис. 19-18). Входящий в клетку кальций вызывает волну экзоцитоза, при котором пузырьки сливаются с пресинаптической мембраной, их содержимое выводится в синаптическую щель и воздействует на постсинаптическую клетку. Экзоцитоз происходит лишь в определенных участках, называемых активными зонами, которые расположены прямо напротив рецепторов постсинаптической клетки; благодаря этому задержка в передаче сигнала, связанная с диффузией нейромедиатора через синаптическую щель, становится пренебрежимо малой. Впоследствии мембраны «разрядившихся» синаптических пузырьков извлекаются из пресинаптической плазматической мембраны путем эндоцитоза.
Имеются данные о том, что входящие в окончание аксона ионы Са2+ не только запускают экзоцитоз, но и активируют Са2+-кальмодулин-зависимую протеинкиназу (Са-киназу II - см. разд. 12.4.3), фосфорилирующую в окончании аксона многие белки, в том числе синапсин /-белок, прикрепленный к поверхности синаптических пузырьков. Как полагают, в результате фосфорилирования синапсин I освобождается, благодаря чему пузырьки переходят в активную зону пресинаптической мембраны, где занимают место пузырьков, исчезнувших в результате экзоцитоза. Весь цикл событий, запускаемый одиночным нервным импульсом, был наглядно продемонстрирован путем очень быстрого замораживания области синапса и исследования препаратов в электронном микроскопе. Некоторые результаты представлены на рис. 19-20.
19.3.4. Нейромедиатор высвобождается «квантами» случайным образом [17]
Под действием одного нервного импульса из окончания аксона в нервно-мышечном соединении обычно высвобождается лишь несколько сотен из многих тысяч находящихся там синаптических пузырьков. Каждый пузырек, выбрасывая свое содержимое в синаптическую щель, вносит свой вклад в изменение мембранного потенциала постсинаптической мышечной клетки, и это можно регистрировать в помощью внутриклеточного электрода (рис. 19-21). Таким образом мембрана мышечной клетки деполяризуется до пороговой величины и генерирует потенциал действия. Это возбуждение распространяется по всей клетке (рис. 19-22), вызывая ее сокращение, как это описано в разд. 11.1.11.
Даже тогда, когда в окончание аксона не поступают импульсы, вблизи синапса наблюдаются случайные кратковременные сдвиги потенциала мышечной мембраны в сторону деполяризации. Эти так называемые миниатюрные синаптические потенциалы имеют примерно одинаковую амплитуду всего лишь около 1 мВ, что намного ниже порогового уровня. Возникают такие потенциалы случайным образом с достаточно низкой вероятностью, в среднем приблизительно раз в секунду (рис. 19-23). Каждый миниатюрный потенциал - это результат слияния одного синаптического пузырька с пресинаптической мембраной, т. е. результат выброса содержимого одного пузырька. Амплитуда, регистрируемая для данной мышечной клетки, более или менее постоянна, так как пузырьки содержат примерно одинаковое число молекул ацетилхолина - около 5000. Это минимальная порция, или «квант», выделяемого медиатора. Сигналам большей силы соответствуют величины, кратные этой основной единице. Ионы кальция, входящие в окончание аксона во время потенциала действия, повышают за доли миллисекунды частоту опорожнения пузырьков более чем в 10000 раз по сравнению с частотой спонтанного опорожнения в покоящемся окончании. Тем не менее процесс остается вероятностным, единичная стимуляция нерва не всегда производит в точности одинаковый постсинаптический эффект: если в среднем высвобождается 300 квантов медиатора, то в каждом отдельном случае число их может быть несколько большим или меньшим.
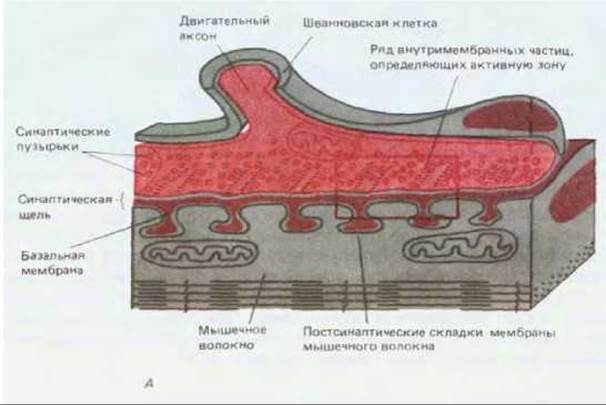
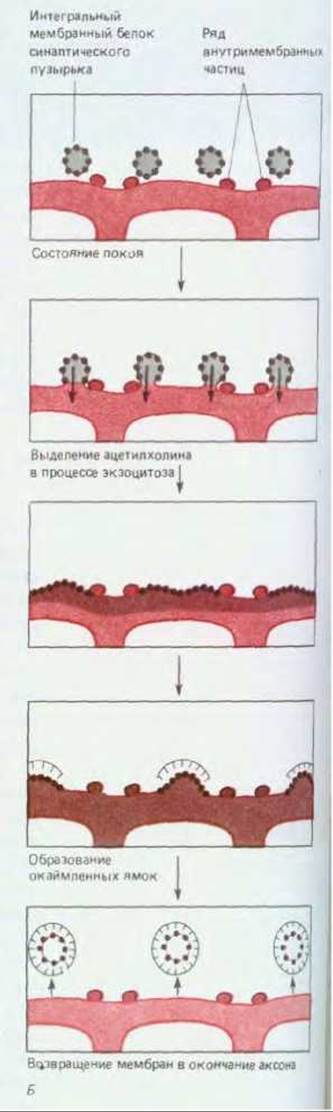
Рис. 19-20. Цикл событий, происходящих на мембране аксонного окончания в нервно-мышечном синапсе после стимуляции. Для того чтобы проследить за цепью событий, образцы ткани подвергали быстрому замораживанию через разные промежутки времени. Для упрощения задачи стимуляция осуществлялась в условиях, специально измененных таким образом, чтобы протекание всего процесса замедлялось в 5 10 раз, а число пузырьков, подвергающихся экзоцитозу, возрастало. А. Схематическое изображение нервно-мышечного соединения; показаны активные зоны, где происходит выделение нейромедиатора. Б. Область, обведенная рамкой на рисунке А, в увеличенном виде; схематически показаны события, происходящие в этой области через разные промежутки времени после стимуляции нерва. В- 3. Мембрана, как она выглядит под электронным микроскопом (фото любезно предоставил John Heuser). Слева представлены электронные микрофотографии препаратов пресинаптической мембраны (со стороны цитоплазмы), полученных методом замораживания скалывания; справа микрофотографии тонких срезов. В и Е- состояние покоя. Г и Ж- слияние синаптических пузырьков с плазматической мембраной в активной зоне (отмечены рядами частиц, включенных в мембрану). Д и 3-возвращение мембран синаптических пузырьков через окаймленные ямки и окаймленные пузырьки. Как можно видеть, синаптические пузырьки начинают сливаться с плазматической мембраной через 5 мс после стимуляции (Г, Ж); каждая «пора» в плазматической мембране, видимая на фотографии Г, - результат слияния одного синаптического пузырька. Еще через 2 мс слияние завершается. Первые признаки восстановления мембраны становятся заметны примерно через 10 с, когда образуются окаймленные ямки (см. разд. 6.5.4), а затем еще через 10 с эти ямки начинают отшнуровываться с образованием окаймленных пузырьков (Д, 3). Эти пузырьки включают первоначальные мембранные белки синаптических пузырьков, а также молекулы, захваченные из внешней среды. Цикл заканчивается отделением от пузырьков окаймляющего их материала, заполнением их ацетилхолином и образованием обычных синаптических пузырьков с гладкой поверхностью. Эта схема, вероятно, позволяет объяснить удивительную однородность синаптических пузырьков по величине; их объем определяется размерами окаймлявшей их оболочки из клатрина (см. разд. 6.5.5).
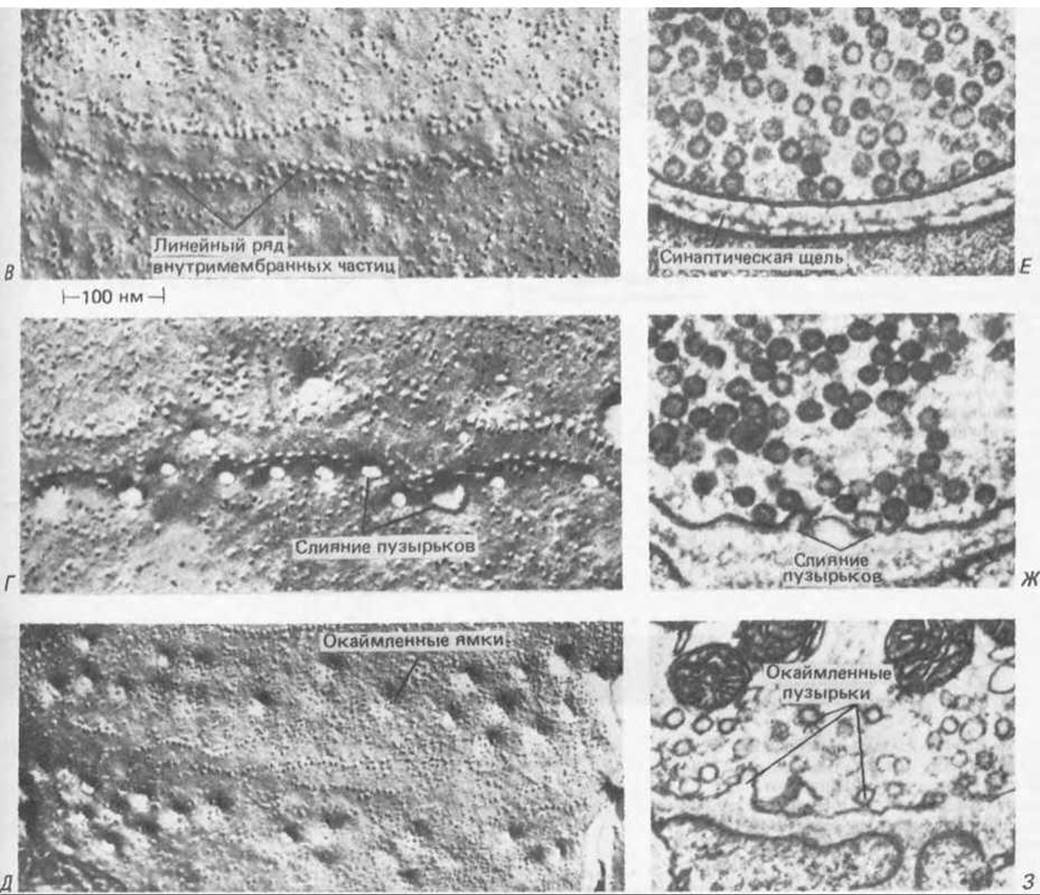
Рис. 19-20 (продолжение). Дальнейшие данные об этом процессе регенерации могут быть получены при стимуляции нерва в присутствии таких электроноплотных маркеров, как ферритин. Эти маркеры быстро появляются внутри окаймленных пузырьков, а затем и в синаптических пузырьках. Следует отметить, однако, что эксперты относятся к подобным опытам скептически, считая некоторые из наблюдаемых явлений артефактом.
19.3.5. Лиганд-зависимые каналы снова преобразуют химический сигнал в электрический [18]
В синапсе мембрана мышечной клетки действует как преобразователь - превращает химический сигнал в форме нейромедиатора в сигнал электрический. Это преобразование осуществляется с помощью лиганд-зависимых ионных каналов (т. е. рецепторов, связанных с каналами) - белков, находящихся в постсинаптической мембране. Присоединение нейромедиатора к этим белкам вызывает изменение их конформации, и каналы открываются, пропуская через мембрану ионы и изменяя тем самым мембранный потенциал. В свою очередь сдвиг мембранного потенциала, если он достаточно велик, заставляет потенциалзависимые каналы открыться, и в результате возникает потенциал действия (рис. 19-24). В отличие от потенциал-зависимых каналов лиганд-зависимые каналы относительно нечувствительны к изменениям мембранного потенциала и поэтому не способны к самоусиливающемуся возбуждению типа «всё или ничего». Вместо этого они генерируют электрический сигнал, сила которого зависит от интенсивности и продолжительности внешнего химического сигнала, т. е. от того, сколько медиатора выводится в синаптическую щель и как долго он там остается. Как мы увидим позже, это свойство лиганд-зависимых каналов имеет большое значение для обработки информации в синапсах.
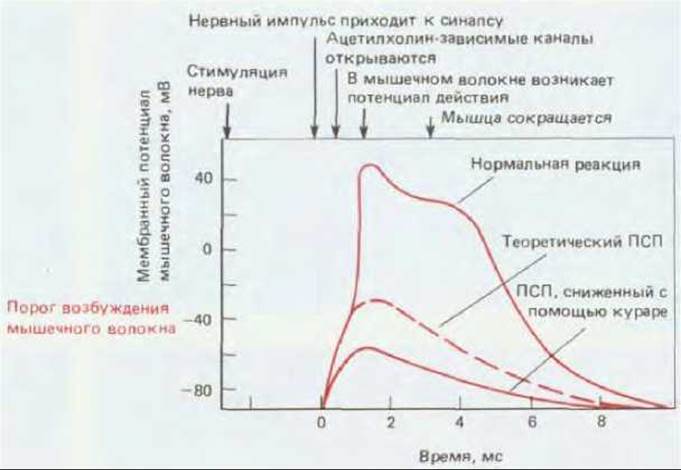
Рис. 19-21. Постсинаптический ответ на одиночный нервный импульс в нервно-мышечном соединении: кривая изменений потенциала в мышечной клетке лягушки, полученная, как и на рис. 19-17, с помощью внутриклеточного электрода, расположенного вблизи синапса. В норме постсинаптический потенциал (ПСП) - деполяризация, возникающая при прямом воздействии нейромедиатора на мембрану мышечной клетки, - достаточно велик для возбуждения потенциала действия, который может помешать эксперименту. «Чистый» ПСП, не осложненный нервным импульсом, можно получить при введении средних концентраций кураре во внеклеточную среду. Этот яд, связываясь с частью рецепторов и блокируя их реакцию на нейромедиатор, снижает величину ПСП до уровня, при котором потенциал действия не возникает.
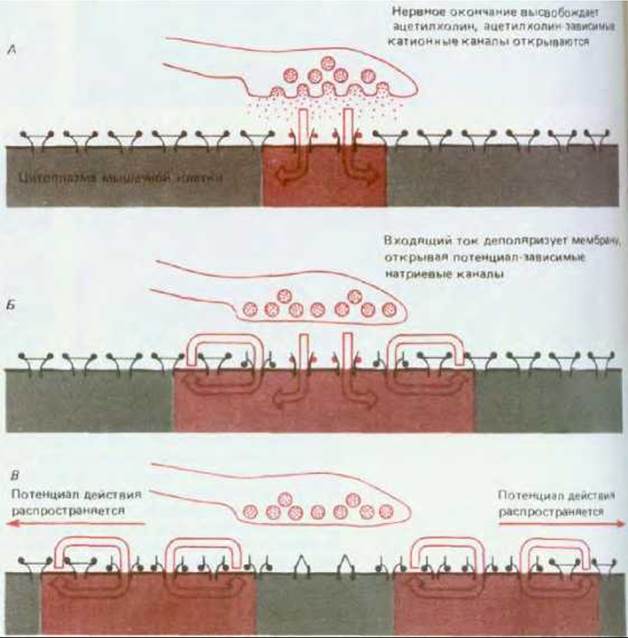
Рис. 19-22. Изменения электрического состояния мембраны мышечной клетки в нервно-мышечном соединении. Открытие ацетилхолин-зависимых ионных каналов (А) приводит к возникновению потенциала действия (Б), который распространяется вдоль мембраны мышечного волокна (В) и вызывает его сокращение.
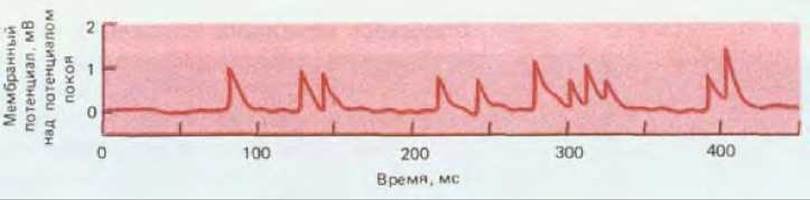
Рис. 19-23. Миниатюрные синаптические потенциалы (или «миниатюрные потенциалы концевой пластинки»), зарегистрированные в мышце лягушки с помощью внутриклеточного электрода, помещенного вблизи нервно-мышечного соединения. Каждый пик - это миниатюрный синаптический потенциал, возникающий в результате высвобождения медиатора из одного синаптического пузырька. (P. Fatt, В. Katz, J. Physiol., 117, 109-128, 1952.)
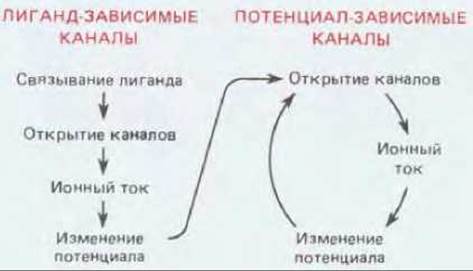
Рис. 19-24. Схема функционирования лиганд- и потенциал-зависимых каналов. Стрелками указаны причинно-следственные связи
Постсинаптические лиганд-зависимые каналы обладают еще двумя важными свойствами. Во-первых, как рецепторы они, подобно ферментам, взаимодействуют лишь с определенными лигандами и поэтому реагируют только на один нейромедиатор - тот, который высвобождается из пресинаптического окончания; другие медиаторы не вызывают практически никакого эффекта. Во-вторых, как каналам им свойственна различная ионная специфичность: одни могут избирательно пропускать К+, другие - Сl- и т.д., в то время как третьи, например, могут быть относительно мало избирательны по отношению к различным катионам, но не пропускают анионов. Как мы увидим, природа постсинаптического ответа зависит от специфичной ионной проницаемости лиганд-зависимых каналов.
19.3.6. Рецептор ацетилхолина представляет собой лиганд-зависимый катионный канал [19]
Из всех лиганд-зависимых ионных каналов наиболее изучен канал, управляемый ацетилхолином (он же рецептор ацетилхолина), в мембране мышечного волокна. Его молекулярные свойства были рассмотрены в гл. 6 (разд. 6.4.18).
Так же как и потенциал-зависимый натриевый канал, рецептор ацетилхолина может находиться в одной из нескольких альтернативных конформаций (рис. 19-25). После связывания ацетилхолина канал в нем сразу же открывается и при связанном лиганде остается некоторое время открытым; это время случайным образом варьирует и составляет в среднем 1 мс или даже меньше в зависимости от температуры и от вида организма. В открытом состоянии канал одинаково проницаем для различных катионов, включая Na+, K+ и Са2+, но совсем непроницаем для анионов (рис. 19-26).
Так как в отношении катионов заметной избирательности нет, вклад каждого катиона в ток, проходящий через канал, зависит главным образом от концентрации данного катиона и от электрохимической движущей силы. Если потенциал на мембране мышечной клетки соответствует уровню покоя, то суммарная движущая сила для К+ близка к нулю, так как градиент заряда почти уравновешивается градиентом концентрации К+. С другой стороны, для Na+ направления градиентов заряда и концентрации совпадают, и их совместное действие направлено на перемещение ионов в клетку. (Это относится и к ионам кальция, хотя внеклеточная концентрация Са2+ настолько ниже концентрации Na+, что доля кальция во всем ионном токе, направленном внутрь клетки, невелика.) Поэтому открытие каналов в ацетилхолиновых рецепторах приводит в основном к значительному притоку ионов Na+, что вызывает деполяризацию мембраны.
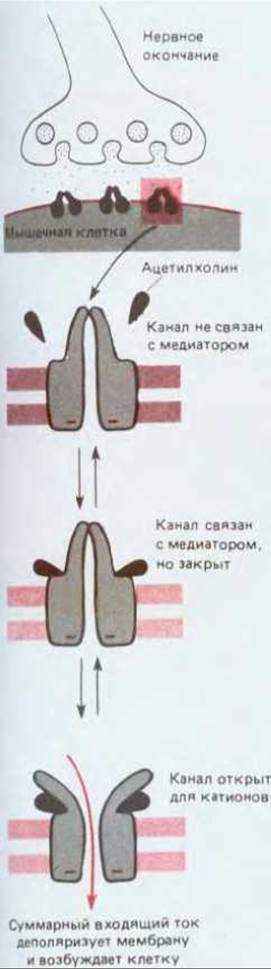
Рис. 19-25. Реакция ацетилхолиновых рецепторов на ацетилхолин. При длительном воздействии высоких концентраций ацетилхолина рецептор переходит еще в одно, не показанное здесь состояние, в котором рецептор инактивирован и не открывается даже в присутствии ацетилхолина.
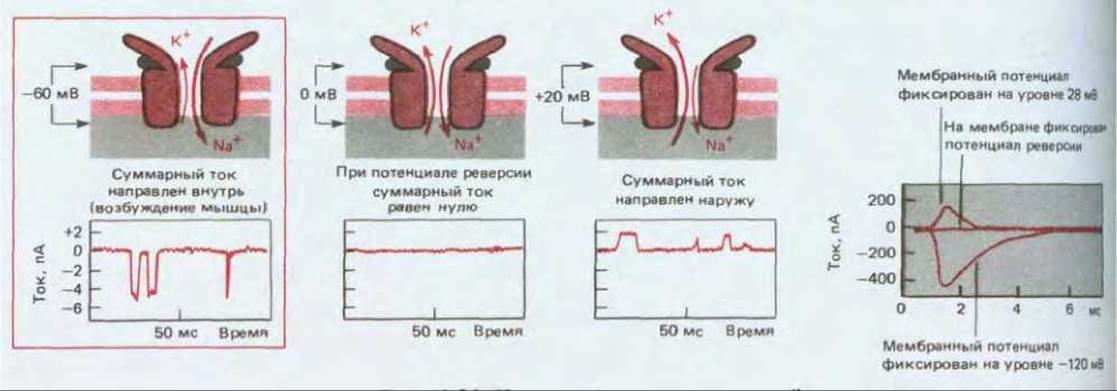
Рис. 19-26. Измерение тока через открытый канал ацетилхолинового рецептора при разных значениях мембранного потенциала. С помощью таких измерений можно установить ионную селективность каналов. Ток, переносимый через открытый канал ионами определенного вида, будет изменяться при изменении мембранного потенциала определенным образом в зависимости от вида иона и градиента его концентрации по обе стороны мембраны. Зная градиенты концентраций основных присутствующих ионов, можно определить ионную селективность канала путем простого измерения зависимости ток/напряжение; более полную информацию можно получить в результате повторных измерений при других концентрациях иона. А. Зарегистрированный с помощью метода пэтч-клампа ток, проходящий через одиночный канал, находящийся в растворе с фиксированной концентрацией ацетилхолина, при трех различных значениях мембранного потенциала. В каждом случае канал случайным образом переходит из закрытого состояния в открытое и обратно, но при некотором значении мембранного потенциала, которое называют потенциалом реверсии, ток равен нулю даже тогда, когда канал открыт. В данном случае потенциал реверсии близок к 0 мВ. Б. Такое же явление можно наблюдать, измеряя после одиночной стимуляции нерва общий ток через большое количество одиночных каналов с ацетилхолиновым рецептором, находящихся в постсинаптической мембране нервно-мышечного соединения. На графиках показаны изменения этого тока, измеренного с помощью внутриклеточных электродов в условиях фиксации напряжения. Каналы открываются при коротком воздействии ацетилхолина, но если мембранный потенциал поддерживается на уровне потенциала реверсии, то ток равен нулю. Поскольку открытые каналы проницаемы как для Na+, так и для К+, а значения электрохимических движущих сил для этих ионов различны, «нулевой ток» в действительности соответствует уравновешенным и направленным навстречу друг другу токам Na+ и К+. (Эти каналы проницаемы и для Са2+, но ток, переносимый ионами кальция, очень мал, так как их концентрация низка.) По величине потенциала реверсии и его чувствительности к концентрациям ионов во внешней среде можно судить об относительной проницаемости канала для разных ионов. Например, некоторые лиганд-зависимые каналы селективно проницаемы для Сl-, и такие каналы можно идентифицировать по величине потенциала реверсии, равной —60 мВ, что близко к равновесному потенциалу Сl-; при этом потенциал реверсии зависит от внеклеточной концентрации Сl-, но не Na+ или К+. (А по данным В. Sakmann et al., Cold Spring Harbor Symp. Quant. Biol., 48, 247-257, 1983; Б по данным К. L. Magleby, C. F. Stevens, J. Physiol., 223, 173-197, 1972.)
19.3.7. Ацетилхолин удаляется из синаптической щели в результате диффузии и гидролиза [20]
Для того чтобы состояние постсинаптической клетки успешно регулировалось сигналами, поступающими от пресинаптической клетки, постсинаптическое возбуждение должно быстро спадать, как только пресинаптическая клетка придет в состояние покоя. В нервно-мышечном соединении это достигается путем быстрого удаления ацетилхолина из синаптической щели с помощью двух механизмов. Во-первых, ацетилхолин рассеивается в результате диффузии, которая благодаря малым расстояниям происходит очень быстро. Во-вторых, ацетилхолин расщепляется ацетилхолинэстеразой на ацетат и холин. Этот фермент, выделяемый мышечными клетками, прикрепляется с помощью коллагеноподобного «хвоста» к базальной мембране, отделяющей нервное окончание от мембраны мышечной клетки. Одна молекула ацетилхолинэстеразы способна гидролизовать до 10 молекул ацетилхолина за 1 мс, поэтому весь медиатор удаляется из синаптической щели через несколько сотен микросекунд после его высвобождения из нервного окончания. Таким образом, период, когда ацетилхолин может связываться с рецепторами и переводить их в открытую конформацию, изменяя тем самым проводимость постсинаптической мембраны, очень короток (рис. 19-27). Благодаря этому временная картина пресинаптических сигналов четко отображается в картине постсинаптических ответов.
19.3.8. Быстрая синаптическая передача осуществляется с помощью небольшого числа нейромедиаторов [13, 21]
Вся структура нервно-мышечного соединения приспособлена для наиболее быстрой передачи сигналов. Для этого служат: миелинизированный двигательный аксон большого диаметра; активные зоны в окончании аксона, где синаптические пузырьки в любой момент готовы высвободить ацетилхолин точно напротив постсинаптических рецепторов; узкая синаптическая щель; лиганд-зависимые каналы постсинаптической мембраны, открывающиеся сразу же после связывания нейромедиатора; наконец, ацетилхолинэстераза в синаптической щели, быстро прерывающая передачу. Время задержки в синапсе между пиком пресинаптического потенциала действия и пиком постсинаптического импульса составляет около миллисекунды или меньше. Все больше данных свидетельствует о том, что в быстрых химических синапсах центральной нервной системы тоже, очевидно, используются лиганд-зависимые каналы и что в основе действия этих синапсов лежат те же структурные принципы: наличие активных зон, узкая синаптическая щель, локализация рецепторов напротив участков экзоцитоза. Кроме того, быстрая передача сигналов здесь также, видимо, опосредуется лишь небольшой группой нейромедиаторов. Однако это обобщение пока еще не вполне достоверно: оказалось, что очень трудно с точностью установить, какой именно медиатор действует в данном синапсе.
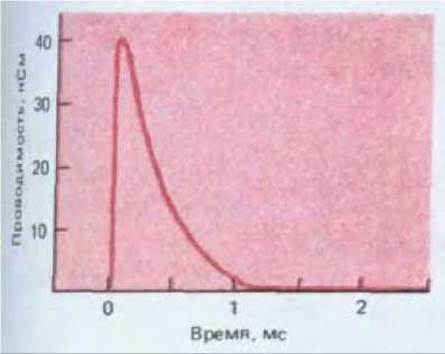
Рис. 19-27. Изменение проводимости постсинаптической мембраны в нервно-мышечном соединении лягушки, вызванное одним «квантом» ацетилхолина (содержимым одного синаптического пузырька). В момент пика проводимости бывает открыто примерно 1600 каналов, каждый из которых остается открытым в среднем в течение 400 мкс.
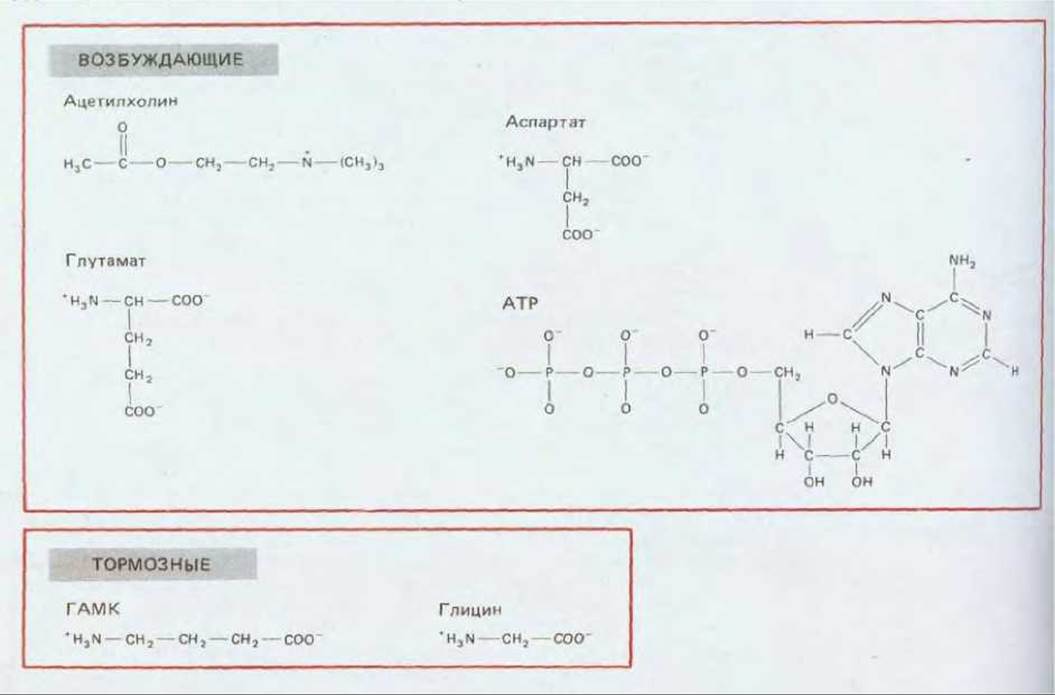
РИС. 19-28. Химическое строение главных нейромедиаторов, которые, как полагают, участвуют в быстрой синаптической передаче, воздействуя на рецепторы, связанные с каналами.
Вероятно, быстрая синаптическая передача появилась очень давно, так как одни и те же нейромедиаторы используются эволюционно весьма далекими друг от друга видами животных - от моллюсков до млекопитающих. К числу быстродействующих медиаторов относятся ацетилхолин, гамма-аминомасляная кислота (ГАМК), глицин, глутамат и, вероятно, аспартат и АТР (рис. 19-28). Обычно каждый нейрон секретирует только один вид медиатора, общий для всех выходных синапсов данного нейрона (лишь иногда их может быть два). С помощью метода «пэтч-кламп» получены прямые данные о том, что рецепторы для ацетилхолина, ГАМК, глицина и глутамата связаны с каналами. В отношении других рецепторов это тоже весьма вероятно, но пока еще не доказано. Благодаря изучению последовательностей ДНК установлена гомологичность строения рецепторов ацетилхолина, ГАМК и глицина; это позволяет предполагать общее эволюционное происхождение всех лиганд-зависимых ионных каналов.
19.3.9 Ацетилхолин и глутамат опосредуют быстрое возбуждение, а ГАМК и глицин - быстрое торможение [19, 22]
Нейромедиаторы можно классифицировать по вызываемым ими эффектам. Как мы уже видели, ацетилхолин, воздействуя на соответствующий рецептор в мембране волокна скелетной мышцы, открывает катионный канал и деполяризует мембрану, приближая ее к порогу возникновения потенциала действия. Таким образом, этот рецептор опосредует возбуждающий эффект. По-видимому, и глутамат воздействует на рецепторы сходного типа. Показано, что в нервно-мышечных соединениях у насекомых глутамат служит возбуждающим медиатором; как полагают, это также главный возбуждающий медиатор в центральной нервной системе позвоночных, подобно тому как в их периферической нервной системе такую же роль играет ацетилхолин (выполняющий, кроме того, и важные центральные функции). Аспартат может воздействовать на те же рецепторы, что и глутамат, вызывая сходные эффекты. Есть данные в пользу того, что в синапсах на некоторых видах гладких мышц быстрым возбуждающим медиатором служит АТР.
В противоположность всем этим медиаторам ГАМК в глицин опосредуют быстрое торможение. Рецепторы, связывающие эти медиаторы, соединены с каналами, которые, открываясь, пропускают небольшие отрицательно заряженные ионы, главным образом Сl-, но непроницаемы для положительных ионов. Концентрация Сl- вне клетки намного выше, чем внутри, а равновесный потенциал Сl- близок к нормальному потенциалу покоя или даже более отрицателен. Поэтому открытые хлоридные каналы удерживают мембрану в поляризованном или даже гиперполяризованном состоянии, тем самым затрудняя деполяризацию клетки и, следовательно, ее возбуждение (рис. 19-29). Полагают, что ГАМК и глицин - главные медиаторы, опосредующие быстрое торможение в центральной нервной системе позвоночных. Известно также, что ГАМК выполняет такую функцию и в нервномышечных соединениях у насекомых и ракообразных. Значение тормозных нейромедиаторов выявляется при воздействии ядов, блокирующих эффекты этих медиаторов; например, стрихнин, связываясь с глициновыми рецепторами и блокируя действие глицина, вызывает мышечные спазмы, судороги и смерть.
19.3.10. Для одного вида нейромедиаторов часто имеется несколько типов рецепторов [23]
Действие нейромедиатора зависит не только от его химической природы, но и от рецептора, который его связывает. В самом деле, часто один и тот же нейромедиатор присоединяется к рецепторам нескольких различных типов. Например, у позвоночных ацетилхолин оказывает противоположное воздействие на клетки скелетной и сердечной мышц, возбуждая первые и затормаживая вторые. В передаче этих двух эффектов участвуют разные ацетилхолиновые рецепторы. Полагают, что в тормозном эффекте, который развивается намного медленнее возбуждения скелетной мышцы, участвуют рецепторы, не связанные с каналами. Связанные с каналами рецепторы, участвующие в передаче быстрых возбуждающих эффектов ацетилхолина, называются никотиновыми рецепторами, так как они могут активироваться никотином. Рецепторы, не связанные с каналами и передающие медленные эффекты ацетилхолина, которые могут быть как тормозными, так и возбуждающими, называются мускариновыми рецепторами, поскольку активируются также мускарином (одним из грибных ядов). Помимо таких веществ, специфически активирующих определенные рецепторы (так называемых агонистов), имеются сильнодействующие рецептор-специфические блокаторы (антагонисты), избирательно подавляющие функцию ацетилхолиновых рецепторов того или другого типа. Например, кураре и а-бунгаротоксин специфически связываются с никотиновыми рецепторами, блокируя их активность, в то время как атропин действует таким же образом на мускариновые рецепторы. Другие агонисты и антагонисты проявляют специфичность по отношению к рецепторам других нейромедиаторов. Очень часто различные рецепторы исследуют, идентифицируют и локализуют при помощи агонистов и антагонистов, которые с ними связываются.
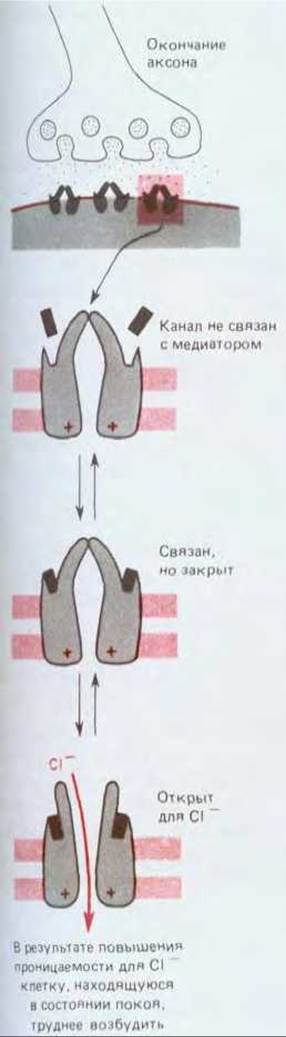
Рис. 19-29. Поведение рецепторов для ГАМК, связанных с каналами. При связывании ГАМК эти рецепторы образуют открытый канал, избирательно проницаемый для Сl-. Таким путем они вызывают тормозный эффект: открытые Cl--каналы удерживают мембранный потенциал вблизи равновесного потенциала для Cl-, который в свою очередь близок к потенциалу покоя.
19.3.11. Синапсы служат важными мишенями для воздействия лекарственных веществ [23, 24]
Рецепторы нейромедиаторов играют важную роль как мишени для ядов и лекарственных препаратов. Змея парализует свою добычу с помощью а-бунгаротоксина, блокирующего никотиновые рецепторы ацетилхолина. Блокируя те же самые рецепторы с помощью кураре, можно вызвать расслабление мышц во время хирургических операций, в то время как сердце будет работать нормально, так как кураре не связывается мускариновыми рецепторами. Таким образом, различия в способности этих двух видов рецепторов ацетилхолина связывать определенные лиганды дает возможность осуществлять точно направленное лекарственное воздействие.
Большинство психотропных препаратов воздействует на синапсы, и при этом многие из них связываются специфическими рецепторами. Примером могут служить рецепторы ГАМК; наиболее изученные из них - ГАМКА-рецепторы - представляют собой лиганд-зависимые хлоридные каналы, участвующие, как уже говорилось выше, в быстром торможении. На них воздействуют как бензодиазепиновые транквилизаторы (например, валиум и либриум), так и барбитураты, применяемые при бессоннице, состоянии беспокойства, эпилепсии. ГАМК, бензодиазепины и барбитураты кооперативно связываются тремя разными участками одного и того же рецепторного белка; вероятно, лекарственные препараты влияют на психику, снижая минимальную концентрацию ГАМК, еще достаточную для открытия хлоридных каналов, и усиливая тем самым тормозное действие ГАМК.
Синаптическую передачу можно нарушить и многими другими способами, например подавляя процессы расщепления медиатора или удаления его из синаптической щели. Имеются препараты, ингибирующие активность ацетилхолинэстеразы в нервно-мышечном соединении, что приводит к увеличению времени воздействия ацетилхолина на мышечную клетку. Это помогает уменьшить слабость у больных, страдающих myasthenia gravis, у которых понижено количество функционально активных рецепторов ацетилхолина (разд. 18.1.9). Другие нейромедиаторы, такие как ГАМК, не расщепляются в синаптической щели ферментами, а всасываются обратно пресинаптическими окончаниями или же близлежащими глиальными клетками. Как правило, в плазматической мембране нервных окончаний и глиальных клеток имеются специальные транспортные белки для активного поглощения нейромедиатора. Некоторые психотропные препараты либо блокируют, либо активируют этот процесс в синапсах определенных классов, что дает положительный клинический эффект.
Заключение
Нервные сигналы передаются от клетки к клетке через синапсы, которые могут быть электрическими (щелевые контакты) или химическими. В химическом синапсе в результате деполяризации пресинаптической мембраны под действием нервного импульса открываются потенциал-зависимые кальциевые каналы, что приводит к притоку ионов Са2+, которые в свою очередь вызывают высвобождение нейромедиатора из синаптических пузырьков путем экзоцитоза. Медиатор диффундирует через синаптическую щель и связывается рецепторными белками в мембране постсинаптической клетки. Из синаптической щели медиатор быстро удаляется путем диффузии, ферментативного расщепления или ж всасывания окончанием аксона или глиальными клетками. Рецептори, нейромедиаторов можно подразделить на связанные и не связанные с каналами. Рецепторы, связанные с каналами (лиганд-зависимые ионные каналы) опосредуют быстрые постсинаптические эффекты, проявляющиеся в течение нескольких миллисекунд. Известно лишь небольшое число нейромедиаторов, взаимодействующих с такими рецепторами. В частности, ацетилхолин и глутамат (а также, вероятно, аспартат и АТР) открывают лиганд-зависимые каналы, проницаемые только для катионов, что ведет к возникновению быстрых возбудительных постсинаптических потенциалов, в то время как ГАМК и глицин открывают гомологичные каналы, пропускающие в основном ионы Сl-, и в результате возникают быстрые тормозные постсинаптические потенциалы. Все эти нейромедиаторы, а также многие другие, способны воздействовать и на рецепторы, не связанные с каналами, реализуя более медленные и более сложные эффекты.