Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Нервная система
Потенциал-зависимые ионные каналы и потенциал действия
Как уже говорилось в гл. 6, разность потенциалов между внутренней и наружной сторонами плазматической мембраны - мембранный потенциал - зависит от распределения электрического заряда (разд. 6.4.15). Заряд переносят через мембрану нервной клетки малые неорганические ионы, главным образом Na+, К+, Cl- и Са2+, которые проходят через липидный бислой по специфическим ионоселективным каналам, образуемым специальными трансмембранными белками (разд. 6.4.14). При открытии и закрытии ионных каналов распределение заряда изменяется и происходит сдвиг мембранного потенциала. Таким образом, передача сигналов нервными клетками зависит от каналов с регулируемой проницаемостью.
Наиболее важны два типа таких каналов: 1) потенциал-зависимые каналы, в особенности натриевые, - они играют ключевую роль во вспышке электрической активности, приводящей к распространению потенциалов действия по аксону; 2) лиганд-зависимые каналы, которые преобразуют внеклеточные химические сигналы в электрические,- от них зависит функционирование синапсов. Ионные каналы и их роль в передаче электрических сигналов уже были описаны в гл. 6 (разд. 6.4.14-6.4.17), и это послужит основой для дальнейшего рассмотрения передачи нервных сигналов в настоящей главе. Некоторые электрические законы, имеющие непосредственное отношение к нервным клеткам, представлены на схеме 19-1.
19.2.1. Изменение потенциала может распространяться в нервной клетке пассивно [3, 4, 8, 9]
Обычно потенциалы действия возникают у основания аксона и затем передаются по всей его длине. Для того чтобы понять механизм этой передачи, полезно вначале рассмотреть, как распространяется электрическое возбуждение по нервной клетке в отсутствие потенциалов действия. Как уже говорилось, такое пассивное распространение - явление весьма обычное, особенно в нейронах, у которых аксоны очень коротки или их нет совсем. Такие клетки часто не имеют или почти не имеют потенциал-зависимых Na+каналов и для передачи сигнала используют только пассивное распространение, связанное с плавно изменяющимися локальными потенциалами.
В состоянии покоя мембранный потенциал аксона имеет повсюду одинаковое отрицательное значение - внутренняя среда аксона электроотрицательна по отношению к внеклеточной среде. Как мы объяснили в гл. 6 (разд. 6.4.15), разность потенциалов зависит от значительных градиентов концентраций Na+ и К+, создаваемых Na+ -К+-насосом. Благодаря каналам утечки К мембрана в состоянии покоя проницаема только для калия, поэтому мембранный потенциал покоя близок к равновесному калиевому потенциалу - обычно около —70 мВ (см. схему 19-1). Электрический сигнал может принимать форму деполяризации, когда падение потенциала на мембране уменьшается, или гиперполяризации, при которой оно возрастает. Чтобы объяснить механизм пассивного распространения электрического сигнала, рассмотрим, что происходит при локальной деполяризации аксона с помощью тока, пропускаемого через введенный в аксон электрод. Если сила тока мала, деполяризация будет подпороговой: практически все Na+-каналы останутся закрытыми и потенциалов действия не возникнет. Быстро установится равновесное состояние, при котором ток, протекающий через микроэлектрод внутрь клетки, точно сбалансирован током (главным образом калиевым), вытекающим через мембрану. Часть тока будет выходить вблизи микроэлектрода, а часть, прежде чем выйти из клетки, пройдет некоторое расстояние внутри аксона в том или другом направлении. Поэтому сдвиг мембранного потенциала будет экспоненциально уменьшаться с увеличением расстояния от источника возмущения (рис. 19-9). Такого рода пассивное распространение электрического сигнала вдоль отростка нервной клетки аналогично распространению сигнала по телеграфному кабелю, лежащему на дне моря. По мере прохождения тока по осевому проводнику (цитоплазме) происходит некоторая утечка через слой изоляции (мембрану) в окружающую среду, в результате чего сигнал постепенно затухает. Поэтому электрические свойства, от которых зависит пассивное распространение сигналов, часто называют кабельными свойствами аксона.

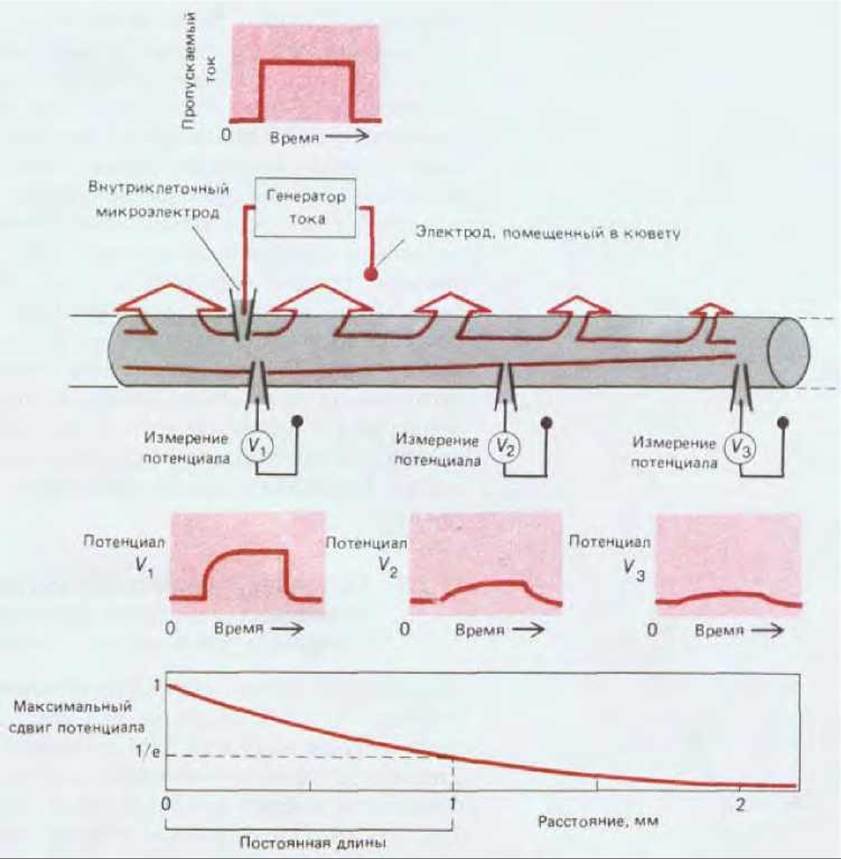
Рис. 19-9. Ток, вводимый в аксон через микроэлектрод, выходит наружу через плазматическую мембрану. Величина выходящего тока уменьшается экспоненциально с увеличением расстояния от микроэлектрода. Предполагается, что этот ток вызывает лишь подпороговую деполяризацию мембраны. На трех графиках под схемой показано, как смещение мембранного потенциала, вызванное коротким толчком тока, уменьшается с увеличением расстояния от источника возмущения. Расстояние, на котором сдвиг мембранного потенциала уменьшается в1/е раз, называют постоянной длины. Постоянная длины варьирует в пределах примерно от 0,1 мм (для очень тонких аксонов с мембраной, относительно легко пропускающей ионы) до 5 мм (для очень толстых аксонов с относительно непроницаемой мембраной). В нашем примере эта постоянная равна 1 мм.
Впрочем, аксоны как проводники намного хуже электрических кабелей, и для передачи сигналов на расстояния больше нескольких миллиметров пассивного распространения уже недостаточно, особенно в тех случаях, когда сигнал слаб и непродолжителен. Это связано не только с утечкой тока, но также и с тем, что сдвиг мембранного потенциала, вызванный током, происходит не мгновенно, а требует некоторого времени. Необходимое время зависит от емкости мембраны, т.е. величины заряда, который должен накопиться по ту и другую сторону мембраны, чтобы произошло данное изменение мембранного потенциала (см. схему 19-1). Мембранная емкость обусловливает как замедление пассивной передачи сигналов вдоль аксона, так и искажение их. Например, резкий короткий стимул, приложенный в одной точке, на расстоянии нескольких миллиметров регистрируется уже как плавный, постепенно возрастающий и падающий потенциал с сильно уменьшенной амплитудой (см. рис. 199). Таким образом, для верной передачи сигналов на расстояния, превышающие несколько миллиметров, в дополнение к пассивным кабельным свойствам аксону необходим активный механизм, поддерживающий силу и форму сигнала на всем его пути. Таким автоматически усиливаемым сигналом служит потенциал действия.
Рис. 19-10. Кальмар: показано расположение гигантских аксонов, большие размеры которых дали возможность провести первые эксперименты по изучению механизма потенциала действия. (Н. Curtis, Biology, 4th ed. New York: Worth, 1983; Keynes R. D. The nerve impulse and the squid. Scientific American, December 1958.)
19.2.2. Потенциал-зависимые натриевые каналы генерируют потенциал действия; потенциал-зависимые калиевые каналы ограничивают его продолжительность [3, 4, 8,10]
Электрохимический механизм потенциалов действия был впервые установлен в 40-50-х годах нашего века. В то время еще не были разработаны методы изучения электрических явлений в небольших одиночных клетках, и поэтому эксперименты можно было проводить только на гигантской клетке, а точнее на ее части - гигантском аксоне кальмара (рис. 19-10). Последующие работы показали, что нейроны большинства животных проводят потенциалы действия таким же образом. На схеме 19-2 представлены некоторые из ключевых основополагающих экспериментов. Несмотря на значительные технические усовершенствования, сделанные с тех пор, логика первоначальных исследований продолжает служить моделью для современных работ. Решающим моментом стало понимание того, что проницаемость мембраны для Na+ и К+ изменяется при изменении мембранного потенциала; иными словами, в мембране имеются натриевые и калиевые каналы, зависимые от потенциала. Метод фиксации потенциала (рис. 19-11) дал возможность подробно изучить закономерности открытия и закрытия этих каналов при изменении мембранного потенциала и показал, что потенциал действия -прямое следствие этих закономерностей.
Потенциал действия возникает, когда мембрана мгновенно деполяризуется до уровня, превышающего определенный порог. Как уже говорилось в гл. 6, в результате такой деполяризации какого-то участка мембраны здесь откроются потенциал-зависимые натриевые каналы, что вызовет ток ионов Na+ вниз по их электрохимическому градиенту; следствием будет дальнейшая деполяризация мембраны, в результате чего откроется еще большее число Na+-каналов, и так далее, подобно цепной реакции, до тех пор, пока потенциал в этом участке мембраны не приблизится к натриевому равновесному потенциалу (см. схему 19-1). На этом этапе происходят два события, которые возвращают потенциал мембраны к первоначальному отрицательному значению: Na+-каналы спонтанно переходят в закрытое, инактивированное состояние, а потенциалзависимые К+-каналы открываются. Эти калиевые каналы реагируют на изменение мембранного потенциала почти так же, как и натриевые, но менее быстро, и поэтому их иногда называют медленными К+-каналами. Как только К+-каналы открываются, выходящий калиевый ток быстро перекрывает по величине входящий натриевый ток и мембранный потенциал возвращается к уровню равновесного К+-потенциала еще до полной инактивации Na+-каналов. В результате реполяризации потенциал-зависимые калиевые каналы вновь закрываются, а инактивированные натриевые каналы переходят в первоначальное закрытое, но способное к активации состояние. Таким образом способность генерировать потенциалы действия может восстановиться в данном участке мембраны менее чем на одну тысячную секунды.
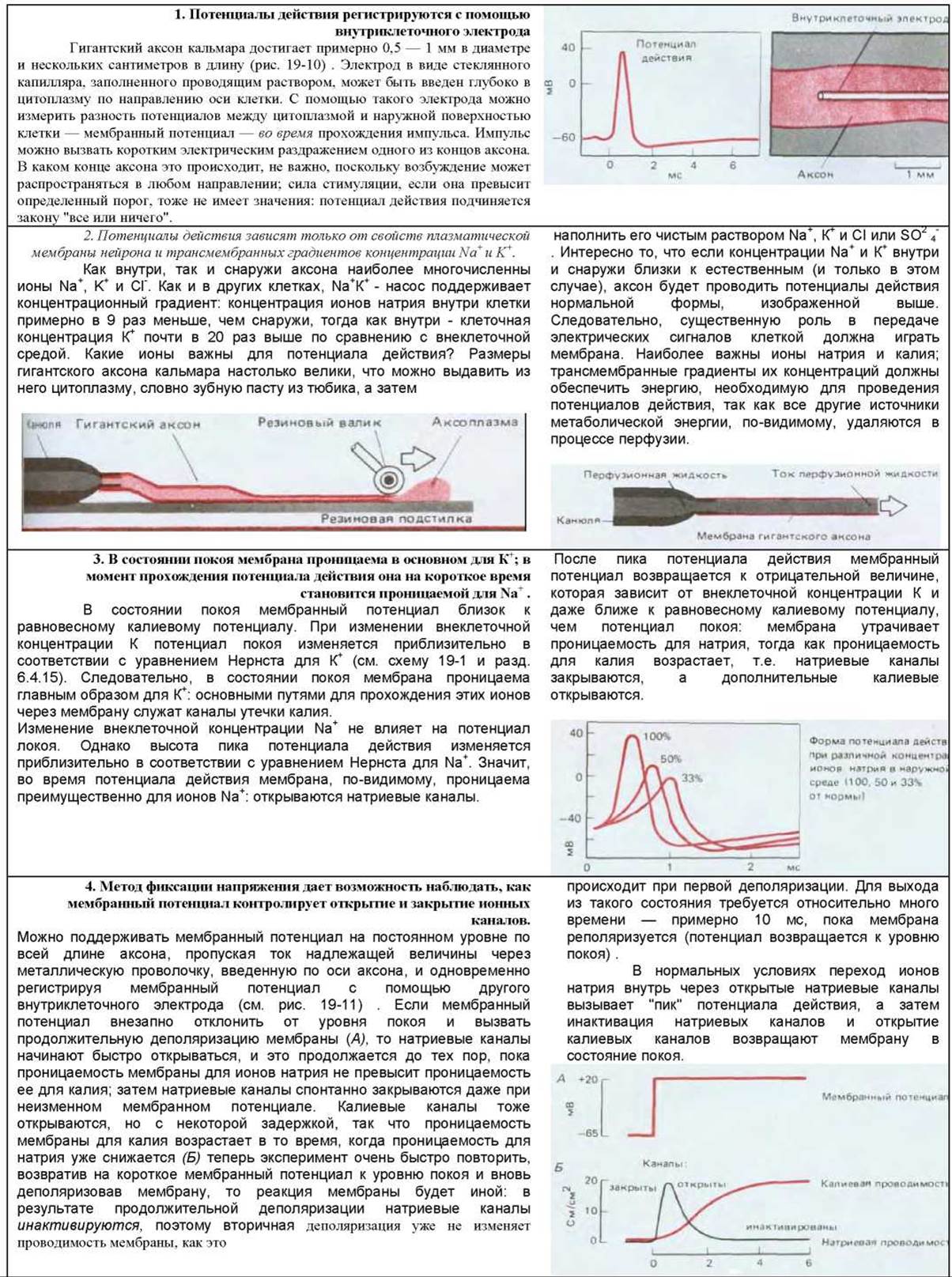
Схема 19-2. Некоторые классические эксперименты на гигантском аксоне кальмара.
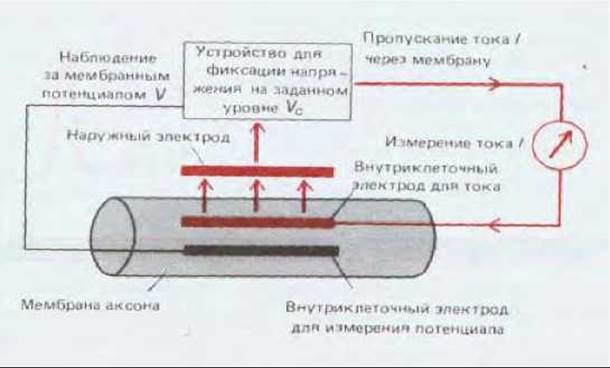
Рис. 19-11. Метод фиксации напряжения, с помощью которого изучают поведение ионных каналов, измеряя ток, протекающий через плазматическую мембрану, когда мембранный потенциал поддерживается на каком-либо постоянном уровне. Используются два внутриклеточных электрода - один для контроля мембранного потенциала, а другой для введения в клетку тока определенной величины. Ток, входящий в клетку через электрод, вытекает наружу через ионные каналы в плазматической мембране; на рисунке эта цепь выделена цветом. До тех пор пока мембранный потенциал имеет постоянную величину, ток 1, входящий в аксон через электрод, полностью уравновешивается суммарным током, вытекающим из клетки через всю поверхность аксона (в противном случае общий заряд внутри клетки изменился бы, что привело бы к сдвигу мембранного потенциала). Мембранный потенциал можно изменять, уменьшая или увеличивая ток, вытекающий наружу. Электронное устройство, фиксирующее напряжение, следит за мембранным потенциалом V и регулирует величину тока I таким образом, чтобы поддерживать V на постоянном уровне: любое небольшое отклонение от заданного значения Vc автоматически приводит к изменению величины тока, благодаря чему мембранный потенциал не отклоняется от фиксированного значения V = Vc. Для того чтобы выяснить, как изменяется поведение мембранных каналов с течением времени, нужно резко переключить потенциал с одного фиксированного уровня на другой и проследить за соответствующими токами с помощью осциллоскопа. Измеряя величину тока при разных концентрациях Na+ и К+ в среде, можно вычислить, какая часть трансмембранного тока переносится теми и другими ионами, и определить вклад в этот ток N+-селективных и К+-селективных каналов. Метод фиксации напряжения может быть приспособлен для анализа поведения отдельных молекул, образующих ионные каналы, которые находятся в маленьких участках мембраны, закрывающих отверстие микроэлектрода; в этом случае методику называют методом «пэтч-клампа».
Последующие эксперименты показали, что не во всех нейронах продолжительность потенциала действия определяется потенциалзависимыми К+-каналами. В частности, в миелинизированных аксонах млекопитающих (разд. 19.2.4) число таких каналов очень невелико и состояние покоя достигается просто в результате инактивации натриевых каналов. Но хотя наличие потенциал-зависимых калиевых каналов несущественно для проведения уже возникших потенциалов действия, позднее мы увидим (разд. 19.4.3), что эти каналы играют решающую роль в механизме первичного генерирования импульсов при раздражении тела нервной клетки.
19.2.3. Потенциалы действия обеспечивают быструю передачу сигналов на дальние расстояния [3, 4, 8, 11]
Благодаря кабельным свойствам аксона локальный приток большого количества ионов Na+ во время потенциала действия приводит к возникновению продольных токов, деполяризующих смежные участи мембраны до порогового уровня, что в свою очередь вызывает и здесь возникновение потенциалов действия (рис. 19-12). Этот процесс распространяется вдоль аксона от одного возбужденного участка к другому со скоростью, которая у позвоночных может составлять от 1 до 100 м/с в зависимости от типа аксона.
Скорость проведения импульса зависит от кабельных свойств аксона: чем больше емкость мембраны, тем больший заряд нужен для деполяризации ее до порогового уровня, а чем больше внутреннее сопротивление цитоплазмы в аксоне, тем меньший ток может проходить через нее и тем больше времени требуется для накопления необходимого заряда Сопротивление и емкость единицы длины аксона определяются площадью поперечного сечения аксона, и простое вычисление показывает, что с увеличением диаметра (толщины) аксона скорость проведения импульсов возрастает. У кальмара и многих других беспозвоночных для быстрой передачи сигналов в ходе эволюции выработались аксоны. огромного диаметра. Однако у позвоночных столь же высокая скорость проведения сигналов достигается гораздо более экономным способом - путем изоляции поверхности многих аксонов миелиновой оболочкой.
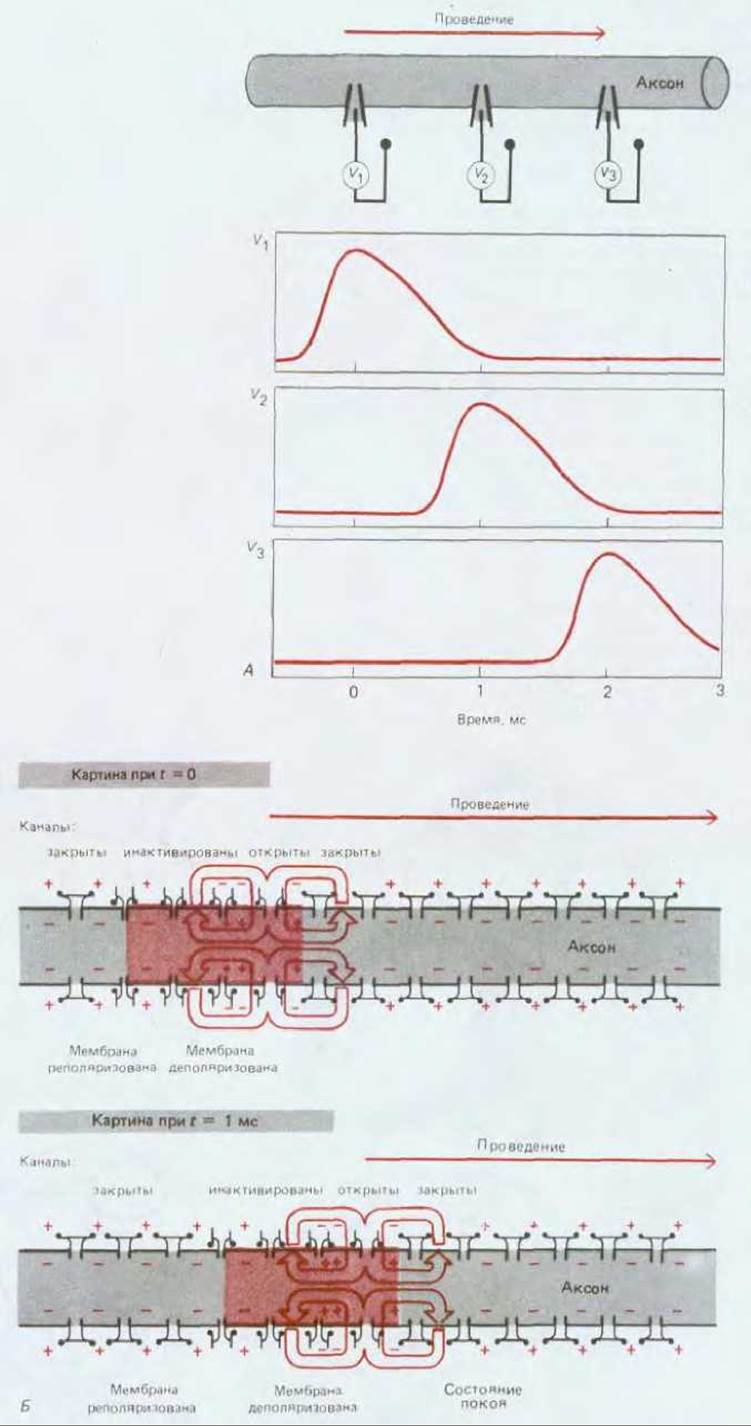
Рис. 19-12. Распространение потенциала действия А. Потенциалы, регистрируемые группой внутриклеточных электродов, расположенных вдоль аксона. Б. Конформационные изменения натриевых каналов и токи (показаны красным ютом), обусловливающие распространение сдвига мембранного потенциала. Участок аксона с деполяризованной мембраной выделен цветом.
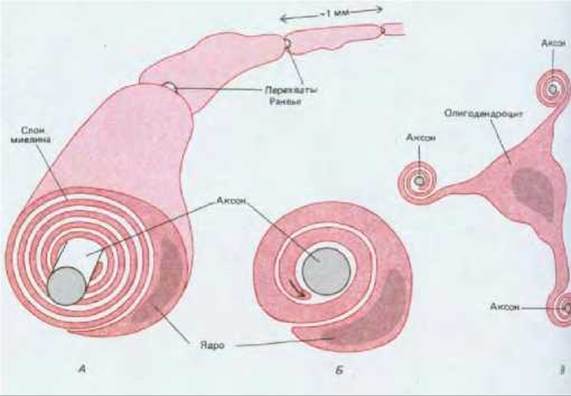
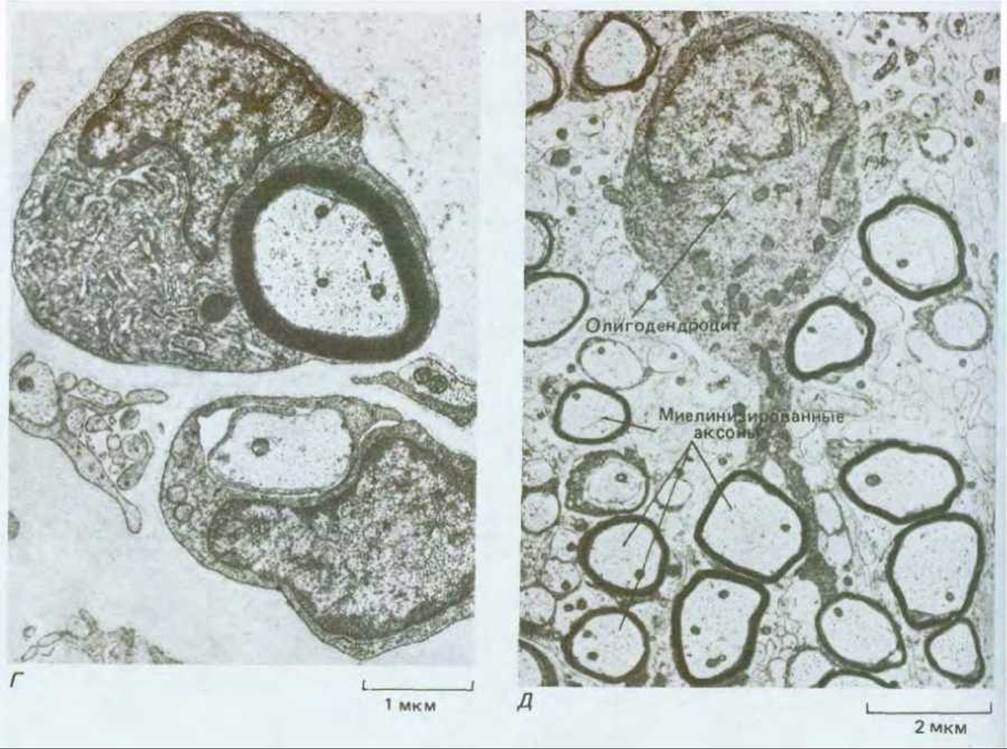
Рис. 19-13. А. Строение миелинизированного аксона. Плазматическая мембрана каждой шванновской клетки концентрическими слоями наматывается на аксон, образуя сегмент миелиновой оболочки длиной около 1 мм. Для большей ясности на рисунке слои миелина прилегают друг к другу не так плотно, как в действительности (см. Г). Б. Схематическое изображение шванновской клетки на ранней стадии образования миелиновой оболочки вокруг аксона во время его развития. Обратите внимание на то, что «наматывание» мембраны шванновской клетки на аксон осуществляется за счет роста внутреннего края (помеченного стрелкой). В. Схематическое изображение олигодендроцита, образующего миелиновые оболочки в центральной нервной системе. Один олигодендроцит миелинизирует несколько разных аксонов. Г. Срез нерва из ноги крысенка (электронная микрофотография). Видны две шванновские клетки: одна только начинает миелинизировать аксон, другая уже полностью сформировала почти зрелую миелиновую оболочку. Д. Олигодендроцит из спинного мозга котенка. Отходящие от него отростки миелинизируют по меньшей мере два аксона. [Г и Д - из С. Raine, in: Myelin (P. Morell, ed.), New York, Plenum, 1976.]
19.2.4. Миелинизация повышает скорость и эффективность проведения нервных импульсов у позвоночных [8, 12]
Миелиновую оболочку образуют специализированные глиальные клетки - шванновские клетки в периферической и олигодендроциты в центральной нервной системе. Плазматическая мембрана этих клеток слой за слоем по спирали плотно наматывается на аксон (рис. 19-13). Каждая шванновская клетка миелинизирует один аксон, образуя сегмент оболочки длиной около 1 мм, содержащий до 300 концентрических слоев; олигодендроциты формируют подобные сегменты оболочки одновременно у нескольких аксонов.
Изолирующий слой, образуемый миелиновой оболочкой, резко уменьшает емкость мембраны аксона и одновременно почти полностью предотвращает утечку тока через нее. Между двумя соседними сегментами миелина остается узкий незащищенный участок мембраны (рис. 19-14). Эти так называемые перехваты Ранвье шириной всего лишь около 0,5 мкм являются центрами электрической активности. Почти все натриевые каналы аксона сосредоточены в перехватах, где плотность этих каналов достигает нескольких тысяч на 1 мкм2, тогда как в участках, прикрытых миелиновой оболочкой, их почти вовсе нет. Поэтому изолированные участки мембраны не способны возбуждаться, но обладают превосходными кабельными свойствами - низкой емкостью и высоким сопротивлением для утечки тока. Поэтому токи, связанные с потенциалом действия в области перехвата, эффективно направляются путем пассивного проведения к следующему перехвату, быстро деполяризуют мембрану и возбуждают очередной потенциал действия. Такое проведение называют сальтаторным - сигнал распространяется вдоль аксона, «перескакивая» с одного перехвата на другой. Миелинизация дает два главных преимущества: быстрее распространяется потенциал действия и сберегается метаболическая энергия, так как активное возбуждение происходит лишь на небольших участках в перехватах Ранвье.
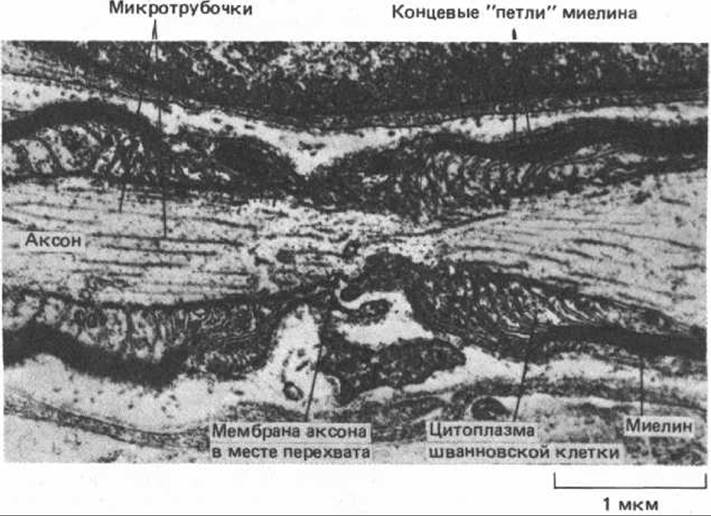
Рис. 19-14. Продольный срез аксона из периферического нерва (электронная микрофотография). Виден перехват Ранвье, где остается открытым небольшой участок плазматической мембраны аксона между двумя соседними сегментами миелиновой оболочки. (С любезного разрешения Richard Bunge.)
Заключение
Передача электрических сигналов нервной клеткой основана на изменении мембранного потенциала в результате прохождения небольших количеств ионов через управляемые ионные каналы. Эти ионы перемещаются за счет энергии, большой запас которой создается благодаря работе натриево-калиевого насоса, поддерживающего высокие градиенты концентрации Na+ и К на мембране нервной клетки. В состоянии покоя мембрана нейрона благодаря каналам утечки К более проницаема дм калия, чем для других ионов, и поэтому мембранный потенциал близок к равновесному калиевому потенциалу, составляющему примерно - 70 мВ. Потенциал действия возникает тогда, когда под влиянием короткого деполяризующего стимула открываются потенциал-зависимые натриевые каналы, так что мембрана становится более проницаемой для Na+ а мембранный потенциал еще дальше смещается в сторону равновесного натриевого потенциала. Благодаря такой положительной обратной связи открывается еще больше натриевых каналов, что в конечном итоге приводит к возникновению потенциала действия, подчиняющегося закону «всё или ничего». На каждом данном участке мембраны потенциал действия быстро исчезает вследствие инактивации натриевых каналов, а во многих нейронах также вследствие открытия потенциал-зависимых калиевых каналов.
Распространение потенциала действия (импульса) вдоль нервного волокна определяется кабельными свойствами этого волокна. При локальной деполяризации мембраны и возникновении потенциала действия ток, проходящий через открытые натриевые каналы, пассивно распространяется и деполяризует соседние участки мембраны, где в свою очередь возникает потенциал действия. Во многих аксонах позвоночных высокая скорость и эффективность проведения импульсов достигается благодаря изоляции поверхности аксона миелиновой оболочкой, изменяющей кабельные свойства аксона и оставляющей открытыми лишь небольшие участки возбудимой мембраны.