Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Нервная система
Рецепторы, не связанные с каналами, и синаптическая модуляция
В тех синапсах, где используются рецепторы, связанные с каналами, нейромедиаторы опосредуют быстрые, простые и кратковременные эффекты и к тому же место их воздействия определено с большой точностью. Медиатор, выделяемый одним окончанием аксона, воздействует лишь на одну постсинаптическую клетку. В противоположность этому рецепторы, не связанные с каналами, могут вызывать медленные, сложные и продолжительные эффекты, нередко рассеянные в пространстве. В этом случае медиатор, выделяемый одним окончанием, может оказывать влияние сразу на несколько клеток, расположенных поблизости. Такие медленные эффекты часто приводят в качестве примеров нейромодуляции, так как они влияют на быстрые ответы, опосредуемые рецепторами той же клетки, связанными с каналами. В основе действия рецепторов, не связанных с каналами, лежат те же молекулярные механизмы, которые опосредуют действие гормонов и локальных химических медиаторов за пределами нервной системы; вероятно, многие рецепторы в обоих случаях идентичны.
Как уже говорилось в гл. 12 (разд. 12.3.1), расположенные на поверхности клетки рецепторы для сигнальных молекул, не связанные с каналами, подразделяют на две большие группы: 1) каталитические рецепторы, большей частью представленные тирозин-специфическими протеинкиназами, которые в результате присоединения лиганда активируются и фосфорилируют остатки тирозина во внутриклеточных белках; и 2) рецепторы, связанные с G-белком, передающие сигнал внутрь клети путем активации регулярного GTP-связывающего белка (G-белка), который в свою очередь активирует или инактивирует мембраносвязанный фермент или ионный канал. По-видимому, большая часть изученных нейромедиаторных рецепторов, не связанных с каналами, связана с G-белком, который участвует в передаче сигнала одним из трех способов:
1. G-белок может активировать или инактивировать аденилатциклазу, регулируя тем самым содержание циклического AMP в постсинаптической клетке. В свою очередь циклический AMP регулирует активность сАМР-зависимой протеинкиназы (А-киназы - см. разд. 12,4.1), которая наряду с другими белками-мишенями способна фосфорилировать ионные каналы плазматической мембраны, изменяя их свойства. Циклический AMP способен также влиять на некоторые ионные! каналы, непосредственно присоединяясь к ним.
2. G-белок может запускать инозитолфосфолипидный путь (разд. 12.3.9), активируя при этом протеинкиназу С (С-киназу) и вызывая выход Са2+ в цитозоль постсинаптической клетки из содержащего кальций компартмента. С-киназа регулирует поведение ионных каналов, фосфорилируя их. Ионы Са2+ могут влиять на поведение ионных каналов либо непосредственно, либо косвенно через Са2+-зависимую протеинкиназу, фосфорилирующую канал (разд. 12.4.3).
3. G-белок может взаимодействовать непосредственно с ионными каналами, заставляя их открываться или закрываться. В каждом случае определенные молекулы действуют в постсинаптической клетке как связующие звенья, или внутриклеточные посредники, которые диффундируют в клетке и передают сигнал от рецептора другим клеточным компонентам. Чем больше этапов включает этот каскад внутриклеточных посредников, тем больше возможностей для усиления и регуляции сигнала (разд. 12.4.6).

Рис. 19-36. Небольшой пучок вегетативных двигательных аксонов, иннервирующих гладкомышечные клетки мочеточника. Микрофотография, полученная с помощью сканирующего электронного микроскопа. «Варикозные» расширения содержат синаптические пузырьки, наполненные нейромедиатором норадреналином. Синапсы здесь плохо различимы; ширина пространства между местом выделения медиатора и мембраной ближайшей мышечной клетки, на которую он должен воздействовать, может достигать 0,2 мкм. (S. Tachibana et al., J. Urol., 134, 582-568, 1985. Copyright by Williams a. Wilkins, 1985.)
Идентифицировано более 50 нейромедиаторов, взаимодействующих с рецепторами, не связанными с каналами, и вызывающих разнообразные и сложные эффекты. Некоторые из них, например ацетилхолин, могут присоединяться к рецепторам, связанным с каналами, тогда как другие, такие как нейропептиды (см. ниже), видимо, не способны к этому.
19.5.1. Рецепторы, не связанные с каналами, опосредуют медленные и рассеянные эффекты [32]
В то время как рецепторы, связанные с каналами, вызывают электрические изменения в постсинаптической клетке за несколько миллисекунд или еще быстрее, рецепторам, не связанным с каналами, для достижения эффекта требуется несколько сотен миллисекунд или более. Этого следовало ожидать, так как между первоначальным сигналом и конечным ответом должна пройти серия ферментативных реакций. Более того, часто сам сигнал «размыт» не только во времени, но и в пространстве.
Ярким примером может служить иннервация гладкой мускулатуры аксонами, выделяющими норадреналин, который активирует аденилатциклазу через посредство рецептора, связанного с G-белком. В этом случае медиатор высвобождается не из нервных окончаний, а из утолщений или узелков, расположенных вдоль аксона (рис. 19-36). В этих узелках содержатся синаптические пузырьки, но здесь нет активных зон, определяющих точные места выхода медиатора. Кроме того, сами узелки не прилегают к каким-то специализированным рецептивным участкам постсинаптической клетки; вместо этого медиатор диффундирует в широких пределах, воздействуя сразу на несколько клеток, расположенных вблизи (подобно локальному химическому медиатору - см. разд. 12.7). Вероятно, многие сигнальные молекулы, взаимодействующие с каталитическими или связанными с G-белком рецепторами в центральной нервной системе, действуют таким же паракринным способом. Действительно, многие из нейромедиаторов используются как гормоны или локальные химические медиаторы за пределами нервной системы: например, норадреналин, а также близко родственный ему адреналин выделяются в качестве гормонов из надпочечников.
Адреналин и норадреналин относятся к семейству моноаминовых медиаторов, выполняющих разнообразные функции как у позвоночных, так и у беспозвоночных и имеющих важное значение для медицины (рис. 19-37, А). Можно создать лекарственные препараты, которые будут препятствовать синтезу, поглощению или расщеплению определенных моноаминов или же взаимодействовать с некоторыми подгруппами их рецепторов. Некоторые из таких препаратов оказались полезными при лечении нервных и психических заболеваний. Например, при шизофрении часто с успехом используют препараты, блокирующие определенные виды дофаминовых рецепторов, а препараты, повышающие концентрацию дофамина в мозгу, резко улучшают двигательные функции при болезни Паркинсона (рис. 19-37, Б). При лечении глубоких депрессий часто бывают эффективны препараты, повышающие концентрацию норадреналина и/или серотонина в синапсах.
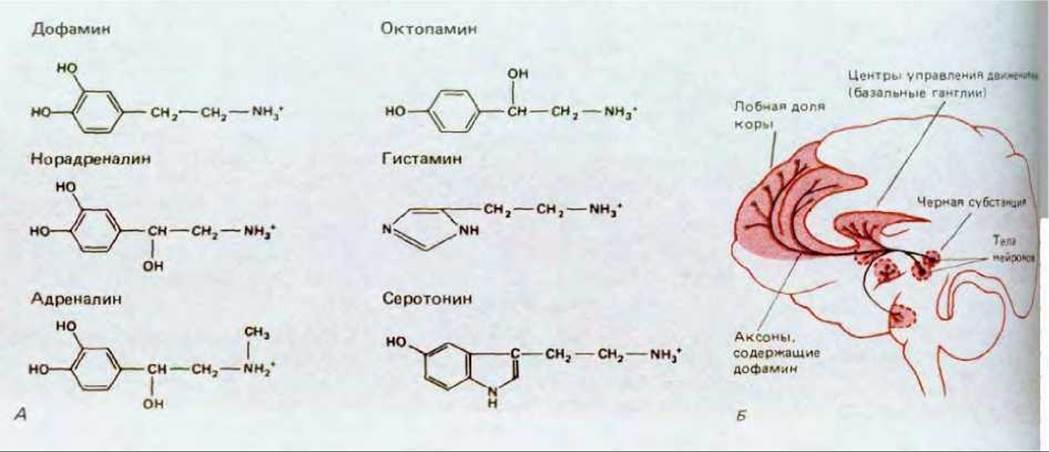
Рис. 19-37. А. Нейромедиаторы из семейства моноаминов. Б. Схема распределения нейронов, содержащих дофамин, в мозгу человека. Нарушение координации движений, наблюдаемое при болезни Паркинсона, связано с гибелью многих клеток, относящихся к определенной группе дофаминсодержащих нейронов (находящихся в substantia nigra). Симптомы заболевания можно смягчить с помощью лекарственных препаратов, способствующих синтезу дофамина и подавляющих его разрушение. Распределение нейронов, содержащих моноамины, можно выявить, обработав срезы ткани формальдегидом, который реагирует с моноаминами с образованием флуоресцирующих продуктов.
19.5.2. Самую большую группу нейромедиаторов образуют нейронептиды [32, 33]
Большая часть сигнальных молекул, используемых в различных часта организма, используется также и нейронами. В особенности это относится к небольшим белковым молекулам или пептидам, которые служат гормонами и локальными медиаторами для регуляции таких функций, как поддержание кровяного давления, секреция пищеварительных ферментов и пролиферация клеток.
За последние десять лет в изучении нейропептидов достигнута значительные успехи. Большую роль в этом сыграла иммуноцитохимия. Можно получить антитела к пептиду, обнаруженному в какой-либо ткани, а затем использовать эти антитела для поиска того же или иных структурно близких пептидов в других тканях организма. С помощью этого метода в нейронах были найдены пептиды, которые прежде не относили к пептидам нервной системы, а также многие новые разновидности пептидов. В большинстве случаев данные в пользу того, что эти нейронептиды (рис. 19-38) служат нейромедиаторами, убедительны, но все же недостаточны. Например, можно показать, что антитела к данному пептиду связываются определенными нейронами и окончаниями их аксонов, а сам пептид при локальном введении способен имитировать эффекты, вызываемые активностью этих нейронов. Иногда удается показать, и это более убедительно, что нейроны в активном состоянии секретируют определенный пептид, а эффект, вызываемый активностью этих нейронов, блокируется антителами к обнаруженному пептиду. По-видимому, нейропептиды играют особенно важную роль в регуляции таких ощущений и потребностей, как боль, наслаждение, голод, жажда и половое влечение.
Медиаторы непептидной природы синтезируются при участии ферментов, которые обычно находятся как в теле нейрона, так и в окончаниях аксона, поэтому запасы медиатора в синапсе могут восстанавливаться очень быстро даже в длинном аксоне. В отличие от этого нейропептиды образуются на рибосомах гранулярного эндоплазматического ретикулума в теле клетки и переносятся к окончаниям аксона с помощью быстрого аксонного транспорта, так что этот путь в длинном аксоне может занять сутки и больше. Нейропептиды образуются из более крупных белков-предшественников в результате их ферментативного расщепления. Часто при расщеплении одной молекулы предшественника образуется несколько функционально активных пептидов; в этом случае белок-предшественник называют полипротеином. Синаптические пузырьки, заполненные нейропептидами, можно обычно распознать по их размерам: они крупнее пузырьков, содержащих ацетилхолин, аминокислотные медиаторы или моноамины.

Рис. 19-38. Некоторые нейропептиды, с указанием ощущений и мотиваций, в возникновении которых они, возможно, участвуют.
Во многих синапсах нейропептиды секретируются одновременно с непептидным медиатором и действуют совместно, но различным образом. Например, окончания пресинаптического аксона в некоторых вегетативных ганглиях лягушки-быка содержат наряду с ацетилхолином пептид, близкий по строению к люлиберину (фактору, стимулирующему выделение лютеинизирующего гормона). Мембрана постсинаптической клетки содержит рецепторы по меньшей мере трех типов: 1) никотиновые (связанные с каналами) рецепторы для ацетилхолина, опосредующие быстрые сигналы; 2) мускариновые (связанные с G-белком) рецепторы для ацетилхолина, опосредующие более медленные эффекты; 3) рецепторы (вероятно, тоже связанные с G-белком) для пептида, сходного с люлиберином, опосредующие самые медленные эффекты (рис. 19-39, А). Действие люлибериноподобного гормона не только более замедленное по сравнению с ацетилхолином, но и более диффузное, поэтому пептидные молекулы, высвобождаемые в синапсе на какой-либо постсинаптической клетке, вызывают постсинаптические потенциалы и в других близлежащих клетках (рис. 19-39, Б).
Если (что кажется вероятным) и другие нейропептидные медиаторы обладают сходными свойствами, то нетрудно понять, почему необходимо такое большое число разнообразных нейропептидов. Поскольку пептиды легко диффундируют, места их воздействия не ограничены местами их выделения. Поэтому для того, чтобы пептиды, высвобождаемые из разных, но расположенных по соседству пресинаптических окончаний, воздействовали на разные постсинаптические мишени, пептиды и их рецепторы должны быть химически различными.
19.5.3. Стойкие изменения в поведении связаны с изменениями в специфических синапсах [34]
Эффекты, которые опосредуются рецепторами, не связанными с каналами, отличаются как длительностью, так и замедленным проявлением. Этим во многом определяется особая роль таких эффектов в регуляции поведения: они вызывают стойкое изменение в немедленном ответе нервной системы на приходящие извне сигналы и, вероятно, составляют основу по меньшей мере некоторых форм памяти. Это наиболее наглядно продемонстрировано в опытах на морском брюхоногом моллюске аплизии (Aplysia) (см. рис. 19-49). У этого животного можно проследить связь приобретенных изменений в поведении с определенными нервными цепями и расшифровать молекулярные механизмы, лежащие в основе этих изменений.
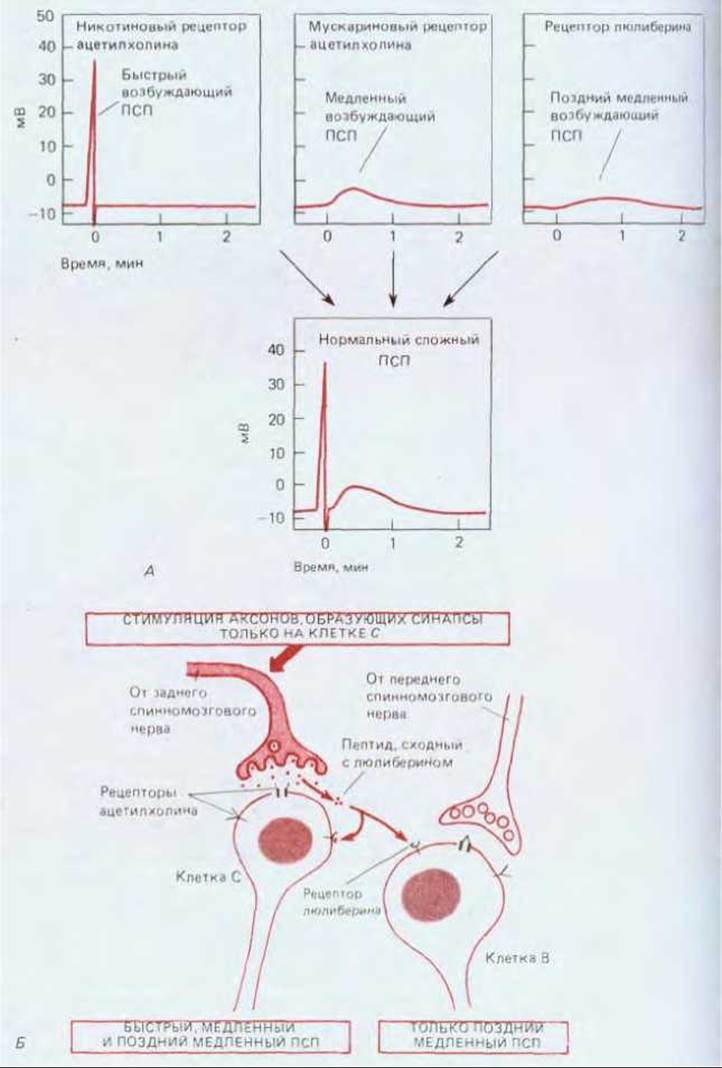
Рис. 19-39. Ответы на пептидный нейромедиатор.
А. Три составляющие постсинаптического потенциала, возникающего в клетке ганглия лягушки после стимуляции пресинаптического нерва. Из окончания пресинаптического аксона выделяются два нейромедиатора - ацетилхолин и пептид, очень сходный с люлиберином (гормоном, стимулирующим высвобождение лютеинизирующего гормона). Как правило, сложный ПСП представляет собой сумму ответов, опосредуемых рецепторами трех видов - двумя разновидностями ацетилхолиновых рецепторов и одним рецептором для пептида, сходного с люлиберином. Вклад каждой из трех составляющих можно оценить, блокируя с помощью специфических токсинов рецепторы, ответственные за две другие составляющие. Только быстрый возбуждающий ПСП, опосредуемый ацетилхолиновыми рецепторами, связанными с каналами, достаточно велик для того, чтобы вызвать потенциал действия. Две медленные составляющие, опосредуемые, вероятно, рецепторами, не связанными с каналами, изменяют возбудимость клетки, делая ее более восприимчивой к стимуляции, следующей сразу за первоначальным стимулом. Б. Схема эксперимента, проведенного на том же ганглии и демонстрирующего диффузный характер воздействия нейропептида, сходного с люлиберином. Этот пептид выделяется одновременно с ацетилхолином в синапсах, образуемых на одной группе клеток (С-клетках), но диффундирует на расстояние в десятки микрометров и вызывает более поздний медленный ПСП в других клетках (В). (А - по Y.N. Jan et al., Cold Spring Harbor Symp. Quant. Biol., 48, 363-374, 1983.)
Аплизия втягивает жабру в ответ на прикосновение к сифону (рис. 19-40). После многократных прикосновений у животного возникает привыкание и реакция исчезает. По своей биологической функции привыкание сходно с адаптацией, но оно развивается более медленно и, как мы увидим, связано с другим участком нервного пути. Какой-либо резкий раздражитель, например сильный толчок или удар электрическим током, снимает эффект привыкания и, наоборот, повышает чувствительность животного, так что оно теперь особенно энергично реагирует на прикосновение к сифону. Этот эффект сенситизации сохраняется в течение многих минут или даже часов в зависимости от силы вызвавшего его стимула и представляет собой простую форму кратковременной памяти. Если воздействие болевого стимула повторяется в течение нескольких дней, сенситизация (т. е. проявление памяти) становится долговременной и сохраняется несколько недель. Описанные модификации поведения удалось связать с изменениями, происходящими в определенной группе синапсов нейронной сети, ответственной за рефлекс втягивания жабры. У аплизии имеются очень крупные (100 мкм) нейроны, которых сравнительно немного (~105), и их можно распознавать индивидуально по их внешнему виду и положению. Прикосновение к сифону приводит к возбуждению группы сенсорных нейронов. Эти нейроны образуют возбуждающие синапсы на двигательных нейронах, ответственных за втягивание жабры. В основе поведенческих феноменов лежат изменения в этих синапсах. Во время привыкания величина постсинаптического потенциала в упомянутых двигательных нейронах уменьшается при повторной стимуляции их сенсорными клетками. При сенситизации наблюдается обратный эффект - постсинаптический потенциал возрастает. И в том и в другом случае изменение величины потенциала - это результат изменения количества медиатора, высвобождаемого из пресинаптических окончаний возбужденных сенсорных нейронов. Таким образом, проблема сводится к вопросу о том, как регулируется высвобождение медиатора в этих синапсах.
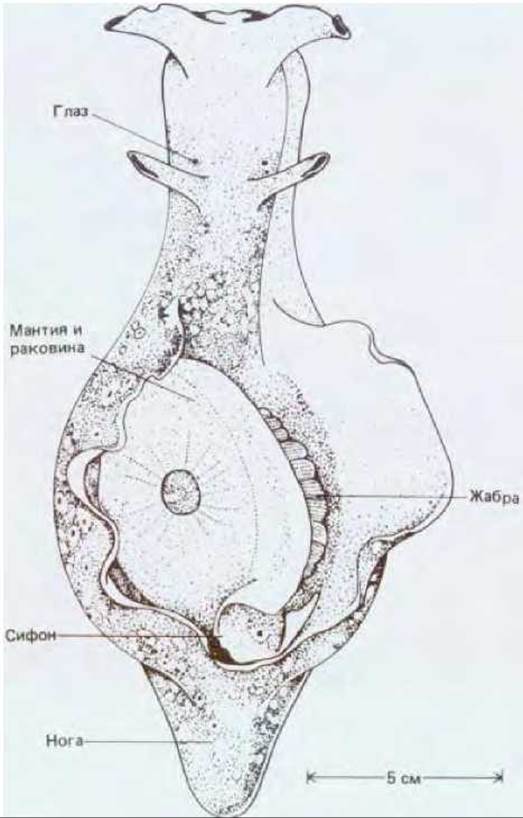
Рис. 19-40. Морская улитка Aplysia punctata (вид сверху). Лежащий сверху лоскут ткани отогнут, что позволяет видеть жабру, защищенную мантией и раковиной. (По J. Giart, Mem. Soc. Zool. France, 14, 219, 1901.)
19.5.4. За сенситизацию у аплизии ответственны рецепторы, связанные с G-белком [35]
Как уже отмечалось в разд. 19.3.2, количество высвобождаемого в синапсах нейромедиатора регулируется количеством ионов Са2+, входящих в нервное окончание во время потенциала действия. В случае привыкания повторяющееся возбуждение сенсорных клеток модифицирует белки каналов в окончаниях их аксонов таким образом, что приток Са2+ в клетку уменьшается и количество высвобождаемого медиатора снижается. Напротив, при сенситизации эти белки изменяются так, что поступление Са2+ в клетку возрастает и выделение нейромедиатора повышается. Лучше всего изучены молекулярные механизмы изменений, происходящих при сенситизации.
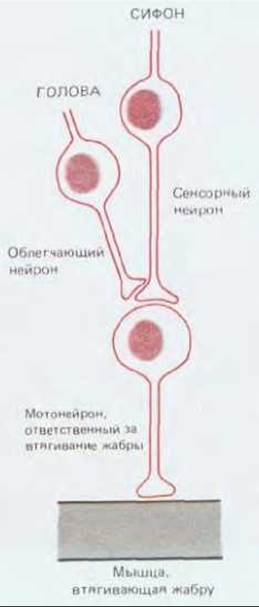
Рис. 19-41. Упрощенная схема нейронных путей, участвующих в привыкании и сенситизации по отношению к рефлексу втягивания жабры у аплизии. Показано только по одному нейрону из каждой группы.
При сенситизации, вызванной, например, ударами по голове, количество нейромедиатора, выделяемого сенсорными нейронами, изменяется в результате возбуждения еще одной группы нейронов, реагирующих на болевой стимул. Эти облегчающие нейроны образуют на пресинаптических окончаниях сенсорных нейронов синапсы (рис. 19-41), выделяющие серотонин (а также некоторые нейропептиды). Эффект облегчающих нейронов можно имитировать, воздействуя серотонином непосредственно на мембрану сенсорных нейронов, у которых окончания пресинаптического аксона содержат серотониновые рецепторы. Действие этих рецепторов опосредуется G-белком: серотонин, связываясь с рецепторами, активирует аденилатциклазу, в результате чего повышается внутриклеточная концентрация циклического AMP, который в свою очередь активирует А-киназу (разд. 12.4.1). Именно эта протеинкиназа изменяет электрические свойства мембраны сенсорного нейрона, фосфорилируя особую группу калиевых каналов (рис. 19-42).
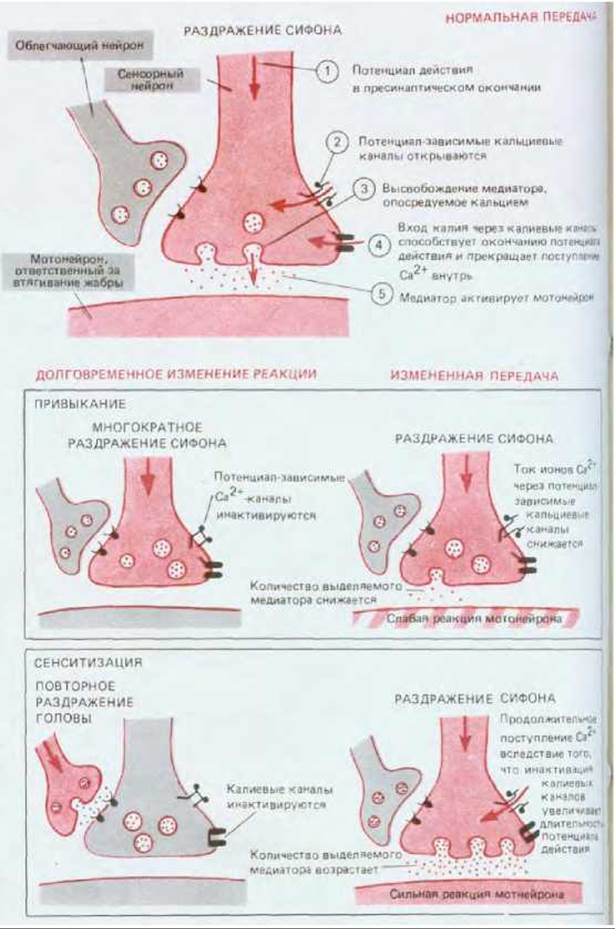
Рис. 19-42. Механизмы, лежащие в основе адаптации и сенситизации рефлекса втягивания жабры у аплизии. Электрически активные нейроны выделены цветом. На верхней схеме представлен нормальный механизм передачи от сенсорного нейрона к мотонейрону, участвующему во втягивании жабры. На обеих нижних схемах справа объяснен механизм возникновения в окончании сенсорного нейрона стойких изменений, лежащих в основе памяти, а слева показано, каким образом эти изменения влияют на синаптическую передачу от сенсорного нейрона к мотонейрону, ответственному за втягивание жабры. Представленное объяснение более достоверно для сенситизации, чем для адаптации.
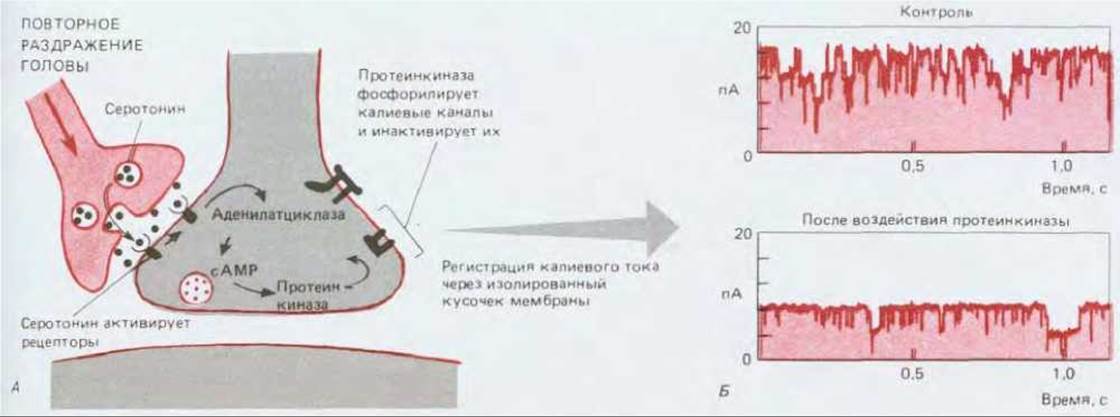
Рис. 19-43. А. Цепь событий, происходящих при сенситизации рефлекса втягивания жабры и приводящих к инактивации особого класса калиевых каналов (так называемых S-каналов) в окончании сенсорного нерва (см. рис. 19-42). Б. Записанные с помощью метода пэтч-клапма токи, проходящие через эти каналы во время их перехода из открытого состояния в закрытое и обратно. Участок мембраны, отделенный от клетки, содержит четыре канала, которые в контрольных условиях большую часть времени открыты. Когда в среду со стороны цитоплазмы добавляют каталитическую субъединицу сАМР-зависимой протеинкиназы (А-киназы), два из четырех каналов фосфорилируются и вследствие этого закрываются, тогда как оставшиеся два канала продолжают находиться большей частью в открытом состоянии; в результате ток, проходящий через данный участок мембраны, уменьшается по сравнению с контролем в два раза. (Данные метода пэтч-клампа перепечатаны с разрешения M.J. Schuster, J.S. Camardo, S. A. Siegelbaum, E.R. Kandel, Nature, 313, 392-395, 1985. Copyright 1985 Macmillan Journals' Limited.)
Поведение таких калиевых каналов, называемых S-каналами, можно детально проследить с помощью метода пэтч-клампа (см. разд. 6.4.17). При связывании серотонина мембранными рецепторами эти каналы закрываются (рис. 19-43). Калиевые каналы закрываются таким же образом и в том случае, если содержащий их участок мембраны перенести в кювету с искусственной средой, где каналы подвергаются прямому фосфорилированию каталитической субъединицей А-киназы. Это заставляет предполагать, что фосфорилирование S-каналов (или тесно связанных с ними белков) способно надолго задержать каналы в закрытом состоянии. Так как в норме именно ток калиевых ионов помогает восстановить потенциал покоя, блокада S-каналов продлевает потенциалы действия, приходящие в окончание аксона. «Продленные» потенциалы действия удерживают потенциал-зависимые кальциевые каналы в открытом состоянии более длительное время, вследствие чего приток ионов кальция возрастает, а это в свою очередь ведет к опорожнению большего числа синаптических пузырьков; в результате в мотонейроне создается более значительный постсинаптический потенциал и происходит более энергичное втягивание жабры.
Эти эксперименты показывают, каким образом рецепторы, связанные с G-белком, могут передавать кратковременные сигналы, приводящие к стойким изменениям электрических свойств синапса и, следовательно, поведения животного. Фосфорилирование S-каналов представляет собой одну из форм памяти, но это лишь кратковременная память, которая легко стирается при воздействии фосфопротеинфосфатаз (дефосфорилирующих S-каналы) и ограничена временем жизни белков, образующих S-каналы. Механизм долговременной памяти, возникающей при повторном воздействии болевого стимула, не известен, но он отличается от кратковременной памяти: он требует синтеза новой РНК и новых белков, а также, вероятно, изменений как в строении, и в химии пресинаптических окончаний (разд. 19.8.12).
Полагают, что циклический AMP и А-киназа тоже опосредуют подобные изменения, вероятно путем фосфорилирования других клеточных белков, которое может изменять экспрессию генов. Этот: пока не изучен в деталях, но один из промежуточных этапов в создании следов долговременной памяти, видимо, состоит в длительной активации А-киназы в результате снижения концентрации регуляторных субъединиц, ингибирующих этот фермент (см. разд. 12.4.1). Как полагают,
при высоких уровнях циклического AMP эти регуляторные субъединицы разрушаются, так как при связывании циклического AMP они отделяются от каталитических субъединиц и подвергаются протеолизу.
19.5.5. Са2+ и циклический AMP-важные внутриклеточные посредники, участвующие в ассоциативном научении у позвоночных [36]
Рассмотренные выше явления привыкания и сенситизации - это лишь очень простые формы научения. Главная особенность более сложных типов научения, наиболее широко изучаемых психологами, - это их ассоциативный характер. Например, в знаменитых экспериментах Павлова собака научалась связывать звук колокольчика с получением пищи. Аплизия тоже способна к ассоциативному научению. Например, если сенситизирующий раздражитель (сильный электрический удар) постоянно воздействует одновременно с определенной мягкой стимул которая в норме вызывает лишь слабый рефлекс втягивания жабры, то животное начинает вести себя так, как если бы оно запомнило, что специфическая мягкая стимуляция связана с электрическим ударом, и оно сильно и специфически сенситизируется к слабому раздражителю. Полагают, что в этом случае участвуют те же группы нейронов, что и при простой сенситизации, описанной ранее. Одновременная стимуляция различных частей тела ведет к одновременному возбуждению сенсорных и облегчающих нейронов. Таким образом, когда потенциал действия приходит в окончания сенсорного аксона, открывая в них потенциал-зависимые кальциевые каналы, из облегчающих нейронов выделяется серотонин (или какой-либо нейропептид), вызывающий повышение концентрации циклического AMP внутри аксона. Циклический AMP и сам по себе вызывает простую сенситизацию; как полагают, приток Са2+ усиливает этот эффект, приводя к гораздо более сильный сенситизации по сравнению с той, которая возникла бы в результате возбуждения облегчающих нейронов на фоне бездействия сенсорных нейронов.
Неясно, как далеко можно экстраполировать данные, полученные на аплизии. Вопрос, регистрируются ли следы памяти у других животных в виде пре- или постсинаптических изменений химической природы или структуры синапсов и вообще в синапсах, остается открытым. Однако эксперименты на мутантах плодовой мушки Drosophila позволяют предполагать, что молекулярные механизмы, подобные описанным у аплизии, лежат в основе многих других форм научения. Например, в норме дрозофилы могут научаться избегать специфического запаха, если этот запах неоднократно сочетался с получением электрического удара. Тех мушек, которые быстро забывают ассоциативную связь или вообще не способны ее усвоить, можно легко изолировать благодаря тому, что они не избегают участков с острым специфическим запахом. Таким способом удавалось отделить «бестолковых» и «забывчивых» мутантов. Две разновидности подобных мутантов, dunce (dnc) и rutabaga (rut), способны обучаться, но обладают поразительно короткой памятью - порядка нескольких десятков секунд в случае dunce. Оказывается, у dunce мутация затрагивает фосфодиэстеразу, расщепляющую циклический AMP, а у rutabaga-Cа2+-зависимую аденилатциклазу, синтезирующую это вещество. Видимо, и слишком большие, и слишком малые концентрации циклического AMP препятствуют закреплению следов памяти. Другие мутанты, называемые Ddc, похоже, не способны научаться вообще: у них отсутствует ген, кодирующий ДОФА-декарбоксилазу, которая катализирует важный этап в синтезе серотонина и дофамина. У всех мутантов с нарушениями ассоциативного научения нарушен и процесс сенситизации. Очевидно, эти два процесса имеют общие механизмы, которые реализуются, так же как сенситизация у аплизии, через моноаминовый нейромедиатор (на начальном этапе) и фосфорилирование белков (регулируемое циклическим AMP и ионами Са2+) для получения стойкого эффекта.
19.5.6. У млекопитающих при обучении происходят изменения в гиппокампе, вызванные притоком Са2+ через двояко регулируемые каналы [37]
Практически все животные способны к научению, но особенно хорошо, вероятно, обучаются млекопитающие (или нам просто приятно так думать?). В основе этих процессов могут лежать какие-то уникальные молекулярные механизмы. Полагают, что у млекопитающих особую роль играет гиппокамп- особый участок коры головного мозга: если он разрушен в обоих полушариях, то способность запоминать новые события резко падает, хотя прежние следы долговременной памяти сохраняются. В некоторых синапсах гиппокампа при многократно повторяющемся возбуждении возникают выраженные функциональные изменения. В то время как случайные единичные потенциалы действия не оставляют в постсинаптической клетке заметного следа, короткий залп следующих друг за другом разрядов приводит к долговременной потенциации, и последующие единичные импульсы, приходящие в пресинаптическое окончание, вызывают в постсинаптической клетке ответ значительно большей силы. В зависимости от числа и интенсивности залпов эффект сохраняется в течение нескольких часов, дней или недель. Потенциация возникает только в активированных синапсах: синапсы на той же самой клетке, оставшиеся в покое, не изменяются. Но если одновременно с тем, как одна группа синапсов получает залп последовательных импульсов, через другой синапс на той же клетке передается одиночный потенциал действия, то в этом последнем синапсе тоже возникает долговременная потенциация, хотя одиночный импульс, пришедший сюда в другое время, не оставит стойкого следа. Несомненно, этот механизм лежит в основе ассоциативного научения.
Правило, которому подчиняются происходящие в гиппокампе процессы, состоит в следующем: долговременная потенциация происходит в тех синапсах, в которых пресинаптическая клетка возбуждается в тот момент, когда постсинаптическая мембрана сильно деполяризована (в результате многократного возбуждения той же самой пресинаптической клетки или по другим причинам). Есть веские данные в пользу того, что это правило отражает поведение специфических ионных каналов в постсинаптической мембране. Деполяризующий ток, ответственный за возбудительный ПСП, возникает в основном обычным путем благодаря лиганд-зависимым ионным каналам, связывающим глутамат. Однако деполяризующий ток имеет также вторую, более загадочную составляющую, которая создается при участии особого подкласса каналов, связанных с глутаматными рецепторами: их называют NMDA-рецепторами, так как они селективно активируются синтетическим аналогом глутамата К-метил-Э-аспартатом. Каналы, связанные с NMDA-рецепторами, имеют «двойные» ворота, открывающиеся только тогда, когда одновременно выполняются два условия: мембрана должна быть сильно деполяризована (это особенные потенциал-зависимые каналы, регулируемые внеклеточным Mg2+), а к рецептору должен присоединиться медиатор глутамат. NMDA-рецепторы играют ключевую роль в долговременной потенциации. Если такие каналы селективно блокировать с помощью специфического ингибитора, то долговременной потенциации не происходит, хотя обычная синаптическая передача не нарушается. Под воздействием подобного ингибитора животное теряет способность к тому виду научения, который, как полагают, зависит от гиппокампа, но в остальном ведет себя почти нормально.
Каким образом NMDA-рецепторы обеспечивают столь поразительный эффект? Ответ, по-видимому, заключается в том, что эти каналы в открытом состоянии свободно пропускают Са2+, который около места своего поступления в постсинаптическую клетку действует как внутриклеточный посредник и вызывает локальные изменения, приводящие к долговременной потенциации. Потенциацию можно предотвратить, значительно снизив уровень Са2+ путем введения в постсинаптическую клетку хелатирующего кальций вещества ЭГТА, и можно, наоборот, вызвать, искусственно повысив концентрацию ионов кальция. Природа долговременных изменений, вызываемых этими ионами, точно не известна, но полагают, что изменяется структура синапса.
Несмотря на различия в механизмах памяти у беспозвоночных и у млекопитающих (см. рассмотренные выше примеры), здесь можно усмотреть нечто общее. Нейромедиаторы, высвобождаемые в синапсах, могут не только передавать кратковременные сигналы, но и изменять концентрацию внутриклеточных молекул-посредников, активирующих каскады ферментативных реакций, что ведет к долговременному изменению эффективности синаптической передачи. Остается, однако, ряд важных неразрешенных вопросов. До сих пор не известно, каким образом подобные изменения сохраняются на протяжении недель, месяцев или всей жизни в условиях нормального обновления компонентов клетки. Как мы увидим позже, сходные вопросы возникают и при изучении развития нервной системы.
Заключение
В отличие от рецепторов, связанных с каналами, не связанные с ионными каналами рецепторы нейромедиаторов, присоединяя лиганд, запускают в постсинаптической клетке каскад ферментативных реакций. В большинстве изученных случаев первая реакция этого каскада ведет к активации G-белка, который либо прямо взаимодействует с ионными каналами, либо регулирует образование таких внутриклеточных посредников, как циклический AMP и Са2+. Эти посредники в свою очередь или непосредственно влияют на ионные каналы, или активируют киназы, фосфорилирующие различные белки, в том числе и белки ионных каналов. Во многих синапсах имеются как связанные, так и не связанные с каналами рецепторы, присоединяющие одни и те же или различные медиаторы. Если рецептор не связан с каналом, то опосредуемый им эффект, как правило, бывает замедленным и продолжительным и может влиять на эффективность последующей синаптической передачи, что составляет основу по меньшей мере некоторых форм памяти. Рецепторы, связанные с каналами и пропускающие в клетку Са2+ (такие, как NMDA-рецептор), могут тоже быть ответственны за проявление долговременной памяти.