Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Особенности растительных клеток
Клеточные основы развития растений
Несмотря на поразительное разнообразие цветковых растений, некоторые особенности их формы и развития остаются удивительно постоянными. Наличие клеточной стенки заставляет растение выбирать иные, чем у животных, стратегии размножения, роста и развития. В данном разделе будут рассмотрены некоторые общие закономерности и обсуждены их клеточные основы. Особенности размножения растений суммированы на схеме 20-2. Вначале мы рассмотрим оплодотворенную зиготу и некоторые процессы в ее раннем развитии. Растения, подобно животным, при дифференцировке клеток широко используют пространственную регуляцию. Однако вместо миграции и перегруппировки клеток, играющих такую важную роль в развитии эмбрионов животных (см. гл. 16), у растений в морфогенезе решающим остается координированное деление клеток и их жестко регулируемый рост. Эти процессы находятся под контролем внешних факторов, таких как свет, гравитация, наличие питательных веществ, и внутренних, таких как фитогормоны. Благодаря открытию факторов роста появилась возможность выращивать клетки и ткани растений в культуре и использовать эти культуры для разнообразных генетических манипуляций.
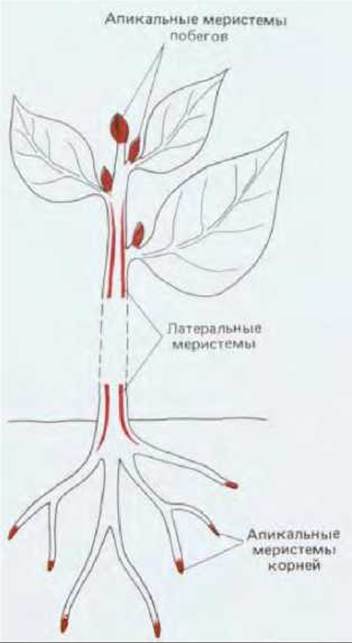
Рис. 20-57. Весьма упрощенная схема расположения главных меристематических зон и участков наиболее быстрого и постоянного деления клеток в высших растениях. Активность апикальных меристем корней и побегов ответственна за рост в длину, тогда как латеральные меристемы (например, камбий) обеспечивают утолщение различных частей растения.
20.5.1. Эмбриональное развитие начинается с установления оси «корень-побег», а после формирования семени приостанавливается [28]
На самых ранних стадиях развития высших растений зигота делится асимметрично, чем определяется полярность будущего зародыша. Одним из продуктов такого деления является маленькая клетка с густой цитоплазмой, из которой и образуется собственно зародыш. Другая крупная вакуолизированная клетка продолжает делиться и образует так называемый подвесок или суспензор - структуру, которая в некотором отношении сравнима с плацентой млекопитающих. Подвесок прикрепляет зародыш к материнской ткани и, кроме того, обеспечивает приток питательных веществ к зародышу из окружающего его эндосперма (последний представляет собой триплоидную питательную ткань, которая при оплодотворении образуется отдельно (см. схему 20-2).
На следующей стадии развития диплоидная зародышевая клетка делится, образуя округлое скопление клеток, в котором формируются первые меристемы растения. Во время роста клеточное деление происходит почти полностью в специализированных участках, меристемах, состоящих из самовозобновляющихся стволовых клеток. Меристемы обычно бывают двух типов: 1) апикальные меристемы на верхушках растущих побегов и на кончиках корней, обеспечивающие главным образом рост растения или его частей в длину и 2) латеральные меристемы - цилидрические прослойки незрелых клеток, обеспечивающие рост в толщину (рис. 20-57). Латеральной меристемой, очень важной для всех растений, является камбий, который представляет собой слой клеток, образующих проводящие ткани.
Шаровидное скопление эмбриональных клеток вскоре разделяется на две группы меристематических клеток. Одна из них располагается на том конце зародыша, где находится подвесок, и образует апикальную меристему корня, а другая, находящаяся на противоположном полюсе, дает начало апикальной меристеме побега. Эти две меристемы определяют основную ось будущего растения в направлении корень - побег. Затем по мере роста зародыша образуется сосудистый камбий, из которого впоследствии возникают проводящие ткани между корнем и побегом. Несколько позже в ходе развития из апикальной меристемы побега формируются зародышевые листья семени или семядоли, одна у однодольных растений и две у двудольных (см. рис. 20-12). На этой стадии дальнейшее развитие обычно приостанавливается и зародыш упаковывается в семя, приспособленное для распространения и для выживания в суровых условиях.
Зародыш в семени стабилизирован посредством дегидратации и может оставаться в состоянии покоя в течение очень длительного времени, даже нескольких тысячелетий, что показано для семян злаков, найденных в египетских захоронениях. При соприкосновении с водой семена набухают и развитие зародыша продолжается. Развитие зародыша обеспечивается большими запасами питательных веществ, собранных в триплоидной ткани эндосперма (см. схему 20-2). При развитии семени этот питательный материал может в той или иной степени переходить в семядоли. Так, например, семена однодольных растений (пшеница и кукуруза) и некоторых двудольных содержат большие запасы эндосперма, а семена большинства двудольных (включая горох и бобы) снабжены питательными веществами, запасенными в толстых семядолях.
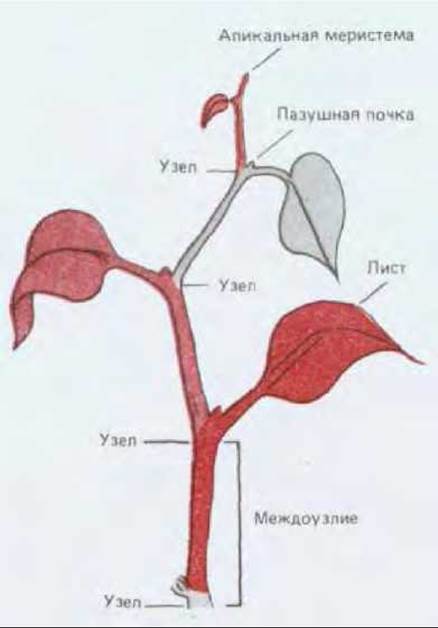
Рис. 20-58. Простой пример модулярного строения растений. Каждый модуль (они окрашены в разные цвета) состоит из стебля, листа и почки, содержащей потенциальную меристему. Модули последовательно возникают друг за другом в результате постоянной активности апикальной меристемы.
20.5.2. Меристемы постоянно образуют новые органы и новые меристемы, в результате чего многократно возникают серии одинаковых модулей [29]
Эмбрион у позвоночных представляет собой уменьшенную копию взрослого организма и обладает большинством характерных для данного животного органов. В противоположность этому зародыш растения, находящийся в семени, совершенно не похож на взрослое растение. Однако каждая из двух его меристем способна полностью воспроизводить в соответствующее время полный набор необходимых органов. При разрыве кожуры семени во время прорастания клетки увеличиваются и появляется корень, чтобы как можно скорее укрепиться в почве. За этим следует активное деление клеток в апикальных меристемах; например, в апикальной меристеме корня кукурузы клетки делятся каждые 12 ч, образуя за день 5 х 105 клеток. Быстрорастущие корни повышают свою способность поглощать воду и неорганические вещества из почвы, а у побегов возрастает фотосинтетическая активность (см. схему 20-2).
Апикальная меристема растений образует два типа структур: 1) основную систему корней и побегов, чей рост постоянно поддерживают сами меристемы и 2) цветки и листья, рост которых ограничен. Структуры первого типа, ответственные за постоянное развитие, существуют в течение всей жизни растения, а в случае привоев, например старых сортов яблонь, и значительно дольше. Второй тип структур имеет короткое время жизни, подвергаясь запрограммированному старению. Сопоставьте ежегодную смену листьев с фактическим отсутствием смены соматических клеток в остальных частях растения!
По мере удлинения побега апикальные меристемы образуют упорядоченную последовательность узлов и междоузлий. Таким образом, постоянная активность меристем приводит к образованию все увеличивающегося числа одинаковых модулей, каждый из которых состоит из листа, стебля и почки (рис. 20-58). Модули соединены друг с другом основной и проводящей тканью, причем последующий модуль расположен по отношению к предыдущему строго определенным образом, в результате чего возникает упорядоченная структура, характерная для растения (рис. 20-59).
Каждый отдельный модуль обладает определенной степенью автономии, и, таким образом, взрослым растениям можно приписать определенные черты колониальных организмов, например губок или кораллов. В соответствии с этим каждый модуль возникает как вздутие определенного размера на апикальной меристеме, однако конкретные условия окружающей среды, в которых развивается этот модуль, могут изменить его конечную форму. Например, необычно большие темно-зеленые листья, как правило, развиваются в тенистых местах, а короткие и толстые листовые черешки там, где часто дуют ветры. Специально проведенные эксперименты доказали, что эти локальные приспособления связаны с каждым отдельным модулем, не затрагивая все растение. Более того, в остром углу, образованном стеблем и отходящим листом (пазуха), в каждом модуле возникает почка, содержащая новую апикальную меристему, которая потенциально может дать начало другой ветви. Однако многие из этих новых меристем активируются лишь в том случае, если исходная апикальная меристема повреждается или удаляется (явление, хорошо известное садовникам, которые прищипывают верхушку, чтобы стимулировать рост боковых побегов).

Рис. 20-59. Упорядоченное расположение следующих друг за другом модулей, возникающих из одной апикальной меристемы, приводит к возникновению правильных, хотя и усложненных, фигур в расположении листьев (А), цветков (Б) и плодов (В). (С любезного разрешения A. Davies.)
Модульная природа растений особенно хорошо демонстрируется при выращивании меристем в культуре. Используя подходящую питательную среду, можно заставить выделенные из растения апикальные меристемы расти и регенерировать, образуя нормальное растение. Этот метод в настоящее время нашел широкое применение в садоводстве для размножения ценных экземпляров роз, орхидей, а также некоторых сельскохозяйственных культур, как, например, земляника и сахарный тростник.
20.5.3. Внешний вид растения зависит от механизмов, определяющих формообразование в апикальных меристемах [30]
Повторяющийся тип роста побега в междоузлиях свидетельствует о том, что клетки в апикальной меристеме, для того чтобы соответствующим образом дифференцироваться, должны «чувствовать» расстояние от предшествующего узла и ориентацию относительно него. У растений, так же как у животных, существуют механизмы, регулирующие образование зачатков. Они действуют на расстоянии менее 1 мм, и, следовательно, охватывают относительно небольшие группы клеток, (см. разд. 16.4.4). Предшественники каждого нового узла (начальная точка ветвления) выявляются как последовательно возникающие вздутия, которые образуются вблизи самого кончика меристемы, причем в состав каждого из этих вздутий входит около 100 клеток (рис. 20-60). В соответствии с самыми простыми моделями, предложенными для объяснения этого процесса, в каждом новом узле вырабатывается диффундирующее вещество - морфоген, которое подавляет образование следующего узла, до тех пор пока не разбавляется на определенном расстоянии от узла при росте междоузлия. Однако о молекулярных механизмах, принимающих участие в этом основном формообразующем процессе царства растений, практически ничего неизвестно.
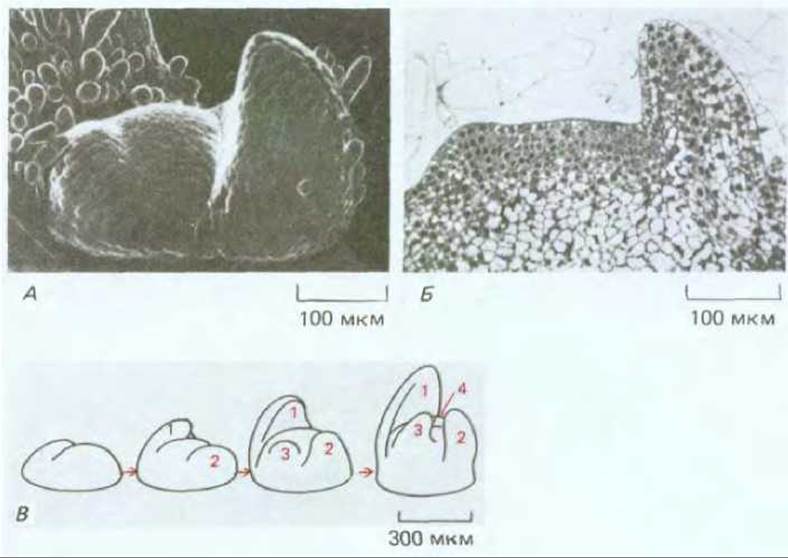
Рис. 20-60. Верхушка побега молодого растения табака. А. На фотографии, полученной с помощью сканирующего электронного микроскопа, видна верхушка побега с двумя зачатками листьев. Зачатки листьев выглядят как боковые выросты с каждой стороны апикальной меристемы, имеющей форму купола. Б. Тонкий срез такой же верхушки: видно как зачатки молодых листьев возникают из небольшой группы клеток (~100 клеток) в наружных четырех или пятиклеточных слоях. В. Очень условная схема, показывающая как зачатки листьев возникают на небольшом расстоянии друг от друга на очень ранних стадиях развития побега. Рост верхушки в конечном итоге приводит к образованию междоузлий, которые по порядку будут разделять листья на стебле (см. рис. 20-58). (А и Б - по R. S. Poethig, I. M. Sussex, Planta, 165, 158-169, 1985.)
20.5.4. Образование новых структур зависит от координированного деления, растяжения и дифференцировки клеток [31]
До сих пор обсуждение развития высших растений велось главным образом на уровне описания тканей и органов. Какие же изменения, происходящие на клеточном уровне, лежат в основе всех этих процессов? Поскольку клетки растений лишены подвижности из-за наличия клеточных стенок, морфогенез растений должен зависеть от регулируемого деления клеток, сопряженного с ростом клеток в строго определенном направлении. Например, большинство клеток, образуемых апикальной меристемой корня, проходит три основные фазы развития: деление, рост (растяжение) и дифференцировку. Эти три стадии, во времени и в пространстве накладывающиеся друг на друга, определяют характерное строение кончика корня. Хотя дифференцировка клетки часто начинается, когда она еще увеличивается в размерах, в кончике корня относительно несложно отличить зону деления клеток, зону их растяжения (в результате чего происходит рост корня в длину) и зону дифференцировки (рис. 20-61). После завершения дифференцировки некоторые из дифференцированных типов клеток остаются живыми (например, клетки флоэмы), а другие погибают (например, клетки ксилемы).
Точное определение плоскости деления клеток является проблемой первостепенной важности для морфогенеза растений и многих процессов развития, таких как образование устьиц или зачатков листа, которые начинаются с изменения плоскости деления клеток. Постоянное деление клеток в меристеме часто приводит к возникновению столбиков дочерних клеток, ориентированных параллельно оси роста (рис. 20-61), а изменения в плоскости деления часто связаны с процессами, происходящими в ходе морфогенеза. В эпидермисе часто происходят антиклинальные деления, в результате которых образуются дополнительные клетки в поверхностном слое. Они могут способствовать утолщению, происходящему в результате периклинальных делений (рис. 20-62, А). Образование таких органов, как цветки, листья и боковые корни, происходит в результате сочетаний локальных изменений в частоте и ориентации плоскостей клеточных делений (рис. 20-62, Б).
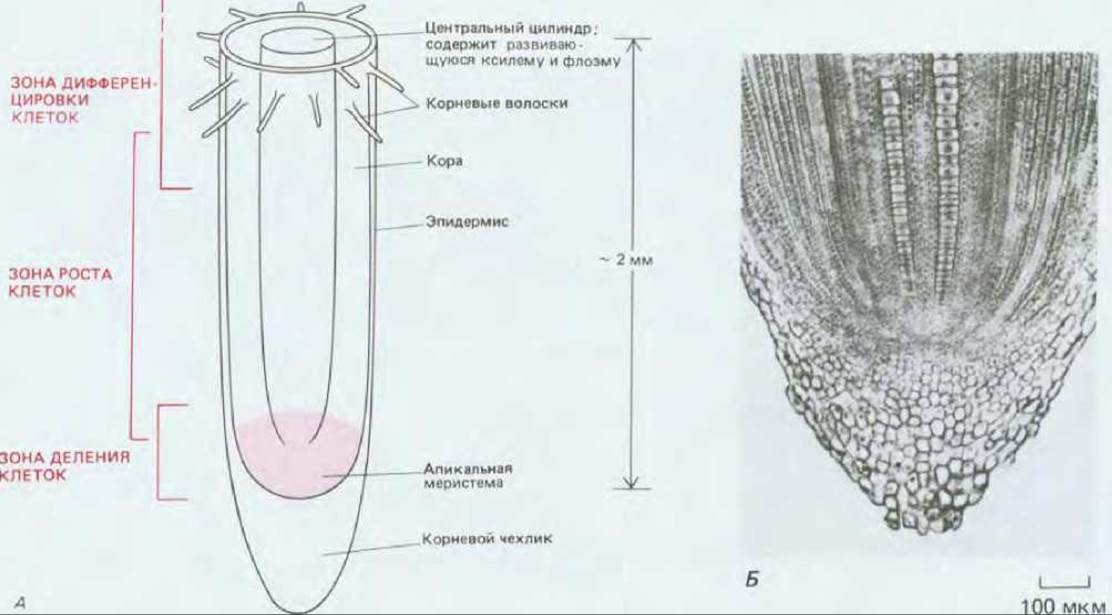
Рис. 20-61. А. Структурно-функциональная организация кончика растущего корня (показан участок 2 мм). Весьма приблизительно обозначены границы трех зон, в которых происходит соответственно деление, рост и дифференцировка клеток. Б. Апикальная меристема и корневой чехлик корня кукурузы, видны упорядоченные ряды образующихся клеток. (Б - по P. H. Raven, R. F. Evert, S. E. Eichhorn, Biology of Plants, 4th ed., New York: Worth, 1986.)
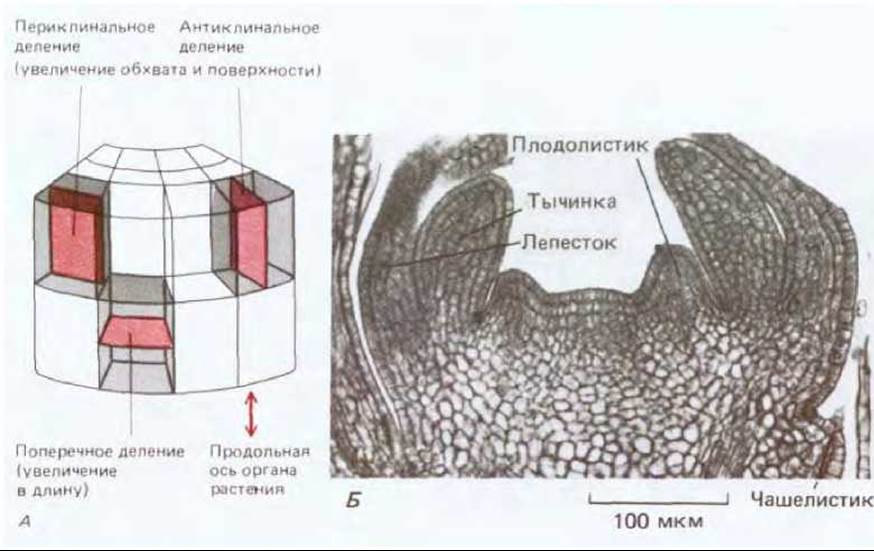
Рис. 20-62. Взаимосвязь плоскости деления, растяжения клеток и морфогенеза. А. Три плоскости деления клеток в типичном органе растения. Форма различных морфогенетических структур растения определяется вариациями в относительных соотношениях этих плоскостей, а также в сочетании с растяжением клеток в определенном направлении. Б. Продольный срез молодого бутона барвинка. Маленькие купола, образованные клетками, которые впоследствии станут частями цветка, возникают в результате комбинаций вновь возникающих новых плоскостей деления клеток, что определяется укреплением целлюлозных колец в клеточной стенке. (По N. Н. Boke, Am.J. Bot, 36, 535-547, 1949.)
Мы уже видели, что вызываемое тургором растяжение растительной клетки, часто приводящее к увеличению ее объема в пятьдесят и более раз, определяется ориентацией целлюлозных микрофибрилл клеточной стенки, что в свою очередь зависит от ориентации микротрубочек кортикального слоя цитоплазмы. В определении плоскости деления клеток важную роль играет также цитоскелет.
20.5.5. Строение цитоскелета определяет плоскость деления клетки [32]
Для организованного роста растения необходимо, чтобы клетки в специализированных участках делились в определенной плоскости и в определенное время, иными словами, чтобы цепочки клеток были правильно ориентированы. Микротрубочки с самого начала принимают участие в ориентации плоскости деления клеток. Таким образом, первые заметные признаки того, что клетка высшего растения собирается делиться в определенной плоскости, появляются сразу же после интерфазы, когда микротрубочки кортикального слоя исчезают в ходе подготовки к митозу. В это время непосредственно под плазматической мембраной появляется узкая окружающая всю клетку зона микротрубочек (рис. 20-63). Так как микротрубочки, входящие в состав этой зоны, появляются в G2 перед началом профазы, данная зона называется препрофазным пучком. Хотя она исчезает перед метафазой, но граница плоскости деления каким-то образом запоминается: когда позже в процессе цитокинеза образуется новая клеточная пластинка, то она начинает расти наружу, сливаясь с родительской стенкой точно в том месте, которое первоначально было занято препрофазным пучком (рис. 20-64). Даже если содержимое клетки после исчезновения препрофазного пучка сместить посредством центрифугирования, растущая клеточная пластинка будет стремиться вернуться в ту плоскость, которая была определена предыдущим препрофазным пучком.
В настоящее время известно, что препрофазный пучок кроме микротрубочек содержит многочисленные актиновые филаменты. Последние не ограничены кортикальным слоем и формируют также радиальные дисковидные скопления нитей, которые пересекают вакуоль, соединяясь вместе и поддерживая делящееся ядро, расположенное в центре. После того как микротрубочки в препрофазном пучке деполимеризуются, эти радиальные актиновые нити сохраняются, обеспечивая «запоминание», предопределяющее положение плоскости деления. В ходе цитокинеза, когда фрагмопласт центробежно разрастается подобно кругам на воде, края растущей клеточной пластинки остаются связанными с местом расположения препрофазного пучка актиновыми филаментами (рис. 13-73).
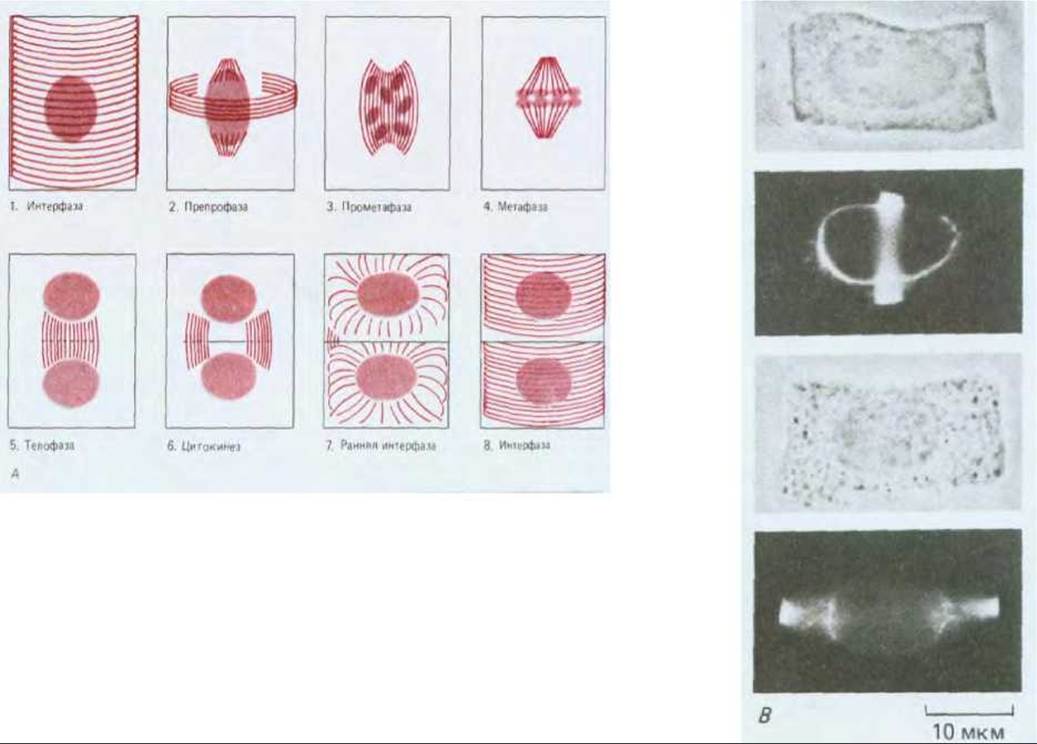
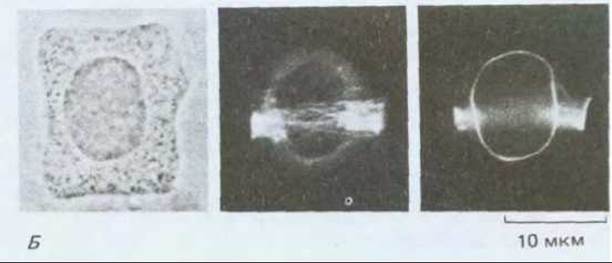
Рис. 20-63. Препрофазный пучок микротрубочек в клетках высших растений. А. Упрощенная схема изменения распределения микротрубочек в ходе клеточного цикла в клетках высших растений. Показаны четыре типа ориентации. По мере перехода клеток из интерфазы в профазу микротрубочки (1) в кортикальном слое стягиваются в плотный препрофазный пучок (2) шириной 1-3 мкм, в состав которого часто входит более сотни микротрубочек. Этот препрофазный пучок определяет будущую плоскость деления клетки. Затем образуется митотическое веретено (3), которое формирует и выстраивает хромосомы вдоль метафазной пластинки (4). В конце микротрубочки в ходе цитокинеза образуют фрагмопласт (5), который определяет новую клеточную стенку (6) (см. рис. 13-71). В дочерних клетках микротрубочки, полимеризующиеся из аморфного материала центросомы на поверхности ядра (7), восстанавливают интерфазную ориентацию (8). Б. Окрашивание флуоресцирующими антителами микротрубочек в препрофазном пучке клеток кончика корня лука. Слева показана отдельная клетка, а справа две фокальные плоскости помогают установить связь пучка с образованием на ранних стадиях веретена, которое происходит вне ядра. В. Несмотря на то, что две клетки, представленные здесь, имеют одинаковую форму, препрофазный пучок определяет, что верхняя клетка будет делиться поперечно, а нижняя - продольно. (Б и В - с любезного разрешения К. Goodbody, С. Lloyd.)
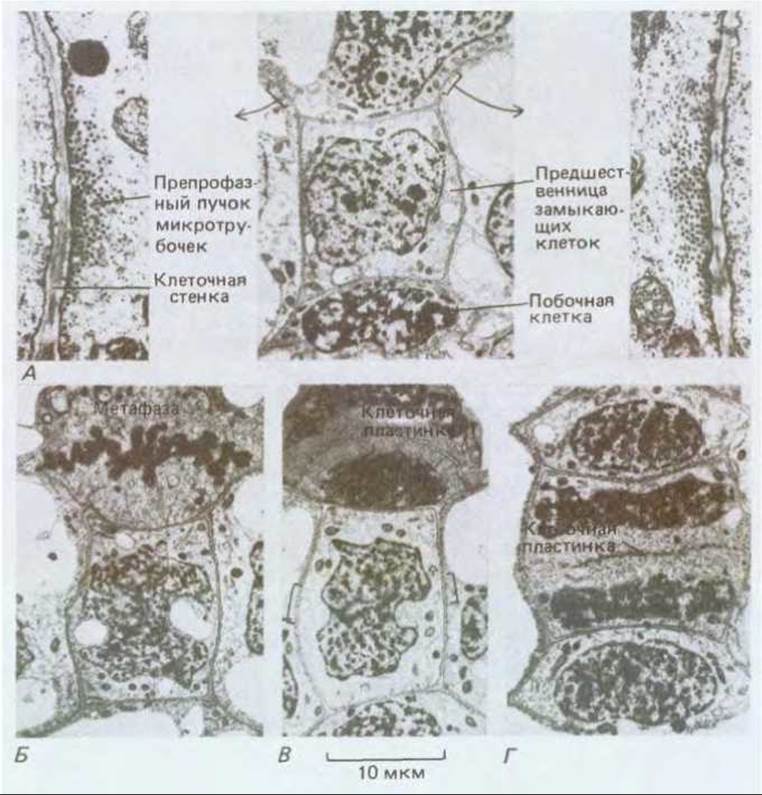
Рис. 20-64. Эта серия электронных микрофотографии эпидермальных клеток листа сахарного тростника демонстрирует строгую последовательность симметричных и асимметричных клеточных делений, происходящих при образовании устьица. Плоскость каждого деления предопределяется препрофазным пучком микротрубочек. А. На среднем фото: верхняя клетка готовится к асимметричному митозу, в результате которого отделится побочная клетка (нижняя клетка уже разделилась, образовав другую побочную клетку). Положение препрофазного пучка отмечено скобками, а детали его структуры при большом увеличении показаны на фото слева и справа. Б. Верхняя клетка вступает в метафазу, препрофазный пучок исчез. В. В верхней клетке образуется клеточная пластинка, ее края загибаются вниз к месту бывшего препрофазного пучка. В то же время крупная центральная клетка - предшественница замыкающих клеток - готовится к симметричному делению, положение препрофазного пучка указано скобками. Г. В верхней клетке цитокинез закончен, а в клетке-предшественнице замыкающих клеток близок к завершению. В результате последнего деления образуется пара замыкающих клеток, которые окружают устьичную щель (см. рис. 20-11). (С любезного разрешения С. Busby.)
Вне зависимости от того, симметрично или асимметрично деление клетки, является оно трансверсальным, периклинальным или антиклинальным, препрофазный пучок в растительной клетке всегда определяет место будущего деления клетки еще до того, как начнется митоз (см. рис. 20-63, Б). Подобный пространственный контроль имеет особенно большое значение в случае асимметричного деления клеток, в результате чего образуются две дочерние клетки с разными последующими путями развития; например, клетки устьиц, клетки корневых волосков и генеративные клетки пыльцевых зерен развиваются из меньшей по размеру дочерней клетки. В ходе такого деления ядро переходит в соответствующую область клетки еще до митоза (рис. 20-65). Хотя механизм перемещения ядра пока остается неизвестным, имеются доказательства того, что в этот процесс вовлечены как микрогрубочки, так и актиновые филаменты.
Такой строгий контроль за плоскостями деления клеток возможен лишь в том случае если ткань растения и составляющие ее клетки обладают определенной структурой полярности, которая впоследствии может быть либо закреплена либо видоизменена. Хотя структурная основа подобной полярности у высших растений еще не выявлена, у низших растений можно найти хорошо изученные примеры, позволяющие создать соответствующие модели.
20.5.6. Полярность растительных клеток зависит от асимметричного распределения ионных каналов и белков-носителей [33]
Полярность растения и составляющих его клеток отличается поразительным постоянством: маленькие отрезки стебля, даже перевернутые вниз своей верхней частью, всегда регенерируют корни и побеги на месте исходных базальных и апикальных концов соответственно. Еще неясно как подобная полярность клеток создается, поддерживается и передается дочерним клеткам, однако имеются определенные доказательства того, что в этом процессе могут участвовать асимметрично расположенные ионные каналы и белки-носители, присутствующие в плазматической мембране, которые могут генерировать внутриклеточные потоки ионов.
Особенно хорошо изученным в этом отношении объектом является широко распространенная в морях бурая водоросль Fucus. Эта крупная водоросль выделяет в окружающую воду тысячи свободно живущих спермиев и яйцеклеток. Округлая оплодотворенная яйцеклетка Fucus, имеющая большие размеры, первоначально совершенно гомогенна и лишена полярности. Однако уже через 18 ч зигота поляризуется и подвергается асимметричному делению, в ходе которого возникшая базальная клетка меньшего размера развивается в структуру, которая впоследствии служит для прикрепления водоросли к камню, а апикальная клетка большего размера образует таллом (фотосинтезирующая часть). Ключом к пониманию механизма поляризации зиготы, находящейся на ранней стадии развития, служит небольшой электрический ток, проходящий через эту клетку. Этот ток генерируется и поддерживается отчасти благодаря пассивному переносу ионов Са2+ в базальный полюс и активной утечке Са2+ из другого участка, что, вероятно, отражает асимметричное распределение кальциевых каналов и насосов в плазматической мембране. Такой ток, проходящий через яйцеклетку, способен перемещать путем электрофореза внутриклеточные компоненты, обладающие высоким зарядом; кроме того, имеются данные, что одним из результатов подобной поляризации является накопление секреторных пузырьков у базального полюса, за которым следует локализованное отложение специфических сульфатированных полисахаридов в этом участке клеточной стенки.
Не обладающая какой-либо полярностью зигота Fucus становится поляризованной в ответ на внешние стимулы, например, градиент освещения или силы тяжести. Полагают, что эти факторы приводят к изначальной неравномерности распределения ионов Са2+ в яйцеклетке (рис. 20-66). По-видимому, даже небольшие сдвиги в гомогенном распределении ионов Са2+ вызывают значительные последствия, поскольку быстро усиливаются и распространяются благодаря механизму с обратной связью. Хотя остается непонятным, как осуществляется стабилизация оси зиготы, известно, что для этого процесса требуются как актиновые филаменты, так и клеточная стенка. Вероятно, элементы, цитоскелета участвуют в соединении кальциевых каналов с фибриллами клеточной стенки путем образования на месте будущего базального полюса трансмембранных мостиков. Полагают, что внутриклеточные градиенты Са2+ существуют и во многих других типах растительных клеток, обладающих полярным ростом. Например, показано, что электрические токи, частично вызываемые ионами Са2+, проходят через растущие верхушки самых разнообразных поляризованных структур, включая корневые волоски, пыльцевые трубки и целые корни, но их нет в тех участках, где рост не происходит. Таким образом, те же механизмы, которые определяют полярность яйцеклеток Fucus, могут определять полярность клеток растений и в других случаях.
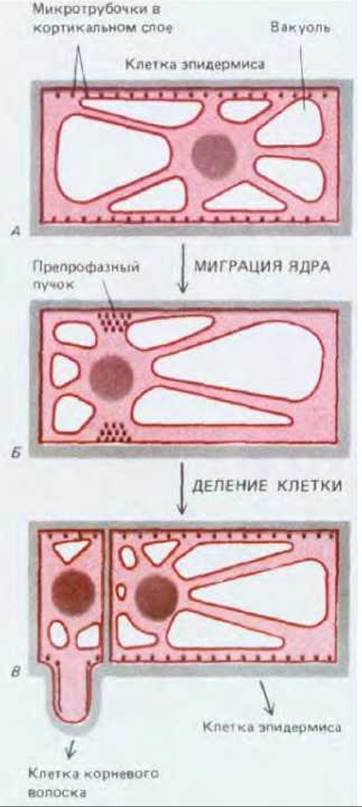
Рис. 20-65. Асимметричное деление в удлиняющейся клетке эпидермиса корня. В интерфазе (А) микротрубочки кортикального слоя располагаются вдоль клеточной стенки. Однако в ходе препрофазы (Б) они собираются в дискретныйпучок, опоясывающий клетку. Такой препрофазный пучок трубочек точно предсказывает место, где новая клеточная стенка соединится со старой, когда клетка разделится. В. Эта клетка эпидермиса делится асимметрично, образуя большую дочернюю клетку, которая остается эпидермальной, и небольшую дочернюю клетку, которая становится клеткой корневого волоска.
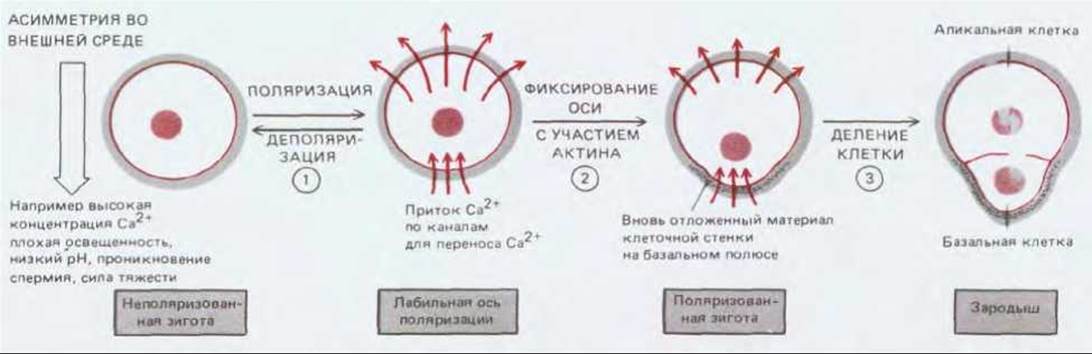
Рис. 20-66. Схема, показывающая, каким образом оплодотворенная яйцеклетка бурой морской водоросли Fucux может стать поляризованной (1). В ответ на одно из указанных асимметричных воздействий внешней среды в плазматической мембране возникают (или активизируются) каналы для переноса ионов Са2+ и насосы в плазматической мембране, что определяет поток ионов Са2+ через клетку (2). Такая, вначале лабильная ось, фиксируется с участием актина и на будущем базальном конце откладываются отрицательно заряженные полисахариды клеточной стенки (3). Начальная структурная асимметрия закрепляется при первом делении клетки, в результате которого образуются большая апикальная и маленькая базальная клетки. Полярность клеток высших растений может определяться аналогичным асимметричным распределением ионных каналов и насосов в плазматической мембране.
20.5.7. Рост и развитие растений реагируют на сигналы окружающей среды [34]
Условия окружающей среды часто оказывают гораздо более выраженное воздействие на развитие растений, чем на развитие животных. У растений в ходе эволюции сформировались специальные механизмы для восприятия силы тяжести, температуры, интенсивности и продолжительности освещения. Ответы на эти сигналы часто оказываются весьма сложными и могут быть либо быстрыми и кратковременными (как при движении хлоропластов, индуцированном светом, см. разд. 20.4.10), либо медленными и продолжительными (как в случае длинного светового дня, который необходим для индукции цветения некоторых растений или длительного периода охлаждения, необходимого для прорастания многих семян).
Ответы на воздействие света принадлежат к числу наиболее сложных реакций, которые разделяются на два типа. Ответные реакции на длительное воздействие обычно связаны с изменением экспрессии генов, тогда как реакции на кратковременное воздействие обычно не затрагивают этот уровень. Хотя в растении присутствует несколько типов фоторецепторных молекул, наиболее основательно изучен фитохром, белок с большой молекулярной массой (124000 дальтон). Это соединение содержит хромоформ, который реагирует на свет, и может существовать в виде двух форм, способных превращаться одна в другую: неактивная форма фитохрома образуется при облучении дальним красным светом (между видимым красным и инфракрасным), а его активная форма - при облучении красным светом. Известно, что фитохром участвует во многих реакциях растения, активируемых светом, включая дифференцировку пластид, прорастание семян, удлинение стебля, инициацию роста листьев и цветение.
Некоторые данные о том, как активированный фитохром вызывает ответ в компетентных клетках, получены на папоротнике Onoclea. Для прорастания спор этого растения необходим красный свет, а дальний красный свет ингибирует прорастание. Вначале, по-видимому, фитохром инициирует кратковременный приток Са2+ из окружающей клетку среды, в результате чего содержание Са2+ в цитозоле увеличивается. Ионофоры Са2+ ускоряют прорастание и в отсутствие света. Остается неясным, какова роль фитохрома в индуцируемых светом реакциях, в результате которых происходят изменения в транскрипции генов. Вероятно, протеинкиназы, чувствительные к притоку ионов Са2+, фосфорилируются, активируя при этом факторы транскрипции, специфичные для фоторегулируемых генов.
Фитохром может действовать при довольно широком диапазоне уровней освещенности: от единичных фотонов до яркого солнечного света, причем каждый из процессов достигает насыщения при разной интенсивности света. Тем не менее почти во всех таких процессах действие света совмещается с воздействием других факторов окружающей среды, а кроме того, во всем этом принимают участие молекулы одного или более регуляторов роста растений.
20.5.8. Рост и развитие растений регулируются химическими посредниками [35]
Координированные процессы клеточного деления, роста и дифференцировки контролируются многими факторами. Среди них особенно выделяется группа сигнальных молекул, называемых фитогормонами (или регуляторами роста растений), которые специфически действуют на рост растений и играют ключевую роль в их развитии. Известно пять классов таких соединений: ауксины, гиббереллины, цитокинины, абсцизовая кислота и газ этилен. Как показано на рис. 20-67, все это небольшие молекулы, способные легко проходить через клеточную стенку. Эти вещества вырабатываются в растительных клетках и либо действуют на месте, либо транспортируются по определенным путям к клеткам-мишеням. Так, например, суммарный поток ауксинов в побегах направлен от верхушки к основанию (скорость его около 1 см/ч). Несмотря на относительно малое число гормонов, растения справляются со своими регуляторными задачами благодаря многообразному использованию каждого гормона: их клетки, как правило, реагируют на определенные комбинации этих веществ. Так, сам по себе ауксин способствует образованию корней, в сочетании с гиббереллином вызывает удлинение стебля, вместе с цитокинином контролирует рост боковых почек, а с этиленом стимулирует рост боковых корней.
Важным общим принципом гормональной регуляции как у растений, так и у животных, является то, что каждая клетка, имея собственную генетическую программу, отвечает на определенные сигналы специфически (см. разд. 12.1.3). Более того, одна и та же клетка на разной стадии развития будет по-разному отвечать на одни и те же сигналы. Так, например, созревание плодов инициируется этиленом (см. разд. 20.1.8), однако чувствительность к этилену клетки приобретают лишь на поздних стадиях развития плода. Аналогичным образом, в семенах ячменя гибберелловая кислота, выделяемая зародышем, приводит к появлению ферментов, индуцирующих мобилизацию резервов крахмала в эндосперме, однако ответственные за реакцию клетки в оболочке семени становятся восприимчивыми к гибберелловой кислоте лишь после процесса дегидратации, необходимого для созревания семени.
До сих пор неизвестно, каким образом регуляторы роста оказывают воздействие на клетки-мишени. Соответствующие белки-рецепторы все еще не выделены и не охарактеризованы. Однако у растений, как и у животных, по-видимому, имеются два класса рецепторов: 1) рецепторы в плазматической мембране, которые активируют ионные каналы (а возможно, и другие еще неизвестные пути), и 2) рецепторы внутри клетки, которые воздействуют на ядро и регулируют экспрессию генов.
Получение очищенных регуляторов роста дало возможность выращивать ткани и клетки растений в культуре, что в значительной мере облегчило изучение различных аспектов роста и развития растений.
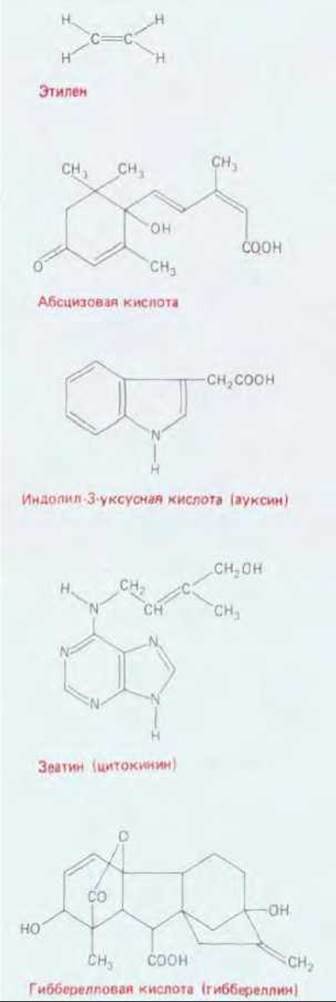
Рис. 20-67. Структурные формулы регуляторов роста растений. Для каждой из пяти групп регуляторов роста приведено по одному представителю, встречающемуся в природе.
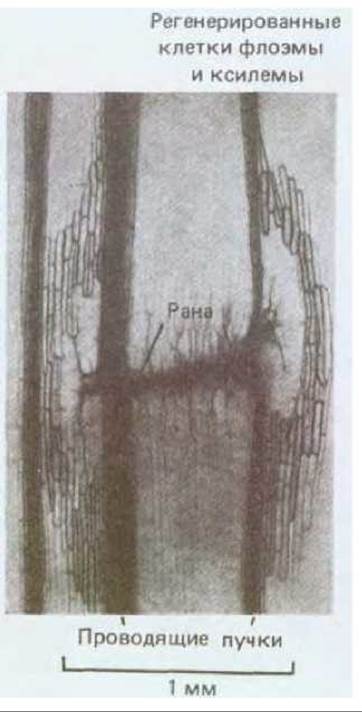
Рис. 20-68. Реакция на повреждение у распространенного комнатного растения Coleus (продольный срез стебля, световая микрофотография). Проводящие сосудистые пучки в области раны были перерезаны. Семь дней спустя в результате стимуляции клеточного деления и передифференцировки близлежащих клеток коры возникло много новых клеток ксилемы и флоэмы и была восстановлена непрерывность проводящих структур в области повреждения. Ауксин обычно поступает к основанию растения из верхушки. Полагают, что повреждение тканей вызывает новый направленный поток ауксина, который в свою очередь индуцирует регенерацию сосуда, показанную на этой микрофотографии. (С любезного разрешения N. P. Thompson.)
20.5.9. Культура клеток и тканей - модный инструмент для изучения развития растений [36]
При определенных условиях зрелые растительные клетки сохраняют способность делиться, а в некоторых случаях могут даже вступить на новый путь развития. Такая пластичность дает растению возможность восстанавливаться после повреждения. Например, если надрезать стебель, близлежащие клетки начинают делиться и закрывают рану, при этом другие клетки подвергаются передифференцировке, образуя ксилему и восстанавливая непрерывность проводящей ткани вокруг раны (рис. 20-68).
Такая пластичность свойственна не только целому растению: если культивировать растительную ткань в среде, содержащей необходимые питательные вещества и регуляторы роста, многие клетки начинают делиться. Они способны к неограниченной пролиферации и в конце концов образуют массу относительно недифференцированных клеток, называемую каллусом. Если правильно подобрать питательные вещества и регуляторы роста, то внутри каллуса начинают формироваться побеги, а затем корень; у многих видов таким образом удается регенерировать целиком новое растение (рис. 20-69).
Каллус можно механически разделить на отдельные клетки и выращивать их затем в суспензионной культуре. В такой культуре клетки очень похожи друг на друга: все они имеют тонкую первичную клеточную стенку и крупные вакуоли, пересеченные тонкими тяжами цитоплазмы (рис. 20-70). В ряде случаев из одиночных клеток, выделенных из суспензии, удавалось вырастить целое взрослое растение. Удачные результаты были получены с клетками картофеля, табака, петунии и моркови (рис. 20-69). Такая способность единственной соматической клетки давать начало целому растению хорошо иллюстрирует тотипотентность многих растительных клеток.

Рис. 20-69. Выращивание целого растения из клеток каллуса. В культуре каллуса Freesia (А) индуцировали сначала развитие побегов (Б), а затем корней (В), меняя соотношение ауксинов и цитокининов в среде. Для формирования побегов и листьев цитокинина в среде должно быть больше, чем ауксина. (С любезного разрешения G. Hussey.)
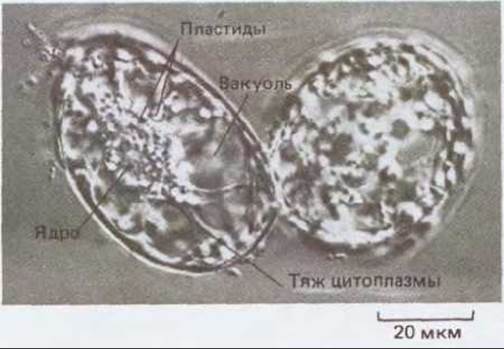
Рис. 20-70. Культуры каллуса можно поддерживать в жидкой среде в виде суспензии одиночных клеток. На микрофотографии показаны две такие клетки из каллуса платана. Они сильно вакуолизированы, и от ядра отходят цитоплазматические тяжи. У этих клеток есть первичная клеточная стенка.
Растения, выращенные из культивируемых клеток, характеризуются генетической нестабильностью (сомаклональная вариация). То же явление имеет место, если интактное растение подвергается стрессу. По-видимому, при стрессах, к которым относят и условия культивирования, в клетках растений происходят разнообразные хромосомные перестройки (см. разд. 10.5.10). Образовавшиеся мутантные растения могут иметь преимущества в изменившихся или неблагоприятных условиях. В настоящее время сомаклональные варианты используются селекционерами как исходный материал для получения улучшенных сортов сельскохозяйственных растений.
20.5.10. Использование методов молекулярной генетики для решения проблем развития растений
Способность соматических клеток растений и регенерации в культуре дает возможность проводить с такими клетками разнообразные генетические манипуляции и получать трансгенные растения. Для того чтобы облегчить попадание чужеродной ДНК в растительные клетки, их лишают жесткой оболочки. Этого можно добиться с помощью обработки клеток ферментами, гидролизующими связи в полисахаридах клеточной стенки. В результате такой обработки клетки превращаются в протопласты (рис. 20-71). После введения в них чужеродной ДНК протопласты можно заставить вновь сформировать клеточную стенку, индуцировать деление и даже регенерировать новое растение.
Для введения чужеродной ДНК в интактные клетки растений используется вектор, полученный на основе Т-ДНК Agrobacterium, о которой говорилось выше (см. разд. 20.3.3). Для этого гены, ответственные за образование опухоли на растении, удаляются и замещаются желаемыми. После переноса модифицированной Т-ДНК в соответствующую Ti-плазмиду Agrobacterium бактерии культивируют вместе с кусочками листа. Эта система позволяет Т-ДНК встроиться к хромосому растения, в результате чего новый ген стабильно включается в растительный геном (рис. 20-72). К сожалению, этот метод успешно используется лишь для некоторых семейств двудольных растений1)
1) В последнее время круг трансформируемых видов растений значительно расширился, методика стала применима и к некоторым однодольным растениям, например кукурузе и рису. - Прим. перев.
Рис. 20-71. Световая микрофотография протопластов, полученных из зеленых клеток листьев табака. Клетки, лишенные стенки, округляются: их можно сохранить только в изотоническом растворе. В каждом протопласте видны многочисленные хлоропласты. (С любезного разрешения F. Burgess.)
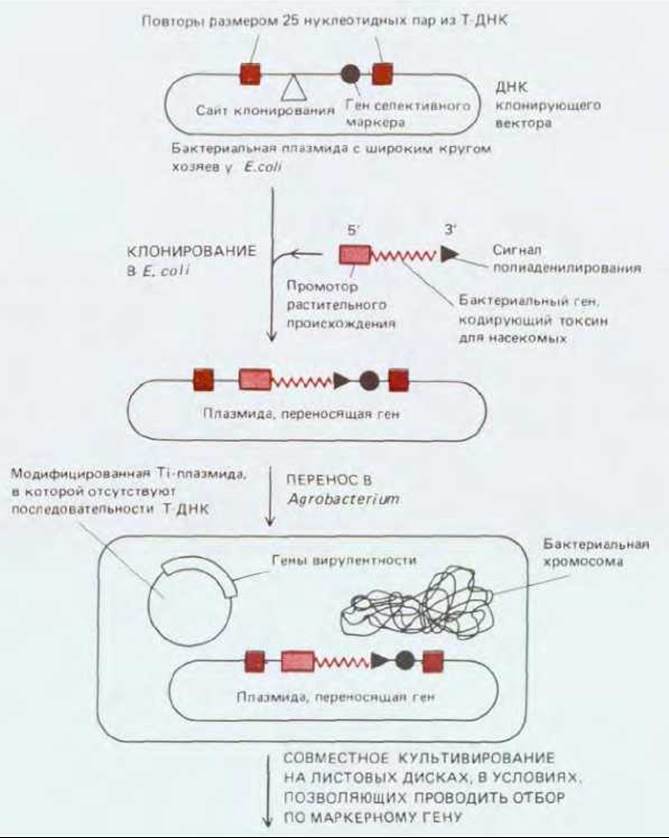
Рис. 20-72. Схема получения трансгенного растения. Интересующий нас ген кодирует бактериальный белок, токсичный для насекомых. Чтобы ген экспрессировался в растительной клетке, его 5'-конец соединяют с растительным промотором, а 3'-конец с сайтом полиаденилирования. Модифицированный ген токсина встраивают в плазмиду, содержащую кроме него и маркерный ген (например, ген устойчивости к канамицину), по которому можно проводить селекцию. Плазмида сконструирована таким образом, чтобы и ген токсина, и маркерный ген были окружены особыми повторами, размером 25 нуклеотидных пар, которые в норме окружают Т-ДНК. Плазмиду из клеток Е. coli переносят в Agrobacterium, где на отдельной плазмиде присутствуют гены вирулентности. Если такую Agrobacterium культивировать вместе с листовыми дисками, продукты генов вирулентности узнают повторы в Т-ДНК и перенесут ДНК, содержащую маркер и гены токсина в хромосому растения. Все клетки листового диска затем заставляют делиться, помещая экспланты на соответствующую питательную среду, однако способность делиться и образовывать каллус сохранят лишь те клетки, которые содержат ген селективного маркера. Из каллуса затем получают трансгенные растения, которые экспрессируют бактериальный ген инсектотоксина и, следовательно, обладают необычной устойчивостью к насекомым.
Применение методов генной инженерии к клеткам растений способствовало решению многих задач: удалось выделить в чистом виде регуляторы роста, прояснить пути морфогенеза и механизмы экспрессии генов. Более того, открылись новые горизонты в сельском хозяйстве: появилась теоретическая возможность получать растения с заданными свойствами, например устойчивые к вредителям или способные расти в экстремальных условиях (засоленная или переувлажненная почва).
Хорошо известно, что успехи в изучении механизмов развития у животных были достигнуты благодаря использованию в качестве объекта беспозвоночных, с которыми удобно проводить генетический анализ и эксперименты. Долгие годы модельными организмами служили плодовая мушка Drosophila (см. разд. 16.5) и нематода Caenorhabditis (см. разд. 16.3). Биология развития растений развивается гораздо медленнее. Это связано с длительностью жизненного цикла у растений и величиной их генома. В последние годы все более широкое применение в качестве объекта молекулярно-генетических исследований находит маленькое травянистое растение Arabidopsis thaliana. Во-первых, оно настолько мало (рис. 20-73), что его можно выращивать в пробирках в лабораторных условиях. Во-вторых, время генерации этого растения составляет всего 5 недель и, наконец, Arabidopsis обладает самым маленьким геномом из всех геномов растений (7 х 107 нуклеотидных пар), сравнимым с геномами дрожжей (2 х 107 нуклеотидных пар), C.elegans (8 х 107 нуклеотидных пар) и дрозофилы (10 х 107 нуклеотидных пар). В настоящее время выявлено большое число интересных мутаций Arabidopsis thaliana и получена полная геномная библиотека этого растения (см. разд. 5.6.3). Можно предположить, что в ближайшем будущем Arabidopsis будет играть в биологии развития растений такую же роль, как дрозофила в биологии развития животных.
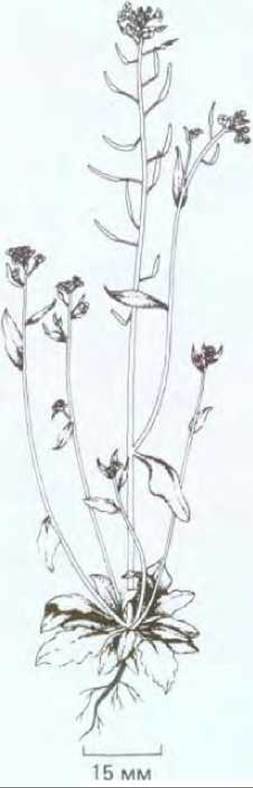
Рис. 20-73. Arabidopsis thaliana - небольшое травянистое растение из семейства крестоцветных, не имеющее никакой хозяйственной ценности, однако необычайно удобное для молекулярногенетических экспериментов с растительными объектами. Небольшой геном Arabidopsis (7 х 107 нуклеотидных пар) сопоставим по размеру с геномом дрозофилы (10 х 107 нуклеотидных пар). (С любезного разрешения Ch. Sommerville.)
Заключение
На самых ранних стадиях развития у высших растений происходит интенсивное деление клеток зародыша. Однако по мере роста зародыша способность клеток к делению сохраняется только в определенных областях, называемых меристемами. Взрослое растение можно рассматривать как серию повторяющихся модулей, возникших в результате действия в этих меристемах формообразующих механизмов.
Морфогенез растений зависит от координированного деления, растяжения и дифференцировки неподвижных клеток. Контроль за расположением плоскостей деления клеток и за их растяжением в определенном направлении частично осуществляется микротрубочками, связанными с внутренней поверхностью плазматической мембраны. На рост и деление клеток растений оказывают влияние свет, сила тяжести, температура и другие факторы окружающей среды, а также такие специфические низко молекулярные регуляторы роста, как ауксины и цитокинины.
Многие аспекты роста и развития растительных клеток были исследованы на культивируемых клетках - как одиночных, так и в составе каллуса. Соматические клетки растений обладают пластичностью, которой лишены клетки животных. Наиболее ярким примером тотипотентности многих соматических клеток растений является их способность давать начало целому растению.
Протопласты - это растительные клетки, лишенные своей жесткой стенки. Их можно изучать in vitro теми же методами, что и клетки животных, но протопласты имеют еще и дополнительное преимущество, так как из них можно регенерировать целые растения.
Благодаря методам генной инженерии в хромосомы протопластов и интактных клеток можно ввести требуемый новый ген. Во многих случаях из этих клеток удается впоследствии получить трансгенное растение.
Литература
Общая
Cutter E.G. Plant Anatomy, 2nd., Part 1, Cells and Tissues; Part 2 Organs. London, Arnold, 1978.
Esau K. Anatomy of Seed Plants, 2nd ed. New York, Wiley, 1977.
Grierson D., Covey S.N. Plant Molecular Biology, 2nd ed. New York, Methuen, 1988.
Gunning B. E. S., Steer M. W. Ultrastructure and the Biology of Plant Cells. London, Arnold, 1975.
Raven P. H., Evert R. F., Eichhorn S. E. Biology of Plants, 4th ed., New York, Worth, 1986.
Roberts K., Johnson A. W.B., Lloyd C. W., Shaw PJ., Woolhouse H. W., eds. The Cell Surface in Plant Growth and Development. J. Cell. Sci., Suppl. 2. Cambridge, U. K., Company of Biologists Ltd, 1985.
Salisbury F.B., Ross C. W. Plant Physiology, 3rd ed. Belmont, CA, Wadsworth, 1985.
Цитированная
1. Bacic A., Harris P.J., Stone B.A. Structure and Function of Plant Cell Walls. In Biochemistry of Plants: A Comprehensive Treatise (J. Preiss, ed.), Vol. 14, Carbohydrates, pp. 287-371. San Diego, CA, Academic Press, 1988.
Brett С. Т., Hillman J. R., eds. Biochemistry of Plant Cell Walls. SEB Seminar Series, 28. New York, Cambridge University Press, 1985.
McNeil M., Darvill A. G., Fry S. C., Albersheim P. Structure and function of the primary cell walls of plants. Annu Rev. Biochem., 53, 625 663, 1984. Rees D.A. Polysaccharide Shapes. London, Chapman and Hall, 1977.
2. Cassab G. I., Varner J. E. Cell wall proteins. Annu. Rev. Plant Physiol., 39, 321 -353, 1988. Fry S. Cross-linking of matrix polymers in the growing cell walls of angiosperms. Annu. Rev. Plant Physiol., 37, 165-186, 1986.
Selvendran R. R. Developments in the chemistry and biochemistry of pectic and hemicellulosic polymers. J. Cell Sci. Suppl., 2, 51-88, 1985.
3. Carpita N., Sabularse D., Montezinos D., Delmer D. P. Determination of the pore size of cell walls of living plant cells. Science, 205, 1144 1147, 1979.
Milburn J. A. Water Flow in Planls. London, Longman, 1979.
4. Street H. E., Öpik H. The physiology of Flowering Plants, 3rd ed. London, U. K., Edward Arnold, 1984.
5. Fry S. C. The Growing Plant Cell Wall: Chemical and Metabolic Analysis. New York, Wiley, 1988.
Masuda Y., Yamamoto R. Cell-wall changes during auxin-induced cell extension. Mechanical properties and constituent polysaccharides of the cell wall. In Biochemistry of Plant Cell Walls; (C.T. Brett, J. R. Hillman, eds.), pp. 269 300. SEB Seminar Series 28, New York, Cambridge University Press, 1985.
6. Baker D. A., Hall J. L. Ion Transport in Plant Cells and Tissues. Amsterdam, North-Holland, 1975. Cheeseman J. M. Mechanisms of salinity tolerance in plants. Plant Physiol., 87, 547 550, 1988.
Morgan J. M. Osmoregulation and water stress in higher plants. Annu. Rev. Plant Physiol., 35, 299-319, 1984.
Zimmerman U. Cell turgor pressure regulation and turgor pressure-mediated transport processes. Symp. Soc. Exp. Biol., 31, 117-154, 1977.
7. Esau K. Anatomy of Seed Plants, 2nd ed. New York, Wiley, 1977.
Tanner W., Loewus F .A., eds. Encyclopedia of Plant Physiology, New Series Vol. 13B, Plant Carbohydrates II, Extracellular Carbohydrates. Heidelberg, Springer-Verlag, 1982.
8. Dugger W. M., Bartnicki-Garcia S., eds. Structure, Function, and Biosynthesis of Plant Cell Walls. Proc. 7th Annu. Symp. Botany Rockville, M.
D., American Society of Plant Physiologists, 1984. (Several relevant papers appear in this collection.)
Fry S. The Growing Plant Cell Wall: Chemical and Metabolic Analysis. New York, Wiley, 1988.
9. Gunning B. E. S., Overall R. L. Plasmodesmata and cell-to-cell transport in plants. Bioscience., 33, 260-265, 1983.
Gunning B. E. S., Robards A. W., eds. Intercellular Communication in Plants: Studies on Plasmodesmata. New York, Springer-Verlag, 1976.
10. Baron-Epel O., Hernandez D., Jiang L.-W., Meiners S., Schindler M. Dynamic continuity of cytoplasmic and membrane compartments between plant cells. J. Cell Biol., 106, 715 721, 1988.
Gunning B. E. S., Hughes J. E. Quantitative assessment of symplastic transport of pre-nectar into the trichomes of Abutilon nectaries. Aust. J. Plant Physiol., 3, 619-637, 1976.
Terry B. R., Robards A. W. Hydrodynamic radius alone governs the mobility of molecules through plasmodesmata. Planta, 171, 145-157, 1987. Zaitlin M., Hull R. Plant virus-host interactions. Annu. Rev. Plant Physiol., 38, 291-315, 1987.
11. Aloni R. Differentiation of vascular tissue. Annu. Rev. Plant Physiol., 38, 179 204, 1987.
Moorby J. Transport Systems in Plants. New York, Longman, 1981.
12. Baker D. A. Transport Phenomena in Plants. London, U.K., Chapman and Hall, 1978.
Clarkson D. T. Factors affecting mineral nutrient acquisition by plants. Annu. Rev. Plant Physiol., 36, 77-115, 1985.
Milburn J. A. Water Flow in Plants. London, Longman, 1979.
Passioura J. B. Water transport in and to roots. Annu, Rev. Plant Physiol. Plant Mol. Biol., 39, 245-265, 1988.
13. Cronshaw J. Phloem structure and function. Annu. Rev. Plant Physiol., 32, 465-484, 1981.
Cronshaw J., Lucas W. J., GiaquintaR. Т., eds. Phloem Transport. New York, Liss, 1986.
Gunning B. E. S. Transfer cells and their roles in transport of solutes in plants. Sci. Prog. (Oxford), 64, 539-568, 1977.
Ho L. C. Metabolism and compartmentation of imported sugars in sink organs in relation of sink strength. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 355-378, 1988.
14. Gianinazzi-Pearson V., Gianinazzi S., eds. Physiological and Genetical Aspects of Mycorrhyzae. Paris, INRA, 1986.
Smith S. E., Gianinazzi-Pearson V. Physiological interactions between symbionts in vesicular-arbuscular mycorrhizal plants. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 221-244, 1988.
15. Downie J. A., Johnson A. W. B. Nodulation of legumes by Rhizobium: the recognized root? Cell., 47, 153-154, 1986.
Peters N. K., Frost J. W., Long S. R. A plant flavone, luteolin induces expression of Rhizobium meliloti nodulation genes. Science., 233, 977-980, 1986.
Rolfe B. G., GresshoffP. M. Genetic analysis of legume nodule initiation Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 297-319, 1988.
16. Buchanan-Wollaston V., Passiatore J. E., Cannon F. The mob and oriT mobilization functions of a bacterial plasmid promote its transfer to plants. Nature., 328, 172-175, 1987.
Klee H., Horsch R., Rogers S. Agrobacterium-medialed plant transformation and its further applications to plant biology. Annu, Rev. Plant Physiol., 38, 467-486, 1987.
Stachel S. E., Messens E., Van Montagu M., Zambryski P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature., 318, 624-629, 1985.
17. Ayers A. R., Ebel J., Finelli F., Berger N., Albersheim P. Host pathogen interactions. Plant Physiol., 57, 751-759, 1976. (This should be read in conjunction with three related papers that follow its.)
Darvill A. G., Albersheim P. Phytoalexins and their elicitors - a defence against microbial infection in plants. Annu. Rev. Plant Physiol., 35, 243-275, 1984.
Ralton V. E., Smart M. G., Clarke A. E. Recognition and infection process in plant pathogen interactions. In Plant-Microbe Interactions. (T. Kosuge, E. W. Nestor, eds.), Vol. 2, pp. 217-252, New York, Macmillan, 1987.
Ryan C. A. Oligosaccharide signalling in plants. Annu. Rev. Cell Biol., 3, 295-317, 1987.
18. McDougall G. J., Fry S.C. Inhibition of auxin-stimulated growth of pea stem segments by a specific monosaccharide of xyloglucan. Planta, 175, 412-416, 1988.
Thanh Van К. Т., et al. Manipulation of the morphogenetic pathways of tobacco explants by oligosaccharins. Nature, 314, 615-617, 1985.
19. Anderson J. M. Photoregulation of the composition, function, and structure of thylakoid membranes. Annu. Rev. Plant Physiol., 37, 93-136, 1986.
Mullett J. E. Chloroplast development and gene expression. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 475-502, 1988.
Thomson W. W., Watley J. M. Development of nongreen plastids. Annu. Rev. Plant Physiol., 31, 375-394, 1980.
20. Boiler Т., Kende H. Hydrolytic enzymes in the central vacuole of plant cells. Plant Physiol., 63, 1123-1132, 1979.
Boiler Т., Wiemken A. Dynamics of vacuolar compartmentation. Annu. Rev. Plant Physiol., 37, 137-164, 1986.
Marin В., ed. Plant Vacuoles: Their Importance in Solute Compartmentations in Cells and Their Applications in Plant Biotechnology. NATO ASI Series, Vol. 134. New York, Plenum, 1987.
Motile P. Biochemistry and function of vacuoles. Annu. Rev. Plant Physiol., 29, 193-213, 1978.
21. Mollenhauer H. H., Morre D. J. The Golgi apparatus. In The Biochemistry of Plants-A Comprehensive Treatise. (N. E. Tolbert, ed.), Vol. 1, pp.
437-488. New York, Academic Press, 1980.
Moore P. J., Staehelin L. A. Immunogold localization of the cell-wall-matrix polysaccharides rhamnogalacturonan I and xyloglucan during cell expansion and cytokinesis in Trifolium pratense L.; implications for secretory pathways. Planta., 174, 433 445, 1988.
Northcote D. H. Macromolecular aspects of cell wall differentiation. In Encyclopedia of Plant Physiology, New Series. Vol. 14A. Nucleic Acids and Proteins in Plants I (D. Boutler, B. Parthier, eds.), pp. 637-655. Berlin, Springer-Verlag, 1982.
22. Coleman J., Evans D., Hawes C., Horsley D., Cole L. Structure and molecular organization of higher plant coated vesicles. J. Cell Sci., 88, 3545, 1987.
Robinson D. G., Depta H. Coated vesicles. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 53-99, 1988.
Tanchak M. A., Griffing L. R., Mersey B. G., Fowke L. C. Endocytosis of cationized ferritin by coated vesicles of soybean protoplasts. Planta., 162, 481-486, 1984.
23. Brown R. M. Cellulose microfibril assembly and orientation: recent developments. J. Cell Sci., Suppl., 2, 13-32, 1985.
Delmer D.P. Cellulose biosynthesis. Annu. Rev. Plant Physiol., 38, 259-290, 1987.
Schneider В., Herth W. Distribution of plasma membrane rosettes and kinetics of cellulose formation in xyleme development of higher plants. Protoplasma., 131, 142 152, 1986.
24. Green P. B. Organogenesis-a biophysical view. Annu. Rev. Plant Physiol., 31, 51 82, 1980.
Herth W. Plant Cell wall formation. In Botanical Microscopy (A. W. Robards, ed.), pp. 285-310. New York. Oxford University Press, 1985.
25. Lloyd C. W., ed. The Cytoskeleton in Plant Growth and Development. New York, Academic Press, 1982. (Chapters 5-8 are particulary relevant.)
26. Kersey Y. M., Helper P. K., Palevitz B. A., Wessels N. K. Polarity of actin filaments in characean algae. Proc. Natl. Acad. Sci. USA., 73, 165-167, 1976.
Parthasarathy M. V. F-actin architecture in coleoptile epidermal cells. Eur. J. Cell Biol., 39, 1-12, 1985.
Sheet: M. P., Spudich J. A. Movement of myosin-coated fluorescent beads on actin cables in vitro. Nature, 303, 31-35, 1983.
Williamson R. E. Organelle movements along actin filaments and microtubules. Plant Physiol., 82, 631 634, 1986.
27. Haupt W. Light-mediated movement of chloroplasts. Annu. Rev. Plant Physiol., 33, 205-233, 1982.
Roberts I. N., Lloyd C. W., Roberts K. Ethylene-induced microtubule reorientations: mediation by helical arrays. Planta, 164, 439-447, 1985. Virgin H. I. Light and chloroplast movements. Symp. Soc. Exp. Biol., 22, 329 352, 1968.
Wagner G., Klein K. Mechanism of chloroplast movement in Mougeotia. Protoplasma, 109, 169-185, 1981.
28. Cutter E.G. Plant Anatomy, 2nd ed., Part 2, Organs. London, Arnold, 1978. Johri B. M. Embryology of Angiosperms. Berlin. Springer-Verlag, 1984.
Raven P. H., Evert R. F., Eichhorn S. E. Biology of Plants, 4th ed. New York. Worth, 1986. (Chapters 19-22 provide a good general outline of plant development.)
29. Harper J. L., ed. Growth and Form of Modular Oganisms. London, Royal Society, 1986. (There are several relevant papers in this collection.)
Walbot V. On the life strategies of plants and animals. Trends Genet., 1, 165-169, 1985.
30. Green P. B. A theory for influorescence development and flower formation based on morphological and biophysical analysis in Echeveria. Planta, 175, 153 169, 1988.
McDaniel C. N., Poething R. S. Cell lineage patterns in the shoot apical meristem of the germinating corn embryo. Planta, 175, 13-22, 1988. Sachs T. Controls of cell patterns in plants. In Pattern Formation (G. M. Malacinski, S. V. Bryant, eds.). New York. Macmillan, 1984.
Sleeves T. A., Sussex I. M. Patterns in Plant Development, 2nd ed. New York, Cambridge University Press, 1988.
31. Gunning B.E.S. Microtubules and cytomorphogenesis in a developing organ: the root primordium of Azolla pinnata. In Cytomorphogenesis in Plants. (O. Kiermayer, ed.), pp. 301-325, New York, Springer, 1981.
Poethig R. S. Clonal analysis of cell lineage patterns in plant development. Am. J. Bot., 74, 581-594, 1987.
32. Gunning B. E. S., Wick S. M. Preprophase bands, phragmoplasts and spatial control of cytokinesis. J. Cell Sci. Suppl., 2, 157-179, 1985.
Lloyd C. Actin in plants. J. Cell Sci., 90, 185-188, 1988. Lloyd C. W. The plant Cytoskeleton: the impact of fluorescence microscopy. Annu. Rev. Plant Physiol., 38, 119-139, 1987.
Pickett-Heaps J. D., Northcote D. H. Organization of microtubules and endoplasmic reticulum during mitosis and cytokinesis in wheat meristems. J. Cell Sci., 1, 109-120, 1966.
Wick S. M., Seagull R. W., Osborn M., Weber K., Gunning B. E. S. Immunofluorescence microscopy of organized microtubule arrays in structurally stabilized meristematic plant cells. J. Cell Biol., 89, 685-690, 1981.
33. Hepler P. K., Wayne R. 0. Calcium and plant development. Annu. Rev. Plant Physiol., 36, 397-439, 1985.
Kropf D. L., Kloareg B. Quatrano R. S. Cell wall is required for fixation of the embryonic axis in Fucus zygotes. Science, 239, 187-190, 1988. Quatrano R.S., Griffing L. R., Huber-Walchli V., Doubet R. S. Cytological and biochemical requirements for the establishments of a polar cell. J. Cell Sci., Suppl., 2, 129-141, 1985.
Schnepf E. Cellular polarity. Annu. Rev. Plant Physiol., 37, 23-47, 1986.
34. Jordan B. R., Partis M. D., Thomas B. The biology and molecular biology of plytochrome. Ox. Sur. Plant. Mol. Cell Biol., 3, 315-362, 1986. Kuhlemeier C., Green P. J., Chua N. Regulation of gene expression in higher plants. Annu. Rev. Plant Physiol., 38, 221-257, 1987.
Tobin E. M., Silverthorne J. Light regulation of gene expression in higher plants. Annu. Rev. Plant Physiol., 36, 569-593, 1985.
Verma D.P.S., Goldberg R. B. Temporal and Spatial Regulation of Plant Genes. New York, Springer-Verlag, 1988.
von Wettstein D., Chua N.-H., eds. Plant Molecular Biology. NATO AS1 Series A, Vol. 140. New York, Plenum, 1987. (Several relevant papers in this collection.)
35. Hoad G. V., Lenton J. R., Jackson M. В., Atkin R. K. Hormone Action in Plant Development: A Critical Appraisal. London, Butterworth, 1987. Salisbury F. В., Ross C. W. Plant Physiology, 3rd ed. Belmonl, CA, Wadsworth, 1985. (Chapters 16 and 17 are relevant.)
Theologis A. Rapid gene regulation by auxin. Annu. Rev. Plant Physiol., 37, 407-438, 1986.
Trewavas A. J. Growth substance sensitivity: the limiting factor in plant development. Physiol. Plant., 35, 60-72, 1982.
36. Application of Plant Cell and Tissue Culture. CIBA Foundation Symposium 137. New York, Wiley, 1988.
Lee M., Phillips R. L. The chromosomal basis of somaclonal variation. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 413 437, 1988.
Vasil I. K., ed. Perspectives in Plant Cell and Tissue Culture. Int. Rev. Cytol., Suppl. 11A and B, 1980.
37. Bevan M. Binary Agrobacterium vectors for plant transformation. Nucl. Acids Res., 12, 8711 -8721, 1984.
De Block M., Herrera-Estrella L., Van Montague M., Schell J., Zambryski P. Expression of foreign genes in regenerated plants and in their progeny. EMBO J., 3, 1681-1689, 1986.
Finkelstein R., Estelle M., Martinez-Zapater J., Somerville C. Arabidopsis as a tool for the identification of genes involved in plant development. In Temporal and Spatial Regulation of Plant Genes. (D. P. S. Verma, and R. B. Goldberg eds.), pp. 1-25. New York, SpringerVerlag. 1988.
Myerowitz E. M. Arabidopsis thaliana. Annu. Rev. Genet. 21, 93-111, 1987.
Vaeck M., et al. Transgenic plants protected from insect attack. Nature, 328, 33 37. 1987.