Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Особенности растительных клеток
Особенности внутренней организации растительной клетки
Клетки высших растений содержат те же внутриклеточные компартменты, которые ранее были описаны для животных клеток, - это цитозоль, аппарат Гольджи, эндоплазматический ретикулум, ядро, митохондрии, пероксисомы и лизосомы. Кроме того, растительные клетки обладают цитоскелетом, состоящим из актиновых филаментов, микротрубочек и промежуточных филаментов, сравнимых с теми, которые обнаруживаются в клетках животных. Тем не менее клетки растений легко отличить от клеток животных по присутствию в них двух особых типов компартментов, окруженных мембраной -вакуолей и пластид. Наличие данных органелл связано с неподвижным образом жизни растительной клетки. Эти и другие особенности внутреннего строения клеток растений будут рассмотрены в данном разделе.
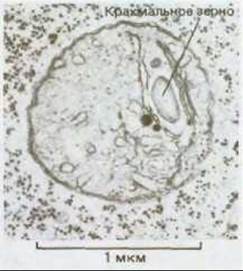
Рис. 20-35. Электронная микрофотография типичной пропластиды из клетки кончика корня бобового растения. Оболочка пропластиды состоит из двух мембран, внутренняя система мембранных структур слабо развита. (В. Gunning, M. Steer, Ultrastructure and the Biology of Plant Cells. London: Arnold, 1975.)
20.4.1. Хлоропласты представители семейства органелл, называемых пластидами, и свойственных только растительным клеткам [19]
Растения сами производят все органические вещества, в которых они нуждаются, посредством фотосинтеза, происходящего в хлоропластах. Продукты фотосинтеза могут непосредственно использоваться клетками для различных процессов биосинтеза, могут запасаться в виде осмотически инертного полисахарида (обычно крахмала) или превращаться в сравнительно низкомолекулярные сахара (как правило, сахарозу), которые транспортируются в другие ткани растения.
Хлоропласты - это лишь один из видов близко родственных органелл, называемых пластидами. Пластиды присутствуют во всех живых клетках растения, причем в каждом типе клеток содержится свой набор этих органелл. Всем пластидам свойствен ряд общих черт. Они имеют небольшой геном, одинаковый у всех представителей одного вида, и окружены оболочкой, состоящей из двух концентрических мембран.
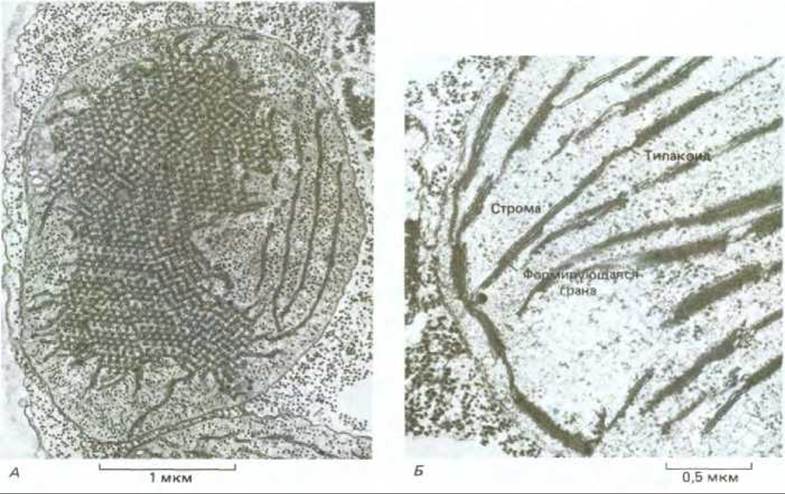
Рис. 20-36. Электронная микрофотография двух форм пластид в проростках овса. А. Этиопласт из проростка, выращенного в темноте. Кристаллоподобная структура, образованная внутренними мембранами, содержит протохлорофилл. Б. После освещения из этиопласта развивается хлоропласт. Показана часть молодого зеленеющего хлоропласта. Происходит реорганизация мембранной системы этиопласта: в ней уже есть хлорофилл, и начинают образовываться небольшие граны. (С любезного разрешения В. Gunning.)
Поскольку структура и функции хлоропластов были подробно рассмотрены в гл. 7, мы сосредоточим свое внимание на других представителях той же группы растительных органелл.
Все пластиды, включая хлоропласты, развиваются из пропластид - относительно мелких органелл, присутствующих в клетках меристемы (рис. 20-35). Судьба пропластид определяется потребностями дифференцированных клеток. Например, если лист растет в темноте, то его пропластиды увеличиваются и превращаются в этиопласты. Внутренние мембраны этиопластов образуют кристаллоподобную структуру, содержащую вместо хлорофилла протохлорофилл (желтый предшественник хлорофилла) (рис. 20-36, А). Под действием света из этиопластов образуются хлоропласты благодаря превращению протохлорофилла в хлорофилл и синтезу новых мембран, пигментов, фотосинтетических ферментов, а также компонентов электронтранспортной цепи (рис. 20-36, Б).
Неудивительно, что многие процессы, происходящие в растении, регулируются светом. Фоторецепторы, включая фитохром (см. разд. 20.5.7), контролируют транскрипцию многих генов, участвующих в развитии хлоропласта, причем эти гены локализованы не только в самом хлоропласте, но и в ядре. Механизм такого контроля пока неясен. Светом регулируется примерно пятая часть из 120 генов, входящих в состав хлоропластного генома (см. разд. 7.5.4).
Хлоропласты представляют собой другую форму пластид (рис. 20-37, А). Они накапливают каротиноидные пигменты, ответственные за желто-оранжевый цвет лепестков (например, у желтых нарциссов) и плодов (например, у помидоров). Еще одна разновидность пластид - лейкопласты, которые, кроме своих более крупных размеров, немногим отличаются от пропластид и имеются во многих эпидермальных и внутренних тканях, не приобретающих зеленой окраски и не способных к фотосинтезу. Распространенной формой лейкопластов являются амилопласты (рис. 20-37, Б), которые служат хранилищами крахмала в запасающих тканях. У некоторых растений, например картофеля, амилопласты, увеличиваясь, могут достигать размера средней клетки животного.
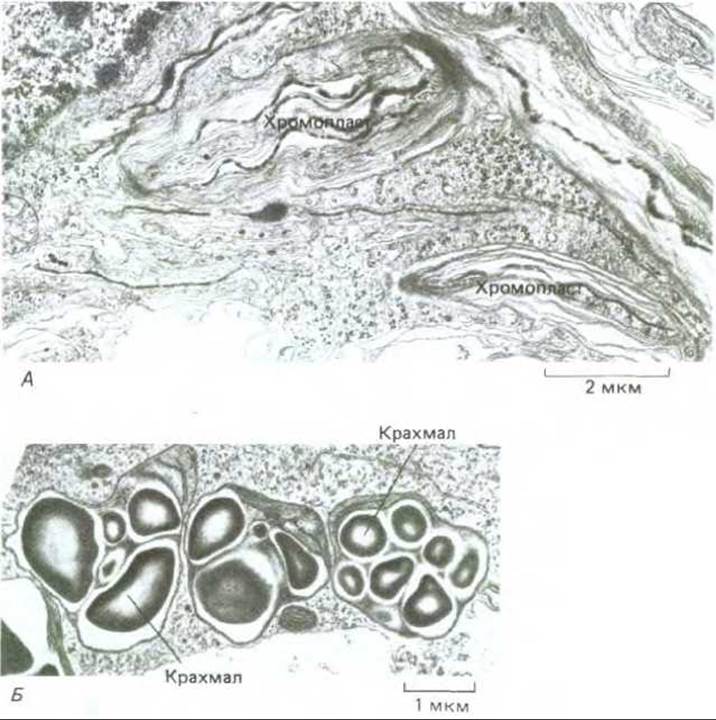
Рис. 20-37. Разнообразные формы пластид. А. Хромопласты из клеток оранжево-желтых лепестков нарцисса. Эти пластиды имеют извилистый контур; в их внутренних мембранах, которые расположены весьма хаотично, содержится пигмент (ß-каротин, придающий лепесткам характерную окраску. Б. Три амилопласта (пластиды, накапливающие крахмал) в клетке кончика корня сои. (В. Gunning, М. Steer, Ultrastucture and the Biology of Plant Cells, London: Arnold, 1975.)
Хотя точно неизвестно, чем определяется превращение пропластиды в ту или иную форму пластид, очевидно, что существенную роль в регуляции этого процесса играет ядерный геном. Ядерные мутации могут переключать развитие с хромопластов на хлоропласты, или же совсем блокировать развитие, в результате чего возникнут либо различные формы лейкопластов, либо незрелые хлоропласты с аномальной пигментацией, которые свойственны многим декоративным растениям.
Пластиды в цитоплазме могут расти и делиться, таким образом происходит их размножение (см. разд. 7.5.1). Единственный тип клеток, утративший пластиды, - это спермии у некоторых высших растений; такие растения (например, кукуруза) получают пластиды только от яйцеклетки, из которой они развились. В этом случае пластиды, подобно митохондриям у животных, наследуются по материнской линии (см. разд. 7.5.10).
Важно усвоить, что пластиды растений - это органеллы, в которых происходит не только фотосинтез. Здесь протекают промежуточные стадии многих метаболических процессов. В пластидах вырабатываются источники химической энергии и восстановители (АТР и NADPH), потребляемые растением в биосинтетических реакциях. Здесь у растений происходит синтез пуринов и пиримидинов, большинства аминокислот и всех жирных кислот, тогда как у животных эти процессы осуществляются в цитозоле.
20.4.2. Вакуоли растительных клеток - это органеллы с удивительно разнообразными функциями [20]
Наиболее заметным компартментом большинства растительных клеток является очень большой пузырек, заполненный жидкостью, который называется вакуолью (рис. 20-38). В одной клетке может присутствовать несколько вакуолей, каждая из которых отделена от цитоплазмы однослойной мембраной, именуемой тонопластом. Вакуоли обычно занимают более 30% всего объема клетки, однако эта величина непостоянна: в зависимости от типа клетки она может составлять от 5 до 90%. Большинство биологов считают, что эта органелла не является частью цитоплазмы, поэтому принято говорить, что растительная клетка содержит ядро, вакуоль и цитоплазму; в цитоплазме же содержатся все остальные органеллы, связанные с мембранами, в том числе пластиды. Вакуоли первоначально образуются в молодых делящихся клетках, вероятно, путем слияния все большего числа пузырьков, отделяющихся от аппарата Гольджи. Как в структурном, так и в функциональном отношении они близки к лизосомам животных клеток, в частности, они тоже содержат множество различных гидролитических ферментов. Вместе с тем функции вакуолей в растительных клетках поразительно многообразны. Они могут использоваться и для запасания питательных веществ, и для хранения отходов, и для увеличения размеров клеток, и для регуляции тургорного давления. В одной и той же клетке часто присутствуют вакуоли с различными функциями (например, действующие как лизосомы и как место хранения). Выше рассматривалась роль вакуолей как компартментов, способствующих заполнению пространства при росте клеток (см. рис. 20-10). В следующем разделе описано участие вакуолей в запасании веществ.
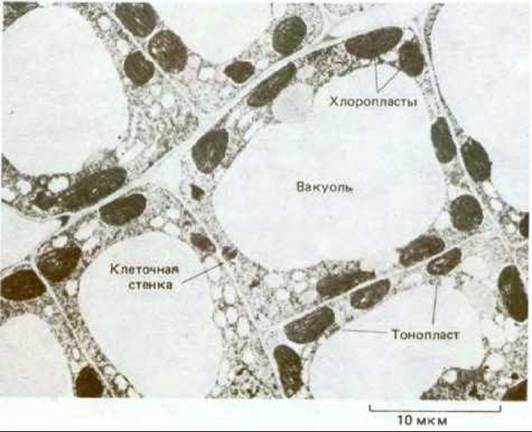
Рис. 20-38. Электронная микрофотография клеток в молодом листе табака. В этих сильно вакуолизированных клетках цитоплазма, в которой много хлоропластов, располагается на периферии в виде тонкого пристеночного слоя. (С любезного разрешения J. Burgess.)
20.4.3. Вакуоли могут служить запасающими органеллами [20]
В вакуолях могут накапливаться и храниться самые различные молекулы, в том числе те необходимые для клетки вещества, которые потенциально опасны, если присутствуют в цитоплазме в больших количествах. Например, у некоторых растений в вакуолях специализированных клеток накапливаются такие хорошо известные продукты, как каучук (у Hevea brasiliensis) и опиум (у Papaver somniferum). Даже вездесущие ионы Na+ могут избирательно накапливаться в этих органеллах, где их осмотическая активность способствует поддержанию тургорного давления. Исследования, проведенные на гигантских клетках водоросли Nitella, показали, что натриевые насосы в тонопласте поддерживают относительно низкую концентрацию Na+ в цитозоле за счет создания 4-5-кратного избытка этих ионов в вакуолях. А поскольку вакуоль занимает в клетке Nitella гораздо больший объем, чем цитоплазма, получается, что основной пул клеточного натрия сосредоточен в вакуолях.
Вакуоль играет важную роль в гомеостазе растительных клеток, которые подвержены самым разнообразным воздействиям внешней среды. Если, например, рН среды падает, приток ионов Н+ в цитоплазму компенсируется, по крайней мере, частично, за счет усиления переноса ионов Н+ в вакуоль. Сходным образом многие клетки растений поддерживают тургорное давление на удивительно постоянном уровне несмотря на значительные изменения в окружающей их среде. Это осуществляется благодаря изменению осмотического давления в цитоплазме и в вакуоли в результате контролируемого распада и повторного синтеза в вакуоли таких полимеров, как полифосфаты. Тургорное давление может поддерживаться постоянным и за счет изменения скорости переноса через плазматическую мембрану и тонопласт. Проницаемость этих двух мембран зависит от определенного набора транспортных белков, переносящих специфические сахара, аминокислоты и другие метаболиты через каждый липидный бислой (см. гл. 6).
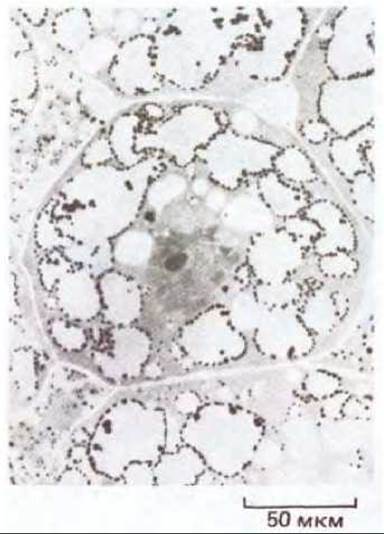
Рис. 20-39. Световая микрофотография клетки из формирующегося семени гороха. По краям развитой системы вакуолей можно увидеть начальные стадии отложения белка. Семена бобовых растений накапливают в клеточных вакуолях большие количества запасного белка, который используется зародышем при прорастании семени. (С любезного разрешения S. Craig.)
Вещества, содержащиеся в вакуоли, как качественно, так и количественно отличаются от веществ, присутствующих в цитоплазме. Однако в связи с тем, что тонопласт не очень прочен механически, гидростатическое давление в вакуоли и цитоплазме должно быть приблизительно одинаковым, и оба эти компартмента для поддержания тургорного давления должны вносить совместный вклад в осмотическое равновесие.
Среди продуктов, запасаемых в вакуолях, важное место занимают различные метаболиты. Например, растения-суккуленты ночью открывают свои устьица, поглощают из воздуха двуокись углерода (в это время суток транспирационные потери уменьшаются) и хранят ее в вакуолях в форме малата, пока на следующий день он не будет с помощью солнечной энергии превращен в сахар при закрытых устьицах. Органические молекулы могут храниться в вакуолях и в течение гораздо более длительного срока, как, например, запасные белки в клетках многих семян, в частности у гороха и фасоли. При набухании семян белки гидролизуются, и аминокислоты используются для питания развивающегося зародыша (рис. 20-39).
Ряд веществ, накапливаемых в вакуолях, участвует во взаимодействии растения с животными или с другими растениями. Например, антоцианины придают окраску лепесткам некоторых цветков, что способствует привлечению насекомых-опылителей. Другие вещества выполняют защитные функции. Растения не могут передвигаться и таким образом избегать уничтожения травоядными животными; вместо этого они синтезируют бесчисленное множество ядовитых веществ, которые высвобождаются из вакуолей при повреждении клеток. Среди них и высокотоксичные алкалоиды, и просто неприятные на вкус вещества, отрицательно влияющие на пищеварение. Ингибиторы трипсина, обычно обнаруживаемые в семенах, а также ингибиторы протеаз, образующиеся в клетках листьев в ответ на ранение, накапливаются в вакуоли и, вероятно, влияют на пищеварение у травоядных. На протяжении всей своей истории растения, так же как и животные, постоянно разнообразили средства ведения химической войны. Равновесие смещалось в ту или иную сторону, когда, например, в растительном мире возникал новый мощный репеллент для растительноядных видов или, наоборот, когда какое-либо насекомое в ходе эволюции научалось нейтрализовать или разрушать токсичный метаболит растения и получало таким образом возможность поедать синтезирующее его растение. Сам токсин в этом случае мог становиться уже не репеллентом, а аттрактантом.
20.4.4. Пузырьки аппарата Гольджи доставляют материал для образования клеточной стенки к определенным участкам цитоплазматической мембраны [21]
Большая часть компонентов матрикса клеточной стенки транспортируется в пузырьках аппарата Гольджи к плазматической мембране, где затем выводится из клетки путем экзоцитоза. Однако в отличие от клеток животных, у которых аппарат Гольджи секретирует гликопротеины, у растений аппарат Гольджи участвует главным образом в продуцировании и секреции широкого круга внеклеточных полисахаридов (рис. 20-40). Детали синтеза этих полисахаридов неизвестны, что не столь уж удивительно, поскольку 1) каждый из полисахаридов, входящих в состав клеточной стенки, образуется из двух или более Сахаров; 2) используется по меньшей мере 12 различных полисахаридов; 3) у большинства этих полисахаридов молекулы разветвленные и 4) полисахариды, после того как они синтезируются, подвергаются многочисленным ковалентным модификациям. Установлено, что в сборке полисахаридных компонентов, необходимых для формирования типичной первичной клеточной стенки, принимает участие несколько сот различных ферментов. Большинство их обнаруживается в эндоплазматическом ретикулуме и аппарате Гольджи, тогда как некоторые из ферментов, связанные с более поздними ковалентными модификациями полисахаридов, присутствуют в самой клеточной стенке, причем часть ферментов ковалентно с ней связана.
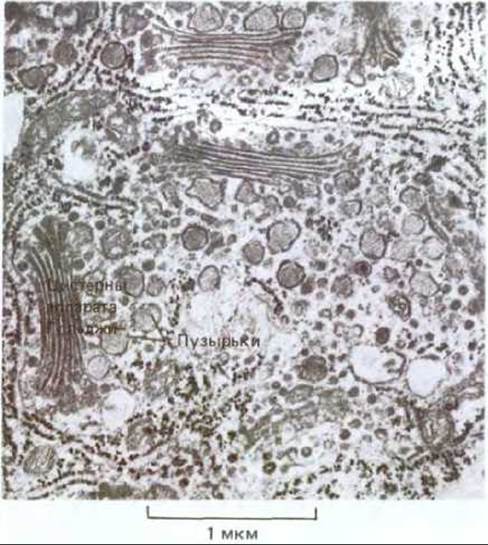
Рис. 20-40. Электронная микрофотография клетки волоска зеленой водоросли Bulbochaete. Хорошо видны обособленные друг от друга стопки цистерн Гольджи и связанные с ними транспортные пузырьки, содержащие секретируемые полисахариды. Четко прослеживается полярная организация: от эндоплазматического ретикулума через цис-, промежуточные и транс-цистерны Гольджи к транспортным пузырькам. В растительных клетках (в отличие от животных) цистерны Гольджи, принадлежащие разным стопкам, не связаны между собой. (С любезного разрешения Т. Frazer, по В. Gunning и М. Steer, Ultrastructure and the Biology of Plant Cells. London: Arnold, 1975.)
Химический состав и структура стенки в разных зонах клеточной поверхности различны, поэтому пузырьки с нужными матрицами должны избирательно направляться к определенным участкам плазматической мембраны. Эту направленность обеспечивают (по крайней мере, частично) элементы цитоскелета; одним из примеров может служить образование de novo первичной клеточной стенки, разделяющей две дочерние клетки после митоза, (рис. 20-41). В конце телофазы между двумя дочерними ядрами остается пучок микротрубочек, расположенных параллельно оси веретена. Этот пучок состоит из двух наборов полюсных микротрубочек веретена, обладающих противоположной полярностью; концы микротрубочек, принадлежащих к разным наборам, перекрываются в дискообразной области, называемой фрагмопластом и находящейся в плоскости экватора бывшего веретена деления (рис. 20-42). Транспортные пузырьки, содержащие различные предшественники клеточной стенки, в частности пектин, перемещаются вдоль этих ориентированных микротрубочек в сторону экватора и, достигнув центрального диска, сливаются друг с другом, образуя клеточную пластинку. Клеточная пластинка расширяется за счет все новых и новых пузырьков, направляемых сюда новыми микротрубочками, образующимися на периферии фрагмопласта, по мере того как более центрально расположенные микротрубочки распадаются. В конце концов растущая пластинка сливается с материнской клеточной стенкой, в результате чего образуются две отдельные дочерние клетки (см. рис. 20-41 и 13-71). Неясно, какие компоненты фрагмопласта - микротрубочки или актиновые филаменты (а может быть и те и другие), ответственны за продвижение пузырьков, образующихся в аппарате Гольджи.
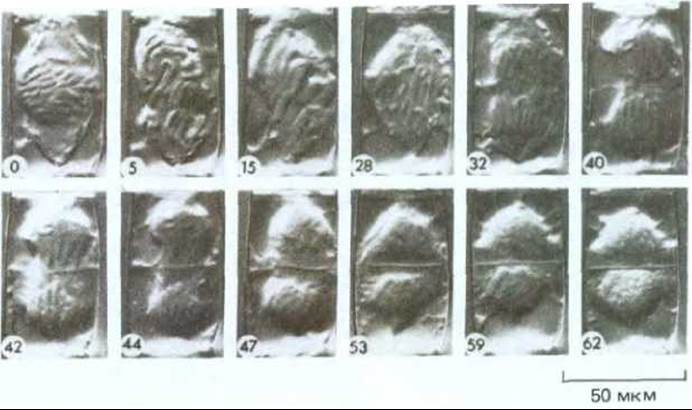
Рис. 20-41. Серия последовательных световых микрофотографий делящейся клетки тычиночного волоска. Цифрами указано время в минутах, прошедшее с момента начала съемки. Пузырьки, слияние которых приводит к образованию клеточной пластинки, становятся различимыми к 42-й минуте. Пластинка постепенно расширяется и в конце концов сливается со стенкой материнской клетки. (С любезного разрешения P. Herler.)
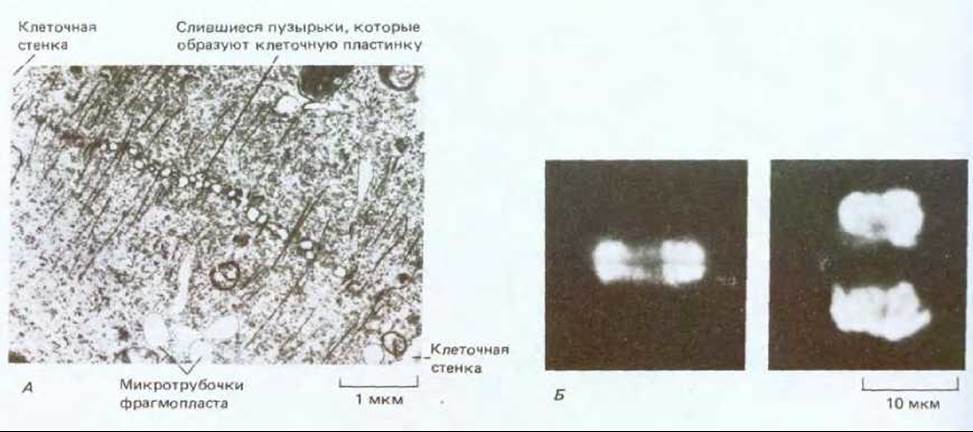
Рис. 20-42. А. Электронная микрофотография фрагмопласта в делящейся клетке растения. Микротрубочки направляют движение пузырьков, содержащих предшественники клеточной стенки, к растущей клеточной пластинке. Подробности см. на рис. 13-71. Б. Флуоресцентные микрофотографии цитокинеза клеток из кончика корня лука. Окрашивание флуоресцирующими антителами позволяет выявить развивающуюся клеточную пластинку и два набора микротрубочек фрагмопласта, располагающихся по бокам этой пластинки (слева); флуоресцентное окрашивание ДНК (справа) дает возможность увидеть расположение двух дочерних ядер, которые будут разделены новой клеточной стенкой. (А - с любезного разрешения J. Pickett-Heaps.)
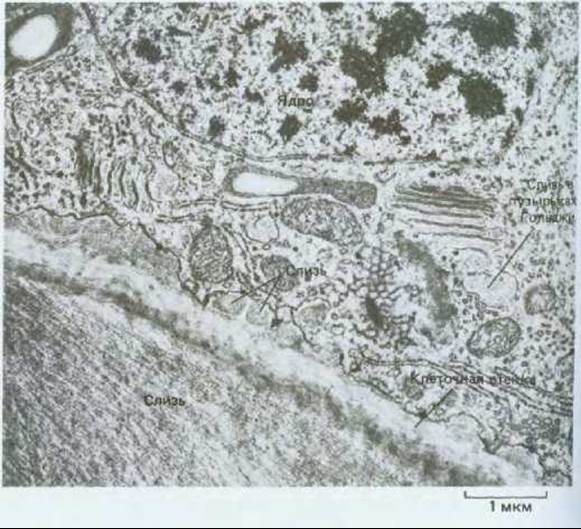
Рис. 20-43. Электронная микрофотография клетки корневого чехлика тимофеевки. В таких клетках аппарат Гольджи занят главным образом выработкой и секрецией слизи, которая, выделяясь на поверхности кончика корня, облегчает его продвижение в почве. Материал, идентичный содержимому цистерн Гольджи, можно видеть также в пузырьках и у наружной поверхности плазматической мембраны. (В. Gunning, M. Steer, Ultrastucture and the Biology of Plant Cells. London: Arnold, 1975.)
Не все полисахариды, образуемые и секретируемые аппаратом Гольджи, предназначены для формирования клеточной стенки. Например, обогащенная фруктозой слизь, секретируемая клетками кончика корня, проходит через клеточную стенку и служит смазкой наружной поверхности корня при его продвижении через почву (рис. 20-43).
20.4.5. В процессе жидкофазного эндоцитоза происходит быстрое рециклирование мембран [22]
Что происходит с большим количеством нового мембранного материала, который добавляется к уже имеющейся плазматической мембране, в ходе все новых слияний с пузырьками? В некоторых, активно секретирующих клетках растений, число транспортных пузырьков аппарата Гольджи, участвующих в экзоцитозе, таково, что поверхность мембраны должна была бы удваиваться каждые 20 мин. Очевидно, однако, что плазматическая мембрана имеет постоянную площадь поверхности и, следовательно, существует какой-то механизм оборота мембранного материала. В плазматической мембране клеток растений существуют многочисленные окаймленные ямки (рис. 20-44, А). Полагают, что они участвуют в рециклировании мембраны, как это имеет место в клетках животных (см. разд. 6.5.4). Подобный путь жидкофазного эндоцитоза недавно был обнаружен у растительных клеток при анализе поглощения протопластами электроноплотных маркеров, таких как ферритин или коллоидное золото. Эти маркеры, введенные в протопласты, быстро попадали в сложную сеть мембранных трубочек, которые были названы частично покрытым (окаймленным) ретикулумом (рис. 20-44, Б и В). Полагают, что эта органелла функционально эквивалентна эндосомному компартменту клеток животных (см. разд. 6.5.4). Отсюда маркер попадает в крупные пузырьки и в конечном счете оказывается в вакуоли. Таким образом, основные внутриклеточные пути синтеза метаболитов, их сортировка, упаковка, секреция и эндоцитоз весьма сходны в клетках растений и животных.
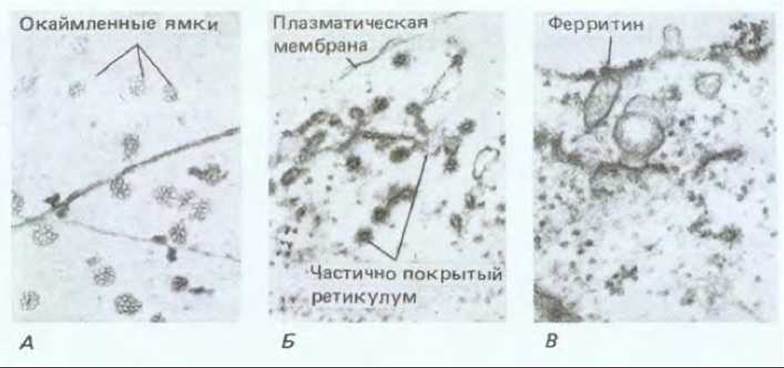
Рис. 20-44. Эндоцитоз в протопластах сои, наблюдаемый с помощью электронной микроскопии. А. Вид плазматической мембраны со стороны цитоплазмы. Протопласт прикрепляли к сеточке для электронной микроскопии и затем лизировали, промывали и негативно окрашивали. Кроме выстланных мембраной многочисленных ямок, которые участвуют в эндоцитозе, видны микротрубочки, лежащие в кортикальном слое. Б. «Частично покрытый ретикулум», видимый на тонких срезах. Он состоит из сложной системы связанных с мембраной трубочек с многочисленными пузырьками, покрытыми клатрином, которые образуются из этой мембраны. Полагают, что это эквивалент эндосомального компартмента клеток животных. В. Вещество, захваченное при эндоцитозе, в данном случае электроноплотный маркер ферритин, впервые появляется в частично покрытом ретикулуме. (С любезного разрешения L. Fowke.)
20.4.6. Синтез целлюлозы происходит на поверхности растительных клеток [23]
Полисахариды клеточной стенки обычно образуются в аппарате Гольджи и выводятся путем экзоцитоза. Однако из этого правила есть одно важное исключение: целлюлоза у большинства растений синтезируется на внешней поверхности клеток с помощью мембраносвязанного ферментного комплекса (целлюлозосинтазы), субстратом для которого служит соединение сахара с нуклеотидом, вероятно UDP-глюкоза. Новообразованные целлюлозные цепи спонтанно объединяются в микрофибриллы, образующие слой на поверхности плазматической мембраны (ламеллу), в которой все микрофибриллы ориентированы приблизительно одинаково. Поскольку целлюлоза синтезируется на плазматической мембране, каждая новая ламелла образуется под предыдущей. В результате клеточная стенка состоит из концентрически расположенных ламелл, самая старая из которых находится снаружи.
Несмотря на многократные попытки, синтез целлюлозы не удалось воспроизвести in vitro. Вероятно, отчасти это связано с тем, что для реакции необходимо присутствие функционально интактной плазматической мембраны. На электронных микрофотографиях сколов замороженных клеток высших растений видны «розетки», состоящие из внутримембранных частиц, которые расположены на цитоплазматической стороне скола. Эти розетки скорее всего представляют собой целлюлозосинтазные комплексы, поскольку они локализуются в областях, где откладываются новые целлюлозные микрофибриллы, например в мембране, покрывающей упорядоченные утолщения клеточной стенки в молодых клетках сосудов ксилемы (рис. 20-45, см. также разд. 20.1.7).
20.4.7. Форма растущей растительной клетки определяется организацией целлюлозных микрофибрилл [24]
Окончательная форма каждой растущей клетки, а в итоге и форма всего растения, определяется растяжением клетки, которое находится под строгим контролем. Как уже отмечалось выше (см. разд. 20.1.5), растяжение является результатом тургорного давления и пластичности стенки. Однако вопрос о том, каким образом такое ненаправленное давление способно вызвать направленное удлинение клетки, пока не затрагивался. В боковых стенках увеличивающейся клетки микрофибриллы, отложенные последними, обычно перпендикулярны оси удлинения. При этом клетка обволакивается ламеллой, в которой микрофибриллы располагаются по спирали. Хотя ориентация отложенных ранее микрофибрилл в наружной ламелле может быть иной, именно от ориентации волокон в этой внутренней ламелле преимущественно зависит направление роста клетки.
Если микрофибриллы целлюлозы во вновь образованной ламелле ориентированы поперечно, они будут ограничивать расширение клетки; однако в связи с тем, что соседние целлюлозные микрофибриллы внутри ламеллы могут отделяться одна от другой под действием тургорного давления, клетка будет растягиваться (рис. 20-46). Чтобы существующая клеточная стенка сохраняла свою прочность и толщину, по мере роста клетки, к уже имеющейся клеточной стенке необходимо добавлять все новые компоненты матрикса и микрофибриллы. Вновь секретируемые компоненты матрикса, вероятно, проникают через толщу стенки, а дополнительные микрофибриллы откладываются в новой ламелле на наружной поверхности плазматической мембраны.
Таким образом, будущая морфология растительных клеток предопределяется ходом образования первичной клеточной стенки. До сих пор точно неизвестно, каким образом определяется тонкая структура всех компонентов клеточной стенки, однако, по всей вероятности, отложение целлюлозы зависит от расположения кортикальных микротрубочек.
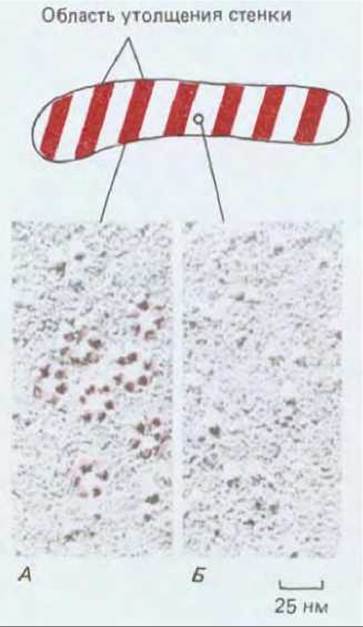
Рис. 20-45. Электронная микрофотография плазматической мембраны развивающегося сосудистого элемента ксилемы в корне перечника (препарат получен методом замораживания-скалывания). Гексагональные группировки белков в мембране («розетки») сконцентрированы в местах, где клеточная стенка утолщается (А) и встречаются реже в местах между утолщениями (Б). Предполагают, что «розетки» представляют собой комплексы целлюлозосинтазы. Каждый из этих комплексов, по-видимому, синтезирует от 60 до 70 цепей целлюлозы, входящих в состав каждой микрофибриллы. (С любезного разрешения W. Herth.)
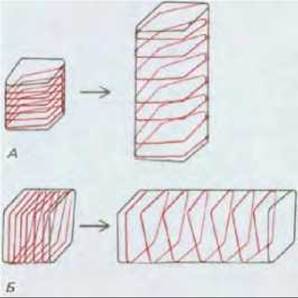
Рис. 20-46. На этой схеме показано, как ориентация целлюлозных микрофибрилл в клеточной стенке влияет на направление, в котором происходит удлинение клетки. Клетки, изображенные на рисунке А и Б, изначально имеют одинаковую форму, но разную ориентацию целлюлозных микрофибрилл. В результате ослабления клеточной стенки и тургорного давления каждая клетка растягивается в направлении, перпендикулярном ориентации микрофибрилл. В свою очередь, конечная форма такого органа, как побег, сильно зависит от того, в каком направлении растягиваются клетки, входящие в его состав. Хотя создается впечатление, что фибриллы имеют форму обруча, многочисленные исследования показали, что они намотаны по спирали, как показано на рисунке.
20.4.8. Ориентацию целлюлозных микрофибрилл, откладывающихся на клеточной поверхности, определяют микротрубочки в кортикальном слое [25]
Ориентация целлюлозных микрофибрилл играет решающую роль в определении формы растительных клеток. Но от чего зависит их расположение? Ответ на этот вопрос был подсказан тем фактом, что большинство микротрубочек в кортикальном слое цитоплазмы ориентировано также, как и целлюлозные микрофибриллы, образующиеся в данное время в данном участке клетки.
Кортикальные микротрубочки лежат вблизи внутренней поверхности плазматической мембраны и направлены, как правило, перпендикулярно длинной оси клетки (рис. 20-47). При изучении этой области методом иммунофлуоресцентной микроскопии оказалось, что система перекрывающихся микротрубочек окружает внутренность клетки сплошным упорядоченным слоем (рис. 20-48). Микротрубочки прикреплены к плазматической мембране белками, природа которых еще плохо изучена.
Согласованная ориентация микротрубочек, расположенных у внутренней поверхности плазматической мембраны и целлюлозных микрофибрилл, образующихся на ее наружной стороне, характерна для многих клеток различного типа и разной формы. Это явление наблюдается при формировании как первичной, так и вторичной клеточной стенки (рис. 20-49), в частности при локальном отложении дополнительных слоев, когда, например, образуются утолщения в определенных участках поверхности клеток ксилемы (см. рис. 20-15).
А что произойдет, если деполимеризовать все микротрубочки кортикальной системы, обработав растительную ткань колхицином? Влияние такой обработки на последующее отложение целлюлозы не столь однозначно, как можно было бы ожидать. Колхицин не подавляет образование новых целлюлозных микрофибрилл, и в некоторых случаях клетки могут продолжать откладывать микрофибриллы, ориентированные в прежнем направлении. Однако любые изменения в расположении микрофибрилл в ходе индивидуального развития, которые обычно происходят при откладывании следующих друг за другом ламелл, становятся невозможными. Кроме того, клетка, которая в норме для формирования сосуда ксилемы должна производить упорядоченное утолщение стенки, вместо этого в присутствии вещества, деполимеризующего микротрубочки, начинает откладывать материал стенки совершенно хаотично (рис. 20-50). Таким образом, ранее существовавшая ориентация микрофибрилл может сохраняться и без микротрубочек, но любая стадия клеточного развития, связанная с отложением микрофибрилл, ориентированных по-иному, требует присутствия интактных микротрубочек, определяющих эту новую ориентацию.
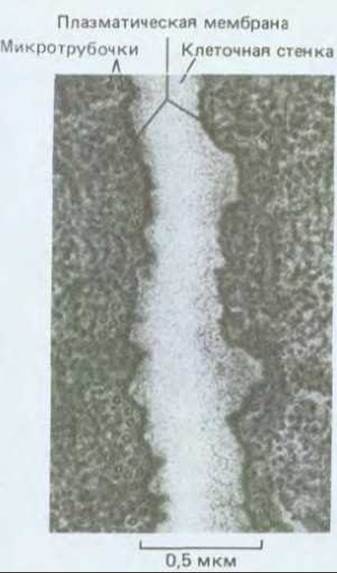
Рис. 20-47. Электронная микрофотография зоны контакта двух соседних клеток кончика корня пшеницы. Видны многочисленные кортикальные микротрубочки, типичные для интерфазных клеток.
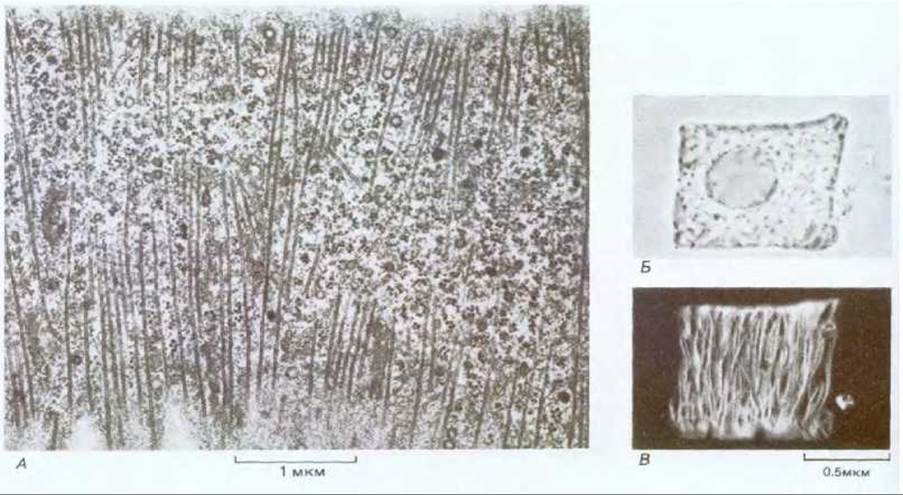
Рис. 20-48. Расположение кортикальных микротрубочек. А. Тангенциальный срез клетки из кончика корня тимофеевки. Видны кортикальные микротрубочки, лежащие непосредственно под плазматической мембраной; они расположены под прямым углом к продольной оси клетки. Б. Отдельная клетка кончика корня лука. В. Та же клетка, окрашенная флуоресцирующими антителами, эта обработка позволяет выявить характер расположения микротрубочек. (А - с любезного разрешения В. Gunning; Б и В - с любезного разрешения К. Goodbody.)

Рис. 20-49. Микротрубочки и целлюлозные микрофибриллы в развивающихся волокнах хлопка. Микротрубочки (А) окрашены флуоресцирующими антителами и располагаются по спирали. Клетка «расплющена», благодаря чему видны части спирали как на передней, так и на задней стенке. Вновь отложенные целлюлозные микрофибриллы в такой же клетке (Б) окрашены красителем калькофлюором белым, который при связывании с растущими молекулами целлюлозы дает свечение. Микрофибриллы, подобно укрепляющему корду садового шланга, делают стенки хлопкового волокна очень прочными. (С любезного разрешения R. Seagull.)
Полагают, что комплексы, синтезирующие целлюлозу и находящиеся в плазматической мембране, вращаются вокруг длинных молекул целлюлозы. По мере биосинтеза и самосборки, т. е. процессов, которые протекают одновременно, дистальный конец микрофибриллы, вероятно, образует поперечные сшивки с ранее отложенным слоем стенки. Следовательно, на растущем проксимальном конце синтазные комплексы должны продвигаться вдоль мембраны в направлении синтеза. Можно предположить два механизма воздействия микротрубочек на направление этого движения, а следовательно, и на ориентацию микрофибрилл. Цитоплазматический домен целлюлозосинтазного комплекса может быть прямо или косвенно связан с микротрубочками, лежащими в кортикальном слое. Согласно другой гипотезе, микротрубочки, подобно берегам канала, направляют движение синтазных комплексов параллельно определенной оси (рис. 20-51). В данном случае интенсивность синтеза целлюлозы не зависит от микротрубочек; они лишь определяют те участки мембраны, внутри которых может продвигаться ферментативный комплекс. Остается неизвестным как контролируется расположение микротрубочек в кортикальном слое. Напомним, что цитоскелет животной клетки тоже определяет ориентацию компонентов внеклеточного матрикса, а белки типа коллагена и фибронектина откладываются клетками в тесной взаимосвязи с их плазматической мембраной см. разд. 14.2.18).

Рис. 20-50. Регулярная картина утолщений клеточной стенки, создающаяся при нормальной дифференцировке клеток ксилемы (А), определяется наличием упорядоченных ансамблей кортикальных микротрубочек. В присутствии колхицина кортикальные микротрубочки деполимеризуются, и это ведет к неупорядоченному образованию утолщений (Б).
20.4.9. В крупных растительных клетках различные материалы перемещаются с ориентированным током цитоплазмы [26]
Клеточный метаболизм требует того, чтобы субстраты, промежуточные продукты, кофакторы, сигнальные молекулы и ферменты могли перемещаться из одной части клетки в другую. В мелких клетках, таких как бактерии или даже большинство животных клеток, диффузия дает возможность низкомолекулярным растворенным веществам в доли секунды преодолевать расстояния, сравнимые с размерами самой клетки. Однако растительные клетки благодаря наличию у них клеточной стенки, вакуолей и тургора могут достигать весьма крупных размеров: обычно их длина превышает 100 мкм, а в отдельных случаях измеряется миллиметрами и даже сантиметрами. Диффузия здесь относительно неэффективна, так как время, необходимое какой-либо молекуле для достижения пункта своего назначения с помощью лишь диффузии, пропорционально квадрату расстояния до этого места (см. разд. 3.1.3). Между тем некоторые клетки взрослого растения могут быть значительно удалены от источника кислорода и питательных веществ. Поэтому неудивительно, что в крупных растительных клетках существуют интенсивные токи цитоплазмы, перемешивающие ее компоненты и обеспечивающие их быструю циркуляцию.
Изучение живых растительных клеток показало, что чем крупнее клетка, тем активнее движется ее цитоплазма. Для мелких клеток характерны скачкообразные перемещения органелл - сальтации (от лат. saltare - танцевать, прыгать). Как и в животных клетках, цитоплазматические частицы передвигаются здесь так, будто они время от времени получают сильный толчок в определенном направлении. В более крупных клетках растений такое перемещение уже носит частично направленный характер, а в клетках, где цитоплазма образует лишь тонкий слой вокруг гигантской центральной ваколи, часто можно наблюдать почти непрерывное круговое перемещение цитоплазмы со скоростью несколько микрометров в секунду. В гигантских клетках зеленой водоросли Nitella полярность актиновых филаментов кортикального слоя такова, что перемещение вдоль них других - миозиновых - филаментов могло бы создать направленный ток цитоплазмы. Вполне возможно, что он способствует не только внутриклеточному передвижению органелл, но также и межклеточному транспорту растворенных веществ к отверстиям плазмодесм, соединяющих соседние клетки.
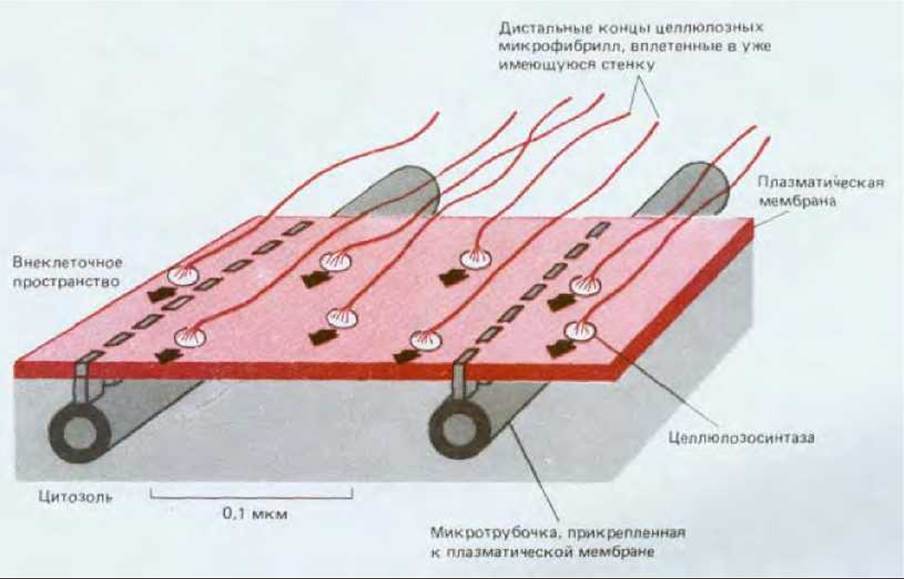
Рис. 20-51. Простая схема, объясняющая каким образом ориентация микротрубочек в кортикальном слое может определять ориентацию новообразованных микрофибрилл. Крупные целлюлозосинтазные комплексы представляют собой составную часть белков мембраны и осуществляют сборку микрофибрилл на наружной поверхности плазматической мембраны. В связи с тем что дистальные концы жестких микрофибрилл входят в состав стенки, их элонгация на проксимальном конце вызывает проталкивание синтазного комплекса вдоль плоскости мембраны. Поскольку микротрубочки прикреплены к плазматической мембране таким образом, что весь комплекс оказывается связанным только с некоторыми каналами мембраны, ориентация микро-трубочек может определять ось, вдоль которой откладываются микрофибриллы.

Рис. 20-52. Тычинки из цветков традесканции покрыты длинными тонкими волосками, каждый из которых состоит из одного ряда крупных клеток. Световые микрофотографии, полученные с интервалом в 5 с, выявляют быстрый ток по цитоплазматическим тяжам, которые пересекают вакуоль. Органеллы по таким тяжам передвигаются со скоростью до 5 мкм/с.
Тонкие прозрачные клетки, образующие волоски на поверхности растений, - очень удобный объект для наблюдения движений цитоплазмы. В такой клетке присутствует большая вакуоль, через которую проходят тонкие тяжи цитоплазмы диаметром около 1 мкм (рис. 20-52). Можно наблюдать как через эти тяжи «проплывают» отдельные частицы, например митохондрии. Похоже, что такие тяжи, содержащие пучки актиновых филаментов, но, по-видимому, лишенные микротрубочек, возникают в области, прилежащей к клеточному ядру (рис. 20-53). Можно наблюдать, как эти тяжи постоянно изменяют свою форму и расположение, исчезая, разветвляясь, слипаясь и образуясь заново.
20.4.10. Цитоскелет растительной клетки реагирует на внеклеточные сигналы [27]
Для растительных клеток, ограниченных клеточной стенкой, большое значение имеют едва различимые ответы на изменения окружающей среды, в особенности на свет. Как уже отмечалось выше, изменения в направлении роста растительной клетки часто зависят от цитоскелета, поэтому неудивительно, что и актин, и микротрубочки, входящие в состав цитоскелета, весьма сложным образом реагируют на внешние разражители.
Многие клетки растений способны отвечать на изменения интенсивности и направления света, меняя расположение своих хлоропластов. При слабой освещенности хлоропласты стремятся выстроиться в монослой, перпендикулярно источнику света и таким образом до предела увеличивают поглощение света. Высокие уровни освещенности индуцируют перемещение хлоропластов и их выстраивание вдоль клеточных стенок, параллельных падающим лучам, что уменьшает действие света (рис. 20-54). Молекулярный механизм такого передвижения изучался на примере весьма необычной водоросли. Mougeotia - это зеленая водоросль, у которой в каждой клетке цилиндрической формы имеется только один плоский хлоропласт. При изменении условий освещения хлоропласт поворачивается и изменяет свою ориентацию таким образом, чтобы лежать вдоль падающих лучей или перпендикулярно к ним в зависимости от силы света. В качестве фоторецепторов, индуцирующих подобный ответ, выступают фитохром (см. разд. 20.5.7) и рецептор синего света, расположенный либо на плазматической мембране, либо непосредственно рядом с ней. Освещение этих рецепторов микропучками света приводит к притоку ионов Са2+ (соответствующий механизм пока не изучен), Са2+ связывается с кальмодулином, который в свою очередь активирует сеть актиновых филаментов, прикрепленных как к наружной мембране оболочки хлоропласта, так и к плазматической мембране, которая принимает участие в повороте пластиды. Если направленным микропучком света осветить лишь малую часть клетки, то изгибаться будет лишь освещенная часть хлоропласта. Следовательно, разные участки активного скелета в одной и той же клетке могут реагировать независимо друг от друга (рис. 20-55).
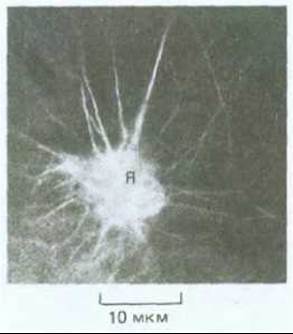
Рис. 20-53. Флуоресцентная микрофотография небольшой части крупной вакуолизированной клетки стебля. Видны пучки актиновых филаментов в тяжах, пересекающих вакуоль. Клетку окрашивали фаллоидином (меченным родамином)-соединением, которое прочно и специфически связывается с актиновыми филаментами. Полагают, что пучки актина, расходящиеся из области ядра (Я), имеют отношение к быстрому току цитоплазмы, который характерен для крупных вакуолизированных клеток высших растений. Вероятно, в этом каким-то образом участвует и миозин.
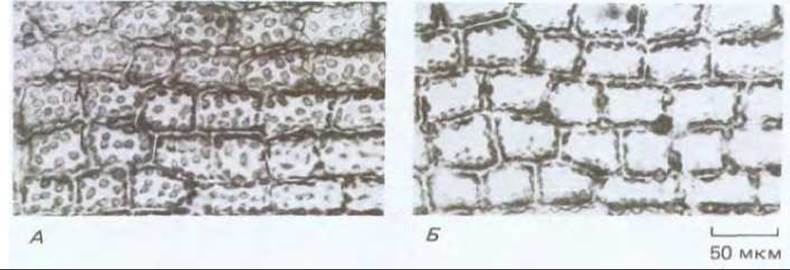
Рис. 20-54. Световая микрофотография клеток листа у мха, на которой видно как происходит перемещение хлоропластов при изменении условий освещения. Световой поток направлен перпендикулярно к плоскости препарата. А. При слабом освещении дискообразные хлоропласты располагаются таким образом, чтобы поглощение света было максимальным. В. После 30-минутной экспозиции того же участка листа на ярком свету хлоропласты переместились и расположены теперь у клеточных стенок, параллельных падающим лучам.
Расположение микротрубочек в кортикальном слое также быстро меняется в ответ на внешние раздражители. Как уже обсуждалось выше, форма растительной клетки (а значит и форма растения) зависит от упорядоченного отложения ориентированных слоев целлюлозы, причем наиболее важной является ориентация самого нижнего слоя (см. разд. 20.4.7). Наружные слои целлюлозы в клеточной стенке часто имеют ориентацию, отличную от ориентации более поздних, внутренних слоев. Существуют по меньшей мере два механизма, благодаря которым новый и старый слои могут быть ориентированы по-разному. По-видимому, оба они функционируют в растительных клетках: 1) целлюлозные микрофибриллы в более старых слоях стенки могут перестраиваться относительно друг друга по мере их продвижения в наружный ряд, причем происходит разрыв и новое образование связей, которые соединяют полисахариды, входящие в состав стенки и 2) на плазматической мембране в стенку могут откладываться новые слои, которые имеют иную ориентацию, чем наружные.
Поскольку ориентация отложений в новой клеточной стенке связана с расположением микротрубочек в кортикальном слое, любые изменения в одной структуре влекут за собой изменения в другой. Таким образом, для функционирования второго механизма необходимо изменение ориентации микротрубочек. Подобные динамические изменения в спиральном расположении микротрубочек можно наблюдать непосредственно. Например, такие регуляторы роста растений, как этилен и гибберелловая кислота, обладают противоположным действием на ориентацию микротрубочек (а следовательно, и направление роста клеток) в клетках эпидермиса молодых побегов гороха. Гибберелловая кислота «заставляет» кортикальные микротрубочки располагаться перпендикулярно продольной оси клетки. При этом целлюлоза откладывается таким образом, что клетки могут только удлиняться, образуя тонкие удлиненные побеги. Однако, если эти побеги обработать этиленом, микротрубочки за час переориентируются и лягут вдоль продольной оси клетки. Отложение целлюлозы в этом направлении приведет к тому, что клетки начнут растягиваться в ширину, в результате чего образуются толстые укороченные побеги (рис. 20-56). Молекулярные механизмы, определяющие подобные резкие перестройки цитоскелета, все еще неясны.
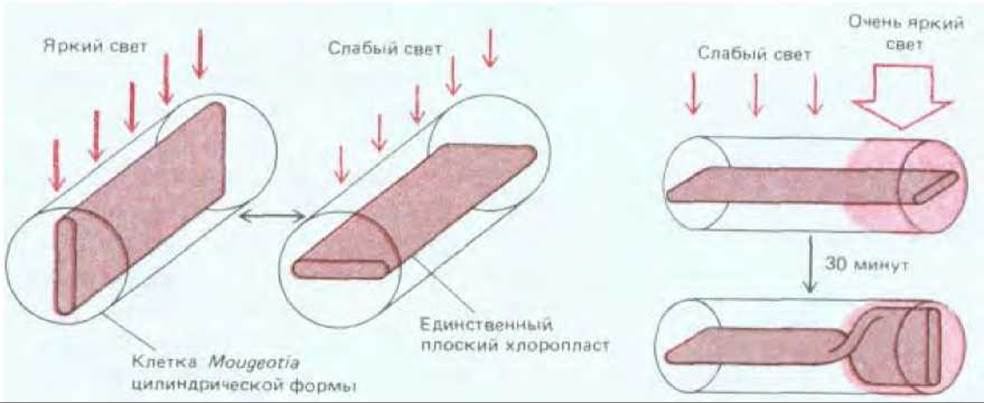
Рис. 20-55. Схема, иллюстрирующая движения хлоропласта в клетке зеленой водоросли Mougeotia. Цилиндрические клетки этой водоросли содержат один-единственный хлоропласт плоской формы, который поворачивается в соответствии с условиями освещения, регулируя тем самым количество поглощаемого света (А). Часть хлоропласта, на которую падает очень яркий свет, способна изменить свою ориентацию независимо от остальной его части, что указывает на локальный механизм реакции (Б).
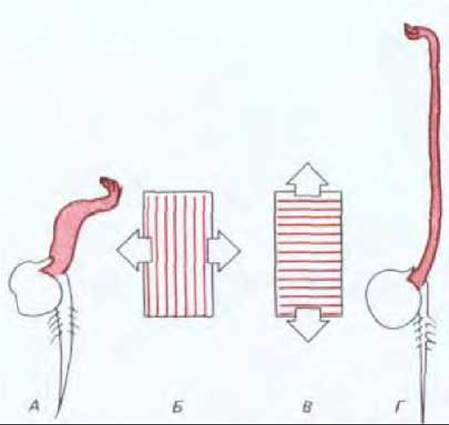
Рис. 20-56. Этилен и гибберелловая кислота (регуляторы роста растений) оказывают противоположное воздействие на ориентацию кортикальных микротрубочек в клетках молодых побегов гороха. В большинстве клеток, обработанных этиленом (Б), обнаруживается исключительно продольная ориентация микротрубочек, тогда как большинство клеток, обработанных гибберелловой кислотой (В), имеет исключительно поперечную ориентацию микротрубочек. Новые микрофибриллы целлюлозы откладываются параллельно микротрубочкам. Так как все это влияет на направление растяжения клетки, гибберелловая кислота и этилен стимулируют рост в противоположных направлениях: проростки, обработанные этиленом, развивают короткие толстые побеги (А), а проростки, обработанные гибберелловой кислотой, образуют длинные тонкие побеги (Г).
Заключение
Два типа органелл — пластиды и вакуоли - свойственны только растительным клеткам. К пластидам относятся разнообразные органеллы, обладающие одинаковым геномом. Среди них наиболее известны фотосинтезирующие хлоропласты, присутствующие во всех зеленых тканях. Вакуоль представляет собой крупную внутриклеточную полость, заполненную водным раствором того или иного состава и ограниченную мембраной, называемой тонопластом. Растительные клетки используют вакуоли в самых разных целях, например для экономного заполнения внутриклеточного пространства при росте, для хранения запасов питательных веществ или для накопления вредных продуктов обмена. Хотя сами растительные клетки не обладают способностью двигаться, их цитоплазма, особенно в клетках с большими вакуолями, постоянно перемешивается в результате поддерживаемых в ней направленных потоков. Показано, что в некоторых случаях движение цитоплазмы связано с функцией цитоплазматических актиновых филаментов.
Внутренняя организация растительной клетки и ее цитоскелет играют важную роль в формировании клеточной стенки, что, в свою очередь, определяет направление роста клетки и, следовательно, ее форму. Компоненты матрикса клеточной стенки вырабатываются и экспортируются аппаратом Гольджи, а целлюлозные микрофибриллы синтезируются непосредственно на поверхности клетки. Как места отложения различных компонентов стенки, так и ориентация целлюлозных фибрилл определяются микротрубочками кортикального слоя цитоплазмы. Элементы цитоскелета способны быстро реагировать на различные внешние стимулы, что может, например, приводить к перемещению хлоропластов под влиянием света.