Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Рак
Рак как микроэволюционный процесс
Организм животного можно рассматривать как сообщество или экосистему, где в роли особей оказываются клетки, размножающиеся делением и организованные в объединенные совместной деятельностью конгломераты или ткани. Ранее, при обсуждении функционирования тканей мы выступали в роли «экологов»: нас интересовали рождение и смерть клеток, места их обитания, территориальные ограничения, поддержание размеров популяции и т. п. Речь шла лишь об одном важном экологическом понятии - естественном отборе; о мутациях и конкуренции среди соматических клеток мы умалчивали. Причина здесь заключается в том, что здоровый организм представляет собой весьма специфическое сообщество клеток, в котором преобладание альтруистических тенденций над конкуренцией является правилом для всех типов клеток, кроме одного: любые соматические клетки обречены на умирание без потомства, однако самим своим существованием они обеспечивают сохранение половых клеток - единственных, кто имеет шанс выжить и продолжить себя в потомстве. В этом нет парадокса, поскольку организм является клоном и генотипы соматических и половых клеток идентичны: жертвуя собой ради блага половых клеток, соматические клетки способствуют распространению копий собственных генов.
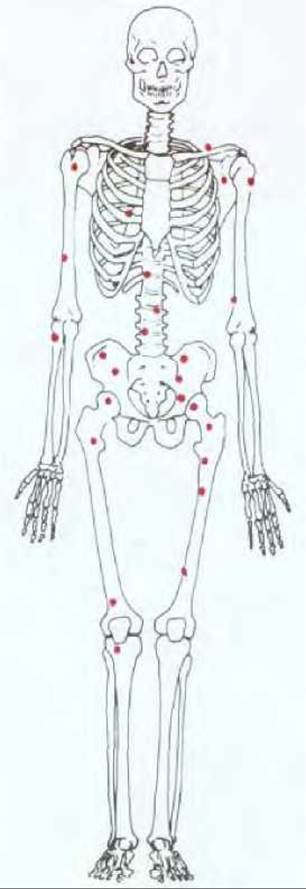
Рис. 21-1. Злокачественные опухоли, как правило, дают начало метастазам (вторичным опухолям), что, собственно, и делает рак столь трудно излечимым. На рисунке изображены те участки костного мозга, где, как правило, обнаруживаются очаги метастазирования при карциноме предстательной железы. (Union International Centre of Cancer, TNM Atlas: Illustrated Guide to the Classification of Malignant Tumors, 2nd ed. Berlin: Springer, 1986.)
Итак, в отличие от свободноживущих клеток (например, бактерий), между которыми происходит постоянная конкуренция в борьбе за выживание, клетки многоклеточного организма обречены на сотрудничество. В этой ситуации любая мутация, которая порождает отход от альтруистического поведения у отдельных членов подобного «кооператива», ставит под угрозу само его существование. Поэтому мутации, конкуренция и естественный отбор, начинающие работать внутри популяции соматических клеток - признаки патологии. Как раз такой тип патологии и имеет место при раке; последний представляет собой заболевание, при котором отдельные клетки стремятся лишь к собственному процветанию в ущерб соседям, но в конце концов разрушают все клеточное сообщество и погибают вместе с ним.
В этом разделе мы рассмотрим развитие рака как микроэволюционный процесс, протекающий в популяции клеток организма и длящийся месяцы и годы, но подчиняющийся тем же факторам - мутациям и естественному отбору, которые управляют долговременной эволюцией всех живых организмов.
21.1.1. Опухоли различаются в соответствии с типом клеток, из которого они происходят [2]
Раковые клетки характеризуются двумя «врожденными» свойствами, которые сохраняются и у их потомства: во-первых, они размножаются без тех ограничений, которые имеют силу для нормальных клеток, и, во-вторых, они захватывают и заполняют в организме места, предназначенные в норме для других клеток. Именно комбинация этих черт делает рак особенно опасным. Отдельная дефектная клетка, размножающаяся не быстрее, чем ее нормальные соседи, принесет немного вреда, какими бы неприятными особенностями она ни обладала, но если ее пролиферация выходит из-под контроля, она дает начало опухоли, или неоплазме - неотвратимо растущей массе аномальных клеток. В том случае, если они остаются компактным скоплением, опухоль считается доброкачественной, и хирургическое удаление ее обычно приводит к полному излечению. Раковой же называют опухоль злокачественную, клетки которой способны проникать в окружающие ткани. Инвазивность обычно означает способность разрушать барьеры, проникать в кровяное русло и лимфатические сосуды и формировать вторичные опухоли (метастазы) в различных частях тела (рис. 21-1). Чем более обширные метастазы дает рак, тем труднее от него избавиться. Раковые опухоли классифицируют в соответствии с той тканью и типом клеток, откуда они берут начало. Те из них, которые имеют эпидермальное происхождение, называют карциномами, соединительнотканное или мышечное - саркомами. Типы злокачественных новообразований, не попадающие в эти две обширные категории, включают различные формы лейкозов, возникающие из кроветворных клеток, и опухоли, ведущие начало от клеток нервной системы. В табл. 21-1 приведены частота заболеваемости и смертности для наиболее обычных в США типов рака. Каждая категория подразделяется на множество групп в соответствии со специфическим типом клеток, локализацией в организме и структурой опухоли; при этом многие названия являются традиционными и не имеют современной рациональной основы. Параллельно с набором названий для злокачественных опухолей существуют родственные термины для обозначения опухолей доброкачественных: примером может служить аденома - доброкачественная опухоль железистых органов и слизистых оболочек, выстланных кубическим или призматическим эпителием, которой соответствует злокачественная опухоль - аденокарцинома (рис. 21-2). Хондрома и хондросаркома - соответственно доброкачественная и злокачественная опухоли хрящевой ткани. Около 90% злокачественных опухолей у человека относится к карциномам, что связано, видимо, как с высокой пролиферативной активностью эпителиальных тканей, так и с тем, что последние чаще других подвергаются вредным физическим и химическим влияниям, способствующим возникновению малигнизации.
Таблица 21-1. Заболеваемость раком и смертность от рака в США, 1986
|
Вид рака |
Число новых случаев за год |
Число смертей за год |
|
Всего |
930000 |
472 000 |
|
Рак эпителиального происхождения |
789000 (85%) |
381400 (81%) |
|
(карциномы) |
||
|
Ротовая полость и глотка |
29 500 (3%) |
9400 (2%) |
|
Органы пищеварения (в целом) |
217800 (23%) |
119700 (25%) |
|
Толстый кишечник, включая прямую кишку |
130000 (14%) |
60000 (13%) |
|
Поджелудочная железа |
25500 (3%) |
24000 (5%) |
|
Желудок |
24700 (3%) |
14300 (3%) |
|
Печень и желчные пути |
13600 (1%) |
10600 (2%) |
|
Дыхательная система (в целом) |
164500 (18%) |
135400 (29%) |
|
Легкие |
149000 (16%) |
130100 (28%) |
|
Молочные железы |
123900 (13%) |
40200 (9%) |
|
Кожа (в целом) |
> 4000001) |
7500 (2%) |
|
Злокачественная меланома |
23 000 (2%) |
5600 (1%) |
|
Репродуктивная система (в целом) |
169800 (18%) |
49400 (10%) |
|
Предстательная железа |
90000 (10%) |
26 100 (6%) |
|
Яичники |
19000 (2%) |
11600 (2%) |
|
Шейка матки |
14000 (2%) |
6800 (1%) |
|
Матка (эндометрий) |
36000 (4%) |
2900 (1%) |
|
Выделительная система (в целом) |
60 500 (7%) |
19800 (4%) |
|
Мочевой пузырь |
40 500 (4%) |
10600 (2%) |
|
Рак кроветворной и иммунной системы: лейкозы и лимфомы |
70 100 (8%) |
41 100 (9%) |
|
Рак центральной нервной системы и глаза: глиомы, ретинобластома и др. |
15600 (2%) |
10600 (2%) |
|
Рак соединительной ткани мышц и сосудистой системы: саркомы |
7100 (1%) |
4200 (1%) |
|
Все прочие случаи рака, включая рак не выясненного происхождения |
48200 (5%) |
34800 (7%) |
1) Сюда не включается рак кожи немеланомного происхождения, так как большинство случаев излечивается легко и многие даже не регистрируются.
Наибольший вклад в общемировую статистику дают пять групп раковых заболеваний: легких, желудка, молочной железы, толстого кишечника (включая прямую кишку), шейки матки, а всего ежегодно регистрируются уже свыше 6 млн. новых случаев рака. Обратите внимание на то, что умирает от рака лишь около половины заболевших. (Данные для США: American Cancer Society, Cancer Facts and Figures, 1986.)
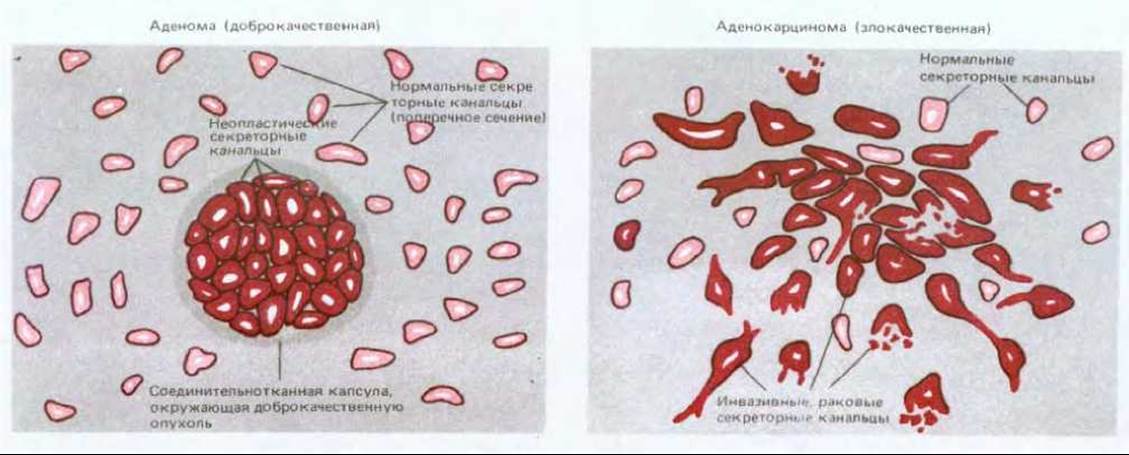
Рис. 21-2. Аденома (доброкачественная опухоль железистой ткани) и аденокарцинома (соответствующая злокачественная опухоль) резко различаются между собой. Существует множество разновидностей этих опухолей; здесь схематически изображены те из них, которые поражают молочную железу.
Каждая раковая опухоль имеет свои характерные черты и особенности, отражающие ее происхождение. Например, клетки эпидермальной базальноклеточной карциномы, возникшие из стволовой клетки кератиноцита, обычно продолжают синтезировать цитокератиновые промежуточные филаменты, тогда как возникшие из пигментных клеток кожи клетки меланомы часто, хотя и не всегда, образуют пигментные гранулы. Вообще говоря, раковые опухоли различного клеточного происхождения являются совершенно различными болезнями. В рассмотренном примере базальноклеточный рак лишь локально инвазивен и редко образует метастазы, меланома же гораздо более злокачественна и быстро дает начало многочисленным метастазам (такое поведение напоминает склонность к миграции предшественников нормальных пигментных клеток в онотогенезе - см. разд. 16.6.5). Хирургическое удаление базальноклеточного рака обычно не встречает затруднений и ведет к полному излечению, в то время как злокачественную меланому, начавшую давать метастазы, зачастую ликвидировать невозможно, и летальный исход неизбежен.
21.1.2. В большинстве случаев раковая опухоль развивается из отдельной аномальной клетки [3]
В большинстве случаев происхождение рака прослеживается до единичной изолированной первичной опухоли; это наводит на мысль, что они образуются путем делений из единичной клетки с некими наследственными изменениями, позволяющими ее потомкам «перерасти» соседей. Однако к моменту обнаружения типичная опухоль состоит, как правило, не менее чем из миллиарда клеток (рис. 21-3), среди которых немало нормальных - например, фибробластов в поддерживающей соединительной ткани, обычно окружающей раковую опухоль. Доказать, что все раковые клетки данной опухоли являются клоном, берущим начало от единственной аномальной клетки, нелегко, однако в настоящее время имеются данные, которые подтверждают моноклональную природу рака. Так, практически у всех больных хроническим миелолейкозом лейкоциты отличаются от нормальных специфическим хромосомным нарушением, так называемой филадельфийской хромосомой, которая образуется при транслокации между длинными плечами 22-й и 9-й хромосом (см. рис. 21-4). Весьма маловероятно, чтобы генетическое событие, ответственное за это нарушение, произошло одновременно в нескольких клетках одного индивидуума; гораздо правдоподобнее выглядит предположение, что все лейкозные клетки являются потомками одной мутантной клетки. Действительно, когда клонировали ДНК в участке транслокации и определяли ее первичную структуру, выяснилось, что точка разрыва и воссоединения транслоцированных фрагментов одна и та же у всех лейкозных клеток данного больного, но у разных больных точки разрывов различны (смещение на несколько сотен или тысяч пар азотистых оснований). Именно такого результата следовало ожидать, если лейкоз всегда является следствием уникального события в единственной клетке.
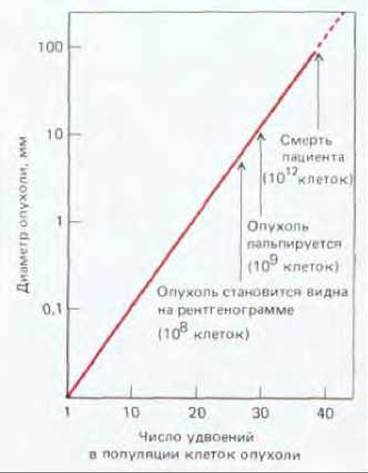
Рис. 21-3. Рост типичной опухоли у человека (диаметр опухоли показан в логарифмической шкале). Могут пройти годы, прежде чем опухоль станет заметной.
Другую возможность показать, что рак имеет моноклональное происхождение дает феномен инактивации Х-хромосомы (см. разд. 10.3.9). Нормальный женский организм - это случайная смесь или мозаика двух классов клеток: тех, в которых инактивирована отцовская Х-хромосома, и тех, в которых инактивирована аналогичная материнская хромосома. Такая инактивация происходит в каждой клетке в раннем эмбриогенезе, поэтому у потомства делящейся соматической клетки всегда инактивирована та же Х- хромосома, что и у нее самой. Следовательно, инактивация Х-хромосомы - отцовской или материнской - может служить наследуемым маркером, при помощи которого можно проследить происхождение клетокорганизма. В подавляющем большинстве исследованных опухолей, доброкачественных и злокачественных, у всех опухолевых клеток была инактивирована одна и та же Х-хромосома; это является сильным аргументом в пользу того, что каждая опухоль - потомство единственной клетки (рис. 21-5).
21.1.3. Большинство раковых опухолей начинается, по-видимому, с изменений в последовательности нуклеотидов клеточной ДНК [4]
Если дефектная клетка дает начало опухоли, она должна передать свою аномальность потомству, т. е. повреждение должно быть наследуемым. Поэтому первая проблема, с которой мы сталкиваемся при попытке понять сущность рака такова: является ли этот наследуемый дефект результатом генетического изменения, т. е. изменения в последовательности нуклеотидов ДНК, или изменения эпигенетического, когда меняется картина экспрессии генов, но не первичная структура ДНК. Наследуемые эпигенетические сдвиги, отражающие «память клеток» (см. разд. 10.3 и 16.2.8), - это черта нормального развития, проявляющаяся в стабильности дифференцированного состояния (разд. 17.1.1) и в таких явлениях как инактивация Х-хромосомы (разд. 10.3.9), и нет никаких оснований сразу отвергать участие подобных процессов в возникновении рака. Для одного редкого и необычного вида рака - тератокарциномы (разд. 16.2.6) - действительно, существуют свидетельства в пользу эпигенетического происхождения. Тем не менее имеются серьезные основания думать, что большинство раковых опухолей вызваны именно генетическими изменениями (хотя эпигенетические также могут вносить свой вклад в дальнейшее развитие болезни). Говоря конкретно, это означает, что в последовательности нуклеотидов ДНК клеток данной опухоли имеется скрытая аномалия, которую нередко удается выявить. Мы уже говорили о хроническом миелогенном лейкозе, подобные примеры нам будут встречаться и в дальнейшем. Однако из сказанного вовсе не следует, что генетическое изменение - это первый шаг, ведущий к раку. Более правильное утверждение состоит в том, что большинство канцерогенных агентов вызывает генетические изменения, и, наоборот, агенты, вызывающие генетические изменения, порождают рак. Такая взаимосвязь между канцерогенезом и мутагенезом ясно прослеживается для трех классов агентов: химических канцерогенов (которые обычно вызывают локальные изменения в последовательности нуклеотидов ДНК); ионизирующих излучений (например, рентгеновского), приводящих обычно к разрывам и транслокациям хромосом; вирусов, которые внедряют в клетку чужеродную ДНК. Роль вирусов в онкологии мы рассмотрим позже, а пока остановимся на химических канцерогенах.
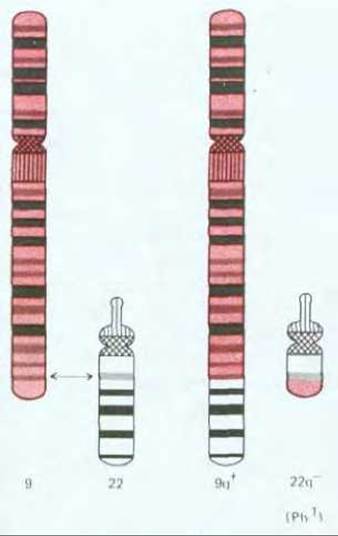
Рис. 21-4. Транслокация между 9-й и 22-й хромосомами ответственна за развитие хронического миелолейкоза у человека. Меньшая из двух дефектных хромосом называется филадельфийской (Ph1) (впервые эта аномалия была описана в Филадельфии).
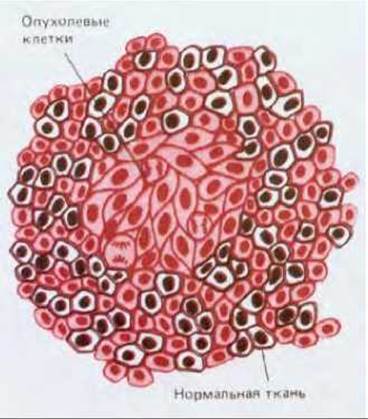
Рис. 21-5. Мозаичность инактивации Х-хромосомы свидетельствует о моноклональном возникновении рака. Вследствие вероятностного характера инактивации Х-хромосомы в раннем эмбриогенезе практически все нормальные ткани женского организма являются смесью клеток с различными инактивированными Х-хромосомами - отцовской или материнской, причем инактивация наследуется всем потомством клетки. Если протестировать клетки опухоли на экспрессию Х-сцепленного гена-маркера, то обычно у всех них оказывается инактивированной одна и та же Х-хромосома. Это сильный довод в пользу того, что все опухолевые клетки - потомки единственной клетки-«родоначальника».
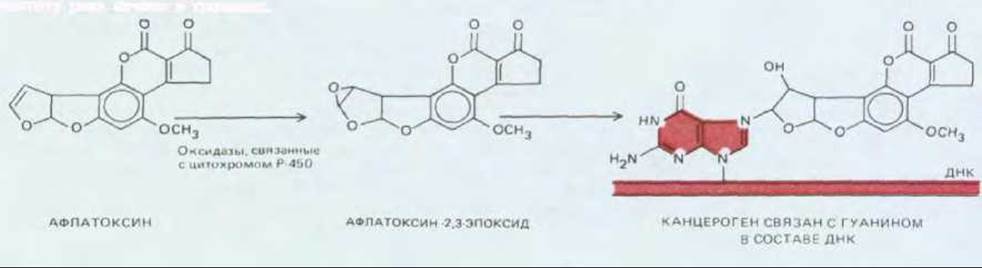
Рис. 21-6. Многие химические канцерогены могут вызывать мутации, взаимодействуя с ДНК, только после того как они активируются, т.е. подвергнутся в организме определенным метаболическим превращениям. Представленное на рисунке соединение - афлатоксин В1 продукт жизнедеятельности плесневого гриба Aspergillus flavus oryzae, который размножается на зерне и земляных орехах при хранении их во влажных теплых условиях. Это вещество считается одним из факторов, повышающих частоту рака печени в тропиках.
Вообще говоря, каждый конкретный случай рака нельзя целиком сводить к какой-то одной причине. Как мы увидим, рак, как правило, есть результат случайного совпадения в одной клетке нескольких независимых событий, последствия которых имеют кумулятивный эффект. На частоту этих событий весьма разнообразными способами влияет внешняя среда клетки, поэтому можно рассматривать рак как исход вероятностного процесса, на который положительно влияют комбинации внешних факторов (см. разд. 21.1.6). Тем не менее бывают такие канцерогенные воздействия, которые увеличивают вероятность критических событий до того, что они становятся практически неизбежными: по крайней мере одна клетка в организме становится раковой. Хрестоматийным примером такого рода стал 2-нафтиламин, который использовался в химической промышленности в начале этого века: на одной английской фабрике у всех рабочих, занятых его перегонкой (и тем самым подвергавшихся длительному воздействию высоких доз), со временем развился рак мочевого пузыря.
Канцерогенными оказываются совершенно различные химические вещества, если их скармливать экспериментальным животным или многократно наносить им на кожу. Некоторые из них действуют на клетки-мишени в своей исходной форме, но многим для этого необходимо превратиться в более активную форму - чаще всего это происходит под действием внутриклеточной системы ферментов, известных как цитохром-Р-450-оксидазы. Эти ферменты в норме превращают попадающие в организм яды и жирорастворимые ксенобиотики в безвредные и легко экскретируемые соединения. Однако окисление этой системой определенных веществ приводит к образованию продуктов, являющихся прямыми канцерогенами (рис. 21-6). Хотя известные на сегодняшний день химические канцерогены весьма разнообразны, большинство из них имеет по крайней мере одно общее свойство - способность вызывать мутации. Мутагенность может быть продемонстрирована различными методами; один из наиболее общепринятых - это тест Эймса, при проведении которого канцероген смешивается с экстрактом клеток печени крысы (играющим активирующую роль) и добавляется к культуре, специально подобранных («тестирующих») бактерий. Частота мутаций в такой бактериальной культуре является мерой мутагенности исследуемого вещества (рис. 21-7). Большинство соединений, обнаруживающих мутагенность в этом тесте, способны также вызывать мутации и (или) хромосомные аберрации в клетках млекопитающих, а их химическая структура позволяет предположить, что они вступают в химические реакции с ДНК. Сопоставление данных о мутагенности, полученных различными методами, с данными о канцерогенности, полученными в исследованиях по индукции рака in vivo, обнаружило, что большинство известных канцерогенов являются мутагенами и, наоборот, большинство мутагенов обладает канцерогенным действием.
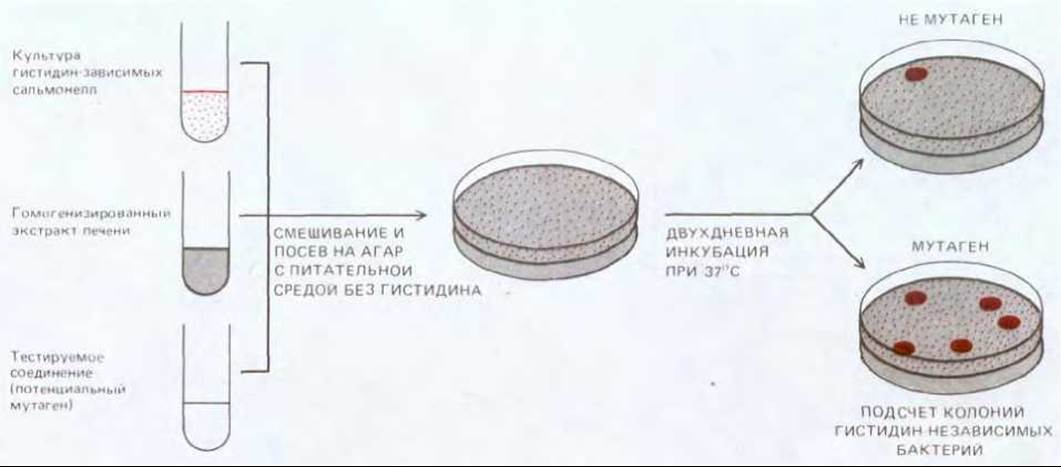
Рис. 21-7. Тест Эймса на мутагенность. В нем используется определенный штамм бактерий рода Salmonella, дефектный по синтезу гистидина (his'), и, следовательно, нуждающийся для роста в этой аминокислоте. Если испытываемое вещество обладает мутагенным эффектом, ген his- может под действием этого соединения ревертировать к дикому типу. Образовавшиеся при этом бактерии-ревертанты способны расти на среде без гистидина. Для увеличения чувствительности теста в геном тестерного штамма введена мутация по системе репарации, что делает эти бактерии особенно восприимчивыми к действию повреждающих ДНК агентов. Большинство соединений, демонстрирующих мутагенность в этом тесте, являются канцерогенными, и наоборот канцерогенам, как правило, свойственна высокая мутагенность.
Существует, тем не менее, важная, хотя и относительно небольшая, группа канцерогенов, которые не являются мутагенами. Ниже мы обсудим (разд. 21.1.7), каким образом немутагенные вещества могут способствовать развитию рака, влияя на поведение уже существующих мутантных клеток. Однако сначала надо рассмотреть вопрос о том, с какой частотой такие мутантные клетки возникают при нормальном развитии организма.
21.1.4. Для возникновения рака недостаточно единичной мутации [1,5]
Число клеточных делений у человека в течение жизни можно оценить величиной порядка 1016, а у мыши, которая состоит из меньшего числа клеток и имеет меньшую продолжительность жизни, соответствующая величина составляет около 1012. Даже если в окружающей среде отсутствуют мутагены, мутации происходят спонтанно, со скоростью примерно 10-6 мутаций на ген в течение клеточного цикла (эта величина определяется основными ограничениями, наложенными на процессы репликации и репарации ДНК, см. разд. 5.3.2). Таким образом, на протяжении жизни человека каждый его отдельный ген может претерпеть около 10 млрд. различных мутаций; у мыши это число может достигать одного миллиона. Можно ожидать, что среди возникших мутантных клеток будет немало таких, у которых произошли изменения в генах, регулирующих клеточное деление и которые, следовательно, могут не подчиняться ограничениям, наложенным в норме на пролиферацию клеток. С этой точки зрения проблема рака состоит не в том, почему он вообще возникает, а почему он возникает так редко.
Очевидно, что млекопитающие должны обладать механизмами страховки - двойной или даже более мощной - защищающей нас от опасности быть порабощенными мутантными клонами клеток, имеющими определенное преимущество над нашими нормальными здоровыми клетками. Действительно, если одной мутации в каком-то гене было бы достаточно, чтобы здоровая клетка стала раковой, мы бы не были жизнеспособными организмами. Существует множество указаний на то, что для возникновения рака необходимо совпадение некоторых событий в одной клетке, происходящих независимо друг от друга и весьма редко. Одно их них получено при эпидемиологических исследованиях частоты раковых заболеваний в зависимости от возраста. Для большинства видов рака заболеваемость резко увеличивается с возрастом и обычно равна третьей, четвертой, а то и пятой степени последнего (рис. 21-8), тогда как если бы для возникновения рака было бы достаточно одной мутации (с постоянной вероятностью), зависимости от возраста не было бы вообще. Эпидемиологическая статистика позволила рассчитать, что в среднем для превращения нормальной клетки в опухолевую требуется от трех до семи независимых случайных событий, каждое из которых имеет низкую вероятность. Число таких событий меньше при лейкозах и больше при солидных раковых опухолях.
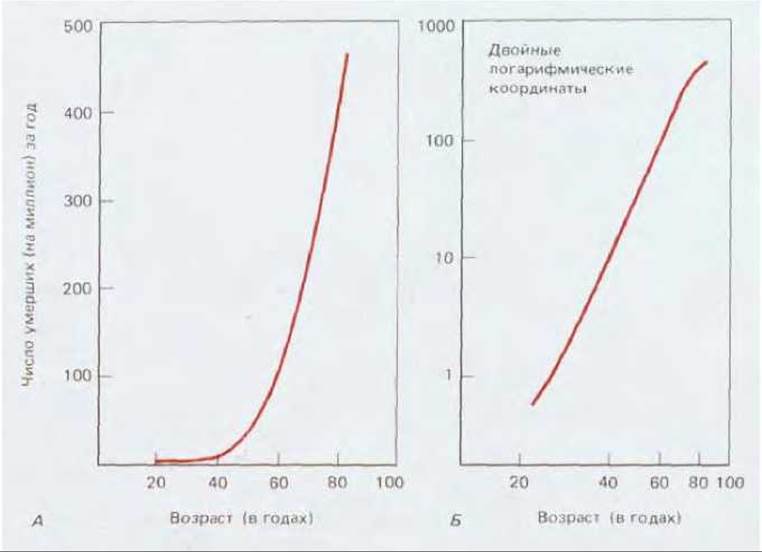
Рис. 21-8. Смертность от рака толстого кишечника в США за один год как функция возраста: А - в обычных линейных координатах; Б - те же данные в двойных логарифмических координатах. Заболеваемость раком стремительно увеличивается с возрастом (наклон графика на рис. Б составляет около 5). По-видимому, для превращения нормальной клетки в раковую в ней должно произойти несколько независимых случайных событий. (U. S. Department of Health, Education and Welfare; Vital Statistics of the United States, Vol. II: Mortality. Washington, D. C.: U. S. Government Printing Office, 1968.)
Теперь, когда идентифицированы многие конкретные мутации, ответственные за развитие рака, появилась возможность изучать эффекты таких мутантных генов на трансгенных мышах (см. разд. 5.6.10). Как мы увидим ниже (разд. 21.2.6), полученные на этом пути результаты представили дополнительные (и более прямые) доказательства в пользу гипотезы о том, что для возникновения рака единичной мутации недостаточно. Эту гипотезу подтверждают и многочисленные более ранние исследования феномена опухолевой прогрессии - процесса, в ходе которого первоначальное малозаметное нарушение клеточного поведения постепенно перерастает в «полноценный» рак. Эти исследования позволили проникнуть в природу множественных изменений, которые необходимы для превращения нормальной клетки в опухолевую, а также обнаружить факторы, вызывающие эти изменения.
21.1.5. Опухоли медленно развиваются из слабо измененных клеток [1, 5, 6]
Если мы рассмотрим связь между внешней причиной (для тех случаев, где внешняя причина очевидна), вызвавшей рак, и началом интенсивного развития болезни, то увидим, что почти всегда они разделены длительным латентным периодом: частота возникновения рака легкого резко возрастает лишь после 10-20 лет курения; частота возникновения лейкоза в Хиросиме и Нагасаки оставалась низкой в первые 5 лет после атомной бомбардировки и достигла пика лишь по истечении 8 лет; у промышленных рабочих, некоторое время имевших дело с химическими канцерогенами, редко выявляется рак соответствующей этиологии прежде, чем пройдет 10-20, а то и более лет после контакта, и т.д. (рис. 21-9). В течение этого длительного инкубационного периода будущие опухолевые клетки претерпевают ряд последовательных изменений. Ярким примером может служить все тот же хронический миелогенный лейкоз. Это заболевание начинается с увеличения количества лейкоцитов, которое не является смертельным и тянется несколько лет, пока не превращается в гораздо более быстро прогрессирующую болезнь, обычно за несколько месяцев приводящую к смерти больного. В начальной хронической фазе лейкозные клетки отличаются от нормальных только наличием хромосомной транслокации (см. разд. 21.1.2). В следующей за ней острой фазе болезни система кроветворения переполнена клетками, у которых помимо указанной хромосомной аномалии, обнаруживаются и некоторые другие. Видимо, клетки первоначального клона, претерпевшие дополнительные мутации, заставляющие их размножаться быстрее (или совершать большее число клеточных делений до терминальной дифференцировки), начинают «обгонять» как нормальные кроветворные клетки, так и своих сестер, несущих только первичный дефект. Полагают, что карциномы и другие солидные опухоли развиваются аналогичным образом. Хотя большинство из них у человека не диагностируются вплоть до относительно поздних стадий, в некоторых случаях можно наблюдать и ранние этапы развития болезни. Типичный пример - рак шейки матки. Опухоли шейки матки происходят из многослойного эпителия, по организации сходного с кожным эпидермисом (см. разд. 17.4.2). В норме размножаются лишь клетки базального слоя, при этом новые клетки постепенно перемещаются к поверхности эпителия, дифференцируясь в уплощенные, богатые кератином, неделящиеся клетки, которые, достигнув наружного слоя, в конце концов слущиваются (рис. 21-10, А). Однако если проанализировать достаточное число образцов такого эпителия, взятых от разных женщин, выяснится, что в них нередки очаги дисплазии, в которых делящиеся клетки обнаруживаются за пределами базального слоя и, следовательно, процесс их дифференцировки как- то нарушен (рис. 21-10, Б). Клетки слущиваются с поверхности эпителия, находясь на аномально ранних стадиях дифференцировки, и поэтому дисплазию можно обнаружить, сделав соскоб эпителия и исследовав его под микроскопом (рис. 21-11). Обычно такие участки дисплазии не причиняют вреда и даже самопроизвольно регрессируют, но иногда они способны прогрессировать, давая, спустя несколько лет, очаги так называемого рака in situ (рис. 21-10, В). При этой более опасной ситуации обычный характер деления и дифференцировки клеток нарушен гораздо сильнее - уже все слои эпителия состоят из делящихся (пролиферирующих) недифференцированных клеток, часто весьма различных по величине и кариотипу. Тем не менее дефектные клетки пока еще находятся по одну сторону базальной мембраны - на стороне эпителия. На этой стадии заболевания можно достичь полного излечения - достаточно разрушить или удалить хирургически измененную ткань. Без такого лечения патологически измененный участок может оставаться безвредным и даже регрессировать, но в 20-30% случаев происходит его дальнейшее развитие (обычно также в течение нескольких лет), приводящее к формированию истинного рака шейки матки (рис. 21-10, Г). Опухолевые клетки при этом нарушают целостность эпителия, проникая сквозь базальную мембрану и внедряются в подлежащую соединительную ткань. С этого момента эффективность хирургического лечения прогрессивно падает по мере распространения инвазивного роста.
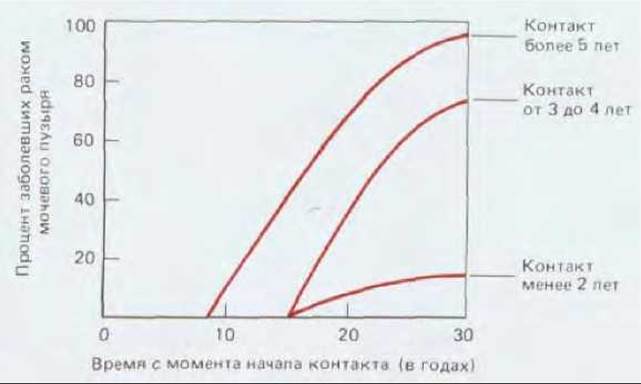
Рис. 21-9. Продолжительность скрытого периода развития рака мочевого пузыря в группе из 78 мужчин, контактировавших с канцерогеном 2-нафтиламином; подгруппы образованы в соответствии с длительностью контакта. (F. Cairns, Cancer: Science and Society. San Francisco: Freeman, 1978; с изменениями. По M. Н. С. Williams, in Cancer, Vol. III (R. W. Raven, ed.), London: Butter-field, 1958.)
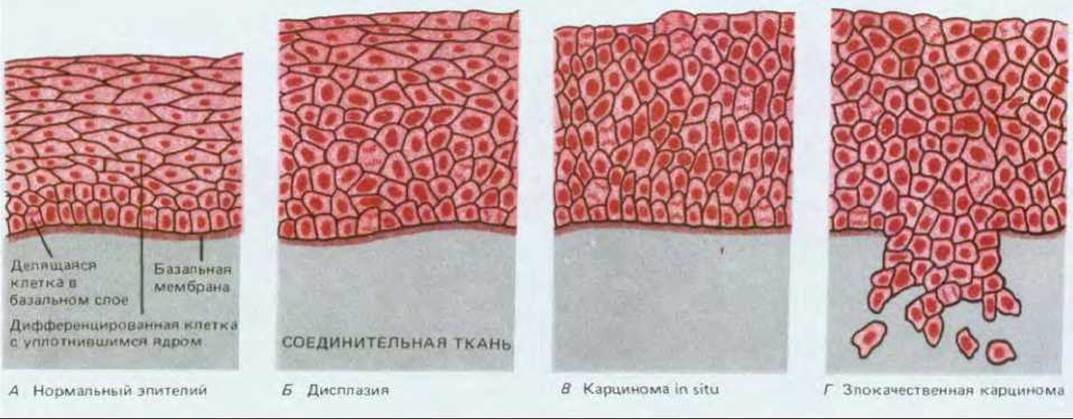
Рис. 21-10. Стадии развития эпителиомы шейки матки. При дисплазии поверхностный слой клеток еще несет определенные черты дифференцированности, однако она неполная, а делящиеся клетки обнаруживаются аномально далеко от базального слоя. В случае карциномы in situ клетки всех слоев делятся и фенотипически недифференцированы. Истинная злокачественность проявляется, когда клетки проникают сквозь базальную мембрану и начинают внедряться в подлежащую соединительную ткань. От первых признаков дисплазии до формирования «полноценной» злокачественной опухоли может пройти несколько лет.
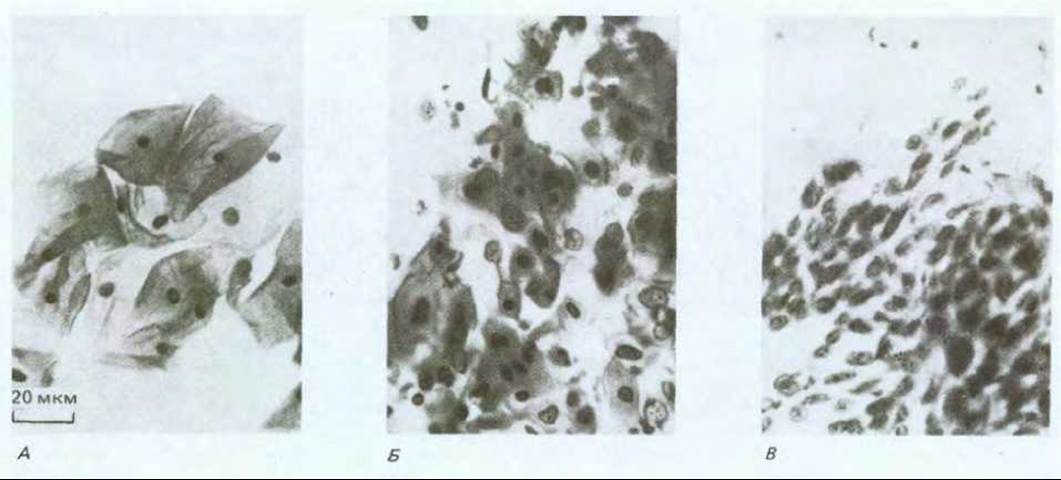
Рис. 21-11. Фотография клеток из соскоба поверхности шейки матки (методика Папаниколау или "Рар smear"). А. Норма: клетки крупные и хорошо дифференцированные с сильно уплотненными ядрами. Б. Дисплазия: клетки находятся на разных стадиях дифференцировки, попадаются совершенно незрелые. В. Инвазивная карцинома; все видимые клетки недифференцированы, с небольшой цитоплазмой и относительно большим ядром; в дебрисе на заднем плане видны клетки крови, разрушившиеся в изъязвленных карциномой местах. (С любезного разрешения Е. Miller.)
21.1.6. Развитие опухоли включает последовательные циклы мутаций и естественного отбора [6, 7]
В предыдущем разделе мы рассмотрели два весьма различных примера, которые иллюстрируют данное положение: в общем виде развитие рака можно описать как процесс, в ходе которого первоначальная популяция незначительно измененных клеток, потомков единственной мутантной клетки-предшественницы, движется «от плохого к худшему», проходя через последовательные циклы мутаций и естественного отбора. Элемент случайности в этой эволюции очень велик, поэтому обычно она охватывает многие годы; большинство людей умирает от других заболеваний до того, как у них успевает развиться рак. Для понимания причин его возникновения необходимо выяснить факторы, которые могут ускорить этот процесс.
Вообще говоря, скорость эволюции - имеем ли мы дело с популяцией клеток, «пытающихся вести себя» как раковые в организме, или с популяцией организмов, адаптирующихся к новой среде обитания, должна зависеть от четырех основных показателей: 1) скорости мутирования, или частоты возникновения мутаций (вероятность того, что каждый член популяции претерпит генетическое изменение); 2) численности популяции; 3) скорости размножения (среднее число поколений потомства в единицу времени); 4) селективного преимущества мутантной особи, которое оценивается как отношение числа выживших плодовитых потомков, произведенных ею за единицу времени, к такому же показателю у немутантной особи. Селективное преимущество зависит как от природы самой мутации, так и от условий внешней среды. Ситуация может усложняться при наличии наследственных эпигенетических изменений.
Справедливость этих эволюционных принципов хорошо иллюстрируется результатами исследований экспериментального рака у животных. При знакомстве с данными, полученными в этих исследованиях, создается впечатление невероятного разнообразия факторов, влияющих на заболеваемость раком человека - от курения (в случае рака легкого) до возраста, в котором женщина впервые рожает (для рака молочной железы). Совершенно ясно, по крайней мере, что скорость мутирования на клетку - не единственная существенная переменная, определяющая развитие рака.
21.1.7. Развитию рака могут способствовать факторы, не изменяющие последовательность нуклеотидов в ДНК клетки [6, 8]
Стадии, через которые проходит поврежденная клетка прежде, чем превратиться в раковую, проще всего наблюдать в коже. У мышей рак кожи можно вызвать экспериментально, смазывая ее химическим канцерогеном бензпиреном (одним из компонентов угольной смолы и табачного дыма) или родственным ему соединением диметилбензоантраценом (ДМБА). Однократный контакт с канцерогеном сам по себе к возникновению опухоли обычно не приводит (как и к какому-нибудь другому очевидному продолжительному нарушению). И все же он вызывает скрытое генетическое повреждение, которое проявляется резким увеличением частоты возникновения опухолей при повторном контакте с тем же канцерогеном или при воздействии других агентов совершенно иной природы. Про канцероген в подобной ситуации говорят, что он действует как опухолевый инициатор. Всего лишь простое повреждение кожи, однажды подвергшейся воздействию такого инициатора, может вызвать рак (почти наверняка он будет развиваться из клеток, расположенных по краю раны). В то же время многократный контакт в течение месяцев с веществами, именуемыми опухолевыми промоторами (которые сами по себе не обладают мутагенным действием), может индуцировать опухолевый рост избирательно в участках кожи, контактировавших с опухолевым инициатором. Из опухолевых промоторов наиболее изучены форболовые эфиры, как, например, тетрадеканоил-форбол-ацетат (ТФА), о которых уже шла речь по другому поводу, как об искусственных активаторах протеинкиназы С (и тем самым как об агентах, активирующих часть фосфатидил-инозитольного внутриклеточного сигнального пути (см. разд. 12.3.10). Эти вещества вызывают рак с высокой частотой только после предварительного воздействия мутагенного инициатора (рис. 21-12).
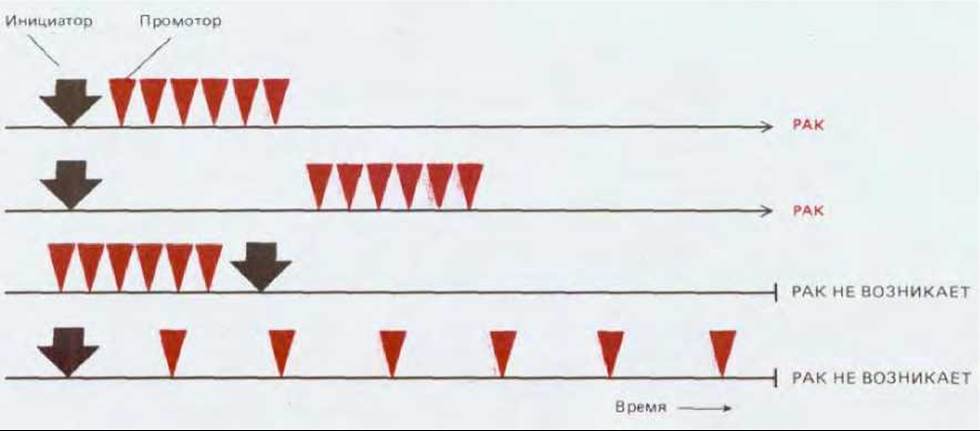
Рис. 21-12. Возникновение опухоли в результате совместного действия опухолевого инициатора (мутагена) и опухолевого промотора (немутагена). Болезнь развивается только в том случае, когда контакт с инициатором предшествует действию промотора, а также если интенсивность воздействия промотора превышает определенный порог. Развитие опухоли имеет место и при многократном воздействии одного инициатора.
Скрытые повреждения, вызываемые опухолевым инициатором, как и генетические повреждения, необратимы, и поэтому могут обнаруживать себя при воздействии опухолевого промотора даже спустя большой промежуток времени. Немедленный первичный эффект промотора, по-видимому, заключается в том, что он стимулирует деление клеток (или задерживает клетки, которые должны были окончательно дифференцироваться, в состоянии продолжающегося деления). В местах воздействия инициатора начинается рост многочисленных мелких доброкачественных бородавкоподобных опухолей, называемых папилломами. Чем больше исходная доза инициатора, тем больше образуется папиллом. Считается, что каждая папиллома, по крайней мере при низких дозах опухолевого инициатора, является одним клоном клеток - потомством мутантной клетки, возникшего под действием инициатора. Опухолевый промотор и механическое повреждение могут индуцировать экспрессию некоторых генов «социального контроля», влияющих прямо или опосредованно, на клеточную пролиферацию (см. разд. 13.4). В спокойном эпителии такие гены могут «молчать», и потому любые мутации, возникшие в них в результате действия инициатора, остаются скрытыми; однако индукция их экспрессии опухолевым промотором или факторами, образующимися при повреждении, ведет к проявлению этих мутаций и, как следствие, изменению пролиферации клеток (рис. 21-13).
Типичная папиллома может содержать примерно 105 клеток, что более чем в тысячу раз превышает число клеток в нормальной «эпидермальной пролиферативной единице» (см. разд. 17.4.2). Если опухолевый промотор удалить, то практически все папилломы исчезают, и кожа вновь приобретает почти нормальный вид - что соответствует гипотезе, изображенной на рис. 21-13. Однако в некоторых папилломах происходят дальнейшие изменения, и они приобретают способность неконтролируемого роста даже после удаления промотора. Эти изменения, судя по всему, возникают в единичных клетках папиллом с частотой, аналогичной таковой для самопроизвольных мутаций. Это путь превращения малой части всех папиллом в раковые опухоли. Таким образом, опухолевый промотор способствует развитию рака (по крайней мере, в рассматриваемой системе), увеличивая популяцию клеток, несущих первичную мутацию: чем больше будет таких клеток, тем больше вероятность, что хотя бы одна из них мутирует еще раз в направлении, приближающем ее к злокачественности. И даже если опухоли «естественного» происхождения не обязательно возникают в точном соответствии с описанной схемой - т. е. проходят через раздельные и последовательные стадии инициации и промоции, их развитие подчиняется аналогичным закономерностям. Они также будут развиваться со скоростью, зависящей как от частоты мутаций, так и от факторов, влияющих на выживаемость, размножение и распространение определенных типов мутантных клеток, если таковые возникнут.
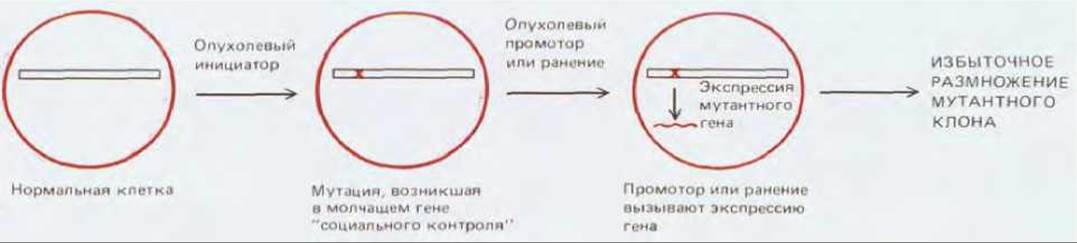
Рис. 21-13. Возможный механизм действия опухолевых промоторов. Согласно другой гипотезе, мутантный ген может экспрессироваться постоянно, но не давать никакого эффекта, пока промотор не активирует дополнительные гены, необходимые для пролиферации клетки.
21.1.8. Большинство раковых заболеваний вызвано такими комбинациями внешних воздействий, которых можно избежать [9]
Развитие рака - процесс многостадийный. На течение каждой стадии влияет множество факторов; некоторые из них зависят от генетической конструкции индивидуума, другие - от условий и образа жизни. Поэтому меняя окружающую среду и/или свои привычки, мы, в принципе, сможем значительно уменьшить шанс возникновения практически любой формы рака. Наиболее яркое тому свидетельство - сравнительная заболеваемость раком в разных странах. Практически для любого вида рака, обычного и весьма распространенного в какой-нибудь определенной стране, найдется другое государство, в котором частота этого вида рака будет в несколько раз ниже (табл. 21-2). При этом заболеваемость раком в популяциях иммигрантов имеет тенденцию к сближению с таковой в популяции аборигенов, что говорит о ведущей роли внешних, а не генетических факторов. На основании этих данных было вычислено, что 80-90% случаев заболевания раком может быть предотвращено. К сожалению, различные раковые заболевания имеют различные внешние факторы риска, и страна, которой удалось свести к минимуму какой-нибудь один из них, не имеет преимущества перед другими в отношении всех остальных факторов. По этой причине общая онкологическая статистика (по всем видам онкологических заболеваний) обнаруживает сходную картину заболеваемости лиц одного возраста во всех странах. Вместе с тем есть группы населения, воздержанный образ жизни которых, видимо, привел к снижению смертности от рака. Так, среди ортодоксальных мормонов в штате Юта, она вдвое ниже, чем в целом по США.
Таблица 21-2. Различия между странами в заболеваемости наиболее обычными видами рака
|
Локализация первичной опухоли |
Регион с высокой заболеваемостью |
Суммарная заболеваемость в данном районе, % |
Регион с низкой заболеваемостью |
Отношение высокой заболеваемости к низкой |
|
Кожа |
Австралия (Квинсленд) |
20 |
Индия (Бомбей) |
>200 |
|
Пищевод |
Иран |
20 |
Нигерия |
300 |
|
Легкие |
Англия |
11 |
Нигерия |
35 |
|
Желудок |
Япония |
11 |
Уганда |
25 |
|
Шейка матки |
Колумбия |
10 |
Израиль (евреи) |
15 |
|
Простата |
США (черные) |
9 |
Япония |
40 |
|
Печень |
Мозамбик |
8 |
Англия |
100 |
|
Молочная железа |
Канада |
7 |
Израиль (не евреи) |
7 |
|
Ободочная кишка |
США (Коннектикут) |
3 |
Нигерия |
10 |
|
Матка |
США (Калифорния) |
3 |
Япония |
30 |
|
Ротовая полость |
Индия (Бомбей) |
2 |
Дания |
25 |
|
Прямая кишка |
Дания |
2 |
Нигерия |
20 |
|
Мочевой пузырь |
США (Коннектикут) |
2 |
Япония |
6 |
|
Яичники |
Дания |
2 |
Япония |
6 |
|
Носоглотка |
Сингапур (китайцы) |
2 |
Англия |
40 |
|
Поджелудочная железа |
Новая Зеландия(маори) |
2 |
Индия (Бомбей) |
8 |
|
Гортань |
Бразилия (Сан-Паулу) |
2 |
Япония |
10 |
|
Глотка |
Индия (Бомбей) |
2 |
Дания |
20 |
|
Пенис |
Некоторые районы Уганды |
1 |
Израиль (евреи) |
300 |
Данные по раку шейки матки, молочной железы, матки и яичников - для женщин, остальные - для мужчин. Суммарная заболеваемость определяется как процент людей, у которых рак развился до 75-летнего возраста (в отсутствие других причин смерти): отношение заболеваемостей рассчитано для возрастной группы от 35 до 64 лет. (С небольшими изменениями из: R. Doll and R. Peto, The Causes of Cancer. New York: Oxford University Press, 1981.)
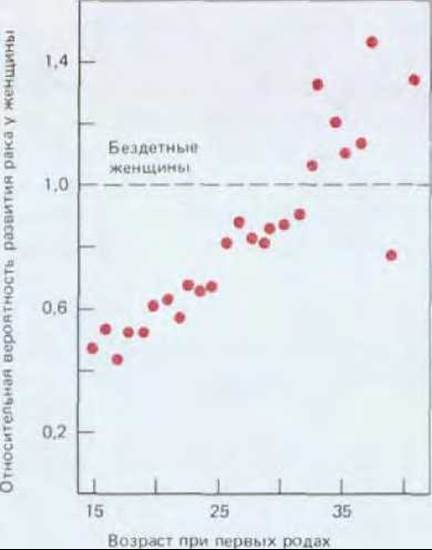
Рис. 21-14. Вероятность возникновения рака молочной железы у женщины в зависимости от возраста ее первых родов. Чем больше возраст, в котором женщина впервые рожает, тем выше вероятность рака молочной железы. По-видимому, определенная комбинация половых гормонов может способствовать развитию опухоли. Согласно данным лабораторных исследований, первая полноценная беременность может приводить к устойчивому эпигенетическому изменению в клетках молочной железы, определяя их последующие ответы на гормоны. Вероятность возникновения рака молочной железы коррелирует и с другими факторами, например, с количеством потребляемых жиров. (F. Cairns, Cancer: Science and Society. San Francisco: Freeman, 1978. По В. MacMahon, P. Cole, F. Brown, F. Natl. Cancer Inst., 50, 21 42, 1973.)
Хотя эти эпидемиологические наблюдения и свидетельствуют о том, что заболевания раком можно избежать, задача идентификации конкретных факторов риска и механизмов их действия остается трудной. Некоторые из этих факторов - явные мутагенные опухолевые инициаторы, непосредственно вызывающие генетические изменения; другие преимущественно служат опухолевыми промоторами, увеличивая популяцию клеток, способных вызвать рак при дальнейших мутациях. Канцерогены, содержащиеся в табачном дыме, как и афлатоксин (см. рис. 21-6), относятся главным образом к первой категории; ко второй можно отнести, например, женские половые гормоны (рис. 21-14).
Возможно, некоторые факторы действуют посредством других механизмов, отличных от обоих описанных выше, - например, вызывая наследуемые эпигенетические изменения. Разумеется, для того, чтобы идентифицировать некий канцерогенный фактор и избежать его воздействия, совсем не обязательно понимать, как он действует; в этом отношении эпидемиология рака уже достигла больших успехов и является многообещающей областью исследований. Только лишь выяснение роли курения в развитии рака легких открыло путь к уменьшению общей смертности от рака в Северной Америке и Европе на 30%. Профилактика рака не только представляется более привлекательной, чем лечение, но и, учитывая нынешний уровень наших знаний, оказывается гораздо эффективнее (и вдобавок обходится значительно дешевле).
21.1.9. Поиск способов лечения рака труден, но не безнадежен [10]
Лечить раковые заболевания столь же трудно, как и избавиться от сорняков в поле. Опухолевые клетки можно удалять хирургически, разрушать с помощью лекарственной и лучевой терапии, но очень трудно уничтожить каждую опухолевую клетку, т. е. ликвидировать их все без исключения. При хирургическом вмешательстве редко удается выявить все имеющиеся метастазы, а химические средства, убивающие раковые клетки, как правило, токсичны и для нормальных. Даже если в организме останется лишь несколько опухолевых клеток, они способны размножиться, и тогда болезнь возродится. Кроме того, раковые клетки могут приобретать устойчивость к тем веществам, которые используются для борьбы с ними, чего нельзя сказать о нормальных клетках. И все же ситуация не является безнадежной. Несмотря на трудности, были разработаны эффективные способы лечения некоторых видов рака (с использованием противоопухолевых препаратов, применяемых самостоятельно или в комбинации с другими средствами), прежде дававших высокий процент смертности (среди них лимфома Ходжкина, рак яичек, хорионкарцинома, а также некоторые виды лейкозов и других злокачественных новообразований, частых в детском возрасте). Современные противоопухолевые препараты, хирургическое вмешательство и местная лучевая терапия позволяют вернуть к нормальной жизни большую часть пациентов в том случае, если болезнь была обнаружена на достаточно ранней стадии. Даже тогда, когда у нас нет возможности вылечить больного, есть способы продлить его жизнь или хотя бы облегчить страдания.
Основная задача клинических исследований рака заключена в проблеме избирательного уничтожения опухолевых клеток. Современные методы лечения опираются, главным образом, на относительно слабые различия в скорости размножения, метаболизме и радиочувствительности нормальных и опухолевых клеток и имеют нежелательные побочные токсические эффекты. Несколько типов раковых клеток особенно уязвимы для избирательных воздействий, так как являются гормонозависимыми или несут на своей поверхности атипичные химические структуры, которые могут распознаваться антителами. Однако в целом решение широко обсуждаемой проблемы избирательной противоопухолевой терапии продвигается медленно, путем предположений, проб и ошибок наряду с рациональным расчетом.
Для поиска оптимальных путей «обуздания» размножения и распространения опухолевых клеток важно более подробно изучить и понять принципы этих процессов (или основные механизмы).
21.1.10. Опухолевый рост часто связан с нарушением клеточной дифференцировки [11]
До сих пор мы делали акцент на утверждении, что деление опухолевых клеток не подчиняется нормальному контролю - это их главная черта. Но многие ткани устроены таким образом, что даже неконтролируемое увеличение частоты клеточного деления не приводит само по себе к устойчиво растущей опухоли. Это положение можно проиллюстрировать рассмотренным выше (разд. 21.1.5) примером рака шейки матки. Подобно кожному эпидермису и многим другим видам эпителия, эпителий шейки матки в норме непрерывно самообновляется - дифференцированные клетки, слущиваются с его наружной поверхности и все время замещаются за счет деления стволовых клеток базального слоя (см. разд. 17.4.4). В среднем, в результате каждого нормального деления стволовой клетки образуется одна дочерняя стволовая клетка и одна клетка, которой предстоит прекращение деления и терминальная дифференцировка. Если стволовая клетка будет просто быстрее делиться, это лишь увеличит скорость обновления эпителия: дифференцированные клетки будут быстрее образовываться и быстрее слущиваться, т.е. клеточный баланс ткани будет сохранен. Между тем в ситуации, когда трансформированная клетка производит постоянно растущее потомство, должно обнаруживаться нарушение этого баланса: либо стволовыми остаются более половины дочерних клеток, либо процесс дифференцировки изменен так, что дочерние дифференцирующиеся клетки сохраняют способность к неограниченному делению, избегая своей обычной участи в конце «жизненного пути» - слущивания (рис. 21-15).
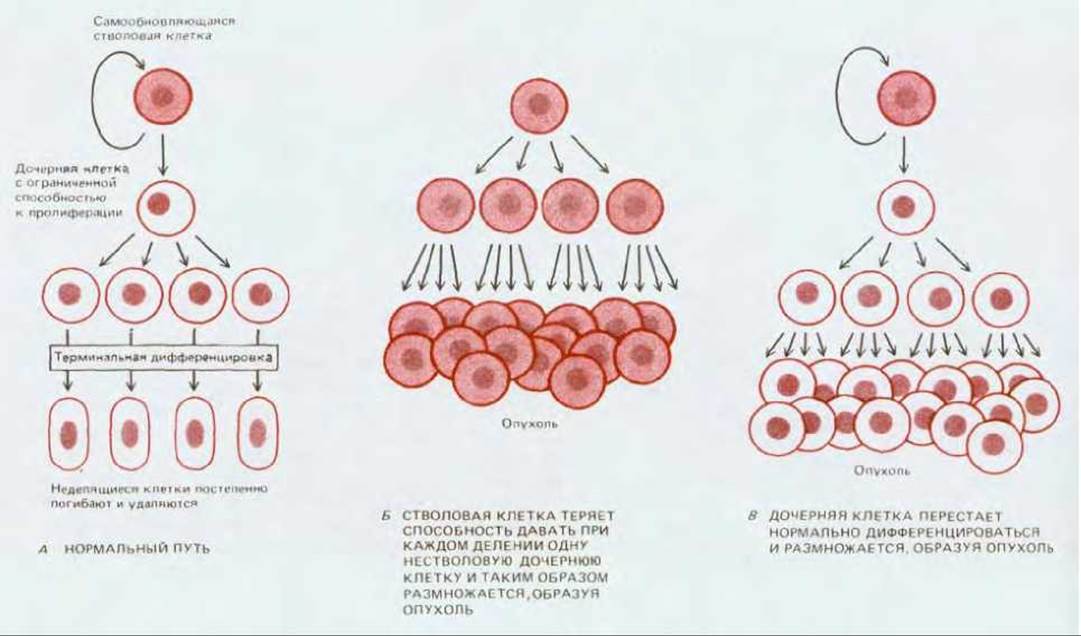
Рис. 21-15. Стратегия стволовой клетки и ее роль в клеточной дифференцировке. Два типа нарушений, которые могут приводить к характерной для рака неудержимой пролиферации. Следует отметить, что повышенная скорость деления стволовой клетки сама по себе не приводит к такому эффекту.
Есть основания предполагать, что развитие подобных свойств лежит в основе перехода от умеренной дисплазии шейки матки до рака in situ и сформированной истинной злокачественной опухоли (см. рис. 21-10). Сходные предположения применимы к развитию рака и в других тканях, которые обновляются за счет стволовых клеток, таких как кожа, эпителий кишечника и кроветворная система. Например, некоторые формы лейкоза, возникают в результате нарушения нормальной программы дифференцировки, когда промежуточный предшественник какого-либо типа клеток крови продолжает неограниченно делиться вместо того, чтобы после строго определенного числа клеточных циклов завершить дифференцировку (см. разд. 17.5.5).
В общем, мутации или эпигенетические изменения, блокирующие нормальное созревание клеток и превращение в неделящиеся дифференцированные формы, должны играть важнейшую роль в патогенезе многих злокачественных новообразований. В связи с этим есть надежда, что препараты, стимулирующие клеточную дифференцировку, могут оказаться перспективными в терапии рака как средство выбора или дополнение к цитостатикам - лекарствам, убивающим делящиеся клетки.
21.1.11. Для того чтобы формировать метастазы, опухолевые клетки должны «уметь» проникать через базальную мембрану [12]
Главное свойство опухолей, затрудняющее их лечение хирургическими методами или местной лучевой терапией, - способность давать метастазы. Чтобы распространиться по организму, клетки типичной солидной опухоли должны освободиться от механического контакта с соседними клетками, «выбраться» из ткани, в которой они возникли, «пробраться» сквозь другие ткани до кровеносного или лимфатического сосуда, проникнуть через базальную мембрану и слой эндотелиальных клеток, чтобы выйти в просвет сосуда; затем вновь «пройти» сквозь его стенку, но в обратном направлении и в другой области тела, выжить и размножаться в своем новом окружении (рис. 21-16). Последние этапы, видимо, наиболее трудные; многие опухоли высвобождают в сосудистое русло огромное количество клеток, но лишь ничтожная доля этих клеток оказывается способной образовывать метастазы (метастатические колонии).
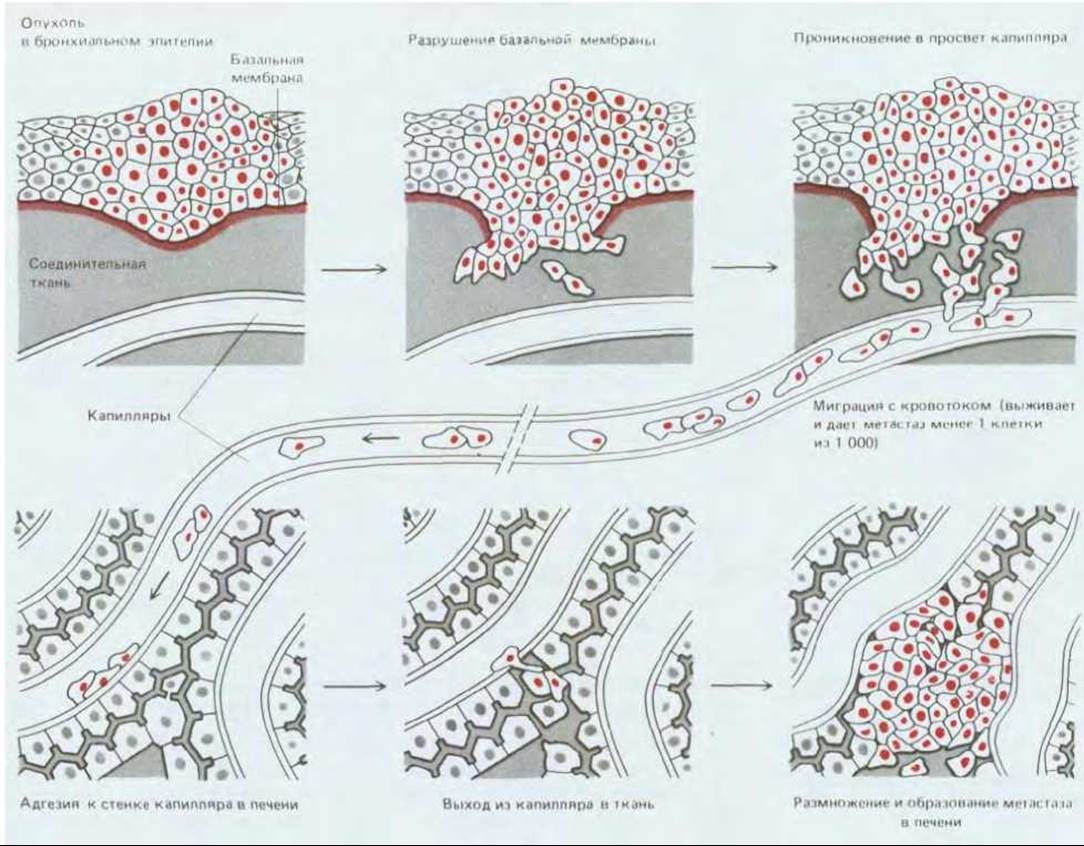
Рис. 21-16. Механизм метастазирования. Данный пример иллюстрирует распространение опухоли из легкого в печень. Опухолевые клетки могут попасть в кровяное русло сквозь стенку кровеносного сосуда, как показано на рисунке, или, что, вероятно, случается чаще, через лимфатическую систему. Лимфатические сосуды выбрасывают свое содержимое (лимфу) в кровяное русло, однако опухолевые клетки часто задерживаются в лимфатических узлах, встречающихся на их пути, давая здесь начало вторичным опухолям. Исследования на животных показали, что из опухолевых клеток, проникших в кровь, способностью образовать опухоль на новом месте обладают лишь немногие. «Успех» метастазирования зависит как от свойств ткани, в которую пытается внедриться клетка опухоли, так и от свойств самой раковой клетки.
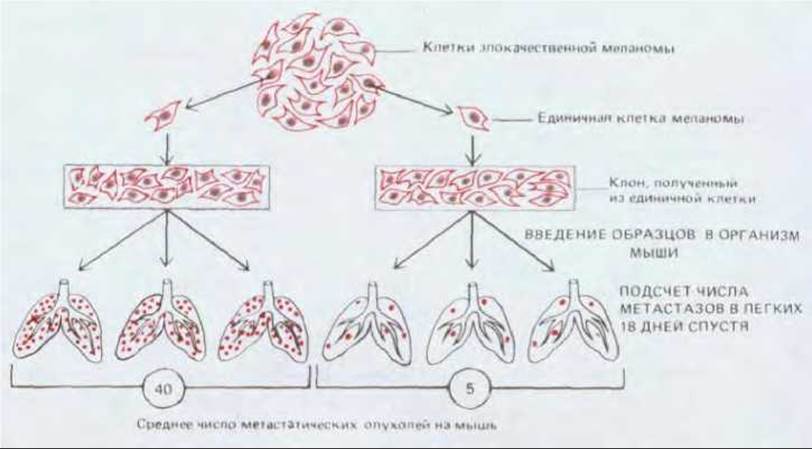
Рис. 21-17. Эксперимент, демонстрирующий наследуемые различия между клетками одной опухоли в отношении способности к метастазированию. Клетки от одной линии субклонируют, и стандартные аликвоты каждого субклона вводят в кровь мышей (тест на способность давать вторичные опухоли). Субклоны значительно отличаются между собой по числу образующихся (на одну мышь) метастазов.
Некоторые типы нормальных клеток, а именно лейкоциты, уже изначально обладают многими или даже всеми свойствами, необходимыми для диссеминирования по организму. Но для большинства опухолей появление способности давать метастазы связано, вероятно, с дополнительными мутациями или эпигенетическими изменениями. Скорее всего подобные изменения (как и другие, вовлеченные в канцерогенез) возникают случайным образом еще в исходной опухолевой популяции; и лишь те немногие клетки, которые приобрели свойства, необходимые для метастазирования, и, кроме того, оказавшиеся в подходящем для них микроокружении, способны будут дать начало вторичным опухолям. Таким образом, клетки одной опухоли являются гетерогенными по своей способности к метастазированию (рис. 21-17).
Понимание молекулярных механизмов метастазирования позволило бы разработать подходы к его предотвращению. В этом направлении достигнуты некоторые успехи. Так, было показано, что опухолевые клетки, чтобы проникнуть через базальную мембрану, должны, во-первых, нести на своей поверхности рецепторы к ламинину (см. разд. 14.2.18), при. помощи которых они прикрепляются к базальной мембране, а во-вторых, секретировать коллагеназу IV типа, чтобы разрушить мембрану (рис. 21-18). Было показано, что антитела или другие реагенты, блокирующие прикрепление к ламинину или активность коллагеназы IV типа, могут подавлять метастазирование у экспериментальных животных. Остается выяснить, будет ли такого рода обработка, останавливающая метастазирование, эффективной у больных раком.
21.1.12 Дефекты в процессах репарации, репликации и рекомбинации ДНК способствуют развитию рака [1, 13]
Мы уже отмечали, что возникновение опухолей и скорость опухолевого развития от доброкачественности к злокачественности зависят от частоты мутаций. Скорость мутирования увеличивают как мутагены, находящиеся во внешней среде, так и внутриклеточные дефекты механизмов репликации, рекомбинации и репарации ДНК. Например, у людей с редким наследственным заболеванием «пигментная ксеродерма» обнаружен дефект в системе ферментов, необходимых для репарации повреждений ДНК, вызванных ультрафиолетовым облучением (см. разд. 5.2.8). Это приводит к тому, что даже непродолжительное пребывание на солнце может спровоцировать возникновение рака кожи. Предрасположенность к раку более общего характера наблюдается при синдроме Блума, когда имеется дефект фермента ДНК-лигазы, необходимой для репликации и репарации ДНК, и при анемии Фанкони и атаксии-телангиэктазии, когда существуют нарушения тех же функций, но менее охарактеризованные. При этих редких генетических расстройствах аномалия наследуется через половые клетки и поэтому присутствует во всех клетках организма. Однако сходные генетические дефекты в метаболизме ДНК могут появляться также в результате мутаций в соматических клетках, и есть основания предполагать, что такие аберрации являются общим и важным фактором в развитии многих злокачественных новообразований.
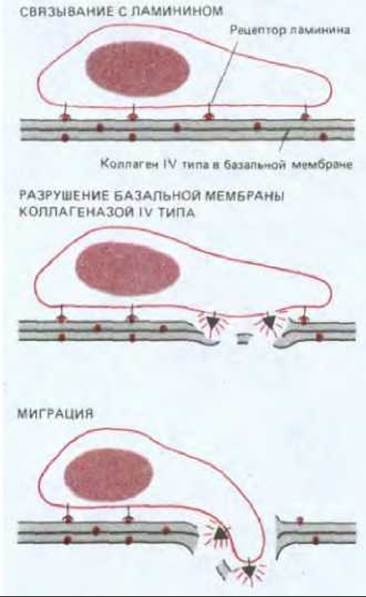
Рис. 21-18. Проникновение опухолевой клетки через базальную мембрану.
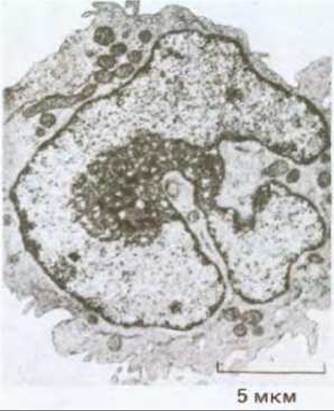
Рис. 21-19. Типичные аномалии в морфологии ядра раковой клетки (в данном случае при эритролейкозе). Ядро такой клетки необычно велико, имеет оболочку с беспорядочно расположенными складками и ядрышко, которое также аномально увеличено и характеризуется сложной структурой. (С любезного разрешения D. Friends.)
Опухолевые клетки нередко обнаруживают аномальную вариабельность формы и размеров ядер (рис. 21-19), а также числа и структуры хромосом; и на практике изменения в морфологии ядер являются для патологов одним из ключевых признаков в диагностике рака. При культивировании опухолевых клеток их кариотип часто оказывается крайне нестабильным: могут наблюдаться амплификация или делеция генов, потеря, дупликация или транслокация хромосом (или их участков) - все это регистрируется с гораздо большей частотой, чем при культивировании нормальных клеток. С одной стороны, такая вариабельность в числе и структуре хромосом может быть просто следствием ускорения клеточного цикла, возникающего в дифференцированной клетке из-за ее слабой адаптации к быстрой пролиферации. С другой стороны, это может отражать наследуемый дефект в самом механизме или регуляции процессов репарации, репликации или рекомбинации ДНК, возникающий в результате соматической мутации в любом из множества вовлеченных в эти сложные процессы генов. Такая мутация будет увеличивать вероятность всех последующих мутаций в других группах генов. Поэтому можно ожидать, что описанный механизм является общим для клеток, претерпевших множество мутаций, необходимых для превращения их в злокачественные. Предположим, к примеру, что для трансформации нормальной клетки в опухолевую необходимы три мутации в генах, контролирующих поведение клеток, и что вероятность каждой такой мутации за время жизни человека составляет 10-4 на клетку. Тогда вероятность того, что одна нормальная клетка успеет (даже за весь указанный промежуток времени) «накопить» эти три мутации, будет 10-4 х 10-4 х 10-4 = 10-12. Но допустим теперь, что скорость мутирования возросла из-за предшествующей мутации в каком-нибудь из ферментов системы репликации или репарации ДНК и достигла 10-2/клетку за время жизни человека. Приняв вероятность этой мутации в системе репарации/репликации стандартной - 10-4, мы увидим, что этот путь, который начинается с мутации, увеличивающей мутабильность, приведет к более частому возникновению раковых клеток: суммарная вероятность превращения клетки в раковую составит в течение жизни 10-4 х 10-2 х 10-2 х 10-2 = 10-10. Это в 100 раз более вероятно, чем в первом случае, хотя и требует не трех, а четырех мутаций.
21.1.13. Высокая мутабильность раковых клеток способствует появлению у них устойчивости к противоопухолевым препаратам [10, 14]
Чем бы ни объяснялась высокая мутабильность раковых клеток, в большинстве опухолей они весьма гетерогенны во многих отношениях, и, кроме того, способны изменяться с пугающей скоростью под влиянием новых факторов отбора; естественно, это лишь усугубляет трудности терапии рака. Длительное лечение препаратами, избирательно токсичными для делящихся клеток, позволяет убить большинство опухолевых клеток у больного, но уничтожить их полностью удается редко - обычно какая-то малая часть их оказывается устойчивой к данному препарату (или классу препаратов). Более того, иногда прием какого-либо препарата обусловливает резистентность не только к нему, но и к другим препаратам, с которыми клетки больного никогда не контактировали.
Этот феномен множественной лекарственной (мультилекарственной) резистентности часто коррелирует с любопытным изменением в кариотипе: в клетках обнаруживаются дополнительные пары маленьких хромосом, так называемые двойные минихромосомы, или гомогенно окрашиваемая область, встроенная в одну из обычных хромосом и нарушающая нормальную картину ее исчерченности. Обе эти аберрации являются результатом огромной амплификации небольшого сегмента генома (см. ниже, рис. 21-26 и 21-31). При клонировании такой амплифицированной ДНК выяснилось, что в ней часто находится специфический ген, известный как ген множественной лекарственной устойчивости (mdr 1). Он кодирует одну из транспортных АТРаз плазматической мембраны, которая, как полагают, предотвращает внутриклеточное накопление определенных классов жирорастворимых препаратов, «откачивая» их из клетки. Амплификация других типов генов также может придавать опухолевым клеткам избирательное преимущество - при лечении антагонистом фолиевой кислоты метатрексатом часто происходит амплификация гена дигидрофолатредуктазы (ДГФР); в некоторых опухолях, как мы увидим ниже, аналогичным образом оказываются амплифицированными определенные протоонкогены, участвующие в регуляции клеточного деления (см. разд. 21.2.8).
Дефекты в процессах репликации, рекомбинации или репарации ДНК, делая опухолевые клетки эволюционно более гибкими за счет увеличения мутабильности, одновременно делают их и более уязвимыми к воздействиям определенного характера. Именно этим можно объяснить хорошо известный факт, используемый в терапии, что клетки многих опухолей гораздо легче, чем нормальные, можно убить облучением или обработкой специфическими веществами, вмешивающимися в метаболизм ДНК. Более полное изучение молекулярных механизмов репликации, репарации и рекомбинации ДНК позволит разработать тесты для выявления нарушений этих процессов в каждом конкретном случае рака. Обладая такой информацией, мы смогли бы с большим успехом уничтожать клетки-нарушители, подбирая лекарства, бьющие по их «слабым местам».
Заключение
Раковые клетки, согласно определению, не подчиняются существующему в норме контролю размножения (и потому называются неопластическими), и, кроме того, способны проникать в окружающие ткани и образовывать в них колонии - метастазы (т.е. являются злокачественными). Способность к метастазированию (образованию вторичных опухолей) затрудняет хирургическое лечение опухолей. Раковые клетки обычно сохраняют многие черты клеток, из которых они произошли («родительских» клеток). Большинство опухолей развивается из единственной клетки, претерпевшей соматическую мутацию; но прежде, чем дать начало раковой опухоли, в потомстве этой клетки должны произойти некоторые изменения (возможно, несколько дополнительных мутаций). Этот феномен - опухолевая прогрессия, растягивающаяся обычно на годы, - представляет собой эволюцию соматических клеток на основе мутаций и естественного отбора. Процесс может быть ускорен мутагенными агентами (опухолевыми инициаторами) и некоторыми воздействиями немутагенной природы (опухолевыми промоторами), влияющими на экспрессию генов, стимулирующими пролиферацию клеток и изменяющими «экологический баланс» между нормальными и мутантными клетками. Поскольку в развитие каждого конкретного случая рака вносит свой вклад множество факторов и поскольку действие некоторых из них, являющихся элементами внешней среды, можно устранить, оказывается в принципе возможным и предотвращение значительной части онкологических заболеваний.
Множество исследований в онкологии было посвящено поиску методов лечения, которые бы избирательно уничтожали опухолевые клетки, не затрагивая при этом их нормальных соседей. Для рационального решения этой проблемы необходимо понять, какие специфические свойства раковых клеток обеспечивают их развитие, размножение и распространение. Так, пролиферация опухолевых клеток часто сопряжена, по-видимому, с нарушением процесса дифференцировки, когда потомство стволовой клетки продолжает делиться вместо того, чтобы перейти в терминальную (неделящуюся) стадию; в принципе, пролиферацию можно подавить, подтолкнув клетки к дифференцировке. Для превращения в злокачественную опухолевая клетка должна приобрести способность проникать через базальную мембрану. Эту способность раковой клетки можно блокировать с помощью соответствующих антител, тем самым подавляя метастазирование. Мутабильность раковых клеток нередко непомерно велика; это ускоряет появление у них комплекса свойств, необходимых для проявления неопластических и злокачественных характеристик, и способствует формированию устойчивости к противоопухолевым лекарственным препаратам. С другой стороны, нарушения метаболизма ДНК, лежащие в основе такой высокой мутабильности, могут делать раковые клетки весьма чувствительными к соответствующей терапии.