ЭКОЛОГИЧЕСКАЯ МИКРОБИОЛОГИЯ - М. И. Чернявская - 2016
ТЕМА 4. МИКРОБИОЦЕНОЗЫ ВОЗДУХА, ВОДОЕМОВ И ПОЧВ
В природных условиях микроорганизмы не существуют в виде чистых культур. Они растут в смешанных культурах, являясь при этом частью более сложного сообщества, включающего организмы других систематических групп. Места обитания микроорганизмов имеют сложный и постоянно меняющийся характер и зависят от градиентов питательных веществ, лимитирующих факторов (температура, рН, свет, активность воды и др.), наличия токсических соединений. Сочетание вышеперечисленных факторов определяет экологическую нишу конкретного микроорганизма.
Воздух — неблагоприятная среда для микроорганизмов. В воздухе нет питательных веществ, постоянной оптимальной температуры, часто отсутствует влага, губительно действуют солнечные лучи. Микроорганизмы попадают в воздух главным образом с пылью или каплями жидкости с поверхности почвы, воды, растений, животных, транспорта. Микроорганизмы в воздухе распространены неравномерно. Атмосферный и воздух закрытых помещений значительно отличаются по качественному и количественному составу микроорганизмов. Количество микроорганизмов в атмосферном воздухе зависит от погоды (в дождливую погоду их меньше, чем в сухую), времени года (летом их больше, чем зимой), места (над крупными населенными пунктами их больше, чем над сельской местностью). Микроорганизмов мало в воздухе над лесами, садами, лугами, озерами, океаном, высоко в горах. Микробиота воздуха характеризуется наличием большого количества кокковых форм (микрококков, диплококков, сарцин, стафилококков), бацилл (B. subtilis, B. cereus, B. mesentericus), грибов (Penicillium, Aspergillus, Mucor), устойчивых к недостатку влаги и ультрафиолетовым лучам.
Содержание микроорганизмов в воздухе жилых помещений выше, чем в атмосферном воздухе. При оценке санитарного состояния закрытых помещений в зависимости от задачи исследования определяют общее микробное число, наличие санитарно-показательных микроорганизмов (стафилококков, α- и β-гемолитических стрептококков). При исследовании воздуха медицинских учреждений (хирургические клиники, родильные дома) основное внимание направлено на выявление патогенных стафилококков, синегнойной палочки (Pseudomonas aeruginosa) и других грамотрицательных условно-патогенных бактерий — возбудителей внутрибольничных инфекций. На предприятиях микробиологической промышленности выявляют наличие и количественное содержание микроорганизмов-продуцентов (Candida на гидролизно-дрожжевых заводах и заводах по производству белково-витаминных концентратов; Aspergillus и спорообразующие бактерии на ферментных заводах; Bacillus thuringiensis и сальмонеллы — при производстве бактериальных средств защиты растений).
Для изучения микробиоты воздуха, в том числе определения содержания патогенных и условно-патогенных микроорганизмов, используют специальные дифференциально-диагностические среды. Исследование микробиоты воздуха осуществляют с помощью нескольких методов:
✵ седиментационного (метод Коха) — базируется на оседании частиц и капель, содержащих бактерии, на поверхности питательной среды открытой чашки Петри. Затем проводят перерасчет по Омелянскому: на поверхность 100 см2 плотной среды оседает за 5 мин такое количество бактерий, которое содержится в 10 л воздуха. Метод не точен и не пригоден для исследования микробиоты атмосферного воздуха, где наблюдаются большие скорости его движения;
✵ аспирационных — основаны на принудительном осаждении микроорганизмов из воздуха на поверхность плотной питательной среды или в улавливающую жидкость. С использованием прибора Дьяконова происходит улавливание бактерий в жидкости при продувании через нее воздуха, после чего жидкость высевают на различные дифференциально-диагностические среды. С помощью прибора Речменского происходит осаждение микробных аэрозолей паром или распыленной жидкостью. Аппарат Кротова функционирует по принципу ударно-прибивного действия воздушной струи. Струя воздуха проходит через узкую клиновидную щель и с большой скоростью ударяется о влажную поверхность питательной среды. В результате удара находящиеся в воздухе аэрозоли, в том числе пылевые частицы и капли, содержащие бактерии, прибиваются к поверхности питательного агара или элективных сред. Данные методы наиболее точны и надежны.
Вода водоемов содержит большое количество микроорганизмов, относящихся к автохтонной микробиоте, а также попадающих в нее с осадками, сточными водами и другими загрязнениями аллохтонных микроорганизмов. Количественный и видовой состав микробиоты воды в значительной степени зависит от условий среды (наличие питательных веществ, температура, аэрация, окислительно-восстановительные условия, рН и др.).
Автохтонная микробиота рек, озер, морей и океанов представлена аэробными видами водных бактерий различных таксономических и физиологических групп. Общее количество автохтонной микробиоты в открытых водоемах зависит от вида водоема, состава и концентрации органических и неорганических веществ, метеорологических условий, поры года. Водные микроорганизмы осуществляют в водоемах замкнутые циклы основных биогенных элементов, поскольку в микробных сообществах присутствуют первичные продуценты органического вещества (эукариотические и прокариотические фототрофы, прокариоты-хемоавтотрофы), консументы (простейшие) и редуценты (большинство гетеротрофных бактерий и грибов). В поверхностной зоне водоема преобладают микроорганизмы, способные находиться во взвешенном состоянии: клетки, имеющие жгутики, простеки, прикрепительные диски, газовые вакуоли или организмы малых размеров. В этой зоне доминируют олиготрофы и простекобактерии родов Hyphomicrobium, Planctomyces, Blastobacter, Pasteuria, Caulobacter, Asticcacaulis, Prosthecomicrobium, Seliberia, Prosthecochloris и др. К типично планктонным бактериям относятся спириллы. Преобладающими типами метаболизма являются фототрофия, метилотрофия, нитрификация. В зависимости от градиента факторов толща воды делится на подзоны фотосинтеза, продукции биомассы гетеротрофных и хемолитотрофных микроорганизмов, деструкции органического вещества и термоклина. В аэробной толще воды (на глубине до 10 м) разлагается основная масса органического вещества, синтезированного в водоеме и привнесенного извне. Миксобактерии, а также бактерии родов Flexibacter и Cellvibrio способны лизировать живые клетки цианобактерий и зеленых водорослей. Биополимеры мертвой массы микроорганизмов, фитопланктона, высших растений и животных разлагают миксобактерии и представители родов Sporocytophaga, Lysobacter, Beneckea, Alginomonas, Vibrio, Cytophaga. В поверхностном слое ила обитают прикрепленные или скользящие микроорганизмы: микроаэрофильные бактерии родов Flexibacter, Beggiatoa, Thiothrix, факультативно-анаэробные цитофаги и бациллы, нитчатые бактерии Pelonema, Peloploca, Leucothrix, Metallogenium, Hyphomicrobium, Seliberia, зеленые нитчатые бактерии. Анаэробный распад органического вещества в приповерхностном слое донных осадков осуществляют клостридии и энтеробактерии. Нижние слои ила составляют сульфатредукторы и метаногены, завершающие анаэробную деструкцию упавших на дно растительных и животных остатков.
В олиготрофных и бедных органическим веществом водах присутствуют скользящие и простековые бактерии, способные прикрепляться к доступному субстрату и обрастать его, образуя хлопья (флоки).
В морских водах находится большое количество вирусов, архей, ультрамикробактерий (нанобактерий). Археи, традиционно обнаруживаемые в экстремальных местообитаниях, составляют приблизительно третью часть пикопланктона (клетки размером менее 2 мкм). Морские ультрамикробактерии, главным образом представители рода Sphingomonas,устойчивы к голоданию и имеют чрезвычайно малые размеры, благодаря которым не поедаются даже нанофлагеллятами.
В прибрежных зонах водоемов численность и видовой состав водных микроорганизмов резко возрастает. Это связано с их загрязнением аллохтонной микробиотой, попадающей из почвы с ливневыми, талыми и сточными водами. Микробиота сточных вод содержит обитателей кишечника человека и животных, включая представителей нормальной и условно-патогенной микробиоты. Патогенные бактерии слабо приспособлены к существованию в воде, где на них оказывают неблагоприятное воздействие солнечный свет и другие факторы окружающей среды, включая конкурентную водную микробиоту. Тем не менее многие из них могут сохраняться в водной среде довольно продолжительное время.
Микробиологические методы исследования воды сводятся к определению общего количества микроорганизмов в 1 мл воды и выявлению патогенных микроорганизмов (сальмонелл, холерных вибрионов, лептоспир, шигелл и энтеровирусов). Поскольку прямое выделение патогенных бактерий из воды требует специальных исследований, существуют косвенные методы, позволяющие количественно оценить степень загрязнения воды (выявление бактерий группы кишечной палочки — БГКП, энтерококков, стафилококков). Обязательному санитарно-микробиологическому исследованию подлежит вода централизованного водоснабжения, колодцев, открытых водоемов, плавательных бассейнов. Пробы воды для санитарно-микробиологического исследования из открытых водоемов (бассейнов, баков и др.) отбирают с глубины 10 — 15 см, при малой глубине — не менее 10 — 15 см от дна. Пробы из проруби берут на глубине 10 — 15 см от нижней поверхности льда. Пробы воды из желаемого водного горизонта открытых водоемов (колодцев, озер, рек) отбирают с помощью батометра. Микробиологическое исследование отобранных проб воды должно осуществляться не позднее, чем через 2 ч после отбора. В случае невозможности соблюдения этих сроков допускается проведение анализа воды не позднее чем через 6 ч хранения пробы при температуре 1 — 6 °С. Исследование микробиоты воды осуществляют с помощью следующих методов:
• определение общего микробного числа воды — количества микроорганизмов в 1 мл воды. Питьевая вода считается хорошей, если общее количество бактерий в 1 мл не превышает 100, сомнительной — 100 — 150, загрязненной — 500 и более;
• определение коли-титра и коли-индекса воды. Коли-титр — минимальное количество воды (мл), в котором обнаруживаются БГКП. Коли-индекс — количество БГКП, содержащихся в 1 л исследуемой воды (по международному и европейскому стандарту — в 100 мл). Эти показатели устанавливают с помощью двухэтапного бродильного (титрационного) метода или метода мембранных фильтров. Бродильный метод основан на посеве определенных объемов анализируемой воды и подращивании при 37 °С в средах накопления с последующим высевом на плотную среду Эндо, дифференцировании выросших бактерий и выявлении наибольшего вероятного числа БГКП в 1 л воды по таблицам. Метод мембранных фильтров включает концентрирование бактерий из определенных объемов анализируемой воды на мембранном фильтре, выращивание их при 37 °С на среде Эндо, дифференцирование выросших колоний, подсчет количества БГКП в 1 л воды.
Почва — благоприятная среда для развития микроорганизмов, она обильно населена ими и является основным источником их распространения. В почве есть все необходимое для жизнедеятельности микроорганизмов — органические и минеральные вещества, влага, защита от губительных ультрафиолетовых лучей солнца. Количество микроорганизмов в почве и их видовой состав зависят от различных почвенно-климатических факторов: механического состава почвы, ее влагоемкости, кислотности, вида обработки, времени года и др. В почве много палочковидных бактерий, актиномицетов, плесневых грибов. При анализе микробиоты почвы следует учитывать, что культивируемыми в лабораторных условиях являются только 1 — 10 % почвенных микроорганизмов. Некультивируемые формы выявляются с помощью молекулярно-генетических методов: полимеразной цепной реакции (ПЦР) и ее различных модификаций, лигазной цепной реакции (ЛЦР), ДНК-ДНК гибридизации, гибридизации тотальной клеточной РНК.
Почвы содержат множество поверхностей, влияющих на доступность питательных веществ, а различный размер пор делает их в разной степени доступными для колонизации микроорганизмами. Почвы состоят из песка, глины, ила и других частиц. Постоянно прибывающие в виде растительных и животных остатков органическое вещество постепенно трансформируется в богатый питательными веществами гумус. Перечисленные компоненты формируют гетерогенные агрегаты, или почвенные частицы, пронизанные сложной сетью пор. Бактерии и грибы используют разные стратегии для получения преимуществ в этом физически сложном субстрате. На поверхности почвенных частиц бактерии обычно присутствуют в виде микроколоний, в почвенном растворе в порах — в виде суспензии. Бактерии нуждаются в непосредственной близости воды и питательных веществ. Мицелиальные грибы растут на почвенных агрегатах или между ними и могут формировать мостики между отдельными агрегатами, добираясь в места, где влага более доступна. Простейшие обитают в водной пленке.
Почвы формируются в различных условиях окружающей среды. В местах выветривания нового геологического материала после землетрясения или извержения вулкана начинается его колонизация микроорганизмами. «Пионерами» здесь выступают цианобактерии, способные к фотосинтезу и азотфиксации. Большую роль в формировании и функционировании почв играют грамположительные бактерии: коринеформные и нокардиоформные бактерии, актиномицеты.
Критическим является распределение микроорганизмов по почвенному профилю: 1) на поверхности почвы в области подстилки и опада; 2) в аэрируемом слое с развитой корневой системой растений; 3) ниже уровня почвенных вод.
Разлагающийся растительный опад — область развития гидролитических аэробных микроорганизмов, оптимальная среда для развития сапро- трофных грибов, поскольку опад представлен в первую очередь лигноцел- люлозой. К характерным сапротрофным грибам в подстилке относятся Alternaria и Cladosporium, в нижележащем гумусовом слое доминируют Penicillium, Trichoderma, Fusarium. Продукты разложения грибами опада, а также отмерший мицелий служат субстратом для развития микофильных бактерий и актиномицетов.
Большой интерес представляет ассоциация микроорганизмов почвы с корневой системой растений. Корни располагаются в почвенном горизонте, наиболее богатом органическим веществом. Взаимодействие микроорганизмов с корневой системой растений включает в себя:
1) область почвы, прилегающую к корням растения и попадающую под непосредственное действие корневых выделений, — ризосферу;
2) поверхность корня — ризоплану;
3) ткань корня.
В ризосфере наблюдается действие корневых экссудатов, содержащих различные органические вещества (углеводы, аминокислоты, органические кислоты), и корневого опада. Разнообразие микроорганизмов вблизи корня определяется множеством поступающих веществ, трофических взаимодействий микроорганизмов между собой и влиянием специфических веществ растений. Здесь обнаруживается широкий спектр органотрофных аэробных бактерий, пищевые потребности которых ориентированы на экссудаты. Как правило, эта область развития микроорганизмов характеризуется избытком органического углерода и лимитирующим содержанием азота и фосфора. На поверхности листьев в филлосфере развиваются организмы, специфически взаимодействующие с растением, а также паразитические бактерии и грибы.
Сапротрофные микроорганизмы, ведущие процессы минерализации веществ органического опада, С. Н. Виноградский предложил назвать зимогенной микробиотой, а микроорганизмы, разлагающие гумус почвы, — автохтонной микробиотой. Микроорганизмы, развивающиеся за счет минимальных концентраций органических веществ, завершающие минерализацию органического опада в почве, получили название олиготрофной микробиоты. Среди этой группы микроорганизмов выделяются олигонитрофилы,нуждающиеся в минимальной концентрации органических азотсодержащих веществ, и олигокарбофилы, потребляющие остаточные органические углеродсодержащие соединения. Микроорганизмы, использующие в качестве источника углерода CO2 или карбонаты и получающие энергию за счет реакций окисления минеральных соединений, объединены в группу автотрофной микробиоты.
Значительный вклад почвенных микроорганизмов в процессы трансформации основных биогенных элементов в природе обусловлен сложной структурой микробиоценоза почвы. Процесс разложения веществ органического опада, поступающего в почву, начинает зимогенная микробиота, представленная различными сапротрофными микроорганизмами. На первых этапах минерализацию легкодоступных органических соединений ведут неспорообразующие бактерии родов Pseudomonas, Proteus и др. Дальнейший процесс глубокой минерализации органических веществ сопровождается сукцессией микроорганизмов. На смену неспорообразующим бактериям приходят различные виды бацилл (B. subtilis, B. mesentericus и др.). Частично продукты растительного и животного опада, а также микробные метаболиты превращаются в перегной, который постепенно минерализуется автохтонной микробиотой. Последняя представляет собой специфическую подгруппу сапротрофных микроорганизмов, обладающих более мощным ферментативным аппаратом, способным окислять сложные циклические соединения. К таким микроорганизмам относятся актиномицеты, ко- ринеформные и нокардиоформные бактерии. Конечные этапы минерализации остаточных продуктов распада органических веществ и гумуса в минимальной концентрации осуществляют олиготрофные микроорганизмы. Эта группа микроорганизмов включает ряд специфических
видов сапротрофных микроорганизмов, приспособившихся к развитию на бедных субстратах. Неорганические соединения (NH3, H2S, Н2 и др.), образующиеся при минерализации органических веществ, трансформируются в процессе жизнедеятельности автотрофных микроорганизмов. Последние используют минеральные соединения как источники энергии, окисляя их в реакциях энергетического метаболизма клетки. Соотношение вышеперечисленных групп микроорганизмов определяет характерную структуру микробиоценоза каждого зонального типа почвы. При составлении микробиологической характеристики почвы необходимо учитывать неравномерность распределения микроорганизмов в почвенных микролокусах, высокую динамичность численности и качественного состава почвенной микробиоты, а также недостаточную разработанность систематики и идентификации большинства видов почвенных микроорганизмов.
Помимо автохтонной микробиоты в почве обнаруживаются попавшие туда представители нормальной микробиоты человека и животных, а также патогенные микроорганизмы. Аллохтонные микроорганизмы в почве обычно долго не выживают, однако некоторые представители нормальной микробиоты человека способны включаться в состав биоценоза почвы, а отдельные виды остаются ее постоянными обитателями. На выживаемость патогенных бактерий в почве влияют состав и тип почвы, температура, влажность, атмосферные осадки, степень и характер загрязненности (органическое, химическое или микробное загрязнение). Патогенные микроорганизмы, обнаруживаемые в почве, разделяют на три группы:
✵ постоянно обитающие в почве (например, Clostridium botulinum, представители рода Actinomyces — возбудители подкожных микозов, некоторые возбудители микотоксикозов);
✵ спорообразующие, для которых почва является вторичным резервуаром (например, Bacillus anthracis, Clostridium tetani, некоторые виды Clostridium, вызывающие анаэробные инфекции). Бактерии попадают в почву с выделениями человека и животных, а также трупами животных. При благоприятных условиях они могут размножаться, а при неблагоприятных — сохраняться в почве в виде спор длительное время;
✵ не образующие спор, попадающие в почву с выделениями человека и животных и сохраняющиеся сравнительно недолго — в течение нескольких недель или месяцев (например, бактерии родов Salmonella, Shigella, Vibrio, Brucella, Francisella, Mycobacterium, Leptospira, Pseudomonas).
Оценку санитарного состояния почв проводят с учетом комплекса показателей: подсчитывают общее количество сапротрофных микроорганизмов и определяют наличие санитарно-показательных микроорганизмов (БГКП, Clostridium perfringens и др.). Высокая численность сапротрофной микробиоты свидетельствует об органическом загрязнении, при микробной контаминации преобладают санитарно-показательные микроорганизмы. При необходимости исследуют состав нитрифицирующих и аммонифицирующих бактерий, актиномицетов, грибов, целлюлозолитических микроорганизмов.
Контрольные вопросы
1. Каковы особенности воздуха как среды обитания микроорганизмов?
2. Какими группами микроорганизмов представлена микробиота воздуха?
3. Какие методы используются для исследования микробиоты воздуха?
4. Какими группами микроорганизмов представлена автохтонная микробиота водоемов?
5. Какие факторы влияют на качественный и количественный состав водных микроорганизмов?
6. Какие микробиологические методы применяются для исследования воды?
7. Каковы особенности почвы как среды обитания микроорганизмов?
8. Назовите основные физиологические и таксономические группы микроорганизмов, обитающих в почве.
9. На какие группы разделяют патогенные микроорганизмы, обнаруживаемые в почве?
10. Какие показатели используют для оценки санитарного состояния почв?
Лабораторная работа 6. Исследование микробиоты воздуха, почвы и воды
Цель работы: освоить методы определения качественного и количественного состава микробиоты воздуха, почвы и воды.
Материалы и оборудование: физиологический раствор, ПДА, среда Эндо, среда Эшби, среда Чапека, казеиново-глицериновый агар (КГА), стерильная дистиллированная вода, стерильные пробирки, стерильные чашки Петри, стерильные флаконы (объемом 500 мл), пипетки на 1 — 2 мл и 5 — 10 мл, шпатели, спиртовка, термостат, предметные стекла, реактивы для окраски по методу Грама.
Ход работы
1. Исследование микробиоты воздуха методом Коха.
1) Чашки Петри с ПДА и средой Эндо открывают в исследуемом помещении (учебная аудитория, лаборатория, коридор, буфет, лестница) и оставляют открытыми в течение 5 мин, после чего закрывают крышкой и помещают в термостат при 28 — 30 °С на 24 ч.
2) Описывают морфологические признаки сформировавшихся колоний.
3) Из морфологически различающихся колоний готовят препараты, окрашивают их по методу Грама, микроскопируют.
4) На основании морфологического разнообразия и количества выросших колоний делают вывод о качественном и количественном составе микробиоты воздуха.
5) Рассчитывают количество микроорганизмов в 1 м3 воздуха для каждого изученного помещения по формуле
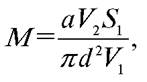
где М — количество КОЕ в 1 м3 воздуха; а — количество колоний, сформировавшихся на чашке; V1 — объем воздуха (л), из которого осаждаются микроорганизмы на поверхности среды площадью S1 (см2) (V1 = 10 л, S1= 10 см2); V2 — объем воздуха, для которого производится расчет (л); d — диаметр чашки Петри.
6) Результаты вносят в таблицу (табл. 6).
Таблица 6. Качественный и количественный состав микробиоты воздуха помещений
Помещение |
Общее число бактерий, КОЕ/м3 |
Количество морфотипов |
2. Исследование микробиоты воды.
1) Воду из водоема (400 — 500 мл) отбирают в стерильные флаконы объемом 500 мл непосредственно перед высевом. Отбор проб проводят на глубине не менее 10 — 15 см от дна.
2) Водопроводную воду (400 — 500 мл) отбирают из крана, предварительно протертого ватным тампоном, смоченным спиртом, после 10 — 15 мин спускания воды. При проведении анализа хлорированной воды во флакон для отбора проб перед стерилизацией вносят дехлоратор — 10 мг гипосульфита натрия.
3) Из каждой пробы воды готовят последовательные десятикратные разведения в стерильной воде (до 10-4).
4) По 1 мл исходной пробы воды и соответствующих разведений (10-1 — 10-4) вносят в стерильные чашки Петри (по 2 серии чашек для каждого разведения), заливают 20 мл расплавленного и остуженного до 45 — 50 °С ПДА, тщательно перемешивают круговыми движениями.
5) После застывания агара одну серию чашек помещают в термостат при 37 °С на 24 ч, вторую — при 20 °С на 48 ч.
6) Подсчитывают количество выросших на поверхности и в глубине агара колоний и вычисляют микробное число воды. Делают вывод о качестве водопроводной воды и воды из водоема.
7) Из колоний различных морфотипов готовят фиксированные препараты, окрашивают их по Граму и микроскопируют. На основании морфологического разнообразия выросших колоний делают вывод о качественном составе микробиоты воды. Результаты вносят в таблицу (табл. 7).
Таблица 7. Качественный и количественный состав микробиоты воды
№ пробы |
Место отбора |
Микробное число |
Количество морфотипов |
Качество воды |
3. Исследование микробиоты почвы.
1) Образцы почвы (200 — 300 г) отбирают стерильным ножом на глубине 10 — 15 см, помещают их в стерильную банку или пакет.
2) Из образцов почвы готовят навеску (10 г), которую переносят в стерильную ступку, добавляют 2 — 3 мл стерильной воды и растирают до пастообразного состояния.
3) Полученную почвенную суспензию вносят в колбу со стерильной водой (90 мл), тщательно размешивают в течение 5 мин, дают отстояться 30 мин. Это первое разведение (10-1) исследуемой пробы почвы.
4) Готовят ряд десятикратных разведений (до 10-6).
5) По 0,1 мл из 10-4 — 10-6 разведений высевают шпателем на поверхность питательных сред (каждое разведение на 4 чашки):
✵ ПДА — для определения общего количества бактерий;
✵ среду Чапека и КГА — для учета и выделения актиномицетов;
✵ среду Эшби — для учета и выделения азотобактера.
6) Засеянные чашки Петри помещают в термостат при 28 °С. Общее количество бактерий на ПДА учитывают через 1 — 5 суток, актиномицетов и азотобактера — 5 — 7 суток.
7) Из колоний с разной морфологией готовят фиксированные препараты, окрашивают их по методу Грама и микроскопируют.
Таблица 8. Качественный и количественный состав микробиоты почвы
№ пробы |
Место отбора |
Общее число бактерий (КОЕ/г) |
Количество в 1 г почвы |
|
актиномицетов |
азотобактера |
|||
8) На основании морфологического разнообразия и количества выросших колоний делают вывод о качественном и количественном составе микробиоты почвы. Результаты вносят в таблицу (табл. 8).