Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Компоненты биомолекулярных комплексов
Химическая связь и межмолекулярные взаимодействия
Возникновение и существование земной жизни, стало возможно лишь благодаря уникальной способности углерода образовывать большие молекулы. Из-за малых размеров и наличия во внешней оболочке четырех электронов атом углерода может образовывать четыре прочные ковалентные связи с другими атомами.
Ковалентная связь образуется при обобществлении электронов взаимодействующими атомами, при этом различие между ковалентной и ионной связями определяется степенью поляризации связи (рисунок 41).
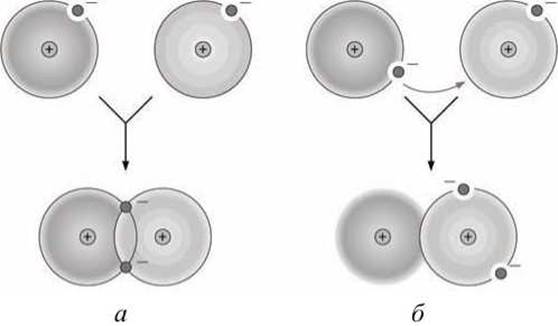
Рисунок 41 - Образование химической связи между двумя атомами: а - ковалентная связь (обобществление электронов); б - ионная связь (перенос электрона)
В случае ионной связи электрон "полностью" переносится от одного атома к другому. В большинстве случаев реализуется промежуточная ситуация ("неравноправное" обобществление электронов), что приводит к образованию полярной ковалентной связи.
Каждый атом образует определенное число ковалентных связей, которые определенным образом расположены в пространстве.
Наиболее важное значение имеет способность атомов углерода соединяться друг с другом (рисунок 42), образуя (а) цепочки, (б) разветвления и (в) кольца и создавая в результате большие и сложные молекулы, на размеры которых не накладывается никаких ограничений.
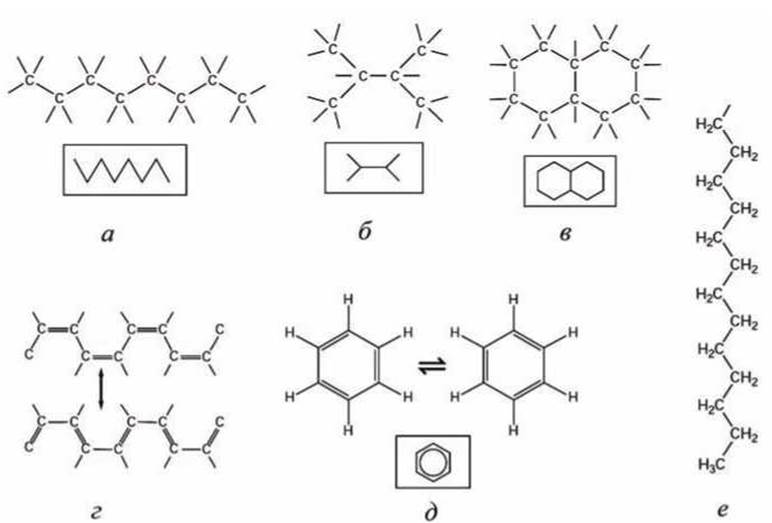
Рисунок 42 - Структуры, образуемые атомами углерода: а - цепочка; б - разветвление; в - кольца; г - система двойных С=С связей, стабилизирующих структуру, может быть представлена как суперпозиция двух состояний; ó - аналогично предыдущему случаю, распределение электронов при образовании углеродного кольца может быть представлено в виде суперпозиции двух состояний; ниже приведено обозначение такой структуры; е - углеводородная цепочка
Нековалентные взаимодействия являются определяющими в формировании функциональной структуры биологических макромолекул и клеточных компонентов.
Силы нековалентных межмолекулярных взаимодействий являются короткодействующими - они проявляются на расстояниях менее 10-9м.
Нековалентные взаимодействия подразделяют на:
(1) электростатические (или ионные) взаимодействия,
(2) ван-дер-ваальсовые силы,
(3) водородную связь,
(4) гидрофобные силы.
Электростатические силы обеспечивают взаимодействие между полностью или частично заряженными функциональными группами.
Ван-дер-ваальсовые взаимодействия имеют электромагнитную природу и определяются взаимодействием электрических диполей молекул. В зависимости от того, обладает ли взаимодействие молекулы электрическим дипольным моментом, или последнее возникает вследствие поляризации оболочек, существуют различные типы ван-дер-ваальсовых сил:
1) диполь-дипольное взаимодействие полярных молекул,
2) индукционное взаимодействие диполя полярной молекулы с индуцированным диполем другой молекулы,
3) дисперсионное взаимодействие индуцированных диполей двух молекул.
Водородная связь определяет растворимость в воде незаряженных молекул.
Водородная связь - это взаимодействие частично положительно заряженного атома водорода в молекулярном диполе (пример такого диполя - молекула воды) с неподелённой электронной парой другого атома либо в этой же молекуле (внутримолекулярная), либо на другой молекуле (межмолекулярная водородная связь).
Система водородных связей определяет уникальные свойства воды - самого распространенного соединения в живых организмах. Вода заполняет клетки и межклеточные пространства и представляет собой ту среду, в которой осуществляются диффузия веществ, химические реакции и взаимодействия макромолекул (белков и нуклеиновых кислот) друг с другом. Кроме того, вода сама непосредственно участвует во многих химических реакциях клетки.
Два свойства воды: (1) способность образовывать водородные связи и (2) обратимая ионизация - оказываются весьма существенными для протекания внутриклеточных процессов.
Атомы кислорода и водорода обладают разным сродством к электрону (электроотрицательностью), и, хотя молекула воды в целом электрически нейтральна, на кислороде локализуется частичный отрицательный, а на атомах водорода - частично положительный заряды. Два электроотрицательных атома связываются через атом водорода, образуя водородную связь. Водородные связи характерны не только для воды.
Белки и нуклеиновые кислоты содержат большое число внутримолекулярных водородных связей, которые играют важную роль в организации структуры и функционировании этих макромолекул (рисунок 43).
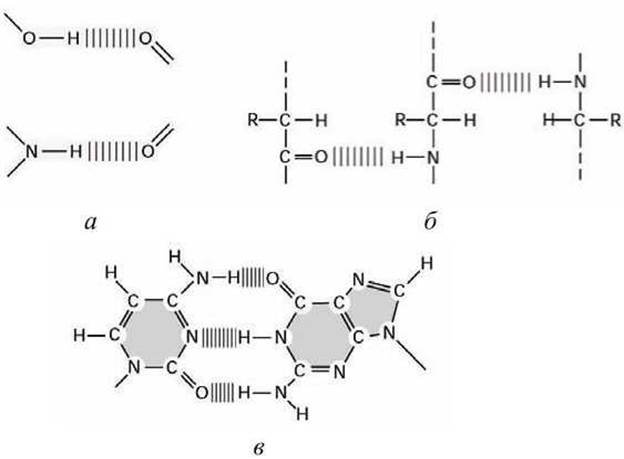
Рисунок 43 - Водородная связь: а - сила связи наибольшая при линейном расположении атомов; б - водородные связи между полипептидными цепями белков; в - азотистые основания цитозин и гуанин в ДНК спариваются, образуя водородные мостики
Водородные связи намного слабее ковалентных. Энергия водородных связей в жидкой воде (т.е. энергия, необходимая для разрушения одной связи) составляет примерно 18,8 кДж/моль, тогда как энергия ковалентных связей Н-O в молекулах воды равна 460 кДж/моль.
Молекулы в жидкой воде находятся в непрерывном тепловом движении, поэтому образующиеся водородные связи постоянно и быстро разрываются и вновь восстанавливаются.
Среднее время жизни водородной связи при комнатной температуре не превышает 1,5x10-9 с. Каждая молекула воды может образовывать водородные связи с четырьмя соседними молекулами, однако при комнатной температуре каждая молекула воды образует водородные связи в среднем с 3,4 других молекул.
Любые молекулы, между которыми возможны водородные связи, могут образовывать такие же связи с молекулами воды. Из-за такой конкуренции с молекулами воды, водородные связи, образуемые между двумя молекулами в водном растворе, относительно слабы.
Аномально высокие (по сравнению с большинством других жидкостей) удельная теплоемкость и теплота испарения воды является следствием высокого межмолекулярного сцепления в воде, обусловленного образованием водородных связей. Эти особенности воды важны для поддержания постоянства внутренней температуры живыми организмами.
При изменении температуры внешней среды в клетке происходит поглощение или выделение тепла благодаря разрыву или новообразованию водородных связей между молекулами воды. Таким образом, колебания температуры внутри клетки, несмотря на резкие её изменения во внешней среде, ослабляются - вода выступает в роли термостата.
Благодаря высокой теплоте испарения воды организмы могут эффективно защищаться от перегрева, поскольку на испарение 1 г воды с поверхности листа или в виде пота с поверхности кожи расходуется 2,26 кДж тепловой энергии.
Полярный характер молекулы воды делает её значительно лучшим растворителем, чем большинство других общеизвестных жидкостей. В воде растворяются очень многие вещества, причем растворимость некоторых веществ определяется способностью воды образовывать водородные связи с гидроксильными и карбоксильными группами других молекул.
Неполярные молекулы не образуют нековалентных связей с молекулами воды, что проявляется в нерастворимости таких веществ в воде - их гидрофобности. При этом, молекулы воды вокруг гидрофобного включения образуют упорядоченную ячеистую (клатратную) сеть водородных связей, понижая энтропию воды (рисунок 44).
Агрегация гидрофобных включений приводит к уменьшению числа молекул воды, задействованных в гидратной оболочке, часть молекул воды "освобождается", что повышает энтропию, а, следовательно, такой процесс энергетически выгоден и может протекать самопроизвольно.
Явление агрегации гидрофобных молекул в объеме воды называют гидрофобным эффектом или гидрофобным взаимодействием этих молекул.
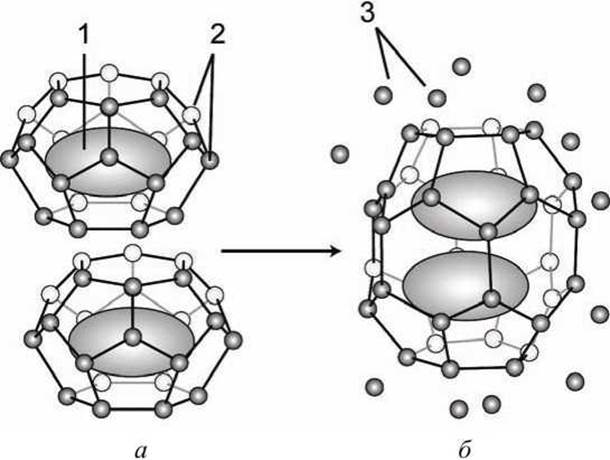
Рисунок 44 - Гидрофобное взаимодействие: а - неагрегированное, энергетически невыгодное состояние, водное окружение более упорядочено, энтропия ниже; б - агрегированное, энергетически выгодное состояние, водное окружение менее упорядочено, энтропия выше. 1 - неполярное вещество; 2 - упорядоченные молекулы воды; 3 - молекулы воды освобожденные в объем раствора
Рисунок 45 иллюстрирует систему нековалентных связей, посредством которой образуется стабильный комплекс из двух белков. Любое другое пространственное расположение тех же самых функциональных групп двух белков не приведет к такому прочному связыванию.
Именно такие множественные специфические взаимодействия между комплементарными областями белковых молекул (1) формируют и поддерживают трехмерную функциональную структуру белковых глобул, а также (2) соединяют две цепи ДНК в двойную спираль.
Молекулы воды обладают лишь слабо выраженной способностью к обратимой ионизации - в чистой воде при нормальных условиях концентрация ионов Н+ и ОН-, на которые диссоциирует молекула воды, не превышает 10-7 моль/литр.
Однако образующиеся при объединении с протоном ионы гидроксония (Н3O+), равно как и гидроксил-ионы (ОН-) играют исключительно важную роль в биологических процессах.
Поскольку молярная концентрация иона гидроксония мала, её принято выражать через величину её отрицательного десятичного логарифма, который обозначается символом pH. От величины pH зависят структура, растворимость и биологическая активность макромолекул.
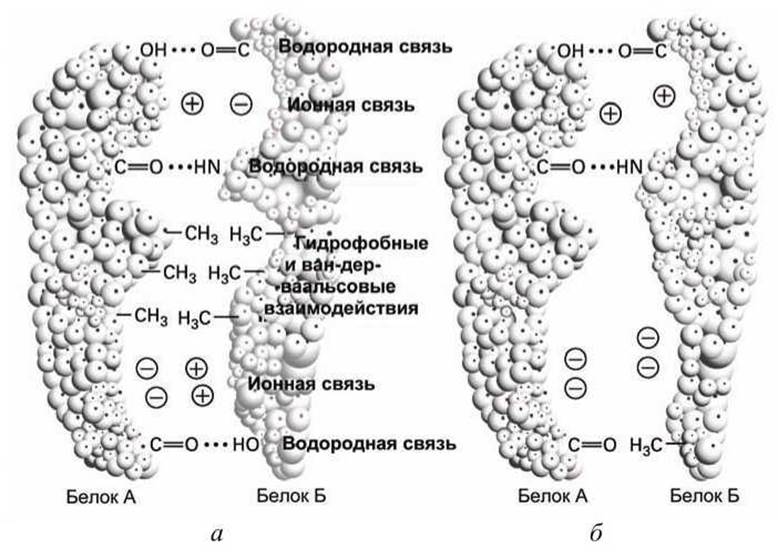
Рисунок 45 - Система нековалентных взаимодействий, объединяющих две белковые молекулы в единый комплекс: а - прочный комплекс; б - менее прочный комплекс