ЗАГАЛЬНА МІКРОБІОЛОГІЯ - Т.П. Пирог - 2004
13. БІОСИНТЕТИЧНІ ПРОЦЕСИ У МІКРООРГАНІЗМІВ
13.2. БІОСИНТЕЗ АМІНОКИСЛОТ
Більшість мікроорганізмів здатні синтезувати de novo всі 20 амінокислот, з яких складаються білки. Вуглецеві скелети амінокислот будуються з проміжних продуктів обміну, аміногрупи вводяться прямим амінуванням або трансамінуванням. Переведення неорганічного азоту в органічні сполуки завжди відбувається через аміак. Нітрати, нітрити, молекулярний азот (джерела азоту в поживних середовищах) попередньо відновлюються до аміаку (асиміляційна нітратредукція) і тільки після цього включаються до складу органічних сполук (рис. 13.1, а, б, в).
Лише небагато амінокислот утворюються в результаті прямого амінування вільними іонами амонію. У первинній асиміляції аміаку беруть участь L-глутаматдегідрогеназа та L-аланіндегідрогеназа, які здійснюють відновлювальне амінування 2-оксокислот (пірувату та 2-оксоглутарату) (рис. 13.1, д, е). АТФ у цьому процесі участі не бере. Утворення глутаміну з глутамату каталізується глутамінсинтетазою і потребує витрат АТФ (рис. 13.1, г). За допомогою глутаматсинтази аміногрупа глутаміну може бути перенесена на 2-оксоглутарат з утворенням глутамату (рис. 13.1. ж).
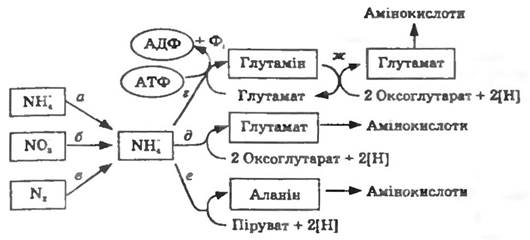
Рис. 13.1. Найважливіші шляхи асиміляції азоту:
іони амонію, що містяться у поживному середовищі, безпосередньо поглинаються клітинами (а). Іони нітрату під час асиміляційної нітрат- редукції (б), в молекулярний азот під час фіксації азоту (в) відновлюються до іонів амонію. В органічні сполуки амонійний азот перетворюється або за участю АТФ утворенням глутаміну, або без витрат АТФ прямим відновлювальним амінуванням 2-оксоглутарату чи пірувату
Решта амінокислот отримує свою аміногрупу від первинних амінокислот у результаті трансамінування. З вільних амінокислот у цитоплазмі кількісно переважає глутамінова кислота (більше половини всього «пулу" амінокислот).

Всі необхідні для синтезу білків 20 амінокислот утворюються з певних метаболічних попередників (рис. 13.2).
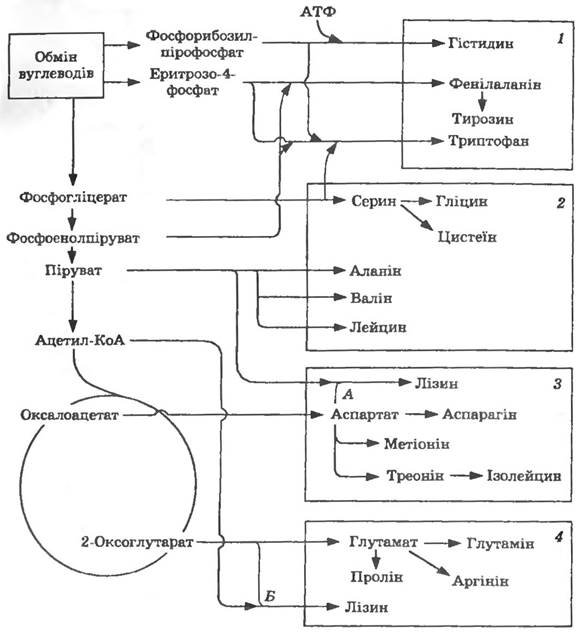
Рис. 13.2. Шляхи біосинтезу амінокислот:
родини амінокислот: і — ароматичних амінокислот і гістидину; 2 — піру- ватна; 3 — аспартатна; 4 — глутаматна.
Шляхи біосинтезу лізину: А —діамінопімеліновий; Б — аміноадипіновий
Як видно з наведених даних, субстратами для синтезу амінокислот є декілька сполук — піруват, оксалоацетат, 2-оксоглу-3-фосфогліцерат, фосфоенолпіруват, еритрозо-4-фосфат і 5-фосфорибозил-пірофосфат. Оксалоацетат являє собою відправну точку для синтезу шести амінокислот, 2-оксоглутаратє попередником синтезу чотирьох, а піруват — трьох амінокислот. На рис. 13.2 показано два можливі шляхи синтезу лізину: А — діамінопімеліновий і Б — аміноадипіновий.
Мікроводорості, гриби, дріжджі здійснюють синтез лізину через аміноадипінову, бактерії — через діамінопімелінову кислоту.
Аланін та аспартат синтезуються з пірувату та оксалоацетату трансамінуванням з використанням глутамату як донора аміногрупи. Аспарагін утворюється в реакції, аналогічній реакції, що каталізується глутамінсинтетазою. Відновлення аспартату дає напівальдегід аспарагінової кислоти — попередник лізину, треоніну та метіоніну. Дезамінування треоніну приводить до утворення 2-оксобутирату, який в результаті послідовної дії чотирьох ферментів перетворюється на ізолейцин. Під дією чотирьох ферментів піруват перетворюється на валін; проміжний продукт синтезу валіну служить попередником в утворенні лейцину. Серин, гліцин і цистеїн синтезуються з 3-фосфогліцерату, а пролін та аргінін — з глутамату.
Складнішим є синтез ароматичних амінокислот (рис. 13.3). Еритрозо-4-фосфат і фосфоенолпіруват конденсуються з утворенням С7-сполуки, яка піддається циклізації. Загальним проміжним продуктом синтезу ароматичних амінокислот є хоризмат. У цій точці біосинтетичний шлях розгалужується на два: 1) утворення триптофану через антранілат; 2) утворення тирозину та фенілаланіну через префенат ірис. 13.3).
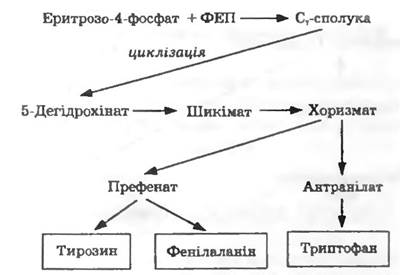
Рис. 13.3. Біосинтез ароматичних амінокислот