Общая микробиология - Шлегель Г. 1987
Фиксация молекулярного азота
Биохимия азотфиксации
Связывание N2 это восстановительный процесс, и первым его продуктом, который можно обнаружить, является аммиак. Процесс восстановления происходит на ферментном комплексе - нитрогеназе. Нитрогеназа состоит из двух компонентов: белка, в состав которого входят молибден, железо и сера, и белка, содержащего железо и серу1. Как сам фермент, так и процесс фиксации N2 отличаются крайней чувствительностью к молекулярному кислороду. Это позволяет понять, почему как у свободноживущих азотфиксирующих бактерий, так и в ткани клубеньков есть особые механизмы, защищающие нитрогеназу от высокого парциального давления кислорода.
Для связывания молекулярного азота необходимы восстановительная сила и энергия (рис. 13.2), которые могут быть получены в процессе фотосинтеза, брожения или дыхания. В модельных экспериментах с очищенными компонентами нитрогеназной системы (in vitro) можно доставлять энергию в виде АТР и восстановительную силу в форме восстановленных пиридиннуклеотидов и ферредоксинов, используя переносчики, содержащие флаводоксин. Затраты АТР при этом очень высоки.
Нитрогеназная система восстанавливает не только молекулярный азот (N≡N), но и ацетилен (НС≡СН), азид, закись азота, цианид, нитриты, изонитрилы и протоны. На восстановлении ацетилена основан наиболее простой метод, позволяющий выявить нитрогеназу. Ацетилен восстанавливается только до этилена, который легко поддается количественному определению с помощью газовой хроматографии. Все до сих пор исследованные азотфиксирующие микроорганизмы и симбиотические системы способны восстанавливать ацетилен.
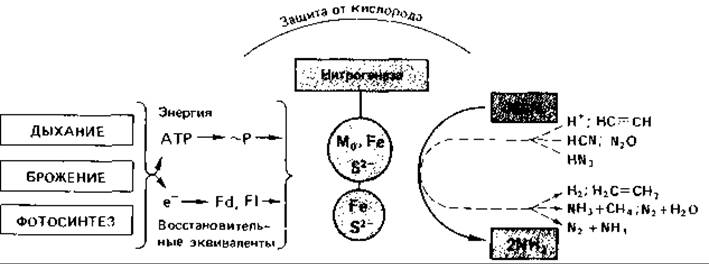
Рис. 13.2. Общая схема фиксации азота. Fd - ферредоксин; Fl - флаводоксин.
1 Их называют «компонент I» (или Mo-Fe-белок) и «компонент II» (или Fe - S-белок). - Прим. ред.
Если не г молекулярного азота, нитрогеназная система восстанавливает протоны до молекулярного водорода. Таким образом, нитрогеназная система обладает также свойствами ATP-зависимой Н2-образующей гидрогеназы. Поскольку молекулярный водород образуется и в присутствии N2, можно включить соответствующую реакцию в уравнение, описывающее фиксацию азота:
8[Н] + N2 + 2Н+ - 2NH+4 + Н2
Большинство азотфиксирующих бактерий содержит наряду с нитрогеназой и (классическую) гидрогеназу. активирующую Н2. Функция этой гидрогеназы заключается, по-видимому, в использовании водорода, образующегося при фиксации молекулярного азота.
Регуляция связывания азота. У многих бактерий нитрогеназа образуется только тогда, когда она необходима, т. е. в отсутствие подходящего источника связанного азота. Ионы аммония подавляют синтез нитрогеназы. У пурпурных и зеленых бактерий под влиянием этих ионов уменьшается также активность уже синтезированного фермента. В регуляции образования нитрогеназы большую роль, очевидно, играет глутаминсинтетаза. Глутаминсинтетаза и глутаматсингаза нужны бактериям для включения ионов аммония в органические соединения в том случае, если эти ионы присутствуют лишь в низкой концентрации. Эта система обладает высоким сродством к ионам аммония и поддерживает их концентрацию в клетке на низком уровне. Повышение концентрации ионов аммония в окружении клетки (а тем самым и внутри клетки) подавляет образование глутаминсинтетазы, а в результате - и нитрогеназы.
Перенос генов азотфиксацни (nif-генов). Способность к азотфиксации удается передавать путем прямого межклеточного контакта от одной бактерии к другой. Возможность передачи nif-генов от Klebsiella pneumoniae к Escherichia coli путем конъюгации, а также факт локализации этих генов в плазмиде позволяют надеяться, что в близком будущем удастся осуществить передачу их другим видам бактерий1, а может быть, даже эукариотическим организмам. Но поскольку для фиксации азота кроме нитрогеназы нужен еще специфический белок, содержащий железо и серу, а также требуется защита этого фермента от O2, подобные эксперименты сопряжены с большими трудностями.
1Сейчас такой перенос уже осуществлен. - Прим. ред.