Общая микробиология - Шлегель Г. 1987
Постоянство, изменение и передача признаков
Передача признаков и генетическая рекомбинация
У эукариотических организмов в процессе оплодотворения объединяются гаплоидные наборы генов и образуется диплоидная зигота. В дочернем диплоидном организме после немногих или же многократных митотических делений в процессе редукционного деления (мейоза) происходит перекомбинирование хромосом, принадлежавших двум родительским наборам, и снова образуются клетки с гаплоидными наборами генов (гаметы). Такому половому способу «перетасовки» генетического материала противопоставляют парасексуальные процессы, к которым относится и рекомбинация признаков у прокариот. Бактерии почти всегда гаплоидны; у них имеется только один набор генов. Зиготы образуются и у бактерий, но они никогда не бывают продуктом объединения целых клеток. Как правило, из клетки-донора в клетку-реципиент переносится лишь часть генетического материала, т. е. образуется неполная зигота (мерозигота). Хромосома реципиента спаривается с фрагментом хромосомы донора, и они обмениваются отдельными участками. При последующем делении ядра и клетки возникает клетка, содержащая только рекомбинированную хромосому (рис. 15.11). У бактерий известны три способа передачи признаков: конъюгация, трансдукция и трансформация.
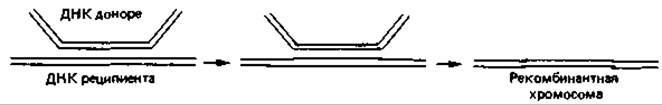
Рис. 15.11. Общая гомологичная рекомбинация: обмен между фрагментом ДНК донора (выделен красным цветом) и хромосомой бактерии-реципиента. Согласно одной, из моделей, гомологичные двойные цепи ДНК сближаются и обмениваются участками одной из цепей, а затем в результате репликации или репарации образуется рекомбинантная хромосома.
В результате этих грех процессов ДНК переносится из бактерии-донора в бактерию-реципиент. Эти процессы отличаются друг от друга способом транспортировки ДНК. После переноса ДНК в клетке-реципиенте происходит рекомбинация. При этом ДНК донора встраивается в ДНК бактерии-реципиента. Клетку, в которой произошла рекомбинация, называют рекомбинантом.
15.3.1 Генетическая рекомбинация
В настоящее время известны по меньшей мере три разных механизма рекомбинации попавшей в бактериальную клетку чужеродной ДНК с бактериальной хромосомой (или с плазмидой) in vivo: 1) общая гомологичная рекомбинация, 2) сайт-специфическая рекомбинация и 3) негомологичная рекомбинация.
Общая гомологичная рекомбинация. В этом случае поступившая извне ДНК рекомбинируется с клеточной ДНК путем реципрокного обмена соответствующими участками. Если не считать различий, обусловленных мутациями, партнеры по рекомбинации должны иметь одинаковую нуклеотидную последовательность, т. е. быть максимально гомологичными. Гомологичная рекомбинация находится под контролем гена rес А; мутанты с дефектом этого гена (rес-) не способны к гомологичной рекомбинации.
Существует несколько моделей данного механизма. Предполагают, что спаривание оснований происходит между деспирализованными, одноцепочечными участками двух двойных цепей ДНК. Вторая цепь, возможно, образуется в результате репликации или репарации.
Сайт-специфическая рекомбинация. Этот процесс осуществляется независимо от гомологичной рекомбинации, т. е. возможен и у мутантов rес-. Он состоит в том, что короткая двухцепочечная ДНК встраивается в определенном месте в длинную двойную спираль; при этом меньший партнер теряет свою автономность. Типичным примером сайт-специфической рекомбинации может служить интеграция бактериофага лямбда (X) (рис. 4.14).
Генетические эксперименты свидетельствуют о том, что фаг при переходе в состояние профага включается в хромосому клетки-хозяина в определенном месте - между gal-опероном и биотиновой областью (рис. 15.12). Включению фага предшествует его присоединение к определенному участку бактериальной ДНК. Ранее считали, что оно определяется высокой степенью гомологии нуклеотидных последовательностей, однако эта гомология оказалась незначительной; по-видимому, большую роль здесь играет кодируемый фагом белок-так называемая иитеграза. В определенном участке фаговой ДНК (att В) и в соответствующем участке бактериальной ДНК (att λ.) этот белок катализирует разрыв и перекрестное воссоединение геномов фага и клетки-хозяина.
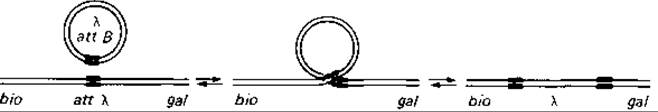
Рис. 15.12. Сайт-специфическая рекомбинация, представленная на примере интеграции бактериофага лямбда в хромосому клетки-хозяина. С помощью специфического белка кольцевая ДНК фага своим участком att В присоединяется к участку att λ на бактериальной ДНК, расположенному между генами biо и gal; затем в результате разрыва и перекрестного воссоединения двойных цепей ДНК фаг включается в хромосому. (См. также рис. 4.14.)
Негомологичная рекомбинация. Рекомбинационные процессы, в которых участвуют сегменты ДНК, не обнаруживающие заметной генетической гомологии, называют негомологичной рекомбинацией. Так же как и сайт-специфическая рекомбинация, она представляет собой интеграционную форму рекомбинации, т. е. не обмен, а соединение ДНК. Негомологичная рекомбинация независима от гена rес А. К такой рекомбинации способны: 1) вставочные последовательности (IS-элементы); 2) транспозоны (Тn); 3) бактериофаг (μ (мю). Молекулярный механизм негомологичной рекомбинации еще не вполне выяснен.
Как было установлено около 15 лет назад, некоторые мутации, спонтанно возникающие у Escherichia coli, объясняются включением чужеродной ДНК. Такие мутации происходят в структурных и регуляторных генах по всей хромосоме. Чужеродная ДНК представляет собой так называемые инсерционные последовательности (IS-элементы); они встречаются как в бактериальных хромосомах, так и в плазмидах. IS-элементы состоят из 800-1400 пар нуклеотидов; распознаваемых фенотипических признаков они не кодируют, и об их функциях мало что известно. Мутагенное действие их обусловлено просто включением посторонней ДНК, нарушающим процесс транскрипции (с. 447). Можно предполагать, что IS-элементы играют важную роль в перестройках генетического материала.
Транспозоны это последовательности ДНК, которые способны встраиваться во многие участки генома и могут «перепрыгивать» с плазмиды на бактериальную хромосому, на другую плазмиду или на умеренный фаг. Транспозоны содержат гены, определяющие внешне распознаваемые признаки, а именно устойчивость к таким антибиотикам, как пенициллин, тетрациклин или канамицин. В связи с этим их легче обнаружить, чем IS-элементы. По обе стороны от генов устойчивости, находящихся внутри транспозона, расположены две одинаковые последовательности, которые могут идти в одном и том же или в противоположных направлениях. Эти повторяющиеся последовательности оснований ДНК частью идентичны с IS-элементами. Расположение этих «фланкирующих» отрезков ДНК можно определить путем электронномикроскопического исследования гетеродуплексов (рис. 15.13). Бактериофаг мю сходен с IS-элементами и с транспозонами необычностью своего поведения при включении в бактериальную хромосому. Он обладает типичными свойствами фага, и в то же время его можно рассматривать как гигантский транспозон.
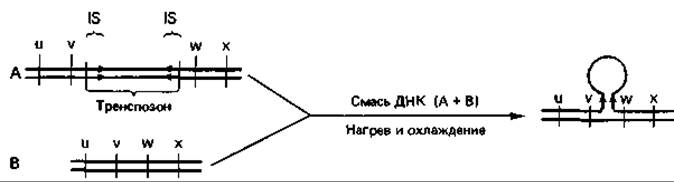
Рис. 15.13. Выявление транспозонов путем электронно-микроскопического исследования гетеродуплексов. Для того чтобы сделать транспозон видимым, нагревают ДНК из бактерии дикого типа (В) и бактерии, несущей транспозон (А), и в результате цепи двойных спиралей расходятся («плавление»). При последующем медленном охлаждении смеси происходит спаривание комплементарных оснований отдельных цепей ДНК А и В, что ведет к образованию гетеродуплексов ДНК. Если на концах транспозона имеются противоположно ориентированные комплементарные IS-элементы, то эти области тоже спариваются и образуют стебелек, на котором средняя часть транспозона выступает вбок в виде петли из одиночной цепи.
15.3.2 Конъюгация
Перенос генетического материала путем прямого контакта между двумя клетками называется конъюгацией. Уже давно на основании морфологических данных предполагали, что и у бактерий может происходить своего рода спаривание; однако только эксперименты с множественными мутантами бесспорно доказали, что и у бактерий возможна передача генетического материала при прямом межклеточном контакте. В 1946 г. Ледерберг и Татум провели решающий опыт с двумя мутантами Е. coli K12, каждый из которых был ауксотрофным по двум различным аминокислотам (рис. 15.14). Один двойной мутант нуждался в аминокислотах А и В, но был способен синтезировать С и D (A- B- C+ D+); другой мутант был ему комплементарен (А+ В+ С-D-). Эти мутанты не росли на минимальной питательной среде и не образовывали колоний. Однако если на ту же минимальную среду высевали смесь суспензий обоих мутантов, то колонии появлялись. Клетки этих колоний обладали наследственной способностью синтезировать все аминокислоты, т.е. принадлежали к типу A+ B+ C+ D+(были прототрофными). Такие клетки возникали с частотой 1:106; это были генетические рекомбинанты - они объединяли в себе генетическую информацию двух реципрокно дефектных (взаимодополняющих) родительских клеток. Использование в качестве исходных штаммов множественных мутантов исключало возможность появления ревертантов, так как вероятность одновременной реверсии по двум генам составляет величину порядка 10-14-10-16 на генерацию. Необходимой предпосылкой рекомбинации служил прямой контакт родительских клеток.
Направленный перенос генов из клетки в клетку. Эксперименты по скрещиванию, в которых один из родительских штаммов был стрептомициноустойчивым, позволили сделать вывод, что генетический материал передается лишь в одном направлении. Если клетки после скрещивания высевали на среду, содержавшую стрептомицин, то рекомбинанты возникали только в тех случаях, когда один из штаммов (штамм-реципиент) был стрептомициноустойчивым и выживал. Как вел себя другой родительский штамм, было несущественно; он мог быть стрептомициночувствительным и мог на этой среде погибнуть - достаточно того, чтобы он успел выполнить свою функцию донора генетического материала. Отсюда можно было заключить, что перенос генетического материала происходит в одном направлении - от донора («мужского» штамма) к реципиенту («женскому» штамму) - и что весь процесс рекомбинации и расщепления протекает в клетках штамма-реципиента. Рекомбинанты наследуют большинство своих признаков от реципиента, а от донора получают только фрагменты генома.
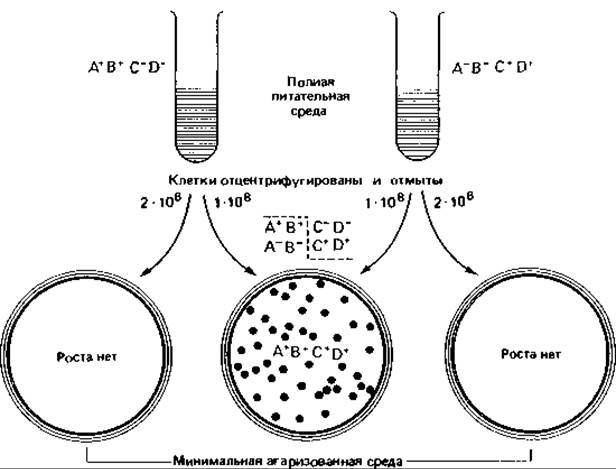
Рис. 15.14. Рекомбинация при конъюгации двух мутантов Escherichia coli К12 с различными парами биохимических дефектов.
Фактор F и состояние Hfr. При исследовании процесса скрещивания бактерий выяснилось, что способность клетки быть донором связана с наличием особого фактора, который при конъюгации передается из одной клетки в другую - полового фактора F (от fertility - плодовитость). Клетки, не содержащие фактора F (клетки F-), могут функционировать только как реципиенты. При конъюгации, т. е. при прямом контакте между клетками, частота передачи фактора F близка к 100%. Таким образом, клетки-реципиенты в результате конъюгации превращаются в потенциальных доноров; при этом хромосомные признаки еще не передаются.
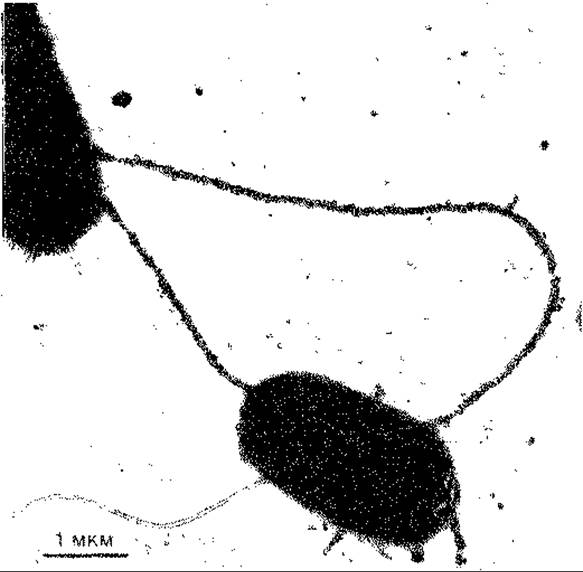
Рис. 15.15. Клетки Escherichia coli, связанные между собой F-пилями. Обе F-пили клетки Hfr помечены донор-специфическими РНК-фагами MS-2. Многочисленные пили типа I клетки-реципиента (в верхнем левом углу) короткие и не адсорбируют бактериофага. Электронные микрофотографии, полученные после негативного контрастирования с помощью фосфорновольфрамовой кислоты. (Curtiss R. et al., J. Bacteriol., 100 [1969], 1091.)
Фактор F представляет собой кольцевую двухцепочечную молекулу ДНК с массой 45∙106 Да. В качестве внехромосомного автономно реплицируемого элемента ДНК ее следует отнести к плазмидам. Эта молекула содержит гены, ответственные за процесс конъюгации, в том числе гены, детерминирующие особые структуры клеточной поверхности, например половые волоски, или F-пили (рис. 15.15), необходимые для конъюгации. По всей вероятности, они служат для взаимного узнавания при контакте между клеткой-донором и клеткой-реципиентом и делают возможным образование конъюгационного мостика, по которому ДНК переходит внутрь клетки-реципиента. Пока не ясно, происходит ли такая «инъекция» ДНК через сами F-пили.
В популяции F+ лишь немногие клетки способны быть донорами хромосомной ДНК. Оказалось, что это те клетки, в которых фактор F интегрировался в бактериальную хромосому (рис. 15.16). Если клоны таких клеток-доноров использовать в экспериментах со скрещиванием, то рекомбинанты образуются примерно в тысячу раз чаще, чем при использовании обычных клеток F+. Клетки-доноры, обеспечивающие высокую частоту рекомбинаций, получили название клеток Hfr (от англ. high frequency of recombinants). Фактор F включается в бактериальную хромосому лишь в определенных участках, число которых ограниченно; этот процесс сравним с интеграцией фага X (лямбда) в хромосому клетки-хозяина (см. рис. 4.14, 15.12 и 15.16).
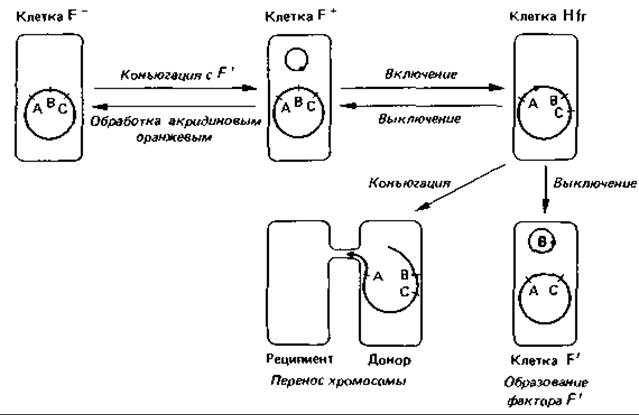
Рис. 15.16. Взаимоотношения между половыми типами Escherichia coli. Клетка F- может служить только реципиентом. При конъюгации с клеткой штамма F+ или Hfr она может получить фактор F и в результате стать клеткой F+. В клетке F+фактор F представляет собой кольцевую молекулу ДНК. Этот фактор можно удалить путем обработки клеток акридиновым оранжевым. При включении фактора F в бактериальную хромосому клетка переходит в состояние Hfr. Фактор может включиться в разные участки хромосомы и в различной ориентации; от этого зависит, с какого места начнется и в каком направлении будет происходить перенос хромосомы (показано красными стрелками). В случае неправильного выключения фактора F из хромосомы он может превратиться в фактор F', содержащий кусочек хромосомной ДНК.
Процесс переноса. Если смешать популяцию клеток Hfr с избытком клеток F-, то почти каждая клетка Hfr найдет себе партнера F- и будет с ним конъюгировать. Из такой смеси через определенные промежутки времени брали пробы и, сильно встряхивая их в смесителе, насильственно разъединяли партнеров. Затем пробы переносили на чашки с агаром для выделения рекомбинантов. И наконец, исследовали рекомбинантные штаммы, чтобы выяснить, какие гены были переданы донорами клеткам-реципиентам. Исследования показали, что каждый ген передается в совершенно определенный момент времени после начала конъюгации (рис. 15.16). Временная последовательность переноса генов соответствовала порядку их расположения в бактериальной хромосоме, установленному в результате генетического анализа. Это значит, что любой штамм Hfr представляет собой гомогенную популяцию, все клетки которой передают свою хромосому реципиенту одинаковым образом - начиная с определенного участка (начала) и в одном и том же направлении. Чем дальше располагается тот или иной ген от «начала» хромосомы, тем позже он передается и тем реже попадает внутрь клетки-реципиента, даже если конъюгацию не прерывать искусственно. Перенос всей хромосомы Е. coli продолжается при 37°С около 100 мин. Эксперименты, осуществленные по принципу «прерванной конъюгации», сделали возможным составление генетических карт.
Разные штаммы Hfr, выделенные независимо друг от друга из одного и того же штамма F+, различаются по двум главным признакам: роль «начала» играет у каждого штамма иная точка хромосомы и каждый штамм отличается своей специфической последовательностью переноса генов. Результаты экспериментов согласуются с представлением о том, что фактор F при интеграции (т. е. при переходе в состояние Hfr) может включаться в бактериальную хромосому в одном из примерно 20 возможных генных локусов. При переносе бактериальная ДНК реплицируется, начиная от места включения фактора F, и вновь синтезированная цепь, двигаясь 5'-концом вперед, проталкивается внутрь клетки-реципиента. Вслед за этим процессом переноса в клетке- реципиенте происходит гомологичная рекомбинация между донорской ДНК и собственной ДНК реципиента. Взаимоотношения между клеткой F-, клеткой F+и клетками Hfr представлены на рис. 15.16.
Генетическая карта. В результате применения описанного выше метода прерванной конъюгации, позволяющего выяснить временную последовательность переноса генов из клетки-донора, можно составить карту расположения генов в бактериальной хромосоме (рис. 15.17). Скорость их переноса в течение всего процесса остается постоянной. Моменты перехода внутрь клетки-реципиента позволяют судить о расстояниях между ними в хромосоме. При использовании этого метода не удается учитывать различия менее одной минуты. Для более тонкого картирования может служить анализ сцепления при трансдукции (переносе генов фагом).
Для Escherichia coli K12 известно расположение более чем тысячи генов, главным образом структурных, кодирующих ферменты. Последовательность расположения генов на бактериальной хромосоме была определена для Salmonella typhimurium, Streptomyces coelicolor, Bacillus subtilis и некоторых других бактерий.
Перенос генов при посредстве фактора F'. Интеграция (включение) фактора F в бактериальную хромосому обратима. F-фактор может быть высвобожден из хромосомы, и тогда клетка Hfr становится клеткой F+(рис. 15.16). Этот процесс «вырезания» (эксцизии, выключения) происходит примерно с той же частотой, что и интеграция. При правильной эксцизии разрыв происходит в том же самом месте, что и при интеграции. В редких случаях он происходит где-то очень близко к этому месту, и в результате соседний участок ДНК остается присоединенным к фактору F. Этот фактор F, содержащий небольшой фрагмент хромосомной ДНК, называют фактором F. Возникновение фактора F аналогично образованию фага, осуществляющего специфическую трансдукцию (разд. 15.3.3).
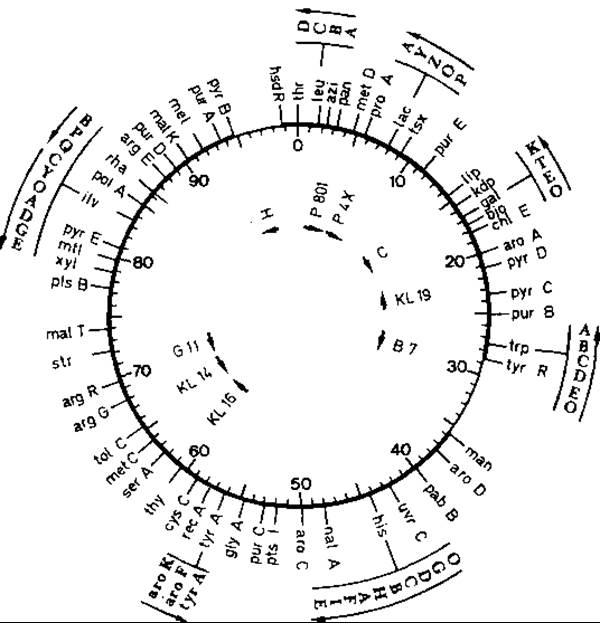
Рис. 15.17. Генетическая карта хромосомы Escherichia coli. Цифры соответствуют положению генов - они указывают, через сколько минут после начала конъюгации (в питательном бульоне при 37°С) те или иные гены переходят в клетку-реципиент. Красными стрелками внутри круга указана последовательность перехода генов в клетку-реципиент при конъюгации с клетками различных штаммов Hfr (направление перемещения хромосомы противоположно направлению стрелки). Красными стрелками вне круга обозначено направление, в котором считываются отдельные гены того или иного оперона при транскрипции (например, в lас-опероне - Р, О, Z, Y, А). Обозначения генов: azі устойчивость к азиду; bio - потребность в биотине; gal - использование галактозы; his - потребность в гистидине и гены ферментов, участвующих в его синтезе; ilv - потребность в изолейцине и валине; lас - оперон лактозы с генами: Р - промотор, О - оператор, Z - ß-галактозидаза, Y - галактозид-пермеаза, А - тиогалактозид-трансацетилаза; pro А -потребность в пролине (блок перед глутаматполуальдегидом); rесА - способность к генетической рекомбинации и репарации лучевых повреждений; thr - потребность в треонине; trp - потребность в триптофане. (Bachmann В. J., Bacteriol. Rev., 40 [1976], 116.)
Клетку, содержащую фактор F, называют первичной клеткой F. Включившаяся в f-фактор ДНК теперь может передаваться клетками-донорами F штаммам F- с такой же высокой частотой (100%), что и при обычной передаче фактора F штаммами F+ реципиентам F-. Тот же самый фрагмент ДНК мог бы передаваться штаммом Hfr штамму F- с максимальной частотой 1%. Если фактор F' будет перенесен из первичной родительской клетки F' (где он впервые возник) в нормальную клетку F-, то образуется вторичная клетка F', в которой небольшой участок бактериальной хромосомы окажется удвоенным (будет в диплоидном состоянии).
Распространенность конъюгации среди других групп бактерий. Передача генов путем конъюгации, открытая у Escherichia coli, очень широко распространена у энтеробактерий.
Посредством переноса факторов F из Е. coli K12 в клетки Salmonella и Shigella удалось создать новые генетические системы. Сходные системы были найдены в группе псевдомонад. Конъюгация у энтеробактерий представляет собой высокоразвитый процесс; чтобы она осуществилась, достаточно суспендировать смесь клеток-партнеров в жидкой среде и оставить на некоторое время в покое. У многих других бактерий конъюгацию удается вызвать лишь в том случае, если колонии обоих партнеров будут хорошо перемешаны и размазаны на твердой среде, где они должны затем расти несколько дней. Если теперь распределить клетки по одной на селективной среде, то окажется, что у многих клеток возникла новая комбинация признаков и, по всей вероятности, произошел обмен крупными участками бактериальных хромосом. Процессы конъюгации широко изучались на Streptomyces coelicolor, видах Nocardia, Rhizobium и других бактериях. Обмен генами путем конъюгации и мобилизация генов с помощью плазмид, вероятно, очень распространены в мире прокариот.
Плазмиды
Многие (если не все) бактерии могут содержать внехромосомные элементы ДНК. Эти малые по сравнению с бактериальной хромосомой, замкнутые в кольцо двухцепочечные ДНК называют плазмидами. При росте в обычных условиях бактерии могут без них обходиться: клетки, «излеченные» от плазмид с помощью УФ-облучения, митомицина С или акридинового красителя, хорошо растут на обычных питательных средах. Плазмиды распознаются по особым свойствам, которые приобретает содержащая их клетка. Некоторые плазмиды делают клетку способной конъюгировать с другими клетками. Это обеспечивает дальнейшее распространение таких плазмид путем прямого межклеточного контакта. С прототипом подобного рода плазмиды мы уже встречались (с. 457) при рассмотрении F-факторов Escherichia coli.
Факторы фертильности (F-факторы). Это, как уже говорилось, плазмиды, которые могут включаться в бактериальную хромосому подобно ДНК умеренного фага лямбда. Они «мобилизуют» генетическую информацию этой хромосомы и осуществляют перенос ее в другую клетку. Такой перенос (конъюгация) был хорошо изучен на Е. coli.
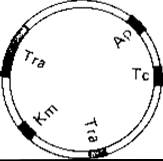
Рис. 15.18. Генетическая карта плазмиды RP4, обусловливающей устойчивость к антибиотикам. В этой плазмиде были найдены две области, содержащие большой и малый фрагменты tra; они ответственны за конъюгацию. Гены, кодирующие устойчивость к антибиотикам-ампициллину (Ар), тетрациклину (Тс) и канамицину (Km), -распределены по разным участкам плазмиды.
Факторы резистентности (R-факторы). Бактерии, устойчивые (резистентные) к некоторым антибиотикам, были впервые открыты в 50-е годы в Японии. Речь идет о штаммах возбудителя дизентерии Shigella, выделенных от больных, которых лечили антибиотиками. Характерно то, что бактерии обнаруживали множественную устойчивость и что эта устойчивость могла передаваться другим бактериям, таким как Escherichia coli. Как стало теперь известно, факторы резистентности (R) содержат гены, которые делают клетку устойчивой, например, к сульфонамидам, стрептомицину, хлорамфениколу и тетрациклину. Некоторые R-факторы обусловливают резистентность сразу к восьми антибиотикам, другие же придают устойчивость к ядовитым тяжелым металлам, например ртути, никелю, кадмию или кобальту. R-плазмида несет две группы генов: 1) гены, ответственные за передачу плазмиды путем конъюгации (гены tra), - они образуют так называемый «фактор переноса устойчивости» (RTF, resistence transfer factor); 2) гены, обусловливающие собственно резистентность (они составляют лишь небольшую часть плазмиды) (рис. 15.18).
Фактор переноса устойчивости (RTF) включает все гены, ответственные за перенос фактора R из клетки в клетку, который осуществляется обычно путем конъюгации. Таким образом, фактор R, так же как и фактор F, в широком смысле инфекционен. Область RTF по своей молекулярной структуре гомологична соответствующей области F-фактора Е. coli. Для некоторых R-факторов характерен широкий круг хозяев; возможен их перенос между несколькими разными родами бактерий, что способствует их дальнейшему распространению. В некоторых случаях наблюдали, что вместе с фактором R передаются и хромосомные гены, которые, по-видимому, были мобилизованы им.
Механизм устойчивости к антибиотикам, определяемой R-факторами, может быть не таким, как в случае ее хромосомного наследования. Наглядным примером этого служит резистентность к стрептомицину. Если она зависит от хромосомного гена, то она связана с изменением субъединицы 30S рибосомы, так что бактерия не имеет мишени для воздействия стрептомицина (разд. 2.2.2). В отличие от этого устойчивость, обусловленная R-фактором, основана на инактивации антибиотика в результате его аденилирования под влиянием фермента. Ферментативная химическая модификация антибиотиков часто бывает причиной устойчивости к ним, обусловленной плазмидами; например, хлорамфеникол ацетилируется, канамицин и неомицин подвергаются фосфорилированиго и ацетилированию, а пенициллин инактивируется пенициллиназой. Поскольку и при наличии К-факторов возможна генетическая рекомбинация, может возникнуть новое сочетание генов, придающее дополнительные свойства устойчивости. К-факторы имеют большое значение для химиотерапии; их существование - лишний довод против бесконтрольного применения антибиотиков, так как они могут распространяться в популяциях бактерий подобно инфекционным агентам.
Бактериоцины. Многие бактерии синтезируют белки, убивающие родственные виды или штаммы или тормозящие их рост. Эти белки с весьма специфическим действием, бактериоцины, кодируются особыми плазмидами, бактериоциногенными факторами. Бактериоцины были выделены из Escherichia coli (колицины), Pseudomonas aeruginosa (пиоцины), Bacillus megaterium (мегацины) и других бактерий.
Другие признаки, определяемые плазмидами. Плазмиды могут содержать также гены, обусловливающие ряд специфических биологических свойств, которые в определенных условиях создают селективное преимущество. Гены ферментов, необходимых для расщепления камфоры, салициловой кислоты, нафталина, октана, 2,4-дихлорфеноксиуксусной кислоты и многих других необычных субстратов, могут находиться в плазмидах. Мы уже упоминали о плазмиде бактерии Agrobacterium tumefaciens, вызывающей опухоли у растений, и ее биохимической активности (разд. 4.3). Перечень свойств, наследуемых с плазмидами, стал сейчас очень длинным и включает, в частности, азотфиксацию, образование клубеньков, синтез индолилуксусной кислоты, диацетила, гидрогеназы, поглощение сахаров. Некоторые из этих свойств могут определяться генами бактериальной хромосомы; это свидетельствует о том, что более или менее часто происходит обмен генами или группами генов между хромосомой и плазмидой. Плазмиды, вероятно, играли очень важную роль в эволюции прокариот.
Несовместимость. Многие бактерии содержат плазмиды различной величины. Сосуществование разных плазмид в одной бактериальной клетке говорит о том, что такие плазмиды совместимы между собой. Однако две родственные плазмиды не могут сосуществовать в одной клетке-они несовместимы. Все плазмиды подразделяются на группы несовместимости: плазмиды, относящиеся к одной и той же группе, несовместимы друг с другом.
15.3.3 Трансдукция
Трансдукцией называют передачу ДНК от клетки-донора клетке-реципиенту при участии бактериофагов. Обычно при этом фаг переносит лишь небольшой фрагмент ДНК хозяина. Различают два вида трансдукции: неспецифическую (общую), при которой может быть перенесен любой фрагмент ДНК хозяина, и специфическую, затрагивающую лишь строго определенные фрагменты ДНК. При неспецифической трансдукции ДНК клетки-хозяина включается в частицу фага либо дополнительно к его собственному геному, либо вместо него, тогда как при специфической трансдукции некоторые гены фага замещаются генами хозяина. В обоих случаях трансдуцирующие фаги, как правило, дефектны - например, они часто теряют способность лизировать клетку-хозяина. Передача признаков путем трансдукции была обнаружена у многих бактерий, в том числе у видов Salmonella, Escherichia, Shigella, Bacillus, Pseudomonas, Staphylococcus, Vibrio и Rhizobium. Но не все фаги могут осуществлять трансдукцию, и не во все бактерии таким путем может быть перенесена ДНК.
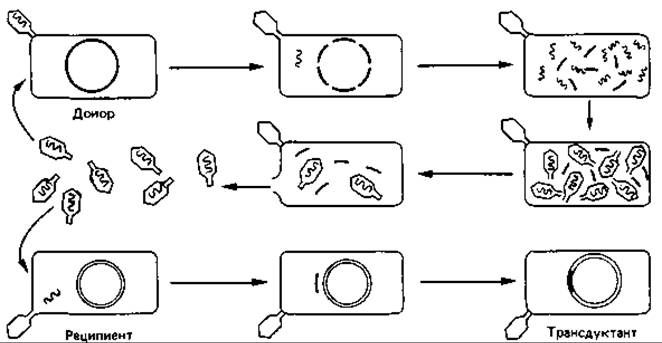
Рис. 15.19. Неспецифическая трансдукция - один из механизмов переноса ДНК из одной бактериальной клетки в другую.
Неспецифическая трансдукции. Перенос участков бактериальной хромосомы фагами был открыт в 1951 г. Ледербергом и Циндером у Salmonella typhimurium. В решающем эксперименте (рис. 15.19) штамм-донор В+ инфицировали умеренным бактериофагом Р22. После лизиса клетки-хозяина выделяли свободные фаги и инкубировали их вместе со штаммом-реципиентом В-, который генетически отличался от штамма В+ по меньшей мере одним признаком. Авторы нашли, что после высева инкубированных клеток на подходящую среду появлялись рекомбинанты, обладавшие признаками штамма-донора В+.
Процессы, происходящие при таком неспецифическом переносе ДНК, весьма сложны. Во время репродукции фага Р22 в клетках штамма-донора В+ в капсиды вместо фаговой ДНК могут включаться фрагменты бактериальной хромосомы. Таким образом, фаголизат содержит смесь нормальных и дефектных фагов. Заражение штамма-реципиента В- нормальным фагом ведет, как правило, к лизису клеток. Однако в некоторые клетки проникают дефектные трансдуцирующие фаги, ДНК которых способна рекомбинироваться с хромосомой реципиента. Происходит обмен гомологичными участками ДНК, что может привести к замене дефектного гена реципиента интактным геном донора.
Так как трансдуцируются лишь небольшие фрагменты ДНК, вероятность рекомбинации, затрагивающей какой-то определенный признак, очень мала: она составляет от 10-6 до 10-8. Становится понятно, что с помощью одной частицы фага Р22 Salmonella или неспецифически трансдуцирующего фага PI Escherichia coli в каждом случае может быть трансдуцирован только один ген (или несколько очень близко расположенных генов). Количество бактериальной ДНК, сравнимое с геномом фага, составляет лишь 1-2% всего количества ДНК, содержащегося в бактериальной клетке. Исключение составляет бактериофаг PBS 1 Bacillus subtilis, который может трансдуцировать до 8% генома хозяина.
Специфическая трансдукция. Наиболее известным примером служит трансдукция, осуществляемая фагом λ (см. разд. 4.2.2). Обычно он трансдуцирует лишь определенные гены, а именно gal и bio. Как уже говорилось, этот фаг при переходе в состояние профага включается в определенный участок хромосомы бактерии-хозяина - между генами gal иbiо. Отделение фаговой ДНК от бактериальной хромосомы (например, в результате УФ-облучения) может произойти неточно, т. е. какой-то фрагмент ее останется в хромосоме, а близко расположенные гены клетки-хозяина будут захвачены фаговой ДНК. По-видимому, причиной этого может быть неправильная рекомбинация.
В случае заражения трансдуцирующим фагом клеток, дефектных по определенному гену, например gal-, может произойти рекомбинация с заменой собственного дефектного гена бактерии интактным трансдуцированным геном; при этом образуются рекомбинанты (трансдуктанты) gal+.
Подобным же образом происходит перенос генов бактериофагом Рhi 80. Его ДНК включается в хромосому вблизи генов, кодирующих ферменты, ответственные за биосинтез триптофана. По этой причине Phi 80 особенно пригоден для переноса генов trp.
Предпосылкой успешного переноса генов при специфической трансдукции (в отличие от неспецифической) является интеграция фага в геном клетки-хозяина.
В некоторых случаях было показано, что трансдуцированный фрагмент ДНК не вступает в рекомбинацию с хромосомой реципиента, а остается вне хромосомы. В этом случае клетка становится гетерозиготной по перенесенным генам. Перенесенная ДНК транскрибируется (на это указывает синтез соответствующего генного продукта), но не реплицируется. Это приводит к тому, что при клеточном делении донорский фрагмент переходит только в одну из дочерних клеток (абортивная трансдукция). Если реципиент ауксотрофный, а перенесенный фрагмент исправляет соответствующий дефект, то расти могут только те клетки, которые унаследовали этот фрагмент; при посеве на агар они образуют мельчайшие колонии.
15.3.4 Трансформация
Гены могут также передаваться из клетки в клетку без всякого межклеточного контакта и без каких-либо переносчиков. Такую передачу генов при помощи свободной растворимой ДНК, выделенной из клеток-доноров, называют трансформацией. У бактерий такой способ передачи признаков стал известен раньше других, и это открытие сыграло важную роль в истории науки.
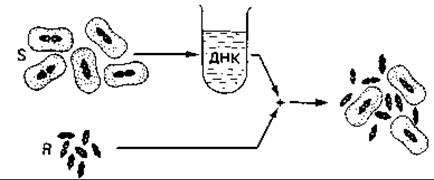
Рис. 15.20. Трансформация Streptococcus pneumoniae (схема). Способность к образованию капсулы передается бескапсульному штамму (R) при помощи интактной ДНК, экстрагированной из капсулообразующего штамма (S). (Nultsch W., Allgemeine Botanik, 3. Aufl., Stuttgart: Thieme, 1968.)
Открытие роли ДНК как генетического материала. В 1928 г. Гриффит описал превращение бескапсульного R-штамма Streptococcus pneumoniae (Pneumococcus) в штамм, образующий капсулу, т. е. в S-форму (рис. 15.20). Гриффит ввел мышам небольшое количество авирулентных R-клеток и одновременно убитые нагреванием S-клетки. R-клетки происходили от S-штамма (SII), капсульное вещество которого принадлежало к иному серологическому типу, нежели капсульное вещество S- штамма, убитого нагреванием (SIII). Из крови погибших мышей были выделены вирулентные бактерии с капсулой типа SIII. Это означало, что убитые клетки типа SIII передали наследственную способность к образованию капсул типа III R-клеткам, которые в свою очередь передали ее своему потомству. Природу «трансформирующего фактора» удалось установить Эвери, Мак-Леоду и Мак-Карти в 1944 г. Оказалось, что этот фактор представляет собой ДНК. Это открытие явилось решающим аргументом в пользу того, что генетическая информация содержится в ДНК, а не в белке.
Компетенция. Позже возможность передачи признаков с помощью очищенной ДНК была доказана для Haemophilus influenzae, Neisseria, Rhizobium, Bacillus subtilis, Acinetobacter calcoaceticus, Escherichia coli, Pseudomonas и многих других бактерий. Этим способом могут передаваться такие признаки, как устойчивость к различным ядам и прототрофность в отношении отдельных аминокислот. Трансформировать удается только те бактерии, в клетки которых может проникать высокомолекулярная двухцепочечная, т. е. интактная, ДНК. Для трансформации требуются чрезвычайно малые концентрации ДНК: 0,1 мкг на 1 мл суспензии клеток-реципиентов достаточно, чтобы трансформировать компетентные клетки (доля их в клеточной популяции составляет максимально 15%). Компетенцией называют способность клеток поглощать ДНК. Компетенция зависит от физиологического состояния клетки: она наиболее высока в середине фазы экспоненциального роста, а затем быстро снижается до минимума. Предполагают, что клеточная поверхность изменяется на протяжении цикла роста и ДНК может поглощаться только в определенную, относительно короткую его фазу. Бактерии, раньше считавшиеся некомпетентными (такие, как Е. coli), удавалось сделать компетентными путем модификации клеточной поверхности, например с помощью обработки хлоридом кальция. Можно ожидать, что передача признаков посредством трансформации будет приобретать все большее значение.
Хотя в компетентные клетки может проникать любая ДНК, рекомбинация происходит лишь в том случае, если это ДНК близко родственного вида: тогда возможен обмен гомологичными участками между собственной и проникшей извне ДНК.
15.3.5 Рестрикция и модификация
Бактериофаги, как правило, проявляют специфичность в отношении хозяев: они инфицируют только один штамм бактерий или ограниченное число родственных штаммов, видов или родов бактерий. В основе этой специфичности лежат прежде всего рецепторные свойства поверхности бактериальных клеток (разд. 4.2.1).
Кроме того, у бактерий есть и другие системы, обусловливающие специфичность взаимоотношений с фагами. Одна из таких систем получила название рестрикции. Суть ее можно проиллюстрировать на следующем примере. Если бактериофаг А вырастить на штамме А Escherichia coli и затем инфицировать полученным лизатом другой штамм В, то в культурах штамма В фаг будет расти значительно хуже, чем на штамме А. Если же немногочисленные фаговые частицы, образовавшиеся на штамме В, использовать для заражения другой культуры штамма В, то размножение фага вновь будет нормальным; однако если перед этим фаг снова провести через исходный штамм А, то на штамме В он опять будет расти очень плохо. Таким образом, рестрикция (ограничение репродукции фага) зависит от того хозяина, в котором данный фаг выращивали предыдущий раз. Она обусловлена расщеплением инфицирующей фаговой ДНК под действием фермента, специфичного для штамма-хозяина. Такого рода ферменты называют рестрикционными эндонуклеазами. Благодаря своему нуклеазному действию они препятствуют проникновению чужеродной ДНК в бактериальную клетку.
Очевидно, что бактериальная клетка должна как-то защищать свою ДНК от воздействия собственной рестрикционной эндонуклеазы. Такую защиту обеспечивает метилирование или глюкозилирование определенных оснований ДНК, обычно аденина или цитозина. Этот процесс известен под названием модификации. Из него извлекают пользу также и фаги, размножающиеся в клетках определенного штамма бактерий. На фаговую ДНК при ее синтезе в клетках данного типа накладывается тот же «отпечаток», что и на ДНК самой клетки: в присутствии модифицирующего фермента фаговая ДНК видоизменяется таким же образом, как и ДНК хозяина. Она так же метилируется и приобретает свойства, защищающие ее от воздействия рестрикционных ферментов данного штамма бактерий.
Рестрикционные эндонуклеазы (рестриктазы). Эти ферменты могут кодироваться не только геномом бактерии, но также бактериофагами и плазмидами. Все они разрезают двухцепочечные ДНК. Различают несколько классов рестрикционных ферментов. Ферменты класса 1 распознают какую-то определенную последовательность нуклеотидов, но и вне этой области могут неспецифически расщеплять ДНК. К ним относится рестрикционная эндонуклеаза из бактериофага Р1. Ферменты класса 2 отличаются тем, что разрывают цепи ДНК только в определенных точках распознаваемой ими области. Это ведет к образованию совершенно определенных фрагментов ДНК. Рестрикционные эндонуклеазы класса 2 используются при молекулярном клонировании, которое будет рассмотрено в следующем разделе.
Примером рестриктаз класса 2, специфически расщепляющих ДНК, может служить рестриктаза EcoRI, действие которой поясняется ниже. Последовательность, распознаваемая этим ферментом, состоит из шести пар оснований, образующих палиндром (в двух цепях последовательности одинаковые, но идут в противоположных направлениях).
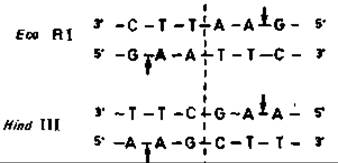
Места расщепления ДНК, указанные стрелками, лежат вне оси симметрии. В результате несовпадения разрывов образуются одноцепочечные концы из четырех пар оснований.
Число известных и охарактеризованных рестриктаз непрерывно растет, так как эти ферменты играют важную роль и в фундаментальных, и в прикладных исследованиях в области молекулярной генетики. Например, полученные с их помощью фрагменты ДНК (рестрикционные фрагменты) можно расположить в такой последовательности, что это даст возможность построить физическую карту генетического материала.
15.3.6 Метод молекулярного клонирования
Рассмотренный в предыдущих разделах обмен участками хромосомной ДНК у бактерий был в основном ограничен пределами одного вида. Но, как мы уже упоминали, передача внехромосомных молекул ДНК, способных к автономной репликации, может преодолеть этот барьер.
При молекулярном клонировании (рис. 15.21) используют плазмиды в качестве переносчиков (векторов) для введения в бактериальную клетку и репродукции в ней чужеродной ДНК, которая может быть даже эукариотического происхождения. Для этой цели плазмиду и соответствующую чужеродную ДНК обрабатывают специфической рестриктазой, например EcoRI. В результате из обоих препаратов ДНК образуются линейные фрагменты ДНК с одноцепочечными концами, состоящими из последовательностей ААТТ или ТТАА. Если полученные таким образом фрагменты той и другой ДНК смешать, то в результате спаривания оснований произойдет соединение комплементарных одноцепочечных концов. Места разрывов ковалентно связывают, добавляя полинуклеотидлигазу. Этим этапом заканчивается создание рекомбинантной молекулы ДНК - так называемой гибридной плазмиды (химерной ДНК).
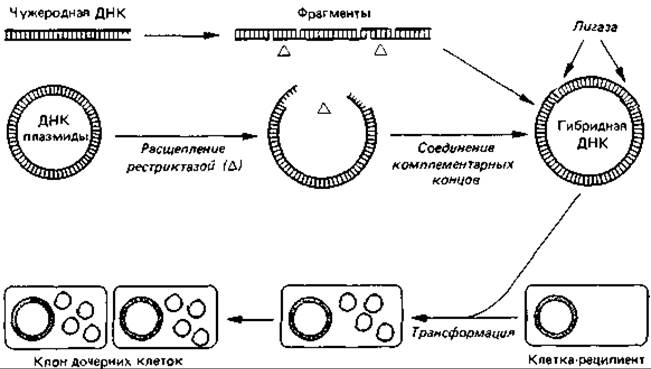
Рис. 15.21. Получение гибридной ДНК путем вставки фрагмента эукариотической ДНК в бактериальную плазмиду (упрощенная схема). Чужеродную ДНК и ДНК плазмиды расщепляют in vitro с помощью одной и той же рестрикционной эндонуклеазы. При этом получаются фрагменты с «липкими» концами (одноцепочечными концевыми участками с комплементарными основаниями). В результате смешивания таких фрагментов и обработки лигазой образуются плазмиды с включенной в них эукариотической ДНК. Эти гибридные ДНК можно вводить в подходящие бактерии и размножать, получая массовые культуры трансформированных ионов. Из такого клона удается выделить чужеродную ДНК.
Для того чтобы генетическая информация гибридной плазмиды могла проявиться, необходим белоксинтезирующий аппарат бактериальной клетки. Поэтому плазмиду вводят в бактериальную клетку путем трансформации (см. выше). Если гибридная плазмида будет представлена в клетке в большом числе копий, то чужеродная ДНК будет многократно воспроизводиться вместе с плазмидой. Потомство клетки, содержащей гибридную ДНК, генетически однородно - оно образует клон.
Метод клонирования нашел множество новых применений. С помощью микробов можно получать большие количества чужеродной ДНК, чтобы исследовать ее. Если в бактериальной клетке происходит экспрессия генов такой ДНК, это позволяет микробиологическим путем получать, например, гормоны и ферменты. Новый метод может быть применен на пользу человека; поскольку, однако, конструирование новых ДНК при неумелом обращении с материалом сопряжено с опасностью, практическое применение описанного метода требует строгого соблюдения ряда предосторожностей.
15.3.7 Слияние протопластов
Еще 15 лет назад был разработан метод гибридизации соматических клеток для проведения генетических исследований на клеточных культурах. На его основе была создана методика генетической рекомбинации путем искусственно вызываемого слияния протопластов; ее уже удалось с успехом применить на материале грибов и растений. Первичный продукт такого слияния-клетка, объединяющая в себе геномы обеих родительских клеток.
Лишь недавно этот метод генетической рекомбинации был испытан и на бактериях: получали протопласты и затем индуцировали их слияние путем обработки полиэтиленгликолем. Из слившихся протопластов в определенных экспериментальных условиях регенерировали морфологически полноценные клетки, из которых получались стабильные рекомбинанты, обладавшие некоторыми признаками обоих родительских штаммов. Пока этот метод успешно применялся только в отношении грам-положительных бактерий, таких как Bacillus и Streptomyces. Следует ожидать, что в будущем он найдет более широкое применение.
В отличие от механизмов переноса ДНК, описанных ранее, а именно конъюгации, трансдукции и трансформации, при которых ДНК передается от донора реципиенту, перенос генетической информации при слиянии протопластов не носит однонаправленного характера.