Общая микробиология - Шлегель Г. 1987
Постоянство, изменение и передача признаков
Мутации и их возникновение
15.2.1 Ненаправленный характер мутаций
Представление о том, что и у микроорганизмов возможны скачкообразные изменения наследственных признаков-мутации,-утверждалось лишь с трудом. До разработки метода чистой культуры многие ученые (Нэгели, Цопф) думали, что у бактерий морфология и физиологические свойства чрезвычайно изменчивы. Считалось, что большое число бактерий, встречающихся в природе, представляют собой разные стадии жизненного цикла небольшого количества видов (плеоморфизм). Возражая против этого на основании результатов, полученных с помощью усовершенствованных методов и чистых культур, другие ученые выступили в пользу теории мономорфизма, согласно которой бактерии можно различать и классифицировать, исходя из постоянства их морфологических и физиологических признаков. Необходимо было научиться различать и у бактерий генотип и фенотип. Генотипом называют совокупность наследственных задатков клетки; ему противопоставляют фенотип-совокупность наблюдаемых признаков. Фенотипическое проявление одного и того же генотипа может быть различным в зависимости от условий среды.
Термин мутация введен Де Фризом, изучавшим изменчивость и наследственность у растений и определившим мутацию как «скачкообразное изменение наследственного признака». Это понятие Бейеринк позднее распространил и на бактерии.
У бактерий наибольшее внимание привлекали варианты, возникающие под действием ядов. Долгое время считали эти резистентные к ядам клетки результатом адаптации. Отличить фенотипическую адаптацию к измененным условиям среды от генотипического изменения оказалось нелегкой задачей, хотя критерий различия достаточно прост. Фенотипическая адаптация проявляется у всех клеток данной культуры, тогда как изменение генотипа затрагивает лишь немногие клетки; благодаря своей лучшей приспособленности к среде клетки, ставшие наследственно устойчивыми, например, к яду, растут быстрее, чем клетки исходного штамма, и в конце концов вытесняют их.
Возник еще один вопрос: не вызывается ли изменение генотипа самим селективным фактором, оказывающим направленное воздействие на гены? Или же мутации происходят независимо от среды и носят ненаправленный характер? Теория Ламарка о наследовании приобретенных адаптивных признаков в отношении высших организмов оказалась несостоятельной. Получила признание теория Дарвина, согласно которой новые типы и виды возникают в результате мутаций, не зависящих от среды, с последующим отбором наиболее приспособленных форм. У высших организмов передающиеся потомкам мутации происходят в половых клетках, в значительной мере защищенных от воздействия среды. В отличие от этого бактериальные клетки легко подвержены внешним влияниям. Поэтому можно было представить себе, что воздействие яда, приводящее к появлению в бактериальной популяции устойчивых мутантов, не сводится только к отбору, а определяет также и направленность мутаций. Вопрос о зависимости мутаций от среды и об их направленном характере оставался кардинальной проблемой биологии, и его предстояло решать на бактериях.
В результате ряда экспериментов, привлекших к себе большое внимание, были получены доказательства того, что и у бактерий мутации носят спонтанный и ненаправленный характер. Здесь мы рассмотрим лишь один из этих классических экспериментов; он легко доступен для понимания и демонстрирует широко применяемую сейчас методику пересева с помощью штампа (метод реплик).
Непрямой отбор мутантов методом реплик (отпечатков). Этот безупречный метод, получивший в настоящее время широкое распространение, был предложен Ледербергами в 1952 г. Он состоит в следующем. Обтянутый бархатом штамп несколько меньшего диаметра, чем чашка Петри, прижимают к агару, на котором растут колонии бактерий. При этом часть клеток пристает к ворсинкам бархата. Если теперь прижать этот штамп к незасеянному агару в другой чашке, то на ней будет воспроизведена вся картина колоний исходной чашки.
Из чашки I с плотным газоном фагочувствительных бактерий (рис. 15.2) при помощи штампа был произведен пересев на обычный агар (II) и на агар, предварительно засеянный фагом (III). После инкубации появились отдельные фагоустойчивые колонии. Затем из чашки с обычным агаром (II) произвели пересев с участка, соответствовавшего ареалу фагоустойчивых колоний в чашке с фагом. Размножившиеся клетки распределили по агару в новой чашке и после инкубации перенесли с помощью бархатного штампа в две чашки (с обычным агаром и с агаром, засеянным фагом). Такую процедуру повторили много раз, и в конце концов была получена суспензия фагоустойчивых мутантов, никогда не имевших контакта с фагом. Этот эксперимент дает четкое доказательство спонтанного возникновения фагоустойчивых мутантов без всякого контакта с селективным агентом.
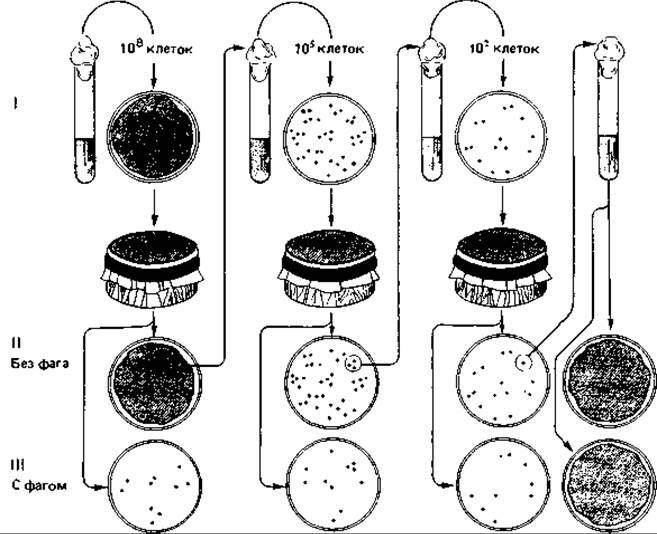
Рис. 15.2. Доказательство ненаправленного характера мутаций у бактерий, полученное с помощью метода реплик (отпечатков). Объяснение см. в тексте.
15.2.2 Спонтанные и индуцированные мутации
Спонтанные мутации
В популяции бактерий без всякого экспериментального вмешательства регулярно возникают мутации; такие мутации называют спонтанными мутациями, а клетки, в которых они возникли, - спонтанными мутантами. Мутагенное действие аналогов оснований ДНК (см. ниже) указывает на возможные причины спонтанных мутаций: вероятно, речь идет о случайных ошибках при включении нуклеотидов во время репликации ДНК-ошибках, вызванных таутомерным перемещением электронов в основании. Тимин, например, обычно находится в оксоформе, в которой он образует водородные связи с аденином. Но если тимин во время спаривания оснований при репликации ДНК переходит в енольную форму, то он спаривается с гуанином. В результате в новой молекуле ДНК на том месте, где раньше находилась пара А—Т, появляется пара G—С.
Доля мутантов в популяции и частота мутирования. Численная доля мутантов в клеточной - популяции для разных признаков различна и варьирует в пределах от 10-4 до 10-11. Она зависит от частоты возникновения мутаций, условий среды, возраста клеточной суспензии и других факторов. Вероятность возникновения определенных мутаций в расчете на одну клетку и на одну генерацию называют частотой мутирования. При высоких скоростях роста она постоянна, и ее обычно определяют для клеток в экспоненциальной фазе роста при оптимальных условиях среды. Частота спонтанных мутаций для определенного гена составляет величину порядка 10-5, а для определенной пары нуклеотидов 10-8.
«Молчащие» мутации. Если под мутацией в традиционном смысле понимают внезапное изменение признака, т. е. изменение генотипа, проявляющееся в фенотипе, то на молекулярном уровне любое стабильное наследуемое изменение ДНК рассматривают как мутацию. Однако ввиду вырожденности генетического кода понятно, что не всякая мутация такого рода будет проявляться в фенотипе. Во многих триплетах изменение третьего основания остается без последствий («молчащие» мутации). Даже замена первого или второго основания триплета не всегда приводит к серьезным последствиям. Хотя структуры высшего порядка (третичная и четвертичная) определяются первичной структурой белка (т. е. последовательностью аминокислот), разные аминокислоты играют в этой структуре не одинаково важную роль. Например, мутация AUC → GUC ведет к замене изолейцина валином, т. е. к замене одной липофильной группы на другую. Однако мутация CUU → CCU приведет к замене лейцина пролином, и последствием такой замены будет отклонение от нормальной пространственной конфигурации полипептидной цепи, что может сильно изменить структуру высшего порядка. Из этого понятно, что различные мутации в одном и том же структурном гене определенного фермента могут по-разному сказываться на его активности: возможны любые изменения - от едва заметного снижения каталитического действия до полной инактивации.
Обратные мутации и реверсии. Из сказанного выше становится ясно, что у мутанта может произойти обратная мутация, в результате которой восстановятся свойства дикого типа. Об истинной обратной мутации говорят лишь в тех случаях, когда вторая мутация точно восстанавливает исходный генотип, т. е. когда измененный при первой мутации триплет будет вновь кодировать ту же аминокислоту, что и раньше. Если же дело сводится к восстановлению исходного фенотипа (например, к возобновлению синтеза нормально функционирующего фермента), то говорят о реверсии или супрессорной мутации и соответственно о ревертантах. Супрессорные мутации могут происходить как в исходном гене, так и в каких-либо других участках хромосомы (интрагенные и экстрагенные супрессорные мутации).
Индуцированные мутации
Обрабатывая клетки мутагенными (вызывающими мутации) веществами, можно повысить частоту мутаций. В этом случае говорят об индукции мутаций, а полученные при этом клетки называют индуцированными мутантами. Мутагенами могут быть химические, физические или биологические агенты. Механизм их действия будет пояснен на ряде примеров.
В отношении генетической структуры различают три класса мутантов со следующими дефектами: 1) одна пара оснований заменена другой, например вместо АТ может быть GC или наоборот; 2) включена дополнительная пара оснований в нуклеотидную последовательность или утрачена одна из существовавших пар; 3) группа оснований или даже генов может быть утрачена (делеция), перемещена в пределах хромосомы (транспозиция) или «разорвана» путем вставки посторонней ДНК (инсерция).
Для мутаций класса 1, называемых также точечными мутациями, характерна высокая частота реверсии. В случае мутаций класса 2, к которым относятся также мутации со сдвигом рамки (см. рис. 15.4), ревертанты редки, а после мутаций класса 3 (за некоторыми исключениями) ревертанты не появляются.
В последующих разделах мы остановимся на некоторых механизмах мутагенеза.
Включение аналогов оснований. Аналоги оснований - это антиметаболиты. Некоторые аналоги настолько сходны с нормальными пиримидиновыми и пуриновыми основаниями, что поглощаются клетками и включаются в ДНК. Здесь они в значительной степени выполняют функцию нормальных оснований, но в отличие от них обнаруживают большую тенденцию связывать «ложного» (неподходящего) партнера при репликации ДНК. Для вызывания мутаций часто используются бромурацил и 2-аминопурин. Бромурацил представляет собой соединение, аналогичное по структуре тимину, которое включается вместо него в цепь ДНК как партнер аденина (рис. 15.3). Бромурацил таутомеризуется в енольную форму чаще, чем тимин. При репликации цепи, содержащей бромурацил, он в енольной форме спаривается как цитозин, т.е. вызывает включение гуанина вместо аденина. Таким образом, в некоторых случаях пара оснований АТ заменяется на CG. 2-Аминопурин включается в ДНК вместо аденина и действует подобным же образом. Этот вид изменений - замену одного пурина другим пурином (A→G) или одного примидина другим пиримидином (С → Т) - называют транзицией.
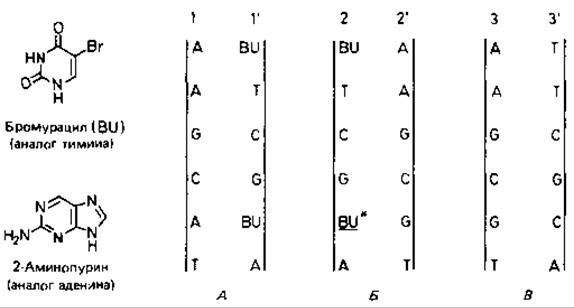
Рис. 15.3. Замена пары оснований АТ парой GC после включения бромурацила (BU) в ДНК. А. Включение нескольких остатков BU вместо тимина во время первой репликации (1-родительская цепь, 1'-дочерняя цепь). Б. Включение G вместо А во время второй репликации в результате спаривания с BU. находящимся в енольной форме. В. Включение С во время третьей репликации.
Химическое изменение оснований. Некоторые мутагенные вещества действуют путем химического изменения содержащихся в ДНК оснований, что приводит к ошибкам репликации. Вполне понятное изменение вызывает нитрит. Азотистая кислота дезаминирует аденин, гуанин или цитозин без разрыва или каких-либо других изменений полинуклеотидной цепи. В результате замещения аминогруппы гидроксильной группой аденин превращается в гипоксантин и спаривается с цитозином вместо тимина, что приводит к мутации АТ → GC. Если цитозин дезаминируется в урацил, то он спаривается с аденином вместо гуанина, и это ведет к мутации GC → АТ. Будучи превращен в ксантин, гуанин по-прежнему спаривается с цитозином, т. е. дезаминирование G не вызывает мутации. Гидроксиламин вступает в реакцию главным образом с цитозином и изменяет его так, что тот спаривается с аденином; значит, он тоже вызывает мутации CG → ТА.
Алкилирующие агенты. Этил- и метилметансульфонат, диметил- и диэтилсульфат, этиленимин, азотистый или серный иприт, а также N-метил-N'-нитро-N-нитрозогуанидин принадлежат к наиболее эффективным мутагенам. Например, этилметансульфонат этилирует преимущественно атом N гуанина. Образовавшийся 7-алкилгуанин отщепляется от цепи, в результате чего в ней образуется «пропуск». При очередной репликации на этом месте часто оказывается «ошибочное» основание.
Включение или утрата отдельных пар оснований. Профлавин и другие акридиновые красители действуют по-иному. Вероятно, молекула акридина внедряется между соседними основаниями цепи ДНК и увеличивает расстояние между ними (интеркаляция). Такое пространственное изменение при репликации ДНК может вызывать ошибки двух типов - утрату нуклеотида или включение дополнительной пары нуклеотидов. Мутации этого типа приводят к очень серьезным последствиям, так как при этом нарушается порядок считывания информации при синтезе белка: начиная с места утраты или включения нуклеотида, информация считывается в «неправильных» триплетах (мутация «со сдвигом рамки», рис. 15.4).

Рис. 15.4. Изменение разбивки считываемой последовательности на триплеты в результате «мутации со сдвигом рамки». Бактериофаг Т4 способен образовывать лизоцим. Этот фермент кодируется геном фага. Вверху представлен отрезок нормальной нуклеотидной последовательности (фаг дикого типа) и указаны соответствующие аминокислоты. Внизу приведена нуклеотидная последовательность двойного мутанта, полученного из дикого типа в результате двукратной обработки профлавином. Нуклеотид А во втором триплете утрачен, и начиная с этого места триплеты считываются неправильно («рамка считывания» сдвинута). В результате включения G в конце пятого неверного триплета в дальнейшем восстанавливается правильный порядок считывания. Таким образом, нуклеотидные последовательности двойного мутанта и дикого типа различны только на участке от второго до пятого триплета включительно. Если кодируемые этими триплетами аминокислоты не существенны для функции данного белка, то вторая мутация восстанавливает свойства (фенотип) дикого типа (генетическая супрессия).
Ультрафиолетовые лучи и ионизирующее излучение. УФ-свет, рентгеновские лучи и другие виды ионизирующего излучения оказывают на микроорганизмы как подавляющее жизнедеятельность (летальное), так и мутагенное воздействие. Их специфическое действие еще мало изучено. Исходя из совпадения кривой поглощения нуклеиновых кислот и кривой подавления жизнедеятельности клеток при облучении в зависимости от длины волны, а также частоты мутаций в популяции, можно сделать вывод о том, что УФ-лучи действуют в основном на нуклеиновые кислоты. Наиболее эффективны лучи ближней УФ-области с длиной волны около 260 нм (рис. 15.5). Побочные повреждения при этом незначительны. Поражаются главным образом пиримидиновые основания. Например, два соседних тиминовых основания в ДНК могут оказаться ковалентно связанными. Наличие таких димеров тимина служит затем источником ошибок при репликации (рис. 15.6).
Репарация ДНК. На подвергнутых УФ-облучению бактериях было показано, что повреждения ДНК частично обратимы. Если облучить бактериальную суспензию большой дозой ультрафиолета, то значительная доля клеток подвергнется летальному повреждению (в них возникнут летальные мутации); при начатой сразу же инкубации в темноте лишь немногие клетки образуют колонии. Но если непосредственно после УФ-облучения воздействовать на клетки светом более длинноволновой области (320-550 нм), то доля выживших клеток возрастет в несколько десятков раз. В такой фотореактивации участвует фермент, активируемый светом и восстанавливающий нормальную структуру ДНК путем расщепления образовавшихся димеров тимина. Есть и другой репаративный механизм, не требующий участия света. При этой темиовой реактивации дефектные участки цепи ДНК вырезаются и заменяются новыми нуклеотидами. Степень эффективности такой репарации лучевых повреждений у разных штаммов бактерий неодинакова. Устойчивость к облучению, характерная для некоторых бактерий (например, Micrococcus radiodurans), обусловлена высокоэффективным механизмом репарации.
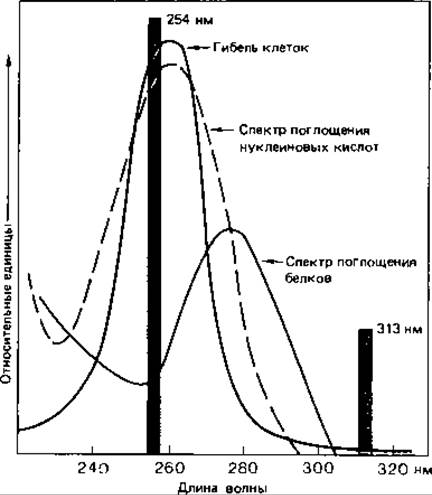
Рис. 15.5. Обоснование использования ртутной лампы низкого давления для вызывания мутаций и уничтожения микроорганизмов. Спектр поглощения нуклеиновых кислот и кривая, описывающая бактерицидное действие света в зависимости от длины волны, имеют максимум при 260 нм. Именно в этой области в спектре ртутной лампы низкого давления имеется сильная полоса испускания (254 нм). Излучение такой УФ-лампы оказывает стерилизующее действие.
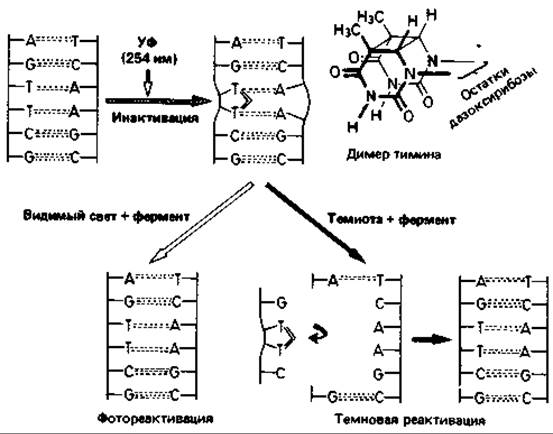
Рис. 15.6. Схема изменений, происходящих в ДНК при УФ-облучении, и процессов фотореактивации и темновой реактивации. Объяснения см. в тексте.
Мутации, вызываемые транспозонами. В генетике бактерий все большее значение приобретает метод получения мутаций с помощью транспозонов. Транспозоны (Тn) представляют собой короткие двойные цепи ДНК, которые состоят из более чем 2000 пар оснований и обычно обусловливают устойчивость к одному антибиотику, в исключительных случаях - к нескольким. Транспозоны способны «перепрыгивать» из одного участка генома в другой, в частности из бактериальной хромосомы в плазмиду и обратно; таким образом, они могут включаться в различные участки генома (см. разд. 15.3.1). В случае внедрения транспозона в какой-либо структурный ген хромосомы нуклеотидная последовательность этого гена будет нарушена и генетическая информация не сможет транслироваться в функционально полноценный полипептид. Возникнет инсерционный мутант.
Поскольку транспозоны не способны к автономной репликации, для переноса их из одной бактериальной клетки в другую необходим так называемый вектор (переносчик). Векторами могут служить плазмиды или бактериофаги. Следует упомянуть, что колифаг мю («фаг-мутатoр»), подобно транспозону, обладает способностью внедряться в различные участки бактериальной хромосомы и вызывать мутации. По этой причине фаг мю был назван «гигантским транспозоном», и его используют в повседневной практике получения мутантов Е. coli.
Проявление признаков. Уже возможность фотореактивации после УФ-облучения указывает на то, что первичный эффект при воздействии мутагенного фактора не обязательно ведет к истинной мутации. Включение бромурацила в цепь ДНК или димеризация тимина представляет собой лишь премутацию; димеризация тимина - процесс обратимый, и в случае фотореактивации дело не доходит до возникновения мутанта. Только при последующей редупликации премутировавшей цепи ДНК первичное повреждение становится стабильным и в дальнейшем передается потомству как новый элемент генотипа. Такая закрепившаяся мутация может исчезнуть только в результате обратной мутации. Проявление мутации в фенотипе связано с рядом последовательных процессов, которые требуют определенного времени или нескольких клеточных делений. Новый фенотип проявится лишь тогда, когда измененный ген начнет функционировать. Этапы, необходимые для реализации нового фенотипа, различны для разных клеток и разных типов мутаций.
Запаздывающее проявление мутаций. Если в гаплоидной клетке произойдет реверсия, превращающая ауксотрофную мутантную клетку в прототрофную, то такая обратная мутация сразу проявится в фенотипе. Восстановление способности вырабатывать определенный фермент можно в надлежащих условиях тотчас же распознать. Иначе обстоит дело с мутациями, приводящими, наоборот, к ауксотрофному состоянию, например к утрате способности синтезировать определенную аминокислоту. Такие мутации удается распознать лишь по прошествии периода, включающего несколько клеточных генераций. Запаздывающее проявление объясняется в данном случае тем, что, хотя мутация и делает невозможным синтез необходимого фермента, еще продолжает какое-то время действовать фермент, синтезированный ранее. Новый признак проявится лишь тогда, когда в результате клеточных делений произойдет достаточное «разбавление» этого фермента. С запаздывающим изменением фенотипа приходится также считаться при выявлении фагоустойчивых бактерий. Если фагочувствительные бактерии приобретают устойчивость в результате мутации, ведущей к утрате способности синтезировать особое рецепторное вещество, то эта устойчивость выявится лишь тогда, когда в результате ряда клеточных делений это вещество будет в достаточной мере разбавлено.
У многоядерных (ценоцитных) клеток тоже следует различать мутации, приводящие к приобретению и к утрате какой-либо функции. Многие бактерии имеют по нескольку ядер (хромосом). Клетки Escherichia coli при быстром росте на средах, богатых питательными веществами, содержат в среднем по четыре хромосомы. При мутации с приобретением функции доминирует мутантная хромосома: она сразу же вызывает синтез нового фермента, и мутация немедленно проявляется в фенотипе. Если же в многоядерной клетке произошла мутация с утратой функции, она оказывается рецессивной. При многократном делении клеток ядра распределяются по разным дочерним клеткам (сегрегация ядер, рис. 15.7). Дефект может проявиться лишь в той клетке, у которой все ядра содержат мутировавший ген. Потомство такой клетки представляет собой генетически чистый клон. Таким образом, при мутациях с утратой функции в случае многоядерных клеток следует учитывать как сегрегацию ядер, так и проявление мутации в фенотипе.
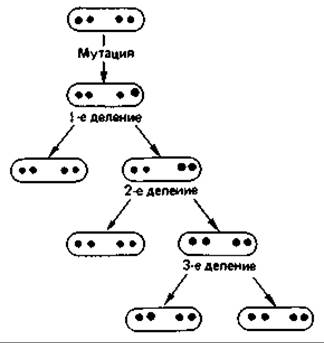
Рис. 15.7. Схема сегрегации ядер при размножении многоядерной бактерии. Только после третьего деления образуется генетически чистый клон. Для проявления мутации в фенотипе может потребоваться еще несколько клеточных генераций (чтобы произошло достаточное разбавление продукта, имевшегося в исходной клетке).
15.2.3 Отбор мутантов
На обычных твердых средах лишь немногие мутации можно непосредственно обнаружить по изменению пигмента, измененному росту колоний или иным признакам. Некоторые мутантные признаки выявляются при добавлении индикаторов или красителей. Для идентификации мутантов, отличающихся от родительских клеток пониженными или повышенными требованиями к питанию, приходится сравнивать рост тех и других на двух средах. Если, например, мутант утратил способность к синтезу лейцина, которой обладали клетки родительского (дикого) типа, то он будет расти только на той среде, к которой добавлена эта аминокислота. Мы называем такого мутанта ауксотрофным по лейцину, т.е. нуждающимся в лейцине (lеu-), а также дефектным по лейцину, противопоставляя ему прототрофный дикий тип (leu+). Если в клеточной суспензии присутствуют одновременно и мутантные клетки leu-, и прототрофные клетки дикого типа, то эти два типа можно различить по росту на двух разных средах. Метод, обычно применяемый для выявления таких дефектных мутантов, представлен на рис. 15.8.

Рис. 15.8. Идентификация и выделение мутантов с биохимическим дефектом. На трех чашках Петри представлен результат опыта по идентификации мутантов Alcaligenes eutrophus, утративших способность расти на среде с фруктозой (Fruc-). Питательная среда в чашках А и Б содержит лактат; на нем одинаково хорошо растут и клетки дикого типа, и мутантные клетки. В чашке В среда содержит только фруктозу; на ней мутанты не растут. Смесь тех и других клеток, полученную в накопительной культуре с помощью модифицированного пенициллинового метода, высеяли в чашку А (исходная чашка). После того как отдельные клетки образовали колонии, их при помощи бархатного штампа перенесли в чашки Б и В. Клетки, не способные использовать фруктозу, выявились благодаря тому, что они росли только в чашке Б, но не в чашке В. Неспособность этих мутантов использовать фруктозу обусловлена дефектом 2-кето-3-дезокси-6-фосфоглюконат-альдолазы. Дефектные колонии указаны стрелками. Аналогичный метод применяют для идентификации и выделения мутантов, ауксотрофных по аминокислотам. (Фото I. Sammler.)

Рис. 15.9. Пенициллиновый метод, применяемый для накопления и выделения ауксотрофных мутантов Escherichia coli или других бактерий, чувствительных к пенициллину.
Как уже упоминалось, частота мутаций для многих признаков очень мала. Для большинства изученных до сих пор физиологических признаков, связанных с типом метаболизма, она варьирует в пределах от 10-10 до 10-5. При частоте 10-8 потребовалось бы обследовать 100 миллионов клеток или их потомство, чтобы выявить новых мутантов. Хотя под влиянием мутагенов частота мутаций значительно возрастает, все равно затрата труда, необходимая для их обнаружения, была бы очень велика. Поэтому перед прямым отбором осуществляют обогащение популяции мутантами.
Получить накопительную культуру мутантов, устойчивых к антибиотикам, ядам или бактериофагам, довольно легко. На среде, к которой добавлен соответствующий агент, выживают только устойчивые к нему мутанты, а клетки дикого типа гибнут.
Методы накопления ауксотрофных мутантов основаны на одном общем принципе: для клеточной суспензии создают такие условия, при которых подлежащие выделению мутанты не растут, а растущие прототрофные клетки отсеиваются или уничтожаются. Существуют средства, которые действуют только на растущие клетки, а нерастущим, «покоящимся», не причиняют вреда. После удаления антимикробного агента и добавления необходимых факторов роста начинают расти ауксотрофные клетки.
Накопление мутантов с применением пенициллина. При накоплении ауксотрофных мутантов Е. coli используют пенициллин. Он убивает растущие клетки дикого типа, а нерастущие мутантные клетки при этом выживают (рис. 15.9).
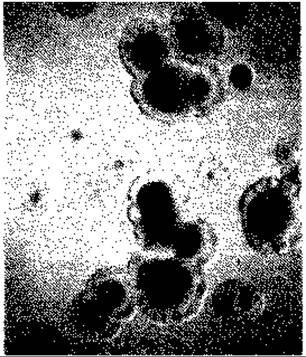
Рис. 15.10. Нормальные колонии и мельчайшие («точечные») колонии дефектного мутанта Alcaligenes eutrophus, образующиеся на агаризованной среде с фруктозой (1%) и сукцинатом (0,01%). (Фото I. Sammler.)
После воздействия, индуцирующего мутации, и многочасового роста бактериальную суспензию инкубируют в среде с глюкозой, но без азота. Это делается для того, чтобы дать возможность клеткам использовать оставшиеся растворимые соединения азота. Через несколько часов добавляют пенициллин и сульфат аммония и проводят инкубацию (на этот раз продолжительностью до 24 ч.). Прототрофные родительские клетки растут, и пенициллин их убивает, тогда как ауксотрофные мутанты, нуждающиеся в определенной аминокислоте, не растут, и это позволяет им уцелеть. Затем суспензию освобождают от пенициллина промыванием или добавлением пенициллиназы и высевают на агаризованную среду, содержащую аминокислоты. Среди вырастающих в таких условиях бактерий процент ауксотрофных клеток оказывается более высоким (помимо них растут также прототрофные клетки, выдержавшие обработку пенициллином). Если бактерии устойчивы к пенициллину, то с той же целью можно применить другие антибиотики (новобиоцин, циклосерин, колистин, канамицин). Для избирательного уничтожения растущих клеток используют и такое явление, как «летальный синтез».
С помощью подобных приемов удается накапливать и выделять мутантов с разного рода дефектами: с нарушениями процессов транспорта или использования субстрата, с дефектами промежуточного обмена, с повышенной чувствительностью к температуре («условно летальные» мутанты). Позднее мы опишем технику выделения других мутантов с измененной регуляцией метаболизма. В табл. 15.2 приводятся краткие сведения о методах отбора и идентификации различных типов мутантов, в том числе и мутантов с дефектами регуляции.
Таблица 15.2. Методы отбора и идентификации разных типов мутантов
|
Тип мутантов |
Методы отбора и накопления |
Идентификация |
|
Мутанты, устойчивые к ингибиторам, антибиотикам, ядам или бактериофагам |
Высев большого числа клеток (> 108) на агаризованную среду, содержащую ингибитор или бактерицидный агент |
Растут только устойчивые мутанты |
|
Ауксотрофные мутанты, нуждающиеся помимо субстрата в дополнительных факторах роста (витаминах, аминокислотах или каких-либо иных веществах) |
Метод с применением пенициллина или аналогичный ему: клетки высевают на среду, лишенную соответствующего фактора роста и содержащую пенициллин или иной агент, оказывающий бактерицидное действие только на растущие клетки |
Клеточную суспензию высевают на полную среду, содержащую необходимый фактор роста (А), и с помощью штампа производят пересев на минимальную среду (Б). Колонии, растущие только на среде А и не растущие на среде Б, - это колонии, образованные ауксотрофными мутантами |
|
Мутанты, не способные использовать определенный субстрат |
Метод с применением пенициллина и (или) непосредственное выделение мельчайших (точечных) колоний. Суспензию высевают на среду, в которой субстрат, используемый диким типом, содержится в нормальной концентрации, а субстрат, доступный для желательного мутанта, - в очень низкой концентрации. После инкубации выделяют мельчайшие колонии (рис. 15.10), которые затем идентифицируют |
Поступают так же, как с ауксотрофными мутантами. Бактерии, осуществляющие брожение или выделяющие какое-либо вещество, можно отличить от клеток дикого типа по цвету колоний, если добавить к среде подходящие красители (эозин + метиленовый синий, рН-индикаторы) |
|
Мутанты, чувствительные к температуре (условно летальные) |
Метод с применением пенициллина: антибиотик убивает клетки дикого типа, растущие при более высокой температуре, например при 37°С |
Поступают так же, как с ауксотрофными мутантами. Проводят инкубацию при различных температурах и выделяют колонии, которые растут, например, при 25°С, но не растут при 37°С |
|
Мутанты с конститутивным синтезом катаболических ферментов |
а) Длительное выращивание при концентрации субстрата, лимитирующих рост б) Попеременное выращивание на двух субстратах в) Выращивание в присутствии вещества, подавляющего индукцию ферментов (антииндуктора) |
Высев суспензии клеток на среду с неиндуцирующим субстратом. Инкубация и опрыскивание колоний «конститутивно» используемым субстратом (+ индикатор + вещества, подавляющие синтез ферментов). Мутанты с конститутивным ферментом немедленно воздействуют на субстрат, и цвет индикатора изменяется |
|
Мутанты с конститутивным синтезом анаболических ферментов |
Выращивание в присутствии антиметаболитов: антиметаболиты (из-за структурного сходства с конечным продуктом одного из процессов биосинтеза) подавляют рост клеток дикого типа. Среди устойчивых колоний имеются такие, у которых ни репрессии, ни ингибирования конечным продуктом уже не происходит |
Растут только устойчивые мутанты. Конститутивный синтез фермента часто распознается по росту сателлитных колоний около устойчивых колоний. Явление это объясняется тем, что в зоне диффузии конечного продукта, выделяемого устойчивыми клетками, антиметаболит не может повлиять на рост клеток дикого типа (рис. 16.15) |