РОСТ И КУЛЬТИВИРОВАНИЕ БИООБЪЕКТОВ - В. М. Самыгин - 2016
ГЛАВА 2. ТЕХНИКА И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
2.1. Технологические особенности и принципы конструирования ферментеров
Еще несколько десятилетий назад простая периодическая культура - это был единственный способ культивирования, который использовался для изучения динамики роста микроорганизмов. Между тем в результате развития инженерных наук, достижений в области биохимии, микробиологии, генетики в вопросах специального применения продуктов биотехнологии стали внедряться не только простые периодические, но и хемостатные культуры, в том числе хемостатные с возвратом биомассы, батареи хемостатов, турбидостат, а также периодическое культивирование с добавлением питательных веществ. За исключением единичных из названных способов культивирование основывается на использовании штаммов микроорганизмов с заданными свойствами и предусматривает аппаратное оформление биотехнологических процессов.
На протяжении многих десятилетий обсуждалась возможность продления жизни микробной культуры. С этой целью были разработаны и предложены различные средства и методы культивирования.
При хемостатном режиме культивирования в биореактор с постоянной контролируемой скоростью вливают питательную среду, один из компонентов которой, часто О2, поступает в количестве, недостаточном для обеспечения максимальной скорости роста культуры. В этом случае реактор с биообъектом приобретает свойства саморегулирующейся системы, автоматически удовлетворяющей равенству μ=Д. Если первоначально скорость разбавления и вымывания биомассы превышает скорость роста клеток, то происходит разбавление культуры свежей средой. Это ведет к повышению концентрации компонента, ограничивающего рост, потому скорость роста культуры увеличивается. Как только μ превысит Д, в реакторе начинает концентрироваться биомасса. Концентрация субстрата падает, что ведет к торможению скорости роста культуры. Таким образом, после серии затухающих колебаний скорость роста становится равной скорости разбавления.
Биреактор, работающий в хемостатном режиме культивирования, называют хемостатом. Он включает: 1) устройство для подачи питательной среды; 2) выпускное приспособление для оттока культуральной жидкости с клетками; 3) систему контроля скорости протока.
Турбидостатный режим культивирования основан на прямом контроле концентрации биомассы. Наиболее распространено измерение светорассеяния содержимого биореактора с помощью фотоэлемента. Сигнал от фотоэлемента управляет скоростью протока жидкости, определяющего скорость роста культуры. Повышение концентрации клеток и соответственно светорассеяния автоматически приводит к ускорению протока жидкости, разбавляющей культуру. Концентрация клеток может оцениваться также по косвенным критериям (по измерению рН, убыли субстрата или накоплению продуктов жизнедеятельности). При этом объем среды поддерживается на постоянном уровне при помощи специального приспособления. По своей конструкции турбидостат отличается от хемостата лишь системой контроля скорости протока. Иначе говоря, с помощью турбидостатного контроля устанавливается плотность биомассы, а скорость разбавления сама подстраивается под стационарное значение. Этим турбидостат отличается от хемостата, в котором фиксируется скорость разбавления, а к стационарному уровню подстраивается концентрация биомассы.
Повысить концентрацию биомассы выше максимума можно, используя возврат биомассы. Хемостат, снабженный специальным устройством для увеличения концентрации биомассы выше значения, возможного для простого хемостата, называется хемостатом с возвратом биомассы. Возврат биомассы предпочтителен, если используется разбавленный лимитирующий субстрат, как, например, в пивоварении или при очистке сточных вод, или в случае малорастворимых субстратов, или, когда следует ограничить концентрацию лимитирующего рост субстрата из-за образования каких- либо ингибирующих продуктов.
Проблема повышения концентрации биомассы при одновременном удалении ингибирующих продуктов отчасти может быть решена путем использования диализного культивирования.
Применение батареи хемостатов расширяет возможности хемостата и имеет преимущество перед одиночным хемостатом. При таком способе культивирования соединяют два и более хемостатов, что создает многостадийные процессы, в каждой стадии которых могут иметь место разные условия.
В зависимости от поставленных научных или производственных задач предусмотрено различное оборудование. Еще в 30-е годы прошлого столетия Клюйвер и Перквин использовали качалку для выращивания глубинным способом грибов, которые в естественных условиях развиваются на поверхности субстрата. Перемешивание культуры микроорганизмов на качалке выполняет две функции: осуществляет массоперенос между различными фазами (газовой, жидкой и твердой) культуры, распределяет клетки так, чтобы поддерживались гомогенные химические и физические условия, что важно для диспергирования биомассы, транспорта тепла и постоянного перемешивания поступающего питательного субстрата. Современные лабораторные ферментеры с перемешиванием снабжены универсальными и полностью контролирующими средствами для глубинного культивирования как микроорганизмов, так и клеток животных и растительных тканей.
Установки для культивирования, как правило, состоят из культурального сосуда и блока регуляции и контроля (блок управления). Культуральный сосуд установки закрыт металлической крышкой, в которой имеются отверстия для подачи стерильного воздуха, питательной среды, корригирующих растворов, внесения инокулята и отбора бульонной культуры в процессе и по окончании культивирования. В культуральном сосуде расположены нагревательный элемент с термистром, рН-электрод, импеллер магнитной мешалки, вращение которого обеспечивается за счет электропривода (рис. 2).
Рис. 2. Схема установки для культивирования микроорганизмов
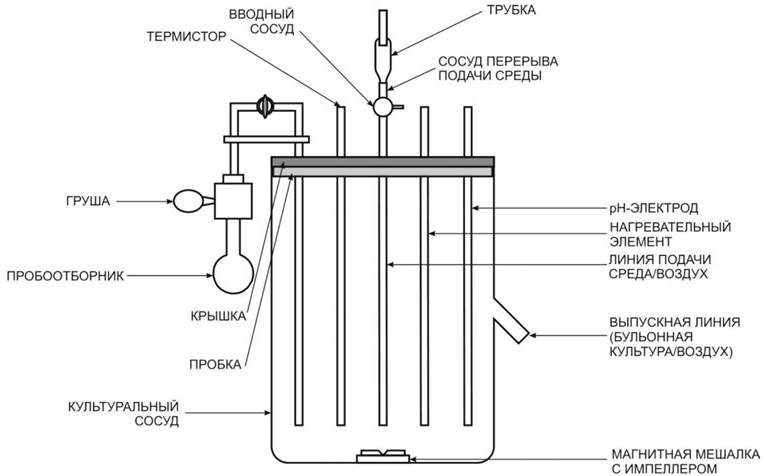
Блок управления обеспечивает нагрев и термостатирование питательной среды, ее аэрацию, заданные значения рН, а при необходимости дополнительные параметры (rН, рО2 и т. д.). В блок управления входит компрессор для подачи воздуха с целью аэрации бульонной культуры и электрический привод магнитной мешалки.
Известные к настоящему времени установки для культивирования, подобные изображенной на рис. 2, предусматривают главным образом эффективное получение целевого продукта при соблюдении соответствующих правил асептики на различных этапах биотехнологического цикла.
В большинстве установок создается избыточное давление воздуха вследствие принудительной аэрации жидкой питательной среды. Повышение давления воздуха наблюдается при перекачивании бактериальной взвеси в ферментер в начале работы или при отборе проб материала (с помощью груши) в процессе и по окончании выращивания. Очевидно, что в таких случаях снижается вероятность контаминанции используемого микроорганизма посторонней микрофлорой, и одновременно повышается производительность технологического процесса.
Однако также очевидно, что возникает реальная возможность выброса вместе с воздухом частиц образующихся бактериальных аэрозолей и последующая угроза контаминации окружающей среды. То есть возникает проблема экологической и биологической безопасности при выращивании микроорганизмов в ферментерах глубинным методом.
Для решения данной проблемы предложена два варианта установок, представленных на рис. 3. Второй вариант отличается более высокой степенью безопасности для обслуживающего персонала, поскольку ферментер помещен в бокс, снабженный фильтром тонкой очистки воздуха.
Рис. 3. Схема установок для глубинного культивирования патогенных микроорганизмов: 1 - культуральный сосуд; 2 - пробка; 3 - крышка; 4 - компрессор; 5 - патрубок для подачи воздуха в культуральный сосуд; 6 - перемешивающее устройство; 7 - магнитный привод; 8 - нагревательный элемент; 9 - термистор; 10 - термостатирующее устройство;11 - рН-электрод; 12 - рН-метр; 13 - блок управления; 14-18 - патрубки для подачи корригирующих растворов, инокулята, отбора проб и выхода отработанного воздуха; 19 - инокулятор; 20 - емкости с дезинфицирующим раствором; 21 - вакуумный насос; 22-24 - клапаны; 25 - пробоотборник; 26 - емкости с корригирующим раствором; 27 - перистальтический насос; 28 - фильтры очистки воздуха; 29 - бокс безопасности; 30 - манометр; 31, 32 - входной и выходной фильтры тонкой очистки воздуха соответственно; 33 - герметичные разъемы электрокоммуникаций
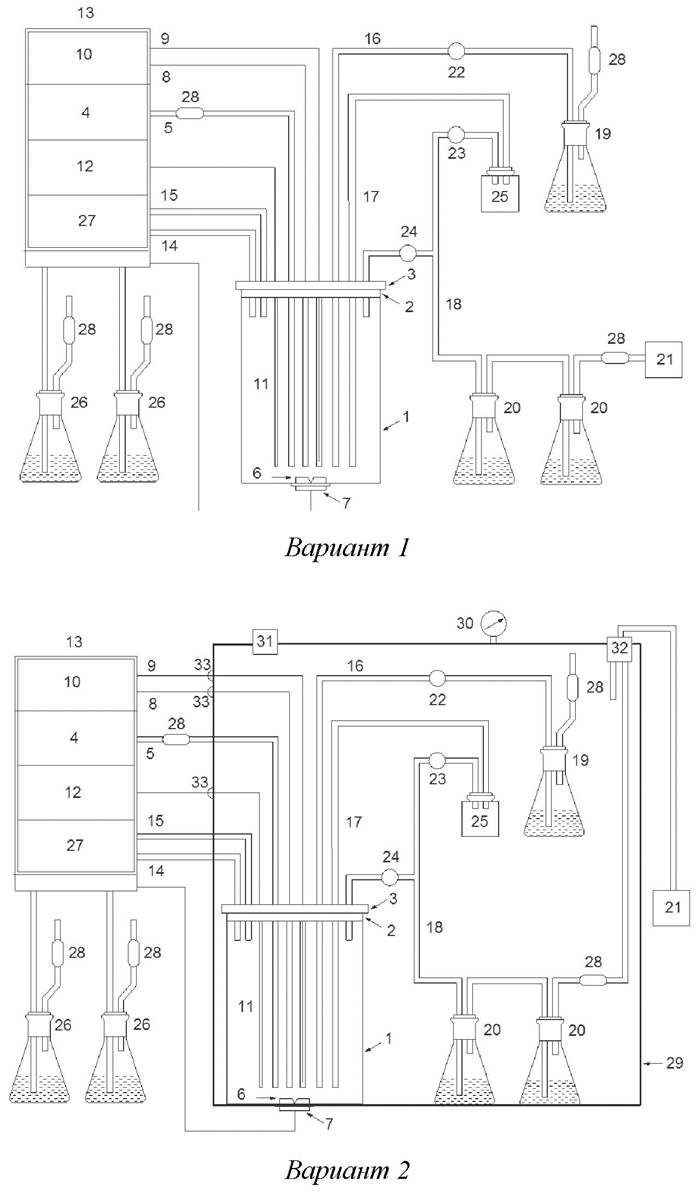
Установка работает следующим образом. Культуральный сосуд заполняют питательной средой с инокулятом за счет разницы давления между культуральным сосудом и инокулятором, создаваемой с помощью вакуумного насоса. Для этого открывают клапаны 22 и 24, а клапан 23 оставляют закрытым. После перекачивания инокулята в культуральный сосуд клапан 22 закрывают. Затем в культуральный сосуд подают воздух, который стерилизуется, проходя через фильтр 28.
Для обеспечения биологической безопасности расход воздуха, подаваемого компрессором и откачиваемого вакуумным насосом, регулируют таким образом, чтобы разрежение в полости культурального сосуда в процессе работы поддерживалось на уровне 5 мм водяного столба. С помощью термостатирующего устройства и рН-метра задают необходимые значения температуры и рН. Контроль рН внутри сосуда осуществляют при помощи рН-электрода, сигнал с которого подается на перистальтический насос для подачи корригирующих растворов, согласно заданным параметрам.
Перемешивание бульонной культуры производят, включая магнитный привод мешалки. Отбираемый с помощью вакуумного насоса воздух проходит через систему очистки, состоящую из двух колб с дезинфицирующими растворами, инактивирующими культивируемый микроорганизм. Отбор проб осуществляется путем открытия клапана 23 и закрытия клапана 24. Пробы отбирают из культурального сосуда в пробоотборник, который затем заменяют новым. После отбора проб клапаны 23 и 24 приводят в исходное положение (клапан 24 открывают, а клапан 23 закрывают). По окончании работы аналогичным образом производят перекачивание конечного продукта (бульонной культуры), заменяя пробоотборник емкостью большего объема, отключают компрессор, перемешивающее устройство, термостатирующее устройство и рН-метр. Вакуумный насос отключают в последнюю очередь.
Находящиеся внутри бокса безопасности оборудование и предметы, заведомо или потенциально контаминированные патогенной микрофлорой (культуральный сосуд ферментера, пробоотборник, коммуникационные материалы, пипетки и т. п.), помещают в металлические контейнеры для последующего автоклавирования. Режим автоклавирования определяется видом используемого в работе микроорганизма.
В обоих случаях можно получать выход материала желаемого качества и создавать условия для изучения эффекта изменения клеточных свойств в ответ на изменение скорости роста без каких-либо изменений в окружающей среде.
2.2. Методы биологического контроля воздуха и система защиты окружающей среды от бактериальных аэрозолей
2.2.1. Средства и методы биологического контроля
Для бактериологического контроля аэрозольных частиц в микробиологии и биотехнологии предложены аспирационные методы, использующие при заборе проб воздуха импакторы, в которых происходит принудительное осаждение микроорганизмов из прокачиваемого воздуха на поверхность плотной питательной среды, или импинжеры, в которых воздух барботируется через слой жидкости, абсорбирующей аэрозольные частицы. Кроме того, воздух контролируют с помощью сепараторов-пробоотборников аэрозолей, используя мембранные фильтры из нитроцеллюлозы или ацетата целлюлозы.
Однако известные методы контроля воздуха имеют определенные недостатки. Импактные методы требуют прокачивания больших объемов воздуха, что неприемлемо для лабораторных и отчасти пилотных ферментеров с небольшим объемом культурального сосуда. Кроме того, эффективность бактериологического контроля при импактных способах ограничена чувствительностью используемых агаризованных питательных сред. У известных барботажных способов отмечается низкая скорость пробоотбора, для них необходимы специальное оборудование.
В настоящее время разработан метод оценки бактериологического контроля воздуха в установках с использованием импактора или импинжера (рис. 4). Для этого между емкостями с дезинфицирующим раствором 20 и выходным фильтром 32 бокса безопасности к вакуумному трубопроводу поочередно подключают импактор 36, соединенный с трубопроводом через клапан 37, или импинжер 38, соединенный через клапаны 39, 40, 41.
Рис. 4. Система бактериологического контроля воздуха в установке для культивирования микроорганизмов: 1 - культуральный сосуд; 2 - пробка; 3 - крышка; 4 -компрессор; 5 - патрубок для подачи воздуха в культуральный сосуд; 6 - перемешивающее устройство; 7 - магнитный привод; 8 - нагревательный элемент; 9 - термистор; 10 - термостатирующее устройство;11 - рН-электрод; 12 - рН-метр; 13 - блок управления; 14-18 - патрубки для подачи корригирующих растворов, инокулята, отбора проб и выхода отработанного воздуха; 19 - инокулятор; 20 - емкости с дезинфицирующим раствором; 21 - вакуумный насос; 22-24 - клапаны; 25 - пробоотборник; 26 - емкости с корригирующим раствором; 27 - перистальтический насос; 28 - фильтры очистки воздуха; 29 - бокс безопасности; 30 - манометр; 31, 32 - входной и выходной фильтры тонкой очистки воздуха соответственно; 33-35 - герметичные разъемы электрокоммуникаций; 36 - импактор; 38 - импинжер; 37, 39-41 - клапаны.
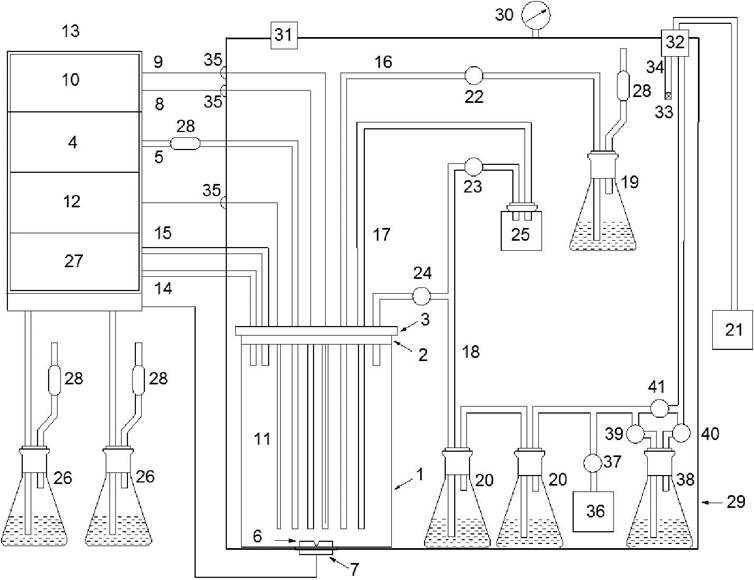
В импактор помещают четыре чашки Петри с агаровой средой, через которую прокачивают воздух, после чего чашки переносят в термостат и инкубируют в течение двух суток при 28 °С и двое суток при комнатной температуре, ежедневно просматривая на наличие характерных колоний тесткультуры. В качестве тест-культуры в фермент ерах используют штамм чудесной палочки (Serratia marcescens).
При использовании импинжера, представляющего сосуд с жидкой питательной средой, воздух барботируют через питательную среду в течение определенного времени, после чего импинжер помещают на сутки в термостат при 28 °С, делают высевы на три чашки с агаризованной средой и исследуют, как описано для импактора. Через импактор воздух прокачивают за счет собственного аспирационного устройства, в импинжер воздух поступает за счет вакуумного насоса 21.
С помощью импактора клетки удавалось выявлять в интервале от 15 до 100 % случаев. Результаты контроля проб с помощью импинжера были положительны во всех случаях независимо от этапа развития бульонной культуры и продолжительности барботирования воздуха через питательный бульон.
Таким образом, абсорбция бактериальных аэрозолей путем барботирования воздуха через жидкую питательную среду выгодно отличается от осаждения микроорганизмов из прокачиваемого воздуха на поверхность плотной питательной среды. Использованный барботажный метод не требует специального оборудования и может быть рекомендован для бактериологического контроля воздушной среды в установках для культивирования микроорганизмов при выполнении биотехнологических процессов.
2.2.2. Система защиты окружающей среды от биологических аэрозольных загрязнений
С целью защиты окружающей среды от биологических выбросов из ферментеров используют различные методы. Чаще всего для этой цели используют фильтрующие системы очистки в виде бактериальных фильтров тонкой очистки (ФТО). Известные системы защиты имеют определенные недостатки. Применение наиболее распространенных фильтров тонкой очистки ограничено прочностью, сопротивлением и нормативными значениями коэффициента проницаемости фильтрующего материала, а также перепадом давлений, возникающим в процессе работы, и повреждениями, которые тотчас же не всегда можно установить. Кроме того, ФТО малоэффективны для отделения мелких частиц, таких как вирусы и риккетсии, но нуждаются в специальной обработке (автоклавировании) или замене после адсорбции на их поверхности бактериальных клеток. Использование ФТО ограничено или недопустимо в условиях избыточного давления воздуха.
Проблема биологической безопасности процессов культивирования отчасти может быть решена за счет использования описанных установок, в которых выращивание бактерий происходит в культуральном сосуде при более низком, по сравнению с атмосферным, давлении. Кроме того, в качестве защитной системы окружающей среды от ферментационных выбросов в установках используют последовательно соединенные емкости с растворами различных дезинфицирующих средств, через которые барботируют отработанный при аэрации бульона воздух.
Для абсорбции и обеззараживания бактериальных аэрозолей в системе установки в качестве дезинфицирующих средств были испытаны в регламентированных и более высоких концентрациях хлорамин, активированный раствор перекиси водорода и формальдегид, являющиеся табельными средствами дезинфекции. Наиболее надежным дезинфицирующим средством оказался 10 %-ный раствор формалина при комнатной температуре (20-25 °С), который приводил к полной инактивации бактериальных аэрозолей на протяжении всего процесса культивирования.
Таким образом, оснащение установок вакуумным насосом, герметичными клапанами трубопроводов, системой очистки отработанного воздуха, состоящей из последовательно соединенных емкостей с 1 0 % раствором формалина, обеспечивает высокую степень биологической и экологической безопасности. Такие установки могут быть рекомендованы для глубинного выращивания микроорганизмов различной степени патогенности.