Клінічна імунологія та алергологія - О.М. Біловол 2011
Імунне запалення й інфекційні хвороби. ВІЛ-інфекція: імунопатогенез, імунодіагностика, імунокорекція
Актуальність теми. Однією з основних функцій імунної системи є розпізнавання і знищення тіл та речовин, що несуть ознаки чужорідної генетичної інформації, включаючи збудників інфекційних хвороб. При формуванні антиінфекційної резистентності в організмі розвиваються специфічні і неспецифічні механізми. Їх взаємодія схильна до певної тимчасової послідовності і характеризується синергізмом взаємного посилення.
З моменту опису перших випадків ВІЛ та СНІДу й ідентифікації вірусу на початку 80-х років ХХ сторіччя захворювання набуло характеру пандемії. За оцінками UNAIDS у 2008 р. у світі налічувалося понад 40 млн ВІЛ-інфікованих. Вперше ВІЛ-інфекція в Україні була зареєстрована в 1987 р. До 1994 р. у країні відзначалися низькі темпи розвитку епідемії, домінував гетеросексуальний шлях поширення інфекції. За період з 1987 р. по 1994 р. було зареєстровано 183 ВІЛ- інфікованих громадянина Україні. З 1995 р. по 1997 р. відбулося лавиноподібне поширення ВІЛ-інфекції серед споживачів ін’єкційних наркотиків в усіх областях Україні.
Загальна мета: вивчення механізмів імунного захисту від інфекційних чинників (бактерії, віруси, грибки, паразити), особливостей імунної відповіді при гострому і хронічному запальному процесі імунопатогенеза при ВІЛ-інфекції та імунологічних методів їх виявлення і контролю.
Конкретні цілі: |
Початковій рівень знань-умінь: |
1. Вивчення механізмів імунного захисту при бактерійних, вірусних, протозойних, опортуністичних інфекціях. 2. Реакції імунної системи при грибковому ураженні та гельмінтозі. 3. Значення стану імунної системи в розвитку опортуністичних і протозойних інфекцій. 4. Імунологічні методи діагностики інфекційних захворювань 5. Імунна відповідь при гострому запальному процесі. 6. Динаміка показників лейкограми, протеїнограми і імунограми при гострому, рецидивуючому і хронічному запаленні. 7. Вивчення імунопатогенеза, імунодіагностики та імунокорекції при ВІЛ-інфекції. |
1. Знання особливостей антибактеріального імунного захисту. 2. Знання особливостей противірусного імунного захисту. 3. Знання особливостей протигрибкового імунного захисту. 4. Знання імунологічних реакцій при гельмінтозі. 5. Розуміння динаміки основних показників лейкограми та імунограми при бактеріальному, вірусному, грибковому, гельмінтному враженні. 6. Знання особливостей лейкограми й імунограми при запальному процесі. 7. Знання імунологічних зрушень, клінічних проявів, класифікації і методів терапії ВІЛ-інфекції. 8. Демонструвати володіння морально-деонтологічними принципами медичного фахівця і принципами професійної субординації. |
Завдання для перевірки початкового рівня знань
1. Укажіть основні механічні фактори, які зашкоджують проникненню інфекційного збудника в організм при наявності імунодефіцитного стану.
A. Цілісний шкірний покрив.
B. Механічне видалення збудника інфекції з організму з секретом: селезінки, потом, назальним секретом, слизом бронхів.
C. Жоден з вказаних варіантів відповіді.
2. На користь якого з перерахованих патологічних станів свідчить високий титр антитіл до стрептолізину О?
A. Хронічній гломерулонефрит.
B. Ревматоїдний артрит.
C. Недавно перенесена стрептококова інфекція.
D. Системний червоний вовчак.
3. Яке з наведених підтверджень вірно описує механізм противірусної дії інтерферону?
A. Інтерферон формує покриття поверхні клітин, зашкоджуючи таким чином пенетрації вірусу.
B. Інтерферон безпосередньо руйнує вірус у позаклітинному середовищі.
C. Інтерферон знищує вірус, який потрапляє в клітину.
D. Інтерферон діє через геном клітини, активуючи продукцію противірусних білків.
4. Стрімкий розвиток імунної недостатності при СНІДі обумовлений:
A. Ураженням CD4-клiтин вірусом імунодефіциту.
B. Приєднанням вторинної інфекції, обумовленої умовно-патогенним збудником.
C. Знищенням Т-хелперів вірусом імунодефіциту.
D. Жодним з перерахованих механізмів.
E. Усіма перерахованими механізмами.
5. Визначіть можливі шляхи поширення набутого імунодефіциту, обумовленого РНК- вміщуючим ретровірусом.
A. Статевим шляхом.
B. Парентеральним шляхом при переливанні цільної крові та окремих її компонентів.
C. Трансплацентарним від матері плоду.
D. Жодним з перерахованих шляхів.
E. Усіма перерахованими шляхами.
6. Укажіть найбільш суттєві клінічні ознаки СНІДу:
A. Пневмоцистна пневмонія
B. Диспепсія, що триває понад місяць.
C. Лихоманка, що триває понад місяць.
D. Втрата ваги більше, ніж на 10%.
E. Лімфоаденопатія.
F. Жодна з вказаних ознак.
7. Які умовно-патогенні мікроорганізми частіше можуть бути причиною летального кінця при СНІДі?
A. Цитомегаловіруси.
B. Вірус Епштейна-Барра.
C. Вірус простого герпесу.
D. Грибки кандида.
E. Грибки кріптококу.
F. Токсоплазми.
G. Пневмоциста карінеї.
H. Жоден з вказаних збудників.
8. Головна роль у захисті новонародженого від інфекції в перші роки життя належить:
A. IgM.
B. IgD.
C. IgG.
D. IgE.
9. Антирезусний гама-глобулін застосовують:
A. Для лікування гемолітичної хвороби новонароджених, зв’язаної з резус-несумісністю матері і плоду.
B. Для профілактики резус-конфлікту в момент повторних пологів резус-негативним матерям.
C. Для лікування стафілококової інфекції, грипу, кашлюка.
10. Які з вказаних структурних елементів вірусу грипу можуть індукувати створення антитіл, що мають виражену захисну дію проти грипу?
A. Нейрамінідаза.
B. Гемаглютинін.
C. Нуклеїнова кислота.
D. Оболонка.
Вірні відповіді на питання: 1 - AB; 2 - C; 3 - D; 4 - AB; 5 - ABC; 6 - ABCDE; 7 - ABCDEFG; 8 - C; 9 - B; 10 - B.
Джерела учбової інформації
1. Клінічна імунологія та алергологія: Підручник / [Г. М. Дранік, О.С. Прилуцький, Ю. І. Бажора та ін.]; за ред. проф. Г.М. Драніка. - К.: Здоров’я, 2006. - 888 с.
2. Казмірчук В. Є. Клінічна імунологія і алергологія / В.Є. Казмірчук, Л.В. Ковальчук. - Вінниця: Нова книга, 2006, 504 с.
3. Андрєйчин М. А. Клінічна імунологія та алергологія: Підручник / Андрєйчин М. А., Чоп’як В. В., Господарський І. Я. - Тернопіль: Укрмедкнига, 2005. - 372 с.
4. Клиническая иммунология и аллергология: Учебное пособие / под ред. А. В. Караулова. - М.: Медицинское информационное агентство, 2002. - 651 с.
5. Никулин Б. А. Оценка и коррекция иммунного статуса / Никулин Б. А. - М.: ГЭОТАР-Медиа, 2007. - 376 с.
6. Бурместер Г. Р. Наглядная иммунология, пер с англ. / Бурместер Г. Р. - М.: БИНОМ. Лаборатория знаний, 2007. - 329 с.
7. Кравченко Е. М. ВИЧ-инфекция и иммунная система: их взаимодействие и последствие / Е. М. Кравченко, В. Н. Иванищев // Клиническая иммунология, аллергология, инфектология. - 2009, №3(22). - С. 23-28.
8. Змушко Е. И. Клиническая иммунология: руководство для врачей / Змушко Е. И. - СПб: "Питер", 2001. - 576 с.
9. Запорожан В. М. ВІЛ-інфекція і СНІД / В. М. Запорожан, М. Л. Аряєва - К.: "Здоров’я", 2004. - 636 с.
10. ВИЧ-инфекция / [Рахманова А.Г., Виноградова Е.Н., Воронин Е.Е., Яковлев А.А.] - СПб., 2004. - 696 с.
11. Бобкова М. Р. Иммунитет и ВИЧ-инфекция / Бобкова М. Р. - М.: Олимпия Пресс, 2006. - 240 с.
12. Шувалова Е. П. Инфекционные болезни / Шувалова Е. П. - М.: Медицина, 2001. - 324 с.
13. Антоняк СМ., Щербинська A.M. Клінічний протокол антиретровірусної терапії ВІЛ-інфекції у дорослих і підлітків / СМ. Антоняк, A.M. Щербинська - "Міжнародний альянс з ВІЛ/СНІД в Україні", 2004. - 112 с.
Механізми імунного захисту при бактеріальних, вірусних, грибкових та протозойних інфекціях
Неспецифічний імунітет. Першим бар’єром на шляху проникнення збудника хвороби в організм хазяїна є шкіра і слизова оболонка. Злущення ороговілого епітелію, присутність на шкірі жирних кислот, виділення сальних залоз, функція миготливого епітелію слизових оболонок, наявність лізоциму, інгібіторів розмноження бактерій і вірусів у секретах обумовлюють знищення збудників. Проте головним механізмом захисту є фагоцитоз. При цьому не всі захоплені клітини гинуть, наприклад мікобактерії, бруцели, сальмонели, лістерії можуть не тільки зберігатися у фагоцитах, але і у ряді випадків розмножуються там. Деякі бактерії (капсульні форми пневмококів) взагалі фагоцитуються.
Клітинні механізми несприйнятності поєднуються з гуморальними чинниками. Це - лізоцим, інтерферон, альтернативний шлях активації комплементу. Остання реакція обумовлена бактеріями, вірусами, грибами, ендотоксинами, розвивається безпосередньо після проникнення інфекційного агента.
Специфічний імунітет. Оскільки мікроорганізми мають різноманітні антигенні детермінанти, то в організмі через певний період часу розвивається поліклональна імунна відповідь. При цьому вхідні ворота інфекції і особливості збудника визначають, яка форма імунної реактивності - клітинна або гуморальна - буде реалізована.
Тривалість імунного захисту може бути довічною (кір, кашлюк) або обмеженою (грип). В обох випадках відповідальними за це є довгоживучі клітки імунологічної пам’яті.
Таким чином, в розвитку специфічного антиінфекційного імунітету можна виділити чотири стадії: 1) індукції (аферентну); 2) імунорегуляторну (проліфера- тивну); 3) ефекторну (продуктивну); 4) формування імунологічної пам’яті (табл. 1).
Таблиця 1
Характеристика стадій антиінфекційного імунітету (за Н. В. Медуніциним)
Стадії імунітету |
Клітини, які беруть участь |
Імунологічні процеси |
Індукція (аферентна) |
Антигенпрезентуючі клітини (макрофаги, дендритні клітини, клітини Лангерганса В-лімфоцити та ін.) |
Процесинг і презентація антигену |
Імунорегуляторна (проліферативна) |
Т-хелпери I і II типу, Т-супресори |
Активація, диференціювання і взаємодія імунорегуляторних клітин |
Ефекторна (продуктивна) |
Т-кілери, плазматичні клітини |
Диференціювання клітин-попередників в ефекторні клітини, антитілоутворення |
Формування імунологічної пам’яті |
Т- і В-клітини пам’яті |
Накопичення клітин пам’яті |
ІМУННЕ ЗАПАЛЕННЯ Й ІНФЕКЦІЙНІ ХВОРОБИ
Особливості імунітету при бактеріальних інфекціях
Імунна відповідь при інвазії позаклітинних мікроорганізмів. Імунна відповідь, направлена проти позаклітинних паразитуючих бактерій (стафілококи, стрептококи, клостридії, збудники дифтерії, кишкових інфекцій та ін.), а також деяких крупних вірусів (кору, поліомієліту), переслідує дві мети: елімінацію самих збудників і нейтралізацію їх токсинів.
Більшість збудників позаклітинних бактерійних інфекцій обумовлюють утворення специфічних антитіл, які зв’язуються з поверхнею бактерій і у присутності комплементу викликають цитотоксичні реакції (бактеріоліз). Крім того, навантажені антитілами або комплементом бактерії дуже схильні до фагоцитозу (опсонізація).
Таким чином, головну протективну роль в імунній відповіді проти бактерійних інфекцій грає гуморальна імунна відповідь, що проявляється синтезом специфічних антитіл, - імуноглобулінів. У реалізації такої відповіді беруть участь В-лімфоцити, Т-хелпери (CD4 Т-лімфоцити) і антиген-презентуючі клітини.
Специфічні Т-клітинні рецептори (ТКР) здатні розпізнавати чужорідний антиген тільки в комплексі з власними клітинними антигенами головного комплексу гістосумісності (MHC) на поверхні допоміжних антиген-презентуючих клітин (АПК). Професійними АПК організму є макрофаги, дендритні клітини і В-лімфоцити. Їх роль у різних типах імунної відповіді неоднакова. Так, у гуморальній імунній відповіді в основному функцію АПК здійснюють В-лімфоцити. В-лімфоцити здатні розпізнавати антиген в розчині і зв’язувати білкові, полісахаридні і ліпопротеїдні розчинні антигени за допомогою специфічних lgМ-рецепторів (а також рецепторів CR1 до СR1-компоненту комплементу, який, у свою чергу, може бути пов’язаний з мікробом), тоді як CD4 Т-лімфоцити можуть розпізнати тільки короткі пептидні фрагменти білкових антигенів у комплексі з молекулами MHC II класу. Так, щоб Т-лімфоцит розпізнав антиген і активувався, необхідний "процесінг" антиген/MHC II антиген- презентуючою клітиною. При цьому антиген фагоцитується АПК і розщеплюється в кислому середовищі фаголізосоми. Серед фрагментів, що утворилися, йде відбір по здатності комплексуватися з молекулами MHC II, пресинтезованими в ендоплазматичному ретикулумі тієї ж клітини. Спеціальна молекула - шаперон - переносить MHC II всередину ендосоми, де і утворюється її комплекс з пептидом, який далі презентується на мембрані клітини. Комплекс антигенного пептиду з MHC II розпізнається ТKР за участю корецепторної молекули CD4. Причому початковий контакт між АПК і Т-лімфоцитом забезпечується взаємодією адгезійних молекул B7 і CD28, які грають також роль стимулюючих чинників. Додатковим сигналом активації CD4 Т-лімфоцита служить IL-1 ß, що виділяється активованою антиген-презентуючою клітиною. IL-10ß продукується багатьма клітинами організму у відповідь на інфекцію, дію мікробних токсинів, запальних агентів, деяких інших цитокінів, активованих компонентів комплементу і має здатність стимулювати Т- і В-лімфоцити, підвищувати продукцію гепатоцитами гострофазових білків, продукцію і секрецію інших цитокінів різними клітинами, підсилювати клітинну проліферацію.
Після активації в результаті розпізнавання антигену CD4 Т-лімфоцит диференціюється в Т-хелпер (Тх). Причому при гуморальній формі імунної відповіді, здійснюваній проти позаклітинних інфекційних агентів, спостерігаються реакції запалення в рихлій сполучній тканині. У ній беруть участь базофіли і опасисті клітини, які при активації виділяють інтерлейкін-4 (IL-4). У присутності IL-4 CD4 Т-лімфоцити (Тх0) диференціюються в Т-хелпери 2-го типу (Тх2) і починають самі синтезувати IL-4, який є головним чинником зростання Тх2 і В-лімфоцитів. У результаті утворюється клон Тх2, здатний активувати специфічні В-лімфоцити, що зв’язали конкретний антиген, який викликав дану імунну відповідь. При цьому Тх2 розпізнає за допомогою CD4 антиген, що асоціюється з MHC II класу, адгезійними молекулами в даному випадку є CD40L і CD40. Другим сигналом для активації В-лімфоцитів служить IL-4, який виділяється Тх2, а також необхідна присутність на мембрані В-лімфоцитів імуноглобулінового рецептора, пов’язаного з антигеном. Активовані Т-хелпером 2-го типу специфічні В-лімфоцити починають посилено продукувати відповідні за специфічністю антитіла - імуноглобуліни.
Антитіла можуть брати участь у різних способах елімінації інфекційних агентів: опсонізації бактерій і посиленні їх фагоцитозу через FCR і CRl-рецептори фагоцитів; нейтралізації бактерійних екзотоксинів; активації системи комплементу з подальшою дією її мембраноатакуючого комплексу. Крім того, специфічні антитіла класу IgA, присутні на поверхні слизових оболонок (sIgA), перешкоджають колонізації поверхні слизових оболонок бактеріями і беруть участь у нейтралізації їх токсинів.
Формування механізмів саногенеза (одужання) при різних бактерійних інфекціях лежить в основі деяких особливостей імунітету, що виникає під час таких захворювань.
Так, при бактеріальних інфекціях, збудники яких продукують екзотоксин (дифтерія, правець, ботулізм, газова гангрена та ін.), провідну роль у формуванні імунітету грають антитіла, що утворюються в організмі (антитоксини). Взаємодія молекули антитоксину і молекули токсину може призводити до різних результатів:
• блокади рецепторної ділянки молекули токсину і, внаслідок цього, обмеженню фіксації токсину на рецепторах клітин-мішеней;
• прямої нейтралізації каталітичної (ензиматичної, токсичної) ділянки молекули токсину;
• утворення імунного комплексу з нейтралізацією токсичного, рецепторного і (або) транслокаційних ділянок (субодиниць) токсину. Такі комплекси фагоцитуються і утилізуються клітинами макроорганізму. Проте антитоксичні антитіла не блокують адгезію бактерій на поверхні клітин-мішеней і їх колонізацію. Внаслідок цього штучний антитоксичний імунітет не створює повного захисту макроорганізму і не запобігає фіксації бактерій на поверхні клітин-мішеней, що сприяє колонізації клітин і тканини, розмноженню бактерій.
У тих випадках, коли патогномонічні збудники утворюють екзотоксини (правець, дифтерія), антитоксини легко нейтралізують токсичні речовини, проте при первинній інфекції вони можуть синтезуватися надто пізно і не здатні захистити організм.
При іншій групі бактеріальних інфекцій (менінгококова інфекція, кашлюк, легіонельоз та ін.) вирішальна роль належить імунному лізису і фагоцитозу бактерій. IgG, що утворюються при цих захворюваннях, ініціюють цілий ряд антитіло-опосередкованих біологічних реакцій:
а) при фіксації антитіла на поверхні бактерій відбувається активація комплементу за класичним варіантом з утворенням мембраноатакуючого комплексу і подальшим лізисом голих ділянок мембран бактерій;
б) опсонізація бактерій антитілами з подальшою взаємодією Fс-фрагментів антитіл з Fс-рецепторами макрофагів, що приводить до посилення поглинальної і перетравлюючої активності фагоцита;
в) комплекс "бактеріальний антиген-антитіло-комплемент" фіксуюється на рецепторах макрофагів до С3в, що також веде до посилення поглинаючої активності таких комплексів фагоцитами;
г) нейтрализація антитілами антифагінів, що виділяються бактеріями назовні (це чинники, що перешкоджають утворенню фагоцитами псевдоподій; чинники, що перешкоджають міграції макрофагів) або що входять до складу анатомічних структур бактерій (М-протеїн стрептококів, капсульні речовини пневмококів та ін.).
Таким чином, імунітет, що формується при менінгококовій інфекції, кашлюку, легіонельозі, залежить від рівня циркулюючих IgG, вмісту і активності компонентів комплементу, а також від функціонального стану фагоцитів.
Імунна відповідь при інвазії внутріклітинних мікроорганізмів
Внутріклітинні паразити здатні тривало існувати усередині фагоцитів і навіть розмножуватися в них (туберкульоз, туляремія, бруцельоз, лістеріоз та ін.).
Основними механізмами, що дозволяють бактеріям здійснювати внутріклітинний паразитизм, є:
• блокада фаголізосомального злиття (мікобактерії туберкульозу);
• резистентність бактерій до дії лізосомальних ферментів (гонококи, стафілококи);
• здатність бактерій швидко залишати фагосоми після поглинання і тривало перебувати в цитоплазмі (лістерії).
Клітинний імунітет має особливе значення в тих випадках, коли реакції фагоцитозу виявляються неспроможними, унаслідок чого виникає персистенція патогенних бактерій, формується скупчення лімфоїдних клітин і макрофагів (гранулема). Іноді це призводить до неспецифічної стимуляції макрофагів, що обумовлює підвищення резистентності до інших інфекцій. Наприклад, при високому рівні клітинного імунітету проти туберкульозу підвищується стійкість до грибків, простіших, бруцел, лістерій.
Отже, для захворювань з тривалим внутріклітинним перебуванням і розмноженням збудника (персистенція) характерне утворення гранулем в ураженій тканині. Такі бактерії стають недоступними для дії антитіл і гуморальних антибактеріальних чинників. Механізм саногенеза і формування імунітету при таких захворюваннях пов’язаний, перш за все, з утворенням цитотоксичних Т-лімфоцитів, які здійснюють кілінг клітин-мішенів, що маркіровані рецепторами MHC-I.
Основна протективна роль в імунній відповіді, що спрямована проти внутріклітинних паразитів (Micobacterium tuberculosis, грибків, найпростіших, вірусів), належить клітинним механізмам. Здатність перерахованих мікробів перебувати і розмножуватися усередині клітин робить їх захищеними від дії антитіл і системи комплементу. Для елімінації таких мікробів необхідна специфічна клітинно-опосередкована відповідь.
Особливості імунітету при вірусних інфекціях
Цілі імунної відповіді: 1) зупинити проникнення віріонів у клітини; 2) нищити вже інфіковані клітини, щоб знизити поширення вірусу. У зв’язку з цим, при проникненні вірусу в організм розвиваються імунологічні реакції двох типів: а) направлені проти віріону; б) діючі на клітину, інфіковану вірусом. Реакції, направлені проти віріону, є переважно гуморальними, а реакції, що впливають на клітини, інфіковані вірусом, є клітинними і опосередковані Т-лімфоцитами.
Інтерферони - група цитокінів, які збільшують резистентність клітин до вірусної інфекції, мають антипроліферативний ефект, а також здатні регулювати імунну відповідь. Розрізняють три види інтерферонів: б - продукований лейкоцитами, в - продукується фібробластами і г - продукований Т-лімфоцитами- хелперами 1-го типу. Інтерферон гальмує транскрипцію вірусного геному в клітині-господарі та перешкоджає трансляції вірусної мРНК, що знижує вірусемію і полегшує завершення процесу елімінації збудника різними чинниками специфічного імунітету. У міжклітинному просторі і крові є постійний рівень інтерферону, що забезпечує природну резистентність організму до вірусної інфекції. Після вірусного інфікування організму вже через 1-3 години в міжклітинному просторі і крові збільшується рівень інтерферону.
Нейтралізація вірусу, що перешкоджає його прикріпленню до клітини-мішені, здійснюється антитілами IgG у позаклітинній рідині, IgM у крові і секреторними IgA-антитілами на поверхні слизових оболонок. Імунні комплекси, що містять вірус, можуть зв’язувати комплемент, що сприяє нейтралізації вірусу.
При розповсюдженні вірусу від клітини до клітини або при їх контакті, або в тих випадках, коли вірус інтегрується в геном чутливої клітини, на перше місце виходять клітинні імунні реакції за участю цитотоксичних Т-лімфоцитів-кілерів. Оскільки віруси є внутріклітинними паразитами, основну функцію захисту від них виконують клітинні реакції.
Специфічні Т-клітини-кілери з’являються через 2-3 дні після зараження і передують появі віруснейтралізуючих антитіл.
У противірусному імунітеті руйнування клітин, що містять віруси, здійснюється як Т-лімфоцитами, так і, паралельно, активованими макрофагами.
Необхідно відзначити, що збудники, що розмножуються прямо в місці проникнення (грип), мають короткий інкубаційний період, що може бути небезпечним через певну інерційність розвитку імунних реакцій, особливо у людей з Т-клітинним імунодефіцитом, що призводить до важкого перебігу захворювання.
Вірусні інфекції, що поширюються гематогенно (поліомієліт, кір, епідемічний паротит, вітряна віспа), можуть елімінуватися гуморальними механізмами, причому дані захворювання, як правило, характеризується тривалим інкубаційним періодом.
Специфічна противірусна імунна відповідь здійснюється при інфікуванні організму вірусами і деякими найпростішими (токсоплазма, лістерія), коли антиген локалізується в цитоплазмі інфікованих клітин. Переважно презентацією антигена у такому разі займаються дендритні антиген-презентуючі клітини. Їх походження до цього часу є суперечливим питанням: вони можуть диференціюватися або з окремої клітини-попередника, або із загального попередника моноцитарно-макрофагального ряду. Дендритні клітини містяться в стромі лімфатичних вузлів і селезінки, а також у деяких нелімфоїдних тканинах: у епідермісі шкіри і слизових оболонках повітряносних шляхів, де вони називаються клітинами Лангерганса, в слизових оболонках шлунково-кишкового і урогенітального трактів, в інтерстиціальних тканинах серця, нирок та інших органів.
Білковий антиген (наприклад, вірусний капсид) у ході процесингу розщеплюється в протеосомах цитоплазми дендритної клітини, транспортується за допомогою білків-трансмітерів в ендоплазматичну мережу, де утворюється його комплекс з пресинтезованою молекулою MHC I. Цей комплекс потім переноситься через апарат Гольджи на поверхню клітини для презентації CD8 Т-лімфоцитам. T-клітинні рецептори (ТКР) CD8 цитотоксичних Т-лімфоцитів (ЦТЛ або Т-кілери) розпізнають антиген у комплексі з MHC I за допомогою молекули CD8 і адгезійних молекул B7 і CD28. Другим сигналом активації цитотоксичних лімфоцитів (ЦТЛ) є секреція антиген-презентуючою клітиною IL-1 на підтвердження того, що MHC асоційована з вірусним пептидом. Після активації ЦТЛ починають секретувати IL-2 і експресують рецептори для IL-2, які є головним чинником зростання Т-лімфоцитів. У результаті утворюється клон цитотоксичних лімфоцитів з ТКР, специфічних для антигена, який викликав дану імунну відповідь. ЦТЛ, після контакту з клітиною-мішенню, швидко вбивають її та відділяються від неї, щоб атакувати наступну мішень. Поки ЦТЛ пов’язані з клітиною-мішенню за участю ТКР, створюються умови фокусування ефекторних молекул, що секретуються лімфоцитом, точно в місці контакту клітин. Цитотоксичні функції CD8 Т-лімфоцитів обумовлені секрецією пресинтезованих цитотоксинів: фрагментинів, що індукують апоптоз у клітині-мішені, і перфоринів, що утворюють пори у клітині-мішені. ЦТЛ також продукують і виділяють:
- IFN-y, що активує макрофаги (фагоцитують наслідки роботи лімфоцитів) і проліферацію Тх1;
- IL-2, чинник зростання Т-лімфоцитів (Т-кілерів, Тх1 і Т-клітин пам’яті), а також прискорення синтезу MHC і презентацію в комплексі з ними чужорідних антигенів;
- TNP-a, що збільшує проникність судин, але при надмірній концентрації призводить до судинного шоку;
- TNP-ß (лімфотоксин), що має власний цитотоксичний ефект (призводить до механізму апоптозу).
При Т-залежній імунній відповіді В-лімфоцити також виступають як антиген-презентуючі клітини. В-лімфоцити своїми антигенрозпізнаваючими рецепторами зв’язуються з антигеном, поглинаючи його. У фагосомі В-лімфоцитів антиген піддається перетравленню. Пептиди, отримані з такого антигена, повертаються на поверхню В-лімфоцитів в асоціації з молекулами гістосумісності класу II (MHC II). Тут вони розпізнаються Т-клітинним рецептором, який є на поверхні CD4+ клітини. Це призводить до стимуляції CD4+ лімфоцита (хелпера) і продукції IL-2, IL-4 і IL-5. Інтерлейкіни, що утворилися, стимулюють В-клітинну проліферацію і диференціювання з перетворенням, врешті-решт, в антитілопродукуючу плазматичну клітину.
Спочатку В-клітини продукують і секретують тільки IgM (перші 4-5 діб після антигенної стимуляції). Потім В-лімфоцити перемикають синтез з IgM на IgG і далі на IgA і IgE (14-16 діб, максимум 21-24 доби). Таким чином, при Т-залежній імунній відповіді індукується продукція імуноглобулінів всіх класів.
Таким чином, наявність у конкретного індивідуума нормально функціонуючої клітинної ланки імунітету сприятиме обмеженню вірусного захворювання (зрештою і одужанню) за рахунок лізису інфікованих вірусом клітин і, як наслідок, припинення породження інфікованого потомства.
Одужання від гострої вірусної інфекції зазвичай супроводжується формуванням клітин пам’яті і виробленням тривалого імунітету, і повторні атаки того ж самого вірусу стають неефективними.
Клінічні прояви, профілактика та лікування грипу
У 1-й день захворювання грипом спостерігається різке підвищення температури, до 38-40ºС, головний біль, нежить, біль у горлі, може бути сльозотеча, подразнення очей, біль у суглобах. Кашель може з’явитися як у 1-й, так і в 2-й день захворювання. Якщо своєчасно не почати лікування, симптоми посилюються. Тому надто важливо при перших же перелічених ознаках відразу звернутися до лікаря.
Якщо після підтвердження у хворого наявності вірусу грипу почати правильне лікування, то вже на 2-3-й день стан хворого поліпшується. Як показала практика, при вчасному звертанні до лікаря хворий видужує протягом 7-9 днів.
Фази розвитку захворювання
Вірус потрапляє в організм людини повітряно-краплинним шляхом або при прямому контакті (через рукостискання, через предмети). При зараженні вірусом уражується слизова оболонка верхніх дихальних шляхів. Потім вірус спускається по дихальних шляхах і вражає легеневі тканини. Після цього починають виявлятися симптоми, перелічені вище.
Але ці симптоми можуть не виявлятися від 24-х до 48-ми годин після зараження. Тому і небезпечний вірус грипу, оскільки заражений, не підозрюючи про те, що він хворий, починає заражати інших людей.
На наступній фазі з’являється віремія, тобто вірус потрапляє в кров і вражає легені.
Причиною смерті внаслідок зараження грипом найчастіше є пневмонія.
Розрізняються наступні симптоми враження легенів: постійний кашель, висока температура. Звичайно, симптоми і тривалість лікування залежать від стану імунної системи хворого.
Виявити штам вірусу можна тільки лабораторним шляхом.
Підтвердженим випадком інфекції вірусом грипу вважається випадок гострого захворювання людини з лабораторно підтвердженим діагнозом за допомогою спеціальних лабораторних тестів.
Випадок інфекції вірусом грипу визначається, якщо:
захворює гострим респіраторним захворюванням людина, яка була в тісному контакті з хворим з підтвердженим діагнозом грипу;
захворює гострим респіраторним захворюванням людина, яка знаходилася в тісному контакті з хворими тваринами (характерно для каліфорнійського грипу A(H1N1);
захворює гострим респіраторним захворюванням людина, яка подорожувала в місцях, де є хворі з підтвердженим діагнозом грипу в останні 7 днів до початку захворювання.
Загальні заходи профілактики грипу
Уникати близького контакту з людьми, які виглядають хворими, мають прояви температури і кашляють.
Ретельно і часто мити руки водою з милом.
Дотримуватися здорового способу життя, включаючи повноцінний сон, вживання здорової їжі, фізичну активність.
Вакцинація. На думку ВООЗ та багатьох провідних вчених, найефективніший захист від всіх інфекційних захворювань - це вакцинація. Попередження грипу за допомогою щеплення залишається першою лінією оборони в боротьбі з цим захворюванням. Протигрипозну вакцинацію зазвичай проводять у жовтні та листопаді. Рекомендується проводити щорічну імунізацію, оскільки було доведено, що вакцини попередніх років менш ефективні проти штамів грипу поточного року. Слід також пам’ятати, що імунітет до грипу розвивається протягом двох тижнів після щеплення. Експертами ВООЗ проводиться моніторинг зміни в антигенному складі вірусів, що допомагає модернізувати вакцини для ефективнішого захисту організму від нових вірусів грипу.
Найбільш ефективні і безпечні в даний час є спліт-вакцини - вакцини з розщеплених вірусів, з яких видалені токсини. Такі вакцини включають 4 антигени на кожен з трьох типів вірусу грипу. Профілактична ефективність вакцин цього класу коливається в інтервалі від 75 до 96%. Класичним прикладом препаратів цього класу є вакцини "Інфлувак" (Голландія) і "Ваксігрип" (Росія).
Залежно від різних умов, вакцинація дає 70-90% гарантію того, що людина не захворіє грипом. Вакцинація 80% колективу (школярів, співробітників фірми, підприємства) дозволяє знизити захворюваність грипом до нульових значень. Щеплення проти грипу на 50-60% знижує захворюваності всіма ОРЗ.
Думка, що вакцини перевантажують імунітет або зовсім пригнічують його, помилкова. Це невірно хоча б тому, що дія вакцин полягає в стимулюванні імунітету, а не в його придушенні. З іншого боку, щодня з їжею, з диханням і через шкіру в організм людини потрапляють тисячі антигенів, не рахуючи антигенів, що породжуються самим організмом ("неправильні", зайві клітини). Введення 6, 12 або навіть 15 додаткових вакцинних антигенів не грає істотної ролі і, звичайно, не перевантажує імунну систему.
Противірусні препарати. Окрім вакцин в арсеналі профілактичних і лікувальних засобів є противірусні препарати. Гропринозин, арбідол справляють імуномодулюючу, інтерфероногенну і антиоксидантну дію, активну відносно вірусів грипу А і B; рібивірин - синтетичний аналог нуклеозидів з широким спектром активності проти різної ДНК і РНК вірусів.
Озельтамівір (таміфлю) - селективний інгібітор нейрамінідаз вірусів грипу А і В. Застосовується для лікування грипу в дорослих і дітей, старших 12 років. 1 капсула містить 75 мг озельтамівіру. Для лікування грипу таміфлю призначають у дозі 75 мг 2 рази на добу протягом 5 днів.
Препарати інтерферону. Важливе значення для профілактики грипу й інших вірусних захворювань мають природні лейкінферон і рекомбінантні (віферон, грипферон) інтерферони інтраназально. Всі препарати інтерферону викликають у клітинах синтез протеїнів, які забезпечують антивірусний та імуномодулюючий ефект, направлений на звільнення клітин від вірусів.
Індуктори інтерферону. Для профілактики вірусних захворювань також широко використовуються індуктори інтерферону - циклоферон (неовір) 12,5% р-р 2 мл в/м 2 рази на тиждень № 7, або аміксин 1 таб. 0,125 г за схемою: 3 таб. відразу, потім по 1 таб. через день № 7; амізон 1 таб. 0,25 г (схема та ж), активізуючи вироблення клітинами організму різних видів інтерферону: альфа-, бета-, гамма- інтерферонів. Посилене вироблення власного інтерферону забезпечує підвищення противірусного захисту організму і справляє імуномодулюючу дію.
Імуноактівні препарати різних груп, зміцнюючі імунітет: лікопід, поліоксидоній, ІРС-19, імудон, бронхомунал, рибомуніл, імунофан.
Використовується фітотерапія (імунал) і гомеопатичні засоби (грипхель, ангингель, афлубін).
Методами неспецифічної імунопрофілактики в період епідемії грипу є:
прийом інтерферону (лаферон, інтерферон людський лейкоцитарний) або його індукторів (неовір, аміксин, циклоферон);
застосування імуномодуляторів бактерійної природи (IRS-19, рибомуніл, бронхомунал) для передсезонної імуностимуляції;
хіміопрофілактика - прийом упродовж усього періоду епідемії ізопринозина (гропринозина) або арбідола, аміксина;
загальнозміцнюючі процедури (загартовування, іглорефлексотерапія), вітамінотерапія, адаптогени (ехінацея, елеутерокок, женьшень) мають другорядне значення.
Медикаментозна профілактика грипу:
1) аміксин 0,125 г (1 таб.) 1 раз на тиждень протягом 6 тижнів;
2) арбідол 0,2 г (2 таб.) 1 раз на день протягом 10-14 днів;
3) анаферон по 1 таб. 1 раз на день за 30 хв до їди або через 30 хв після їди, розсмоктувати у роті, протягом 1-3 місяців - епідемічного сезону.
4) вітамін С по 1 г на добу;
5) ліки-адаптогени - настойка родіоли рожевої, елеутерокока, лимонника по 10 крапель 3 рази на день після їди, а також циклоферон по 1 таб. 1 раз на день 3 рази на тиждень або альфа-інтерферон у вигляді мазі для носа від 3 тижнів до 1 місяця;
6) кагоцел призначають 7-денними циклами (2 дні по 2 таб. на день, потім - перерва 5 днів і ще 2 дні по 2 таб. на день) протягом 1 місяця.
Вагітним жінкам (починаючи з 14-го тижня вагітності) можна використовувати альфа-інтерферон у супозиторіях по 150 000 МО двічі на день протягом 5 діб.
Екстрена хіміопрофілактика грипу:
1) озельтамівір (таміфлю) - 75 мг 2 рази на добу протягом 5-7 днів;
2) гропринозин - має прямий антивірусний та імуностимулюючий ефект. Приймають під час піку захворювання з профілактичною метою по 0,5 г (1 таб.) 3 рази на день протягом 7 - 10 днів;
3) арбідол - дія та ж. Приймають під час піку захворювання з профілактичною метою по 0,2 г (2 таб. по 0,1 г) 1 раз на день протягом 10-14 днів.
Етіотропна терапія грипу при захворюванні:
1) озельтамівір (таміфлю) - 75 мг 2 рази на добу протягом 5 днів;
2) гропринозин - приймають, починаючи з першої доби грипу з лікувальною метою бажано після їжі, пігулку можна подрібнити, по 1 г (2 таб. по 500 міліграм, добова доза 50 мг/кг маси тіла) 3-4 рази на день протягом 5-7 днів. Лікування продовжують ще 1-2 дні після зникнення симптомів. У важких випадках добову дозу можна збільшити в 2 рази до 100 мг/кг;
3) арбідол - дія та ж. Приймають, починаючи з першої доби захворювання, по 0,2 г (2 таб. по 0,1 г) 4 рази на день протягом 5 днів;
4) аміксин 0,125 г (1 таб.) 1 раз на день після їжи в 1, 2 та 4-й дні від початку лікування;
5) анаферон в перші 2 години по 1 таб. через кожних 30 хв, потім протягом 1 доби 3 рази на день, з другої доби і далі - по 1 таб. 3 рази на день до повного одужання.
Вітамінотерапія активує гуморальні і клітинні реакції імунітету.
Лікування легких випадків вірусної пневмонії, викликаної вірусом грипу, противірусними препаратами:
1) арбідол 0,2 г (2 таб.) 4 рази на день після їди протягом 7-10 днів;
2) альфа-інтерферон або гамма по 1 млн Од внутрішньом’язово щодня протягом 5 днів;
3) тіотріазолін 40 мг (2 мл) в/в струменево або крапельно 1 раз в день 10 днів;
4) аскорбінова кислота 1 г/добу протягом 5 днів.
Крім того, як альтернативну схему рекомендують поєднувати альфа- і гамма- інтерферон, приймати їх від 2 до 6 разів на день протягом 10 днів. Після перерви в один тиждень повторюється та ж схема лікування.
Для лікування вагітних жінок (починаючи з 14-го тижня вагітності) можна використовувати альфа-інтерферон в суппозиторіях - по 500 000 МО двічі на день (добова доза 1 млн Од) протягом 5 діб.
Лікування середньо-важких і важких випадків вірусної пневмонії.
У лікуванні грипу, який перебігає з середньою тяжкістю, рекомендують комбінувати кагоцел і арбідол.
У перший день від початку хвороби потрібно приймати кагоцел по 2 таб. 3 рази на день, наступні три дні - по 1 таб. 3 рази на день.
Арбідол потрібно приймати 4 рази на добу по 2 таблетки кожні 6 годин протягом 7-10 днів.
Застосовувати альфа- і гамма-інтерферон за тією же схемою, яка описана вище.
Можна також застосовувати інгаверін - добова доза 90 мг один раз в день протягом 5 днів, таміфлю - по 75 м 2 рази на день протягом 5 днів. Препарати необхідно приймати в перші дні хвороби.
Для лікування вагітних жінок (починаючи з 14-го тижня вагітності) можна використовувати альфа-інтерферон в супозиторіях по 500 000 МО двічі на день протягом 5 діб. Потім необхідна підтримуюча терапія по 150 000 МО двічі на день протягом 3 тижнів.
Лікування хворих з важкими формами грипу, ускладненого пневмонією, за наявності вираженого лейкоцитозу, що супроводжується токсикогенною зерністістю нейтрофілів:
1) інтерферон-альфа і бета по 1 млн Од в/м 1 раз на день протягом 5 днів;
2) внутрішньовенні імуноглобуліни (ВІГ) безпечні в плані перенесення вірусних інфекцій, містять достатню кількість IgG, відповідального за нейтралізацію вірусів, з активністю Fc-фрагмента. ВІГ вводять у добовій дозі 400 мг/кг в/в краплинно або інфузійно по 1 мл/кг/год через день 3 рази; застосовують інтраглобін - ВІГ, що містить в 1 мл 50 мг IgG і близько 2,5 мг IgA;
пентаглобін - ВІГ, збагачений IgM, що містить: IgM - 6 мг, IgG - 38 мг, IgA - 6 мг в 1 мл. Застосовують дорослим 0,4 мл/кг/час, далі 0,2 мл/кг до 15 мл/кг/год протягом 72 годин - 5 мл/кг 3 дні, при необхідності - повторний курс. Октагам - ВІГ містить в 1 мл 50 мг білків плазми, з них - 95% IgG; менше 100 мкг IgA і менше 100 мкг IgM. Близький до нативного IgG плазми крові, присутні всі субкласи IgG;
3) імуноглобулін людський нормальний для в/м’язового застосування призначають по 6 мл (2 ампули) через день 3 рази;
4) преднізолон по 60-90 мг в/в крапельно і всередину в таблетках щодня протягом 3-х днів, потім поступово зменшити дозу і відмінити препарат;
5) цефтріаксон по 1,0 в/в або в/м’язово протягом 5-7 днів (відповідно до Наказу МОЗ України № 122).
Особливості імунітету при бактеріальних інфекціях, що мають первинно-хронічний перебіг
Другий механізм клітинно-опосередкованої імунної відповіді - хронічне запалення. Воно розвивається на патогени, що розвиваються усередині вакуолей клітин (деякі бактерії, мікобактерії - збудники туберкульозу і прокази, деякі найпростіші - лейшманія). Презентацію антигена здійснюють в основному макрофаги в асоціації з MHC II класу. Процесінг антигена відбувається так само, як при гуморальній імунній відповіді - у візикулярній фракції. Активовані антиген-презентуючі клітини CD4 Т-лімфоцити (Тh0) диференціюються в Т-хелпери 1-го типу за участю IL-2. Диференціювання Тh0 саме в цьому напрямі визначається присутністю IL-2, що продукується активованими макрофагами, і IFN, що продукується натуральними кілерами, активованими в ранню фазу відповіді на внутріклітинні паразитуючі збудники. У результаті утворюється клон специфічних Тh1, що активують систему мононуклеарних фагоцитів. Макрофаги отримують від Тh1 два сигнали активації: IFN секретується Тh1 і діє через специфічний рецептор, а другий сигнал виходить від мембранозв’язаної форми TNF або секретованої TN. Хоча всі макрофаги мають рецептори для IFN, активуватися при контактах з Тh1 будуть, у першу чергу, інфіковані макрофаги, які несуть на мембрані ТКР, що розпізнає антиген.
Отже, ефекторним механізмом при такій формі імунної відповіді є скупчення залучених у вогнище макрофагів. Причому може відбуватися злиття частини клітин між собою з утворенням гігантської багатоядерної синцитіальної структури, внаслідок чого об’єднуються метаболічні апарати макрофагів, збільшується продукція активних форм кисню і лізосомальних ферментів. Якщо і це не допомагає знищити збудника, використовується інший механізм знешкодження патогена: ізоляція. За допомогою фібробластів формується фіброзна сумка (гранулема), яка може просочуватися солями кальцію. Гранулема є невід’ємною рисою хронічного запалення при персистуванні інфекції. Будь-яка форма імунної відповіді починається з розпізнавання чужорідного антигена, тобто його пов’язування із специфічним рецептором на мембрані зрілого лімфоцита. Такі специфічні рецептори існують на лімфоцитах до зустрічі з антигеном. Величезну їх різноманітність забезпечує широкий репертуар клонів лімфоцитів і можливість розпізнати будь-який чужорідний антиген. Специфічне розпізнавання і скріплення антигена з антиген-розпізнаючим рецептором спричиняє активацію лімфоцита, яка виявляється його посиленою проліферацією (клональною експансією), тобто накопиченням клона антиген-специфічних лімфоцитів, і подальшим диференціюванням лімфоцитів з набуванням ними ефекторних функцій. Результатом ефекторної фази імунної відповіді є елімінація антигена за участю активованих лімфоцитів, їх продуктів, а також інших клітин і механізмів неспецифічного захисту, що залучаються лімфоцитами в імунну відповідь: фагоцитуючих клітин, натуральних кілерів, системи комплементу.
Особливості імунітету при грибкових захворюваннях
Особливості протигрибкового імунітету залежать від морфологічних властивостей грибків (розміри клітин, форма), їх антигенного складу, форми і стадії мікозу.
Більшість грибків відносяться до вільноживучих організмів, і лише деякі з них здатні викликати захворювання. Більш того, для виникнення захворювання у людини, інфікованої грибками, необхідною умовою є наявність у неї імунодефіциту поліморфноядерних лейкоцитів, Т-лімфоцитів, С3 компонента комплементу. Функціональними дефектами лейкоцитів є їх нездатність утворювати псевдоподії (синдром "ледачих лейкоцитів"), нездатність формувати фаголізосоми (синдром Чедіака-Хигасі), порушення здатності до продукції активних форм кисню, що забезпечують переварювання мікроба. Дефіцит по С3 також веде до зниження активності фагоцитів. І, нарешті, найчастіше мікози у людини виникають при низькій продукції Т-лімфоцитів (Т-супресорів і Т-хелперів).
Формування імунітету пов’язують з відновленням функціональної активності поліморфно-ядерних лейкоцитів і посиленою продукцією Т-лімфоцитів.
Специфічні антитіла утворюються лише при деяких формах глибоких мікозів. Вважають, що вони не беруть участі в механізмах захисту, будучи свідками імунної перебудови організму.
Профілактика і лікування грибкових інфекцій
Дріжджові і цвілеві грибки входять до числа десяти патогенів, що найчастіше виявляються в клініках. Близько 7% лихоманок неясного генезу в стаціонарі і до 50% в онкогематології обумовлені грибками. В Україні, де відсутні епідемічні вогнища особливо небезпечних грибкових інфекцій, провідне місце в структурі мікотичної патології займають умовно патогенні грибки.
Збудниками мікозів людини є різні дріжджеподібні (Candida spp., Cryptococcus spp.) і цвілеві (Asparagillus spp., Penicillum spp., Mucoz spp.) грибки.
Кандидоз може розвиватися як ендогенне і екзогенне захворювання. Оскільки патогенність Candida невисока, переважно розвиваються ендогенні форми на фоні ослаблення захисних сил організму.
З сучасних позицій розглядають два принципово різні механізми патогенезу кандидозу: інвазивний і неінвазивний кандидоз. Інвазивний кандидоз обумовлений проникненням нитчастої форми гриба Candida в тканини макроорганізму з розвитком системного кандидозу, з ураженням вісцеральних органів. Неінвазівній кандидоз реалізується без трансформації гриба в нитчасту форму за рахунок проліферації його в просвіті полого резорбуючого органу - кишки або на поверхні шкіри і слизових оболонок. У патогенезі кандидозу грає роль розвиток і поглиблення дисбіозу і мікст-інфекцій у просвіті кишки, на поверхні шкіри і слизових оболонок, резорбція продуктів аномальної ферментації живильних речовин і метаболітів грибків.
У розвитку рецидивуючого кандидозу грають роль як неповна ерадикація грибків із слизової оболонки, так і реінфекція, екзогенна або ендогенна.
Класифікація кандидозу за глибиною ураження:
1) поверхневий кандидоз з ураженням слизової оболонки порожнини рота, глотки, стравоходу, товстої кишки, піхви;
2) поверхневий інвазивний кандидоз з розповсюдженням інфекції за межі базальної мембрани, але без ураження паренхіми органів;
3) глибокий кандидоз - ураження паренхіматозних органів і нервової системи.
Клінічні форми кандидозу відрізняються великим різноманіттям, основними з них є: кандидоз шкіри, нігтьових валиків і нігтів, слизової оболонки рота, геніталій, дихальних шляхів і вуха, травного тракту, кандидозний менінгіт, кандидозний ендокардит, перикардит, міокардит; кандидозний тромбофлебіт; кандидозний остеомієліт, артрит, медіастеніт; внутрішньочеревні абсцеси, перитоніт, абсцеси селезінки, печінки, підшлункової залози, асоційовані з Candida spp.; кандидозний ендофтальміт; кандидемія і гострий гемобластозний кандидоз.
Слід зазначити, що при кандидозі може вражатися практично будь-який орган. Найчастіше вражаються легені, головний мозок, очеревина, печінка, селезінка. Тому при виявленні кандидемії обов’язкове додаткове обстеження для виявлення вогнищ дисемінації (комп’ютерна томографія органів черевної порожнини, офтальмоскопія з розширенням зіниці та ін.).
Клінічні і лабораторні ознаки кандидозу:
• клінічні і гістологічні ознаки грибкових інфекцій;
• гіпертермія, резистентна до антибіотиків широкого спектру дії;
• позитивна серологічна реакція.
• багатофокусна колонізація Candida у хворих, що мають чинники ризику;
• виділення грибів роду Candida з крові та інших стерильних анатомічних зон;
• виявлення грибкового ендофтальміту;
• чинники ризику інвазивного кандидозу:
• тривала антибактеріальна терапія препаратами широкого спектру дії;
• виділення Candida spp. з двох і більше анатомічних зон;
• проведення програмного гемодіалізу;
• багатократні трансфузії компонентів і препаратів крові;
• тривале знаходження у відділенні інтенсивної терапії;
• катетеризація венозних судин;
• тривала катетеризація сечового міхура;
• парентеральне харчування, особливе застосування жирових емульсій;
• зондове ентеральне харчування;
• операції на органах черевної порожнини, особливо з приводу перфорацій порожнистих органів і гострого панкреатиту;
• опіки II-III ступеня;
• важкі черепно-мозкові травми, поєднані травми;
• важкі інфекції (сепсис, перитоніт, інтраабдомінальні абсцеси);
• імуносупресивні стани (цукровий діабет, застосування імунодепресантів, тривале лікування кортикостероїдами, хіміо- і променева терапія пухлин, ВІЛ-інфекція;
• діарея або виражений мукозит.
Лікування мікозів. У даний час існує 4 групи протигрибкових препаратів наступної дії: антибіотики, пірімідинові похідні, азоли та інші.
Амфотерицин В. Найбільш широкий спектр протигрибкової активності властивий полієновому антибіотику - амфотерицину В. Він є стандартом при лікуванні інвазивних мікозів, але відрізняється високою токсичністю. Доза препарату, що рекомендується, - 0,5-1 мг/добу протягом 10-14 днів. Мають ряд переваг ліпід-асоційовані форми амфотерицину. Парентеральне введення амфотерицину В використовують лише у випадках інфекції грибами, не чутливими до флуконазолу, зокрема С. krusei і C. glabrata, і при аспергільозі.
Ністатин мало всмоктується в кишку і не виводиться парентерально. Спектр його застосування обмежується призначенням при орофарінгеальному кандидозі, поверхневому кандидозі стравоходу, неінвазивному кандидозі кишечника.
Антімікотики групи піримідину мають обмежений спектр протигрибкової активності.
Похідними азолов є імідазоли (клотримазол, міконазол, кетоконазол) і тріазоли першого покоління (флуконазол, ітраконазол) і другого покоління - похідні флуконазолу (воріконазол, равуконазол) і похідні ітраконазола (позаконазол і альбаконазол). Препаратам цієї групи властиві широкий спектр активності, простота в застосуванні, обмежена токсичність, що робить їх препаратами вибору для лікування інвазивних мікозів.
Флуконазол. Профілактична доза флуконазола складає 50-400 мг/добу (у середньому 6 мг/кг/добу).
Воріконазол. Основною відмінністю воріконазолу від його попередника, флуконазолу є ширший спектр антифунгальної активності. Воріконазол блокує синтез ферменту 14а-деметилази, пов’язаного з продукцією ергостабілу - важливого компонента мембрани клітини грибів. Призначають воріконазол у дозі 0,2-0,4 г/добу всередину або в/в крапельно.
Равуконазол має хімічну структуру, схожу з флуконазолом і воріконазолом. Має широкий спектр активності, включаючи полірезистентні штами. Активний відносно Candida spp., включаючи С. krusei і C. glabrata, а також Scedosporium spp., Aspergillus spp. і Cryptococcus neoformans. Равуконазол призначають у дозі 5 і 10 мг/кг/добу.
Тербінафін (ламізил) - препарат з широким спектром дії, активний відносно дерматофітів, цвілі (у тому числі і аспергіл), диморфних грибів, з первинною фунгіцидною дією і дуже високою активністю при системних мікозах. Тербінафін призначають у дозі 250 мг на день протягом 4 тижнів.
Кетоконазол (нізорал) у дозі 200-400 мг на добу призводить до очищення слизових оболонок від нальотів молочниці протягом 24-72 год. Усунення шкірних пошкоджень вимагає 2-9 тижнів. Випускають у пігулках по 200 мг.
Ітраконазол (орунгал, інтрунгар) інгібірує синтез ергостерину клітинної мембрани грибів, що обумовлює протигрибковий ефект препарату. Ітраконазол активний відносно Candida albicans, інших видів роду Candida, Aspergillus spp., Trichosporon spp., Geotrichum spp., Cryptococcus neoformans, дерматофітів і дріжджоподібних грибів, у т.ч. Fonsecaea spp., Histoplasma spp., Pseudallescheria boydii і Penicullium marneffei. Призначають при оральному кандидозі по 100 мг 1 раз/добу протягом 15 днів, при вульвовагінальному кандидозі по 200 мг 1 раз/добу протягом 3 днів, при поверхневому кандидозі по 100 мг 1 раз/добу протягом 7 днів, при ураженні висококератинізованих зон шкіри, таких як кисті рук і стопи, призначають додаткове лікування по 100 мг/добу протягом 15 днів.
Позаконазол є похідним ітраконазола. Препарат має дуже низьку розчинність у воді, в даний час він доступний тільки у формі для прийому всередину. Позаконазол відрізняється широким спектром активності. Має високу активність відносно дріжджів, включаючи Candida spp. і Cryptococcus neoformans, а також більшості міцеліальних збудників мікозів, зокрема полірезистентних Scedosporium і Fusarium spp. Важливою особливістю позаконазолу є його не така, як у більшості інших антимікотиків, активність проти збудників зигомікозів - Rhizopus, Mucor і Absidia spp.
Альбаконазол характеризується широким спектром активності in vitro, діє проти Candida spp., Aspergillus spp. і Paecilomyces spp.
Ехінокандіни є новим класом антимікотиків, з не таким, як в інших антимікотиків, механізмом дії, пов’язаним з блокадою синтезу 1,3-β-D-глюкана, - важливого структурного і функціонального компоненту клітинної стінки грибів. У зв’язку з тим, що 1,3-β-D-глюкан відсутній в організмі людини, ехінокандини мають дуже хорошу переносимість з мінімальною кількістю небажаних явищ.
Каспофунгін - напівсинтетичний водорозчинний ліпопептид, що отримується при ферментації продуктів життєдіяльності гриба Glarea lozoyensis. Каспофунгін проявляє фунгіцидну активність проти Candida spp., включаючи резистентні (C. krusei) і з пониженою чутливістю (C. glabrata) до азолів, або резистентні до Амфотерицину В (C. lusitaniae) штами. Каспофунгін не активний відносно Cryptococcus neoformans, фунгістатично діє на Aspergillus fumigatus, A. flavus, A. niger і A. Terreus. Каспофунгін призначають в дозі 70 мг у перший день, потім - 50 мг на добу.
Мікафунгін є синтетичним препаратом, що отримується при хімічній переробці продуктів життєдіяльності гриба Coleophoma empedri. Має широкий спектр активності in vitro, який включає C. albicans, C. glabrata, C. tropicalis, C. krusei, C. parapsilosis, зокрема резистентні до азолів і Амфотерицину В штами. Активний відносно Aspergillus spp., хоча і не справляє на них фунгіцидної дії. Як і всі ехінокандини, мікафунгін не активний проти Cryptococcus, Fusarium і Trichosporon spp.
Анідулафунгін має спектр активності, схожий з каспофунгіном і мікафунгіном. Має високу активністю in vitro відносно Candida spp., включаючи штами, резистентні до флуконазолу й ітраконазолу, менш активний проти C. famata і C. parapsilosis. Відносно Aspergillus spp. анідулафунгін активніший, ніж ітраконазол і Амфотерицин В.
Ентеральне лікування доцільно поєднувати з місцевим застосуванням протигрибкових мазей і рідин. Не зважаючи на позитивний ефект, який спостерігається впродовж всього курсу лікування й у найближчі після його завершення терміни, відміна препарату призводить до поступових рецидивів грибкових уражень. Тому схеми лікування хворих хронічним кандидозом індивідуальні.
При проведенні тривалої антибактеріальної терапії потрібна профілактика грибкових інфекцій. Профілактичним препаратом, що широко застосовується, є ністатин. Проте він ефективний для профілактики кандидозу тільки в просвіті кишечника. Системна абсорбція його не перевищує 3-5%. Тому препаратами вибору слід вважати препарати з групи тріазолів (флуконазол, ітраконазол), що призначаються одноразово в ударних дозах.
У профілактиці кандидозу в осіб, страждаючих важкими захворюваннями, які розглядаються як сприяючі чинники (цукровий діабет, імунодефіцитні стани), ефективні тільки системні азольні препарати і амфотерицин. При виборі системного антимікотика слід віддавати перевагу тріазолам: флуконазолу і ітраконазолу.
При лікуванні вагітних жінок місцеві антимікотики за показаннями можна призначати тільки в II і III триместрах. Системні антимікотики при вагітності не рекомендуються.
Особливості імунітету при протозойних захворюваннях
Для збудників протозойних інфекцій характерна надзвичайна різноманітність антигенного складу. Особливості обумовлені внутріклітинною локалізацією збудників, мінливістю їх поверхневих антигенів, наявністю антигенів, загальних з антигенами клітин людини, імуносупресивними властивостями паразитів. До того ж, більшість цих збудників мають досить складний механізм життєвого циклу, що ще ускладнює імунний захист. До цього слід додати ту обставину, що самі збудники наділені імуносупресорною дією, а також те, що при даних патологічних процесах реалізується виражений поліклональний мітогенний ефект, що виснажує захисні можливості імунної системи, не формуючи резистентності.
При протозойних захворюваннях можуть утворюватися lgМ і IgG, але специфічність їх украй низька внаслідок їх утворення в результаті поліклональної активації В-лімфоцитів і антигенної мінливості паразитів.
Одужання наступає при активації Т-лімфоцитів (Тс, Тh). Повноцінній постінфекційний імунітет формується дуже рідко.
Особливості імунітету при глистних інвазіях
Глистні інвазії (аскаридоз, трихіноз) сприяють стимуляції синтезу IgE. На місці проникнення збудника утворюється інфільтрат, що складається з еозинофілів, базофілів і опасистих клітин. У деяких випадках паразитичним хробакам вдається уникнути розпізнавання завдяки шару перехресно-реагуючих антигенів з організмом хазяїна.
Індукція специфічних імунних реакцій при інфекціях може бути причиною формування імунопатологічних станів (алергічні, автоімунні реакції та імунологічна недостатність).
Так, при раптовому вивільненні великих кількостей антигенів у результаті загибелі мікроорганізмів у сенсибілізованому організмі утворюються імунні комплекси, що викликають автоімунні гломерулонефрити. Це ускладнює перебіг стрептококових, пневмококових і стафілококових інфекцій. Токсичні імунні комплекси можуть утворюватися і при персистуючих вірусних інфекціях. Особливо чітко це виявляється при гострому вірусному гепатиті А, коли загибель гепатоцитів проявляється типовими клінічними симптомами, співпадаючими з початком імунної відповіді. Поява антитіл у надлишку антигена призводить до утворення токсичних імунних комплексів, а виникнення імунних комплексів в надлишку антитіл при руйнуванні інфікованих клітин призводить до елімінації збудника.
Більшість глистних інвазій супроводжуються алергічними реакціями, частіше імунокомплексними (тип III) або клітинними (тип IV). Зустрічаються такі атопічні реакції (тип I) при аскаридозі, кропив’янці і бронхіальній астмі.
Автоімунні реакції часто супроводжують інфекційні захворювання. Класичним прикладом їх є ураження суглобів і ендокарду при ревматизмі, що спричиняється, як відомо, ß-гемолітичним стрептококом. У їх реалізації беруть участь декілька механізмів: модифікація власних антигенів збудниками або їх токсинами, наявність перехресно-реагуючих антигенів між хазяїном і мікроорганізмом, інтеграція вірусної нуклеїнової кислоти в геном хазяїна, модифікація білків клітини-мішені білковими структурами вірусів, що проникли в неї.
Імунологічна недостатність, особливо по Т-ланці, практично завжди супроводжує бактерійні, вірусні, грибкові і паразитарні захворювання. Ці стани можуть бути скороминущими або викликати серйозну патологію, виявлятися негайно або відстрочено, коли інфекція давно перенесена, супроводжуватися різноманітною клінічною картиною (часті ОРЗ, грип) або протікати безсимптомно, виражаючись у хронізації інфекційних процесів. При гострих, особливо вірусних інфекціях, можливе катастрофічне ослаблення імунної реактивності, при хронічних (малярія) відбувається більш сповільнене функціональне виснаження імунної системи.
Лікування і профілактика гельмінтозів
Пірантел застосовується по 1 таб. 3 рази на день протягом 1 дня (за 2 тижні повторити лікування).
Вермокс - по 1 таб. 2 рази на день протягом 3 днів (за 2 тижні повторити).
Декаріс - по 1 таб. на ніч, за 2 тижні ще 1 пігулку на ніч. Найменшим достатньо 0,5 пігулки на прийом.
При деяких видах гельмінтів (гострики) застосовуються лікувальні клізми (50-100 г) з настоєм часнику, приготованим безпосередньо перед введенням. 2-3 г (1-3 часточки, залежно від величини і ступеня свіжості) роздрібленого часнику залити 50-100 г гарячого молока, настояти 15-20 хв, процідити і в остудженому вигляді ввести в клізмі на ніч.
Строге дотримання санітарно-гігієнічного режиму. Дотримання епідеміологічного режиму: коротка стрижка нігтів і догляд за ними, миття рук з милом перед їжею і після відвідування туалету. Ретельне миття овочів і фруктів перед вживанням, боротьба з мухами. Вологе прибирання житлових приміщень. Проведення протиглистного лікування всіх наявних у сім’ї тварин (кішки, собаки). Пройти обстеження і профілактичне протиглистне лікування всім членам сім’ї.
Механізми ухиляння мікроорганізмів від імунної відповіді
Багато патогенних мікроорганізмів у процесі еволюції паразитизму набули чинників стратегії, що дозволяють їм подолати дію захисних механізмів хазяїна.
Деякі мікроорганізми, ймовірно, для того, щоб ухилитися від небажаних контактів з фагоцитуючими клітинами, прикріпляються до поверхні зовнішніх слизових покривів тіла і заселяють їх. Так, поверхня слизового епітелію служить містом перебування у людини гонококів, холерних вібріонів, збудників кашлюку, а також таких найпростіших, як лямблії, трихомонади, і Candida albicans - представника патогенних грибів. Функцію захисту на слизових оболонках виконує секреторний IgA, який перешкоджає адгезії і розмноженню збудників шляхом блокади поверхневих антигенів. Проте деякі бактерії (Haemophilus influenzae, Streptococcus pneumoniae) секретують ферменти, які вибірково руйнують секреторний IgA.
Інші збудники, що селяться в тканинах хазяїна, намагаються уникнути поглинання фагоцитуючими клітинами. Так, полісахаридна капсула оберігає пневмококи від взаємодії з рецепторами фагоцитуючих клітин, що ускладнює адгезію. Іноді в капсулі містяться речовини, які і в разі адгезії мікробів до фагоцитів ефективно інгібують фагоцитоз. Деякі бактерії секретують коагулазу, яка викликає утворення навколо бактерії захисного шару фібрину, або токсини, що вбивають фагоцити.
Захисні механізми хазяїна в таких випадках засновані на специфічності і різноманітності антитіл. Циркулюючі в крові антитіла здатні нейтралізувати антифагоцитарні продукти бактерій та інші екзотоксини шляхом приєднання поблизу активного центру токсину і стереохімічного блокування його взаємодії з субстратом. У комплексі з антитілами токсин втрачає здібність до дифузії в тканинах і може стати об’єктом фагоцитозу. Зв’язуючись з поверхнею мікробів, антитіла не тільки не дозволяють їм уникнути фагоцитозу, але і полегшують (шляхом опсонізації) їх поглинання поліморфноядерними лейкоцитами і макрофагами.
Деякі збудники інфекційних захворювань намагаються уникнути дії імунної системи організму, пристосувавшись жити і розмножуватися усередині самих фагоцитів. У цьому випадку мікроби не тільки не уникають захоплення цими клітинами, але, проникнувши в організм, навіть прямують до тканинних гістіоцитів або виділяють хемотактичні чинники, що привертають фагоцити. Не виключена можливість, що деякі з них, не чекаючи фагоцитозу, самі проникають у клітини типумакрофагів. Внутріклітинне паразитування мікроорганізмів може здійснюватися різними способами. Деякі рикетсії, найпростіші (Tripanosoma cruzi) уникають загибелі, знаходячись не в травній вакуолі (фагосомі), а прямо в цитоплазмі інфікованої клітини. Цей спосіб заснований на тому, що лізосоми не здатні позбавлятися паразита, не відокремленого мембраною від клітинних структур, що привело б до пошкодження і загибелі самої клітини.
Деякі мікроби (мікобактерії, хламідії, токсоплазми) інгібують злиття фагосом, у яких вони знаходяться, з лізосомами. Інші пристосовуються до бактерицидних речовин і протеолітичних ферментів лізосом. Мікобактерії мають оболонку, резистентну до лізосомальних ферментів, а також продукують ряд ферментів, нейтралізуючих реактивні кисневі радикали фагоцитів. Лейшманії секретують протеази, що інактивують лізосомальні ферменти. Деякі бактерії продукують екзотоксини, що отримали назву лейкоцидини - вони викликають дезінтеграцію лізосом усередині макрофагів, що веде до руйнування клітинної органели і загибелі клітин.
Багато з внутріклітинно паразитуючих бактерій, найпростіших і вірусів усередині макрофагів по-різному інтерферують зі складною системою внутріклітинної трансдукції сигналів. Викликане ними порушення взаємозв’язків між протеінкіназами, фосфоліпазами та іншими молекулами внутріклітинних вторинних месенджерів призводить до інактивації макрофагів. При цьому знижується переробка (процесинг) захоплених антигенів, експресія антигенів гістосумісності MHC II, презентація антигена, продукція цитокінів, страждають і захисні функції макрофагів.
У людей, інфікованих плазмодіями або трипаносомами, а також мікобактеріями, було описано появу "супресивних" макрофагів, що секретують цитокін, який інгібував і секрецію IL-2, і експресію рецепторів до IL-2 на Т-лімфоцитах. Існування мікробів у клітинах типу макрофагів, як правило, призводить до розвитку поліморфних захворювань, часто з гострою стадією, але з характерним тривалим персистуванням збудника, з чергуванням періодів відносного благополуччя і загострень. Так, захворювання, що спричиняються мікобактеріями (туберкульоз, проказа), характеризуються дуже високим ступенем інфікованості і низькою частотою розвитку в інфікованих клінічно вираженого захворювання. Тоді як інфіковані Mycobacterium tuberculosis складають одну третину всього населення земної кулі, але хвороба розвивається лише у незначного числа з них.
У деяких осіб хвороба розвивається відразу ж після інфікування, тоді як у інших вона може зберігатися в субклінічному стані персистування впродовж багатьох років і навіть десятиліть їх життя до моменту її клінічного прояву. Проте паразити, нечутливі до мікробицидних чинників макрофагів (або ті, що поселилися в яких-небудь інших клітинах), далеко не завжди мають стійкість до активніших фагоцитів - полінуклеарів (у нейтрофілах можуть тривало зберігатися і розмножуватися тільки менінгококи і гонококи, але і це є суперечливим). Для мікроба, що знаходиться усередині живої клітини, поліморфноядерні лейкоцити безпечні: на власну клітину, покриту непошкодженою оболонкою, вони не діють. Але після руйнування клітини-хазяїна навколо неї скупчуються нейтрофіли і активно фагоцитують збудника. Для внутріклітинних паразитів безпечні не тільки фагоцити, але і гуморальні чинники захисту організму: специфічні антитіла не проникають у заражену клітину. Для лікарської практики особливо важливо, що таким мікробам не особливо загрожують і деякі лікарські речовини, зокрема антибіотики. І хоча деякі з них все ж таки можуть проходити крізь клітинні мембрани, радикальна терапія інфекцій, що викликаються внутріклітинними паразитами, залишається важким завданням.
З імунологічної точки зору вірусні інфекції відрізняються від інших (протозойних, бактерійних) тим, що генетична інформація вірусу тісно зв’язується з геномом інвазованої клітини. Віруси не мають власних механізмів для синтезу білків і реплікації і використовують для цього відповідні механізми клітини хазяїна. Тому з погляду існування виду вірусу вигідна тривала його персистенція в організмі хазяїна. Багато вірусів захищено від дії імунологічних механізмів у випадках, коли вони розмножуються в недоступній для лімфоцитів тканині. Такі віруси взагалі не індукують імунну відповідь. Це так звані повільні віруси, що розвиваються в мозку і викликають інфекції з дуже тривалим інкубаційним періодом. При обумовлених цими вірусами інфекціях (скрепі) імунітет не виникає зовсім: не виявлено ні антитіл, ні клітинного імунітету. Ці віруси не чутливі і до інтерферону. Віруси, що розмножуються в ороговілому епідермісі, також не піддаються тиску механізмів імунного захисту, оскільки лімфоцити і антитіла не можуть туди проникати.
"Латентні" віруси здатні тривало (роками і десятиліттями) зберігатися в організмі, залишаючись усередині клітин і не виходячи за їх межі (наприклад, герпес симплекс, вірус Епштейна-Барра). При таких інфекціях, як і при внутріклітинному паразитуванні бактерій, протягом десятків років чергуються періоди латентності без явних проявів і повторні запалення, що викликають клінічні симптоми. Дуже часто віруси безпосередньо впливають на здійснення механізмів імунного захисту. Так, геном аденовірусів кодує білок, що перешкоджає транскрипції і трансляції молекул МНС I, які грають істотну роль у противірусній імунній відповіді. Інший продукт гена аденовіруса може зв’язуватися безпосередньо з MHC I в клітинах і перешкоджати їх експресії на клітинних мембранах. Це призводить, відповідно, до зниження експресії молекул MHC I на поверхні клітин і оберігає інфіковані клітини від атаки цитотоксичними Т-лімфоцитами. Герпес-віруси теж здатні знижувати експресію антигенів MHC I і II класів, а також адгезійних молекул ICAM-1 і LFA-3, що беруть участь у первинному зв’язуванні імунокомпетентних клітин з іншими (антиген-презентуючими клітинами, інфікованими клітинами). Риновіруси зв’язуються з ICAM-1 на епітеліальних клітинах, використовуючи ці адгезійні молекули як власні рецептори.
Цитомегаловірус людини стимулює створення макрофагами цитокінів, а вони - гемаглютиніну, за допомогою якого вірус прикріпляється до клітини, і нейрамінідази, що звільняє новоутворені вірусні частинки від поверхневих сіалових кислот зараженої клітини. Поступові зміни антигенних властивостей гемаглютиніну відбуваються в результаті точкових мутацій вірусного генома (антигенний дрейф), тоді як значні зміни виникають у результаті обміну генетичним матеріалом з іншими вірусами інших господарів (антигенний шифт). Коли антигенна специфічність гемаглютиніну змінюється настільки, що набутий у минулу епідемію імунітет стає неефективним, починається нова епідемія грипу. Деякі віруси в ході антигенних варіацій утворюють набір квазівидів з білками мутантів, які не розпізнаються цитотоксичними лімфоцитами, або взагалі не транспортуються з цитозоля в позаклітинний простір.
Такі паразити, як найпростіші і гельмінти, також виробили в процесі еволюції дуже складні засоби захисту від численних механізмів імунітету. Серед них дуже поширена зміна антигенного складу паразита в процесі онтогенезу. Яйця, личинки і дорослі особини ряду гельмінтів представляють значні антигенні відмінності, і це вигідно паразитові, оскільки з переходом до нової стадії його розвитку якийсь час не спрацьовує механізм специфічного захисту, що існує в організмі хазяїна, необхідно його перебудовувати і доповнювати. Наприклад, у зовнішньому шарі покривів дорослих паразитів не залишиться антигенів, що розпізнаються антитілами, специфічними по відношенню до попередніх стадій розвитку паразита.
Антигенні варіації використовують для уникнення згубної дії антитіл Trypanosoma brucei і деяких видів Plasmodium. Велике значення мають процеси мімікрії - покриття поверхні паразита антигенами хазяїна. Наприклад, дорослі шистосоми мають рецептори для Fc-фрагмента імуноглобулінів хазяїна. Навіть специфічний IgE нешкідливий для такого паразита, оскільки Fc-фрагмент, через який до нього приєднуються еозинофіли, виявляється зайнятим. Більш того, шистосоми можуть швидко викликати відділення Fab-фрагментов від Fc- фрагмента, причому Fab-фрагменти, що відокремилися, надають сильну супресивну дію, зокрема пригнічують залежну від IgE цитотоксичність макрофагів по відношенню до шистосом in vitro. Фрагмент Fc залишається прикріпленим до паразита, продовжуючи сприяти мімікрії. Окрім імуноглобулінів паразити здатні сорбувати на своїй мембрані інші антигени хазяїна: гліколіпіди і глікопротеїни еритроцитів, молекули MHC, що також сприяє маскуванню паразита і порушує ефективну дію механізмів імунітету.
Паразитуючі внутріклітинні найпростіші, як і бактерії, блокують нормальні механізми знищення таких мікробів макрофагами. Toxoplasma gondii, наприклад, пригнічує злиття фагосом з лізосомами, якимось чином "вибудовуючи" уздовж мембрани фагосоми мітохондрії клітини-хазяїна. Trypanosoma crusi вивільняється з фагосоми в цитоплазму, а Leishmania оточені електроннощільним матеріалом, який, мабуть, захищає їх від "дихального вибуху". Макрофаги, проте, можуть знищувати цих паразитів, якщо будуть активовані лімфокінами (IFN), які продукують Т-лімфоцити. Більшість паразитарних інфекцій (втім, як і багато інших) супроводжуються імунодепресією. Деякі гельмінти здібні до поліклональної активації В-лімфоцитів, продукуючих IgE, що дає перевагу паразитові і, відповідно, ослабляє імунітет хазяїна: високі концентрації неспецифічного IgE, зв’язуючись з опасистими клітинами, можуть витіснити специфічні до паразита молекули IgE і тим самим понизити можливість активації опасистих клітин специфічним антигеном. Інші виділяють чинники, які можуть викликати зрушення співвідношення Тх1/Тх2 клітин-хелперів у напрямі, сприятливому для виживання збудника. Крайнім випадком вторгнення паразитів у функціонування імунної системи є використання деякими з них (головним чином трипаносоматидами) імунорегуляторних білків хазяїна - цитокінів - як власних ростових чинників.
Обрані паразитичними організмами стратегії протидії імунній системі господаря не менш численні, складні і "розумні", ніж власне механізми захисту від них. Саме ці стратегії і дозволяють інфекційним агентам не тільки виживати, але деколи і процвітати в організмі.
Імунологічні (серологічні) методи дослідження інфекційних хвороб
Серологічні реакції застосовують у двох напрямах:
виявлення з діагностичною метою антитіл у сироватці крові обстежуваного за наявністю набору відомих антигенів. Як антигени застосовують суспензії мікроорганізмів, інактивовані хімічними або фізичними методами, або використовують діагностикуми, що представляють фракції мікроорганізму. Як правило, результати серологічної діагностики отримують при дослідженні парних сироваток крові хворих, узятих у перші дні хвороби і через певні проміжки часу від початку захворювання;
визначення родової, видової і типової приналежності мікроорганізму або його антигенів з відомими імунними сироватками. Імунні сироватки повинні містити антитіла у високому титрі і бути строго специфічними. У лабораторній практиці застосовують серологічні реакції, засновані на прямій взаємодії антигена з антитілом (аглютинація, преципітація) і опосередковані реакції (реакція непрямої гемаглютинації, реакція скріплення комплементу), а також реакції з використанням мічених антитіл або антигенів (імуноферментний, радіоімунний аналіз, метод флюоресцуючих антитіл).
Реакція аглютинації застосовується в лабораторній практиці для ідентифікації виділених мікроорганізмів або для виявлення специфічних антитіл у сироватці крові. Механізм реакції заснований на взаємодії детермінантних груп антигена з активними центрами імуноглобуліну в електролітному середовищі.
Реакція преципітації. Феномен преципітації полягає у взаємодії дрібнодисперсних антигенів (преципітиногенів) з відповідними антитілами (преципітинами) і утворенням преципітату. Постановку реакції преципітації здійснюють двома методами: у рідкому середовищі - за типом реакції флокуляції, кільцепреципітації або в щільному середовищі в агарі (гелі). Реакцію преципітації застосовують у двох цілях: виявлення антигенів за відомою імунною сироваткою, або антитіл з використанням відомих антигенів. Існує багато варіантів постановок реакції, але найчастіше використовують наступні методики: реакція преципітації в гелі за Оухтерлоні, радіальна імунодифузія за Манчині, реакція імуноелектро- форезу, реакція флокуляції, кільцепреципітації.
Реакція скріплення комплементу (РСК) використовується для лабораторної діагностики венеричних захворювань, рикетсіозів, вірусних інфекцій (грип, кір, кліщовий енцефаліт та ін.) і ґрунтується на здатності комплементу зв’язуватися з комплексом антиген + антитіло. Комплемент адсорбується на Fc-фрагменті імуноглобулінів G і М. Реакція протікає в дві фази. Перша фаза - взаємодія антигена і антитіла. Як матеріал, що містить антитіла, використовується досліджувана сироватка, до якої додається відомий антиген. До цієї системи додають стандартний комплемент і інкубують при 37 °С протягом однієї години.
Друга фаза - виявлення результатів реакції за допомогою індикаторної гемолітичної системи (еритроцити барана і гемолітична сироватка кролика, що містить гемолізини до еритроцитів барана). До суміші антиген + антитіло + комплемент (перша фаза) додають індикаторну систему і знов інкубують при 37 °С протягом 30-60 хв, після чого оцінюють результати реакції. Руйнування еритроцитів відбувається у разі приєднання до гемолітичної системи комплементу.
Реакція непрямої гемаглютинації (РНГА). РНГА застосовують у двох варіантах: з відомими антигеном для виявлення антитіл або з відомими антитілами для виявлення антигена. Ця реакція специфічна і застосовують її для діагностики захворювань, що викликані бактеріями і рикетсіями. Для постановки РНГА використовують еритроцитарні діагностикуми, приготовані шляхом адсорбції на еритроцитах антигенів або антитіл залежно від мети дослідження. У позитивних випадках ступінь аглютинації еритроцитів відзначають плюсами.
Реакція гемаглютинації (РГА) і реакція гальмування гемаглютинації (РГГА). В основі РГА лежить здатність еритроцитів склеюватися при адсорбції на них певних антигенів. Як досліджуваний матеріал при гемаглютинації використовують алантоїсну, амніотичну рідину, суспензію хоріоналантоїсних оболонок курячих ембріонів, суспензії і екстракти з культур або органів тварин, заражених вірусами, нативний інфекційний матеріал. РГА не є серологічною, оскільки відбувається без участі імунної сироватки і використовується для вибору робочого розведення антигена для постановки РГГА або на наявність антигена (вірусу) в досліджуваному матеріалі (наприклад, при грипі). У реакції використовуються еритроцити тварин, птахів, людини I (0) групи крові. При позитивному результаті РГА дослідження продовжують, визначаючи тип виділеного вірусу за допомогою реакції гальмування гемаглютинації типоспецифічними сироватками.
РТГА заснована на властивості антисироватки пригнічувати вірусну гемаглютинацію, оскільки нейтралізований специфічними антитілами вірус втрачає здатність аглютинувати еритроцити.
Реакція імунофлюоресценції (РІФ). РІФ заснована на з’єднанні антигенів бактерій, рикетсій і вірусів із специфічними антитілами, міченими флюоресцируючими фарбниками (флюоресцеїнізотіоціанат, родамін, В-ізотіціаніт, лісатинродамін В-200, сульфохлорид та ін.), що мають реакційно-здатні групи (сульфохлорид, ізотіоціаніт та ін.). Ці групи з’єднуються з вільними аміногрупами молекул антитіл, які не втрачають при обробці флюорохромом специфічної спорідненості до відповідного антигену. Комплекси антиген-антитіло, що утворилися, стають добре видимими структурами, що яскраво світяться під люмінесцентним мікроскопом. З допомогою РІФ можна виявляти невеликі кількості бактерійних і вірусних антигенів.
Імуноферментний аналіз (ІФА) використовується для виявлення антигенів за допомогою відповідних ним антитіл, кон’югованих з ферментом-міткою. Після з’єднання антигену з міченою ферментом імунною сироваткою в суміш додають субстрат і хромоген. Субстрат розщеплюється ферментом, а його продукти деградації викликають хімічну модифікацію хромогену. При цьому хромоген міняє свій колір - інтенсивність забарвлення прямо пропорційна кількості молекул антигена і антитіл, що зв’язалися. ІФА застосовують для діагностики захворювань, викликаних вірусними і бактерійними збудниками.
Динаміка лейко- та імунограм при інфекційних захворюваннях
При розвитку імунопатологічних станів одночасно відбуваються специфічні і неспецифічні зміни імунної реактивності, причому другі в кількісному плані завжди переважають і розвиваються у ряді випадків більш прискорено. Особливо демонстративно це відбувається при розвитку запалення.
Запальний процес має характерні клінічні етапи, що супроводжуються виразними зрушеннями на імунограмі: а) інкубаційний період; б) стадія продроми; в) поява і розвиток клінічної картини захворювання; г) максимальний розвиток процесу; д) криза захворювання; е) закінчення клінічних проявів хвороби; ж) реконвалесценція; з) одужання або перехід захворювання в хронічний перебіг (де потрібно розділити фази ремісії і загострення процесу).
Схема таких змін в динаміці стадій запального процесу для ряду показників імунограми приведена на рис. 1. Наявність або відсутність в імунограмі зрушень показників, характерних для відповідної стадії запального процесу, може служити основою для прогнозування перебігу захворювання і корекції лікувальних заходів.
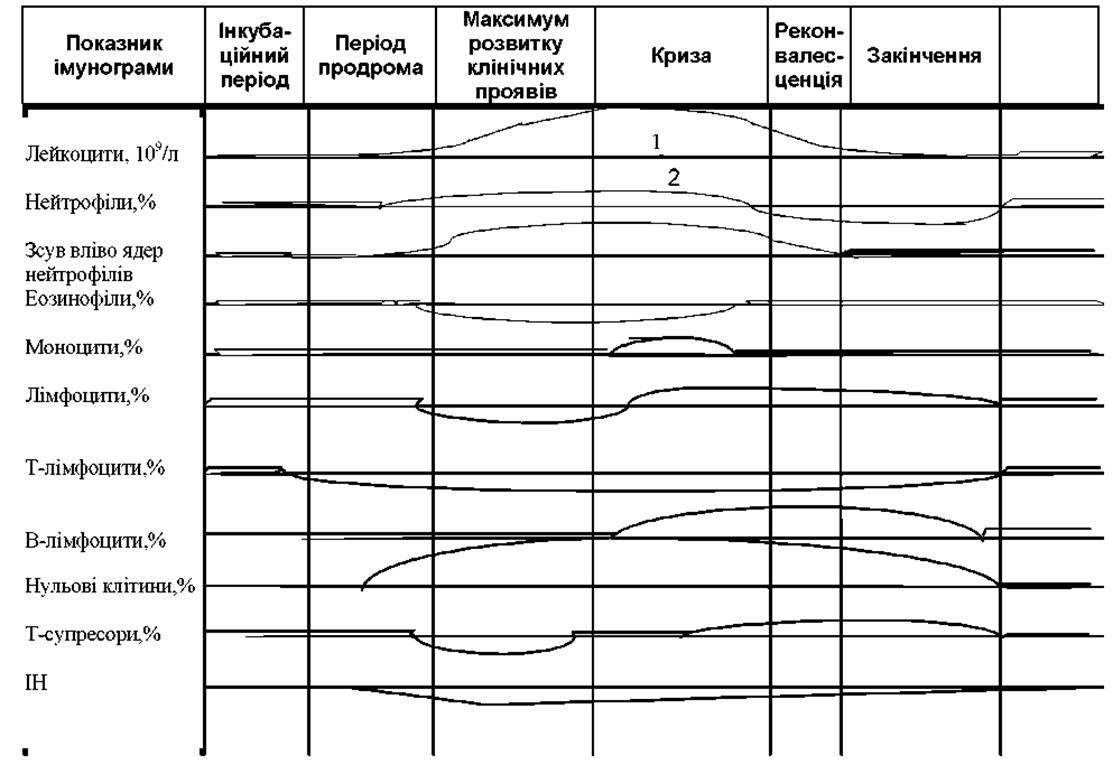
Рисунок. 1. Схема динаміки основних показників імунограми при гострому запальному процесі (Лєбєдєв К.А. Імунологія в клінічній практиці, 1996). 1 - у нормі (прямі горизонтальні лінії); 2 - при запаленні (хвилясті лінії).
В інкубаційному періоді зміни імуногемограми мінімальні, лише в кінці періоду падає відсоток Т-клітин.
У стадії продрома відбувається помірне зменшення відсотка еозинофілів, зниження відносної і абсолютної кількості базофілів, відсотка Т-клітин і збільшення рівня нульових лімфоцитів.
Стадія розгорненої клінічної картини характеризується максимальними значеннями лейкоцитозу, збільшенням рівня моноцитів, у середині стадії або ближче до кінця відсоток нейтрофілів нормалізується або знижується за рахунок збільшення відносного числа лімфоцитів. Зрушення формули вліво залишається тим самим або збільшується за рахунок появи юних форм, що і є свідоцтвом активації імунної системи. У разі наростання інтоксикації знижується фагоцитарна активність нейтрофілів.
Украй несприятливою ознакою є подальше зниження кількості Т-клітин і нуклеарів. Також прогностично несприятливим є посилення зрушення лейкоцитарної формули вліво, збільшення кількості юних форм нейтрофілів з продовженням зростання лейкопенії, з підвищенням вмісту Т-супресорів відносно до Т-хелперів, при зниженні фагоцитарної активності нейтрофілів. Подібні стани виникають при високій патогенності причинного збудника.
У табл. 2 представлена динаміка змін показників імунограми в перші три доби розвитку гострої пневмонії бактерійного походження в порівнянні з імунограмою тієї ж пацієнтки через 2 місяці після закінчення захворювання.
Таблиця 2
Динаміка показників імунограми в період розвитку пневмонії бактерійного походження (Лєбєдєв К.А. Імунологія в клінічній практиці, 1996).
Де ІН - індекс навантаження (пояснення див. у тексті)
Жінка 42-х років |
Лейк. |
Б |
Е |
М |
Ю |
П |
С |
Лімф. |
T-л |
B-л |
0-кл. |
Тх |
Тс |
Фз |
Фа |
ІН |
ШОЕ |
1-ша доба |
7,9 |
0 |
0. |
3 |
0 |
4 |
69 |
24 |
50 |
9 |
41 |
48 |
2 |
31 |
35 |
1,8 |
10 |
2-га доба |
11,0 |
0 |
0 |
2 |
0 |
6 |
76 |
16 |
54 |
6 |
40 |
50 |
4 |
38 |
29 |
0,9 |
9 |
3-та доба |
12,2 |
0 |
0. |
3 |
0 |
9 |
70 |
18 |
49 |
8 |
43 |
45 |
4 |
21 |
27 |
1,0 |
11 |
5-та доба |
14,0 |
0 |
0 |
9 |
0 |
7 |
60 |
24 |
58 |
5 |
37 |
45 |
13 |
9 |
15 |
1,6 |
20 |
7-ма доба |
8,9 |
0 |
3 |
12 |
1 |
8 |
45 |
31 |
60 |
10 |
30 |
48 |
12 |
12 |
35 |
1,9 |
35 |
13-та доба пневмонії |
6,1 |
0 |
2 |
5 |
0 |
3 |
60 |
30 |
70 |
12 |
28 |
50 |
20 |
30 |
20 |
2,7 |
26 |
Через 2 міс. |
6,5 |
0 |
4 |
3 |
0 |
3 |
66 |
24 |
69 |
10 |
21 |
58 |
11 |
40 |
21 |
3,0 |
8 |
У стадії кризи захворювання з подальшим одужанням спостерігається нормалізація вмісту еозинофілів, збільшення відсотка В-клітин, зростання рівня Т-супресорів відносно до Т-хелперів з відновленням пониженої кількості Т-клітин і нормалізація нуклеарів. У загальному аналізі крові спостерігається зниження загального числа лейкоцитів з нормалізацією зрушення ядерної формули нейтрофілів із зменшенням юних форм на фоні збереження високого відносного вмісту лімфоцитів. Сприятливий перебіг відновного періоду ілюструється імунограмою на 7-му добу розвитку пневмонії (табл. 3).
Стадія переходу процесу в млявий підгострий перебіг супроводжується зниженням рівня еозинофілів. Одночасно спостерігається тривала відсутність відновлення кількості Т-лімфоцитів і кілерів, тенденція до збільшення числа моноцитів при лімфопенії, стійке зрушення вліво при омолоджуванні незрілих форм нейтрофілів, низька активність фагоцитозу нейтрофілів при високій або пониженій адгезивній активності цих клітин. У табл. 3 представлена імунограма, що характеризує затяжний перебіг пневмонії на фоні цукрового діабету. Хвора знаходилася в ОРІТ з приводу діабетичної коми. На 8-му добу в неї розвинулася двостороння пневмонія. На фоні антибіотикотерапії через 10 діб відмічено поліпшення, підтверджене динамікою імунограми. Проте ще через 3 доби на імунограмі пацієнтки відмічені несприятливі тенденції в розвитку завершуючої стадії процесу. Клінічне одужання хворої затягнулося на 15 діб.
Таблиця 3
Імунограма, що характеризує затяжний перебіг пневмонії на фоні цукрового діабету. (Лєбєдєв К.А. Імунологія в клінічній практиці, 1996)
Жінка 58-ти років |
Лейк. |
Б |
Е |
М |
П |
С |
Лімф. |
Т-л. |
B-л. |
0-кл. |
Тх |
Тс |
Фз |
Фа |
ІН |
ШОЕ |
8-ма доба |
8,1 |
0 |
0 |
4 |
4 |
74 |
18 |
53 |
8 |
39 |
47 |
6 |
41 |
20 |
1,2 |
12 |
18-та доба |
9,2 |
0 |
3 |
15 |
3 |
61 |
18 |
43 |
10 |
47 |
42 |
1 |
12 |
30 |
0,9 |
18 |
21-ша доба |
6,3 |
0 |
1 |
17 |
3 |
54 |
25 |
47 |
11 |
42 |
42 |
5 |
15 |
31 |
3,9 |
40 |
Стадія реконвалесценції при закінченні одужання. Провідним критерієм незавершеності процесу є зниження кількості Т-клітин і підвищений вміст нульових лімфоцитів. Підтвердженням реконвалесценції є збільшення вмісту В-клітин.
Якщо на даній стадії перевести пацієнта на звичайний повний режим навантаження, відмінити всі лікувальні заходи, то може виникнути або нове загострення захворювання з клінічними симптомами, або, що значно частіше, буде сформований хронічний процес на фоні різної за тривалістю ремісії захворювання. Завданням клініциста на цьому етапі захворювання є диференціація повного одужання і переходу захворювання в стадію реконвалесценції (при зникненні у пацієнта клінічних проявів захворювання). Аналіз імунограми, особливо знятої в динаміці процесу, допоможе лікареві виявити час закінчення запального процесу, що дозволить визначити терміни припинення лікувальних заходів.
Хронічний запальний процес у фазі ремісії характеризується істотним зниженням імунологічної регуляції, високою лабільністю імунограми, часто з виходом її параметрів за межі нормальних значень.
Показником імунограми, вказуючим на наявність клінічної ремісії хронічного процесу, є істотно знижений у порівнянні з нормою здорової людини індекс навантаження (ІН). Індексом навантаження (ІН) є співвідношення Е-РОЛ/Е- РОН у серії тестів навантажень, наприклад, після 30 хв інкубації лімфоцитів при 37 °С або після інкубації з теофіліном. Для дорослих людей середнього віку значення ІН менші 2. Наявність зрушення ІН як без клінічних проявів, так і в їх присутності вказує на факт високосинхронізованої активної роботи імунної системи без урахування місця прикладання цієї роботи. Тому зниження ІН можна виявити при будь-якому хронічному або незавершеному гострому процесі. Наприклад, знижений ІН може в рівній мірі указувати на наявність і продовження хронічного холециститу і тонзиліту, якщо вони були в анамнезі у даного пацієнта. Проте при відновленні у пацієнта на фоні клінічного здоров’я ІН до норми можна з великою часткою впевненості говорити про припинення у нього всіх хронічних запальних процесів.
У табл. 4 наведена імунограма пацієнтки з хронічним тонзилітом, обтяженим частими ОРЗ (більше 6 захворювань на рік), отримана через 36 днів після закінчення чергової ангіни та на тлі повного клінічного здоров’я. Дана імунограма характеризується зниженим значенням ІН, що вказує на наявність у жінки перебігаючого хронічного процесу в стадії ремісії, незважаючи на картину клінічного здоров’я. В імунограмі в табл. 4 можна відзначити високий рівень Т-супресорів, майже рівний відсотку Т -хелперів, що у здорових людей зустрічається вкрай рідко.
Таблиця 4
Імунограма пацієнтки з хронічним тонзилітом, обтяженим частими ОРЗ (більше 6 захворювань на рік), отримана через 36 днів після закінчення чергової ангіни та після 2 років профілактики на тлі повного клінічного здоров’я (Лєбєдєв К.А. Імунологія в клінічній практиці, 1996)
Жінка 32-х років |
Лейк. |
Б |
Е |
М |
П |
С |
Лімф. |
T-л |
B-л |
0-кл. |
Тх |
Тс |
Фз |
Фа |
ІН |
ШОЕ |
Ремісія |
4,2 |
1 |
2 |
3 |
1 |
69 |
24 |
76 |
10 |
14 |
40 |
36 |
36 |
- |
1,2 |
7 |
Через 2 роки (Практично здорова) |
5,1 |
0 |
1 |
2 |
0 |
70 |
27 |
68 |
14 |
18 |
50 |
18 |
30 |
22 |
3,2 |
10 |
При хронічному запальному процесі у фазі загострення спостерігається наступна закономірність. Переважна більшість зрушень показників імунограми в цьому випадку подібна до зрушень, що виявляються при гострому запальному процесі, хоча найчастіше вони виражені менш різко. При слабкому запаленні виразність імунодефіцитності знижується, при значному - підвищується. Дуже високі значення імунних показників є несприятливим прогнозом.
При слабкому загостренні хронічного процесу ІН залишається на тому ж рівні, на якому підтримується протягом всього загострення. Якщо ж загострення достатньо інтенсивне, ІН підвищується до значень, характерних для норми, або навіть перевищує рівень, що зазвичай є у здорових людей. Дуже високі цифри ІН - ознака несприятлива, що свідчить про важкий перебіг процесу загострення на фоні зниженої опірності організму. Зміни імунограми при хронічному процесі у фазі загострення представлені в табл. 5. Перша імунограма знята у пацієнтки в розпал важкого загострення хронічного обструктивного захворювання легень, друга - після лікування, при виписці її з клініки в задовільному стані.
Таблиця 5
Зміни імунограми при хронічному процесі у фазі загострення (Лєбєдєв К.А. Імунологія в клінічній практиці, 1996).
Де ІН - індекс навантаження (пояснення див. у тексті)
Жінка 67-ми років |
Лейк. |
Б |
Е |
М |
Ю |
П |
С |
Лімф. |
T-л |
B-л |
0-кл. |
Тх |
Тс |
Фз |
Фа |
ІН |
ШОЕ |
ХОЗЛ загострення |
9,5 |
0 |
3 |
8 |
1 |
4 |
49 |
35 |
55 |
9 |
36 |
30 |
25 |
14 |
30 |
3,2 |
27 |
При виписці з клініки |
6,7 |
1 |
3 |
4 |
0 |
1 |
68 |
23 |
60 |
20 |
20 |
50 |
10 |
41 |
33 |
1,6 |
16 |
При загостренні хронічного запального процесу не спостерігається зниження кількості еозинофілів у крові на початку загострення і нормалізація показника в кінці, що пояснюється частою присутністю при хронічному процесі алергічного компоненту. При загостренні хронічного процесу частіше і більш стійко зростає ШОЕ, ніж при гострому процесі. При загостренні хронічного процесу зростання рівня В-лімфоцитів відмічається на більш ранніх етапах і досягає набагато вищих значень, ніж при гострому процесі.
Класифікація імунограм при інфекційному запаленні
К.А. Лєбєдєвим і С.Д. Понякіною (1996 р.) наводиться наступна класифікація імунограм і гемограм при запаленні.
1. Нейтрофільний і лімфоцитарний тип - це класичний тип з вираженою нейтрофільною і лімфоцитарною фазами. Він найчастіше зустрічається при гнійно- септичних захворюваннях (рожа, мікробна пневмонія та ін.).
2. Нейтрофільний тип - на початку розгорнутої клінічної картини спостерігається максимально розширена в часі нейтрофільна фаза, яка переходить в лімфоцитарну, невиражену і лише на етапі одужання.
3. Лімфоцитарний тип. У даному випадку нейтрофільна фаза скорочена до мінімуму, вона слабко виражена, виявляється в продромі, основний час займає лімфоцитарна фаза. Вказана фаза характерна для ряду вірусних інфекцій, пригноблюючих нейтрофільний паросток крові (кір, грип). При цьому існує декілька варіантів зрушень показників гемограми.
Еозинофілія частіше виявляється на ранніх етапах хвороби, характеризуючи наявність у патогенезі хвороби алергії, супроводжує посилення продукції IgE, як, наприклад, при туберкульозі і шистоматозі.
Моноцитоз - тривале виражене підвищення числа моноцитів, що захоплює основний період захворювання. Характерний для патологічних процесів з вираженою продуктивною фазою за наявністю гіперчутливості до туберкульозної палички та ін.
Моноцитопенія характерна для процесів з невираженою продуктивною фазою запалення, як при стрептококовій ангіні.
Плазмоцитоз виражається в появі в гемограмі значного числа плазматичних клітин. Зазвичай цей феномен спостерігається при гострих запальних захворюваннях з подразненням лімфоїдної системи, наприклад при кору.
Різке збільшення ШОЕ.
Співвідношення Тх/Тс рівне або менше 1 (при підвищеній кількості Т-супресорів). Протягом ряду запальних процесів число Т-супресорів збільшується до цифр, що перевищують кількість Т-хелперів (наприклад кір). При подібних захворюваннях зниження співвідношення Тх/Тс до значень, менших 1, вельми часта ознака, яка в основному не корелює з тяжкістю процесу, і лише дуже різке зниження даного співвідношення може свідчити про тяжкість захворювання (порівняйте з динамікою даного співвідношення при класичному перебігу запалення, коли будь-яке зниження співвідношення Тх/Тс до цифр, менших 1, свідчить про важкий перебіг процесу).
Співвідношення Тх/Тс більше максимального значення норми (понад 5).
Є ряд патологій, при яких, на відміну від класичної динаміки імунограми, протягом всього запального процесу підвищене співвідношення Тх/Тс за рахунок зменшення числа Т-супресорів. Це найбільш характерне для ряду автоімунних захворювань, наприклад саркоїдозу.
Збільшення вмісту імуноглобулінів. Деякі запальні захворювання характеризуються істотним підвищенням в крові рівня сумарних імуноглобулінів або їх окремих субкласів. Прикладом такого захворювання може служити вірусний гепатит.
Слабка реакція імунограми на запальний процес. В імунограмі, що слабко реагує, зрушення показників класичного аналізу крові практично відсутні, і лише ряд знов введених у лейкограму параметрів указує на процес, що йде. Це, в першу чергу, зниження відносної кількості Т-лімфоцитів, підвищення рівня нульових клітин, зниження ІН. Імунограми, що характеризуються подібними зрушеннями, зустрічаються при захворюваннях всіх типів, коли є "стертий" їх перебіг.
Особливості імунограми при деяких запальних хворобах
При виділенні від хворих синьогнійної палички, протея, епідермального стафілокока відмічається в основному зниження рівня В-клітин, Т-клітин і регуляторних субпопуляцій останніх. При висіванні кишкової палички, золотистого стафілокока, окрім дефіциту В-клітин, патогномонічною виявилася гіперпродукція імунноглобулінів класів М і А. Наведені дані обґрунтовують припущення, що виражений дефіцит основних ланок імунної системи сприяє розмноженню у вогнищі інфекції патогенних збудників, тоді як благополучніший стан імунної реактивності у пацієнта обумовлює накопичення непатогенної мікрофлори.
Така ж закономірність простежувалася і у жінок з гострими запальними захворюваннями придатків матки. При виділенні умовнопатогенної мікрофлори ведучим виявилося зниження функціональної активності і кількості Т-лімфоцитів, надмірний вміст лізоциму. Поєднання умовнопатогенної флори з гонококом супроводжувалося надлишком лізоциму, придушенням реакції бласттрансформації лімфоцитів (РБТЛ) і активацією поглинальної функції нейтрофілів. Нарешті, умовнопатогенні збудники і кампілобактерії зумовили інгібицію РБТЛ, зменшення рівня Т-клітин і гіперпродукцію IgM.
При холециститі характер імунних порушень принципово інший. Він виражається гіперпродукцією імуноглобулінів основних класів і дефіцитом кількості Т-клітин, у міру обтяження процесу ступінь пошкоджень також зростає.
При неспецифічному цервіциті, який є іншим прикладом неспецифічної інфекції, у хворих відмічається зниження рівня Т-клітин, В-лімфоцитів і надмірна продукція IgA мінімального першого ступеня, тобто в наявності дисбаланс імунної системи. Гнійна інфекція м’яких тканин обумовлює переважну зміну інших маркерних показників - РБТЛ (ФГА); патологічний процес супресує функціональну активність Т-клітин, збільшує вміст В-лімфоцитів і пригнічує кількість Т-хелперів.
При пієлонефриті калькульозний і некалькульозний його варіанти обумовлюють принципово іншу форму імунних розладів. Так, у першому випадку зміни стосуються Т- і фагоцитарної ланки, при другому - Т- і В-імунних механізмів.
Специфічна інфекція - вірусний гепатит А - призводить до диференційованої реакції з боку імунної системи залежно від тяжкості захворювання і наявності або відсутності гастродуоденіту. При атиповій безжовтяничній і легкій формі в спектрі дії патологічного процесу значаться Т-клітини, їх регуляторні субпопуляції і В-лімфоцити, при середньоважкій і важкій - ті ж клітини і натуральні кілери.
При кампілобактерному дисбіоценозі спостерігається стимуляція В-клітин і падіння вмісту Т-супресорів і Т-хелперів. Важко сказати, що є первинним. Або формування певних імунних розладів обумовлює розвиток дисбіоза, або дисбіоз визначає характер імунних порушень.
При носійстві патогенних стафілококів на слизовій оболонці носа ведучим виявився дефіцит концентрації IgG, загальних лімфоцитів і Т-клітин 2-го ступеня. У пацієнтів з апендектомією формула міняється, відображаючи зниження продукції IgG, надмірну кількість IgM і дефіцит загальних лімфоцитів.
Імунні зміни у часто хворіючих дітей. При дослідженні клітинних і гуморальних параметрів імунітету в часто хворіючих дітей виявляються досить однотипні відхилення від нормальних значень. В основному відмічається падіння вмісту загальних Т-лімфоцитів, Т-хелперів, зменшення концентрації секреторного IgA, низька активність лізоциму в носовому секреті, зниження інтерферонпродукуючої здатності лейкоцитів. Проте залежно від наявності супутньої патології виявляються певні особливості імунних розладів при аналізі їх формули.
Так, у часто хворіючих дітей без супутньої патології і з алергією переважно страждає клітинна ланка імунітету, що виражено в зниженні кількості Т-хелперів, активних Т-клітин і Т-супресорів. У дітей з хворобами ЛОР-органів і тубінфікованих формується дисбаланс Т-ланки імунітету, оскільки одночасно відмічається падіння кількості Т-хелперів і активних Т-лімфоцитів і збільшення рівня Т-супресорів.
При поєднанні захворювання ЛОР-органів і алергії відбувається зниження числа Т-хелперів, Т-активних лімфоцитів і гіперпродукція IgM. Нарешті, у дітей з надмірною масою тіла формула імунних порушень міняється принципово: зменшується кількість загальних Т-клітин і IgA.
ВІЛ ІНФЕКЦІЯ: ІМУНОПАТОГЕНЕЗ, ІМУНОДІАГНОСТИКА, ІМУНОКОРЕКЦІЯ
ВІЛ-інфекція - хвороба, що викликається ретровірусом, уражує клітини імунної, нервової та інших систем і органів людини. Для неї характерний тривалий хронічний прогресуючий перебіг, що завершується розвитком СНІДу і супроводжуючих його опортуністичних захворювань.
Етіологія. ВІЛ відноситься до підродини лентивірусів сімейства ретровірусів. Відомі два типи вірусу: ВІЛ-1 і ВІЛ-2. Обидва типи вірусу мають схожу структуру. В той же час вони мають відмінності - по молекулярній масі білків і деяким додатковим генам.
Морфологія збудника. Особливістю ретровірусів є наявність зворотної транскриптази (РНК-залежна ДНК-полімераза або ревертаза) у складі генома. У зв’язку з наявністю ферменту родина і отримала свою назву (від англ. retro - назад).
Повна вірусна частинка має сферичну форму діаметром 100-120 нм. Віріон складається з серцевини (ядро, нуклеокапсид), оточеної зовнішньою мембраною (суперкапсид), і матриксу (основний вміст). Ядро включає геном, внутрішні білки р7 і р9 і ферменти - зворотну транскриптазу і ендонуклеазу.
Нуклеокапсид має циліндрову або конічну форму і утворений білками р18 і р24. Геном утворюють дві нитки РНК, зв’язані білками р6 і р7. Білок р 17 створює прошарок (матрикс) між ядром і зовнішньою оболонкою .
Зовнішня мембрана, або суперкапсид, складається з двошарової ліпідної оболонки, пронизаної 72 глікопротеїновими шпильками. У складі кожної шпильки - 3 пари глікопротеїнів gp41 і gp120. Глікопротеїни gp 120 локалізовані у виступаючій частині шпильки і взаємодіють з молекулами CD4 на мембранах клітин.
Основні механізми взаємодії ВІЛ і клітин-мішеней. Життєвий цикл ВІЛ (період від зараження клітини-мішені до утворення інфекційного вірусного потомства) можна розділити на наступні етапи:
• приєднання вірусу до рецепторів клітини: білок gpl20 ВІЛ взаємодіє з CD4- peцептором і ССК5/СХСК4-корецептором;
• зміна конформації поверхневих білків ВІЛ і злиття мембран;
• "роздягання вірусу": вірусна РНК звільняється від білків капсиду і нуклеокапсиду;
• зворотна транскрипція вірусною РНК за участю ферменту ВІЛ-зворотньої транскриптази: утворюється ДНК двухланцюгова - копія вірусного генома;
• міграція (транслокація) ДНК у ядро клітини;
• інтеграція ДНК у хромосомну ДНК клітини за участю ферменту ВІЛ-інтегрази; інтегрована ДНК отримує назву провірусної ДНК;
• транскрипція провірусної ДНК за участю клітинного ферменту РНК-полімерази;
• транспорт мРНК ВІЛ з ядра в цитоплазму;
• синтез вірусних білків за участю клітинних ферментів;
• транспорт вірусних білків до місця складання, упаковка і складання нових віріонів;
• відбрунькування і дозрівання вірусних частинок за участю ферменту ВІЛ-протеази.
Клітини-мішені. ВІЛ має тропність до певних типів клітин, що обумовлено наявністю на поверхні клітин-мішеней рецептора для даного вірусу. Рецепторну функцію можуть виконувати різні структури (ліганди), вуглеводні компоненти білків і ліпідів.
Рецептори, незалежно від біохімічної будови, мають загальну структурну характеристику: складаються з трьох ділянок - позаклітинної, внутрішньо- мембранної і зануреної в цитоплазму.
У 1984 р. стало відомо, що молекула CD4 є головним і необхідним рецептором для ВІЛ-1 і ВІЛ-2. CD4 - це глікопротеїд за своєю будовою, що має гомології з певними ділянками імуноглобулінів. Аналогічні гомології має і білок вірусу gp120, що і визначає його тропність. Рецептори CD4 на своїй поверхні містять наступні клітини: СD4+-лімфоцити, СD8+-лімфоцити, дендритні клітини, моноцити, еозинофіли, мегакаріоцити, нейрони, мікроглії, сперматозоїди.
Хемокіни і їхня роль у патогенезі ВІЛ-інфекції. Зовнішня клітинна мембрана може мати декілька рецепторів для різних типів вірусу, але саме конкретний вірус взаємодіє з певним рецептором.
Експериментальним шляхом встановлено, що одних CD4-рецепторов для проникнення вірусу в клітину недостатньо. Був зроблений висновок про існування додаткових рецепторів - корецепторів.
У 1996 р. були опубліковані дані, згідно яким люди, що не мають рецептора CCR5 на моноцитах, можуть бути несприйнятливими до ВІЛ-інфекції, оскільки саме цей рецептор спільно з CD4 визначає здатність ВІЛ прикріплятися до клітин людини, а потім проникати в них з подальшим їх руйнуванням і розвитком синдрому імунодефіциту. Рецептор CCR5 є природним лігандом хемокіна.
Хемокіни - це низькомолекулярні молекули, які продукуються в основному клітинами запалення (лімфоцити, макрофаги, гранулоцити і еозинофіли) у відповідь на стимуляцію антигенами, мітогенами та іншими активаторами. Вони забезпечують направлений рух клітин, що мають хемокінові рецептори. Цей феномен називається хемоаттракцією.
З біологічної точки зору хемокіни є білками, що мають у складі 68-120 амінокислот. Залежно від порядку цистеїнових послідовностей хемокіни діляться на С-Х-С (а-хемокіни), С-С (ß-хемокіни) і С-хемокіни. Хемокіни гомологічні за структурою між собою і можуть зв’язуватися з одними і тими ж рецепторами.
У табл. 6. наведені рецептори, їх ліганди і клітини, що несуть рецептори (за C.R. Machery, зі змінами).
Таблиця 6
Рецептори, їх ліганди і клітини, що несуть рецептори
Назва рецептору |
Хемокіни-ліганди |
Клітини, експресуючі рецептори |
CCR1 |
MIP-1a, RANTES, MCP-2,3 |
Моноцити, Т-лімфоцити |
CCR2a, ß |
MCP-1,2,3,4 |
Моноцити, Т-лімфоцити, базофіли |
CCR 3 |
Eotaxin, RANTES, MCP-2,3,4 |
Базофіли, еозинофіли |
CCR 4 |
RANTES, MIP-1a |
Базофіли, Т-лімфоцити |
CCR 5 |
RANTES, MIP-1a и ß |
Моноцити, Т-хелпери 1-го типу |
CXCR 1 |
IL-8 |
Нейтрофіли, натуральні кілери (NK) |
CXCR2 |
IL-8, GRO-a, NAP-2, ENA-78 |
Нейтрофіли, NK |
CXCR 3 |
IP-10, Mig |
Активовані Т-лімфоцити |
CXCR 4 |
SDF-1 |
Багато типів клітин |
Примітка: MIP - макрофагальний білок запалення; МСР - макрофагальний хемоаттрактний білок; Eotaxin - хемоаттрактант для еозинофілів; GRO - білок, що активує нейтрофіли, чинник зростання меланоми; NAP - білок, що аттрактує нейтрофіли; ENA - епітеліальний білок, що активує нейтрофіли; IP-10 - білок, що індукує продукцію інтерферону-у (ІФН-у); Mig - індуктор ІФН-у; SDF - стромальний аттрактуючий чинник.
Хемокіновий рецептор CXCR4 забезпечує проникнення ВІЛ, тропного до Т-клітин, CCR2 - до макрофагів, CCR3 - до еозинофілів, CCR5 - до Т-хелперів 1-го типу. Еотаксин перериває зв’язок вірусу з рецептором CCR3, що вказує на важливішу роль останнього в патогенезі ВІЛ-інфекції. Природні ліганди (MIP-1 (а, ß) і RANTES блокують макрофаготропну ВІЛ-інфекцію, але не інфекцію, викликану вірусами, тропними до Т-клітин.
У природних умовах тільки CCR5 і CXCR4 рецептори здатні розпізнавати ВІЛ-1. У зв’язку з цим важливо зазначити, що генетичний дефект, пов’язаний з відсутністю CCR5, майже повністю виключає можливість зараження ВІЛ-1.
Імунопатогенез. Дендритні клітини (клітини Лангерганса, спеціалізовані клітини шкіри і слизових оболонок) одними з перших стикаються з ВІЛ у слизових оболонках і, згідно своєму призначенню, захоплюють, переробляють і переносять його на свою поверхню. Після цього вони мігрують у лімфоїдну тканину, де представляють антиген Т-лімфоцитам, внаслідок чого відбувається активація останніх.
Оболонковий білок gp120 ВІЛ-1 зв’язується з CD4, а також хемокіновими рецепторами, і починається складний біологічний процес взаємодії вірусу з клітиною, що закінчується синтезом нового покоління віріонів.
Вірус і клітина-мішень зближуються, після чого вірус розпізнає специфічні для нього рецептори. Обов’язковою умовою є наявність двох рецепторів, причому вони повинні бути розташовані достатньо близько один від іншого.
СD4-зв’язуюча ділянка оболонкового білка gpl20 з’єднується з CD4-рецептором клітини-мішені. Цей крок негайно призводить до конформаційних змін, а окремі ділянки білків міняють своє розташування одна відносно іншої. У результаті відкривається і стає доступна для взаємодії друга ділянка gpl20, призначена для пов’язання з корецептором CCR5.
На наступному етапі відбувається взаємодія CCR5 з CCR5-зв’язуючою ділянкою gpl20. Після завершення цього процесу починаються конформаційні зміни gp41. Позамембранна частина gp41 включає дві а-спіралі: HR 1 і HR 2, які по черзі починають "закручуватися". У результаті молекула gp41 сильно коротшає, зближуючи вірусну і клітинну мембрани. Конформаційні зміни супроводжуються вивільненням енергії, яка ініціює змішування ліпідних шарів. У процесі злиття беруть участь 4-6 молекул CCR5, багато молекул CD4 і 3-6 Env-тримерів.
Після злиття вірусна мембрана втрачає білки gp41 і gp120. РНК вірусу в оточенні нуклеокапсидних і капсидних білків потрапляє в клітину, і віріон "приступає" до процесу "роздягання". У результаті ослаблення міжмолекулярних зв’язків оболонки вірусу руйнуються. Під дією ферменту МАР-кінази відбувається фосфорилування матриксного білка.
Після "роздягання" вміст капсиду, і перш за все РНК, поступає в цитоплазму клітини, і починається зворотна транскрипція вірусної РНК за участю ферменту зворотної транскриптази.
У цитоплазмі інформація з вірусної РНК за допомогою зворотної транскриптази (ревертази) переписується на ДНК.
Провірусна ДНК, сформована в цитоплазмі, транспортується в ядро клітини у складі нуклеопротеїнового комплексу. Ядерна ДНК захищена двошаровою мембраною. Вона є бар’єром для більшості ретровірусів. Під час мітозу мембрана розчиняється, і ядро стає доступним для проникнення вірусного генетичного матеріалу.
Відмінністю ВІЛ-1 є його здатність транспортувати свою ДНК через інтактну ядерну мембрану. Це дозволяє вірусу заражати клітини, що не діляться, макрофаги і мікрогліальні клітини.
На наступному етапі провірусна ДНК вбудовується в хромосомний апарат клітини. Фермент інтеграза на трьох кінцях молекули провіруса видаляє по два нуклеотиди, а також надрізає хромосомну ДНК. Клітинні ферменти репарації ДНК "прибирають" зайві нуклеотиди на п’яти кінцях провіруса, добудовують "пропущені частки" і за допомогою інтегрази зшивають кінці провірусної і хромосомної ДНК. Після вбудовування провірусна ДНК служить матрицею для транскрипції.
Транскрипція. Фермент РНК-полімераза, використовуючи провірусну ДНК як матрицю, синтезує матричну вірусну РНК (мРНК). Знов утворена мРНК ВІЛ-1 транспортується з ядра в цитоплазму. Перед цим вона повинна пройти в ядрі процес дозрівання, або процесингу.
Дозріла мРНК експортується в цитоплазму клітини, де виконує дві функції: служить матрицею для трансляції (синтезу білків) і вбудовується в нові вірусні частинки як геном РНК.
Вірусні білки в процесі трансляції синтезуються точно так, як і клітинні білки.
Збірка нових вірусних частинок відбувається поблизу плазматичної мембрани, після цього вони відокремлюються від клітинної поверхні.
В- і Т-лімфоцити - головні ефекторні клітини антиген-специфічної імунної відповіді. Їх функція залежить від дендритних клітин. Розпізнавання антигену Т-лімфоцитами можливе тільки після попередньої переробки і представлення пептидних фрагментів антигена дендритними клітинами. З цієї миті запускається каскад імунопатологічних реакцій, що характеризуються порушенням роботи імунної системи, яке супроводжується розвитком клінічних симптомів.
Вірусна інфекція справляє хронічну збудливу і стимулюючу дію на імунну систему. Ураження імунної системи носять кількісний і якісний характер: кількісні полягають у зміні чисельності клітин, якісні - в порушенні функції клітинних субпопуляцій.
Механізми зменшення кількості Т-лімфоцитів. Ключовим чинником у патогенезі ВІЛ-інфекції є зменшення популяції СБ4+-лімфоцитів. Зникнення лімфоцитів CD4 з кровотоку має складний механізм і передбачає загибель клітин, недостатнє вироблення нових і перерозподіл наявних лімфоцитів в лімфоїдні тканини. Механізми знищення, які можна пов’язати з інфікованими Т-клітинами CD4+, називають прямими, а способи знищення неінфікованих T-хелперів об’єднують поняттям "непрямі механізми".
Тільки 1% Т-клітин гине, будучи інфікованими ВІЛ-1, 99% - з інших причин. Однією з причин можна назвати пошкодження мембрани клітини, що відбувається при відокремленні вірусних частинок.
У міру розмноження вірусу в цитоплазмі відбувається накопичення вірусних білків і нуклеїнових кислот. Знов утворений вірус живе за рахунок клітини і використовує для власного розвитку всі її ресурси. Підсумком цього стає прискорене виснаження запасів живильних речовин і енергоресурсів клітини.
Взаємодія gpl20 ВІЛ-1 з мембраною CD4+-лімфоцитів призводить до програмованої клітинної загибелі - апоптозу зрілих СD4+-лімфоцитів або CD34+- гемопоетичних клітин-попередників навіть без інфікування їх вірусом.
Т-супресори, NK-клітини розчиняють інфіковані СD4+-лімфоцити, а разом з ними і вірус; цей прямий шлях називають ще цитотоксичним.
ВІЛ-інфіковані клітини в результаті злиття мембран утворюють групи (кількість клітин у них доходить до 500), що отримали назву синцитія. На поверхні клітин визначається молекула білка Env, який має спорідненість до СD4-рецептора і формує "містки" між сусідніми лімфоцитами. За зближенням клітин слідує їх злиття. Клітини, що потрапляють у таку мережу, стають досяжними для вірусу, а також втрачають свою функціональну активність і можуть знищуватися організмом.
Час напівжиття ВІЛ-1 - час, який потрібний 50% віріонів, щоб проникнути в клітини, розмножитися і заразити нову мішень, - за оцінками різних дослідників, складає від півгодини до 1-2 днів. Це означає, що в організмі інфікованої людини щодня утворюються від 2000 до 20000 млн нових вірусних частинок.
Більше 99% вірусних частинок продукують СD4+-лімфоцити (близько 2,6x109клітин щодня), решта частинок припадає на макрофаги. Інфіковані Т-клітини живуть не більше 3 днів, а значить, мільярди нових СD4+-лімфоцитів повинні заповнювати нестачу приблизно з такою ж швидкістю. Близько 2% цих клітин потрапляє в кров, а останні населяють собою лімфовузли та інші тканини. Це відбувається протягом тривалого часу, поки імунна система в змозі підтримувати відносну рівновагу між руйнуванням і синтезом інфікованих клітин (тривалість складає в середньому 11 років). При природному перебігу ВІЛ-інфекції кількість лімфоцитів СD4+постепенно знижується, тоді як концентрація ВІЛ у крові поступово збільшується. На певному етапі імунна система вже не в змозі самостійно поновлювати свої клітини, що призводить до розмноження вірусу і розвитку імунодефіциту.
Кількісні зміни в роботі клітинної ланки імунітету неминуче супроводжуються порушеннями якісного характеру - зниженням функціональної активності Т-лімфоцитів.
Клітинна імунна відповідь. У залежності від цитокінів, що секретуються, Т-хелпери діляться на два типи. Т-хелпери 1-го типу виробляють в основному інтерлейкін-2 (IL-2) й інтерферон-а. Ці цитокіни підтримують ефекторні функції імунної системи (цитотоксичних Т-лімфоцитів, NK-лімфоцитів, макрофагів). Т-хелпери 2-го типу виробляють переважно IL-4, IL-5, IL-6 і IL-10, які активують гуморальну відповідь. Т-лімфоцити втрачають здатність продукувати Т-клітинний ростовий чинник - IL-2, внаслідок цього порушується диференціювання Т-клітин у різні функціональні субпопуляції - CD4 і CD8, а також активність NK-клітин.
IL-6 грає головну роль у термінальному В-клітинному диференціюванні в імуноглобулін-секретуючі клітини. Оболонковий білок вірусу діє безпосередньо на CD4 клони Т-клітин, індукуючи синтез IL-6 і збільшуючи його продукцію. Зменшення субпопуляції Т-хелперів 1-го типу супроводжується зниженням вироблення а- і у-інтерферону. У свою чергу, функціональна активність NK-лімфоцитів знаходиться під безпосереднім впливом таких цитокінів, як IL-2 і інтерферон-у.
У процесі розвитку ВІЛ-інфекції не тільки уражуються лімфоцити з CD4+- фенотипом, але і порушується функція лімфоцитів з СD8+-фенотипом, тобто Т-супресорів. Білок вірусу р 15 надає супресивну дію на продукцію Т-клітинами IL-2 і у-інтерферону.
З IL-2 та іншими цитокінами тісно пов’язана функція цитотоксичних Т-лімфоцитів, відповідальних за противірусний і протипухлинний захист організму.
Гуморальна імунна відповідь. ВІЛ впливає на функціональну активність В-лімфоцитів, збільшуючи синтез імуноглобулінів і особливо продукцію IgG. Більшість антитіл, незважаючи на присутність вірусу, є неспецифічними (лише близько 5% від усіх імуноглобулінів - специфічні) і їх виробляється значно більше, ніж нормальними В-клітинами. Така гіперпродукція імуноглобулінів наростає в процесі розвитку інфекції.
Моноцити і макрофаги. Тканинні макрофаги у ВІЛ-інфікованих часто містять вірус, і оскільки вони не гинуть від його дії, вони можуть виступати джерелом даного вірусу в організмі. У макрофагів знижується хемотаксис, продукція активних форм кисню, антибактеріальна токсичність.
Таким чином, ураження імунної системи при ВІЛ-інфекції носить системний характер, виявляючись глибокою супресією Т- і В-ланок клітинного імунітету. Разом з ураженням Т-лімфоцитів у хворих ВІЛ-інфекцією відзначається поліклональна активація В-лімфоцитів із збільшенням синтезу імуноглобулінів усіх класів, особливо IgG і IgA, і подальшим виснаженням цього відділу імунної системи. Порушення регуляції імунних процесів виявляється також підвищенням рівня а-інтерферону, а2-макроглобуліну, зниженням рівня IL-2.
У результаті порушення функції імунної системи, при зниженні числа Т-лімфоцитів (CD4+) до 400 і менше клітин в 1 мкл крові, виникають умови для неконтрольованої реплікації ВІЛ із значним підвищенням кількості віріонів у різних середовищах організму. Внаслідок ураження багатьох ланцюгів імунної системи людина, заражена ВІЛ, стає беззахисною перед збудниками різних інфекцій. Порушення імунного статусу клінічно проявляється інфекційними, алергічними, автоімунними та лімфопроліферативними синдромами, синдромом імунологічної недостатності. Все це характеризує клініку ВІЛ-інфекції.
Клінічна картина. Наслідком впливу вірусу є наростаюче пригнічення функції імунної системи з подальшим розвитком опортуністичних інфекцій (вірусної, бактеріальної, грибкової, протозойної етіології). У своєму перебігу ВІЛ-інфекція проходить декілька стадій, які мають особливості клінічних проявів і достатньо чіткі лабораторні критерії.
Інкубаційний період може складати від 3 тижнів до 3 місяців, а в деяких випадках від 2 до 5 років і більше з моменту зараження.
Стадія гострого захворювання характеризується розвитком "мононуклеозного" симптомокомплексу. При цьому відмічаються підвищення температури до 38-38,5 °С, явища інтоксикації, фарингіт, лімфоаденопатія, збільшення печінки і селезінки, проноси (більше тижня), дрібні не сверблячі висипання на шкірі (що зберігаються від 1-2 тижнів до 1-2 місяців). Можливі менінгіальні явища.
У крові реєструється транзиторне зниження рівня СD4+-лімфоцитів і зростання числа CD8+-лімфоцитів.
Тривалість цієї стадії складає 2-3 тижні, після чого захворювання переходить в одну з двох інших стадій - безсимптомну інфекцію або персистуючу генералізовану лімфоаденопатію (ПГЛА). Можливі рецидиви клінічних проявів гострої стадії.
Стадія безсимптомного носійства реєструється в половини хворих і може розтягуватися на 3-6 років. У цей період хворий скарг не пред’являє, клінічні прояви хвороби відсутні. У крові хворих визначаються антитіла до антигенів ВІЛ. Протягом усього цього часу людина є вірусоносієм і може бути джерелом зараження.
Стадія персистуючої генералізованої лімфоаденопатії. У цій стадії захворювання відзначається збільшенням шийних, надключичних, пахвових, ліктьових, пахових лімфовузлів. Залози досягають 1-3 см у діаметрі (рідкіше до 4-5 см), частіше м’які, але можуть бути і щільними, болючі при пальпації, рухомі, не спаяні з оточуючими тканинами і між собою.
Стадія відповідає напрузі В-клітинної ланки імунітету і характеризується накопиченням антитіл до ВІЛ, а також до всіх антигенів мікроорганизмів, з якими ВІЛ-інфікований коли-небудь зустрічався. Спостерігається поступове зниження рівня СD4+-лімфоцитів.
СНІД-асоційований коплекс, окрім збільшення лімфовузлів, характеризується тривалими підйомами температури до 38-39 °С, пітливістю, особливо в нічний час, яка може спостерігатися і без підвищення температури, тривалою діареєю, прогресуючою втратою маси тіла, слабкістю, нездужанням, відсутністю апетиту. Спостерігається спленомегалія, з’являються неврологічні порушення, які призводять до втрати пам’яті і периферичної нейропатії.
Лабораторними ознаками СНІД-асоційованого коплексу є: зменшення рівня СD4+-лімфоцитів; зниження співвідношенняТх/Тс; анемія, лейкопенія, тромбоцитопенія, лімфопенія; підвищення рівня lgА і IgG; підвищення рівня ЦІК; анергія шкіри в реакції ГЗТ.
Для постановки діагнозу досить двох з наведених лабораторних ознак.
СНІД призводить до повної неспроможності імунної відповіді, наслідком чого є важкі опортуністичні інфекції і агресивні бластоматозні процеси. Клінічна картина залежить від характеру і локалізації асоційованих захворювань. Ці захворювання називаються СНІД-маркерні (індикаторні) (табл. 7).
Перша група - захворювання, які властиві тільки важкому імунодефіциту (рівень CD4+ ниже 200). Клінічний діагноз ставиться навіть за відсутності анти- ВІЛ-антитіл або ВІЛ-антигенів.
Друга група - захворювання, які можуть розвиватися як на фоні важкого імунодефіциту, так у ряді випадків і без нього. Тому в цих випадках необхідне лабораторне підтвердження діагнозу.
Таблиця 7
СНІД-індикаторні хвороби
Перша група:
• кандидоз стравоходу, трахеї, бронхів;
• позалегеневий криптококоз;
• криптоспорідіоз з діареєю понад 1 міс.;
• цитомегаловірусні ураження різних органів, крім печінки, селезінки або лімфатичних вузлів, у хворого віком старше 1 міс.;
• інфекція, обумовлена вірусом простого герпесу, виявляється виразками на шкірі та слизових оболонках, які персистують понад 1 міс., а також бронхітом, пневмонією або езофагітом будь-якої тривалості, що вражає хворого у віці старше 1 міс.;
• генералізована саркома Капоши в хворих молодше 60 років;
• лімфома головного мозку (первинна) в хворих молодше 60 років;
• лімфоцитарна інтерстиціальна пневмонія і/або легенева лімфоїдна дисплазія в дітей у віці до 12 років;
• диссемінована інфекція, викликана атиповими мікобактеріями (мікобактерії комплексу М. avium-intracellulare) з позалегеневою локалізацією або локалізацією (додатково до легень) в шкірі, шийних лімфатичних вузлах, лімфатичних вузлах коренів легень;
• пневмоцистна пневмонія;
• прогресуюча багатоосередкова лейкоенцефалопатія;
• токсоплазмоз головного мозку в хворого старше за 1 міс.
Друга група:
• бактерійні інфекції, поєднані або рецидивуючі, в дітей до 13 років (більше 2 випадків за 2 роки спостереження): сепсіс, пневмонія, менінгіт, ураження кісток або суглобів, абсцеси, обумовлені гемофільними паличками, стрептококами;
• кокцидіоїдомікоз дисемінований (позалегенева локалізація);
• ВІЛ-енцефалопатія (ВІЛ-деменція, СНІД-деменція);
• гістоплазмоз з діареєю, персистуючою понад 1 міс.;
• ізоспороз з діареєю, персистуючою понад 1 міс.;
• саркома Капоши в будь-якому віці;
• лімфома головного мозку (первинна) в осіб будь-якого віку;
• інші В-клітинні лімфоми (за винятком хвороби Ходжкіна) або лімфоми невідомого імунофенотипу:
дрібноклітинні лімфоми (типу лімфоми Беркітта та ін.);
імунобластні саркоми (лімфоми імунобластні, крупноклітинні, дифузні
гістіоцитарні, дифузні недиференційовані);
• мікобактеріоз дисемінований (не туберкульоз) з ураженням (крім легень) шкіри, шийних або прикореневих лімфатичних вузлів;
• туберкульоз позалегеневий (з ураженням внутрішніх органів, крім легень);
• сальмонеллезна септицемія рецидивуюча;
• ВІЛ-дістрофія (виснаження, різке схуднення).
Класифікація СНІДу. Згідно класифікації (табл. 8), діагноз СНІДу встановлюється особам, що мають рівень СD4+-лімфоцитів нижче 200 в 1 мкл крові, навіть за відсутністю СНІД-індікаторних хвороб.
Категорія А включає безсимптомних ВІЛ-серопозитивних осіб, осіб з периферичною генералізованою лімфоаденопатією, а також гострою первинною ВІЛ-інфекцією.
Таблиця 8
Класифікація СНІДу
Рівень CD4+ Т-клітин в 1 мкл крові |
Клінічні категорії |
||
А - безсимптомна, гостра (первинна) ВІЛ- інфекція або ПГЛ |
В - маніфестна, але не А і не С |
С - СНІД-індікаторні стани |
|
> 500/мкл |
А1 |
В1 |
С1 |
200-400/мкл |
А2 |
В2 |
С2 |
< 200/мкл |
A3 |
ВЗ |
СЗ |
Примітка: ПГЛ - периферична генералізована лімфоаденопатія.
Категорія B включає різні синдроми, найважливіші з яких, - бацилярний ангіоматоз, орофарінгеальний кандидоз, рецидивуючий кандидозний вульвовагініт, що важко піддається терапії, цервікальна дисплазія, цервікальна карцинома, ідіопатична тромбоцитопенічна пурпура, лістеріоз, периферична нейропатія.
Вторинні інфекції, що виявляються у пацієнтів з ВІЛ-інфекцією, і рівень CD4 Т-клітин у крові наведені в табл. 9 (Rich R. R., 2001).
Таблиця 9
Вторинні інфекції, що виявляються у пацієнтів з ВІЛ-інфекцією
Рівень CD4 Т-клітин в 1 мкл крові |
Етіологічний агент |
Клінічні прояви |
Незначне зниження |
Вірус папіломи людини Вірус Herpes simplex Вірус Herpes zoster Вірус гепатиту В Вірус гепатиту С Вірус гепатиту D Rochalimaea henselae Encapsulated bacteria Candida spp. Coccidioides immitis |
Конділоми Рецидивуючі виразки Шкірні висипи Персистентна антигенемія Хронічний гепатит Хронічний гепатит Бацилярний ангіоматоз Синусити Стоматити, вагініти Пневмонія |
Рівень CD4 Т-клітин в 1 мкл крові |
Етіологічний агент |
Клінічні прояви |
< 500 |
Вірус Епштейна-Барра Вірус герпесу людини 8 Вірус папіломи людини Mycobacterium tuberculosis |
Ротова волосатоклітинна лейкоплакія, лімфома Саркома Капоши Цервікальна чи аноректальна дисплазія Пневмонія |
<200 |
Pneumocystis carinii Toxoplasma gondii Criptosposporidia/micosporidia Isospora Encapsulated bacteria Shigella, Salmonella, Campylobacter Treponema Pallidum Mycobacterium tuberculosis |
Пневмонія, диссемінована інфекція Енцефаліт, хоріоїдит Гастроентерит Діарея Пневмонія, синусит Дизентерія, бактеріємія Вторинний і нейросифіліс Пневмонія, диссеміноване захворювання |
< 100 |
Вірус Herpes simplex Вірус Herpes zoster Цитомегаловірус Candida spp. Cryptococcus neoformans Histoplasma capsulatum Penicillum mameffei Mycobacterium avium intracellulare |
Езофагіт Шкірна диссемінація Ретиніт, коліт, нейропатія Езофагіт Менінгіт, пневмонія, диссеминація Диссеміноване захворювання Диссеміноване захворювання Диссеміноване захворювання |
Лабораторна діагностика ВІЛ-інфекції та СНІДу
Лабораторна діагностика ґрунтується на виявленні маркерів вірусу й специфічних антитіл у біологічних рідинах.
Для постановки діагнозу використовуються наступні методики:
1. Полімеразна ланцюгова реакція (ПЛР) - високочутливий метод виявлення вірусної РНК.
2. Гибрідизаційній аналіз (ГА) - пошук певних нуклеїнових кислот і визначення їхньої кількості по зв’язуванню з ДНК-зондом.
3. Реакція імунофлюоресценції (РІФ) - виявлення антигенів у лейкоцитах крові. Метод специфічний, але низькочутливий.
4. Імуноферментний аналіз (ІФА) - високочутливий метод виявлення антитіл до ВІЛ у сироватці хворого або носія.
5. Імуноблотінг - підтверджувальний тест. Метод виявляє антитіла до одного або декількох оболонкових або серцевинних білків ВІЛ. Результат вважається позитивним, якщо виявлені антитіла до будь-яких двох із трьох основних антигенів ВІЛ - р24, gp 41 і gp 120 (або gp 160).
6. Проточна цитометрія - дозволяє проводити визначення субпопуляцій лімфоцитів і виявляти фенотипічні маркери, що характеризують зміни функціонального стану клітин.
Визначення антитіл до ВІЛ 1-2 в крові. Антитіла до ВІЛ-1 і 2 в сироватці крові в нормі відсутні. Визначення антитіл до ВІЛ є основним методом лабораторної діагностики ВІЛ-інфекції. У основі методу лежить ІФА (чутливість більше 99,5%, специфічність більше 99,8%). Антитіла до ВІЛ з’являються у 90-95% інфікованих протягом 3 міс. після зараження, у 5-9% - через 6 міс. і 0,5-1% - в пізніші терміни. У стадії СНІДу кількість антитіл може знижуватися аж до повного зникнення. При отриманні позитивної відповіді виявлення антитіл до ВІЛ, щоб уникнути псевдопозитивних результатів, аналіз повинен бути повторений ще 1 або 2 рази, бажано з використанням діагностикуму іншої серії. Позитивним результатом вважається той, якщо з двох обидва або з трьох два аналізи виразно виявили антитіла.
Імуноблотінг на антитіла до вірусних білків ВІЛ у сироватці крові. Антитіла до вірусних білків ВІЛ у сироватці крові в нормі відсутні. Метод ІФА за визначенням антитіл до ВІЛ є скринінговим. При отриманні позитивного результату для підтвердження його специфічності використовується метод імуноблотінга Western-blot - зустрічна преципітація в гелі антитіл у сироватці крові хворого з різними вірусними білками, підданими розділенню по молекулярній масі за допомогою електрофорезу і нанесеними на нітроцелюлозу. Визначаються антитіла до вірусних білків gp41, gp120, gp160, р24, р18, р17 та ін. Виявлення антитіл до одного з глікопротеїнів gp41, gp120, gp160 слід вважати позитивним результатом. У разі виявлення антитіл до інших білків вірусу результат вважається сумнівним, і таку людину слід обстежувати ще двічі - через 3 і 6 міс. Відсутність антитіл до специфічних білків ВІЛ означає, що ІФА дав псевдопозитивний результат. Разом з тим, у практичній роботі при оцінці результатів методу імуноблотінга необхідно керуватися інструкцією, що додається фірмою до використовуваного набору для дослідження.
Антиген р24 у сироватці крові. Антиген р24 у сироватці крові в нормі відсутній. Антигеном р24 є білок стінки нуклеотиду ВІЛ. Стадія первинних проявів після інфікування ВІЛ є наслідком початку реплікативного процесу. Антиген р24 з’являється в крові через 2 тижні після інфікування і може бути виявлений методом ІФА в період від 2 до 8 тижнів. Через 2 міс. від початку інфікування антиген р24 зникає з крові. Надалі в клінічному перебігу ВІЛ-інфекції відмічається другий підйом вмісту в крові білка р24. Він припадає на період формування СНІДу. Існуючі тест-системи ІФА для детекції антигена р24 використовуються для раннього виявлення ВІЛ у донорів крові і дітей, визначення прогнозу перебігу СНІДу і контролю за терапією, що проводиться у цих хворих. Метод ІФА має високу аналітичну чутливість, що дозволяє виявляти антиген р24 при ВІЛ-1 у сироватці крові в концентраціях 5-10 пкг/мл і менше 0,5 нг/мл - при ВІЛ-2, і високу специфічність. Разом з тим слід зазначити, що рівень антигену р24 у крові схильний до індивідуальних варіацій, а це означає, що тільки 20-30% пацієнтів можуть бути виявлені за допомогою даного дослідження в ранній період після інфікування.
Антитіла до антигена р24 класів IgM і IgG з’являються в крові, починаючи з 2-го тижня, досягають піку протягом 2-4 тижнів і тримаються на такому рівні різний час: антитіла класу IgM протягом декількох місяців, зникаючи протягом року після інфікування, а антитіла IgG можуть зберігатися роками.
Алгоритм діагностики ВІЛ-інфекції приведений на схемі 1.
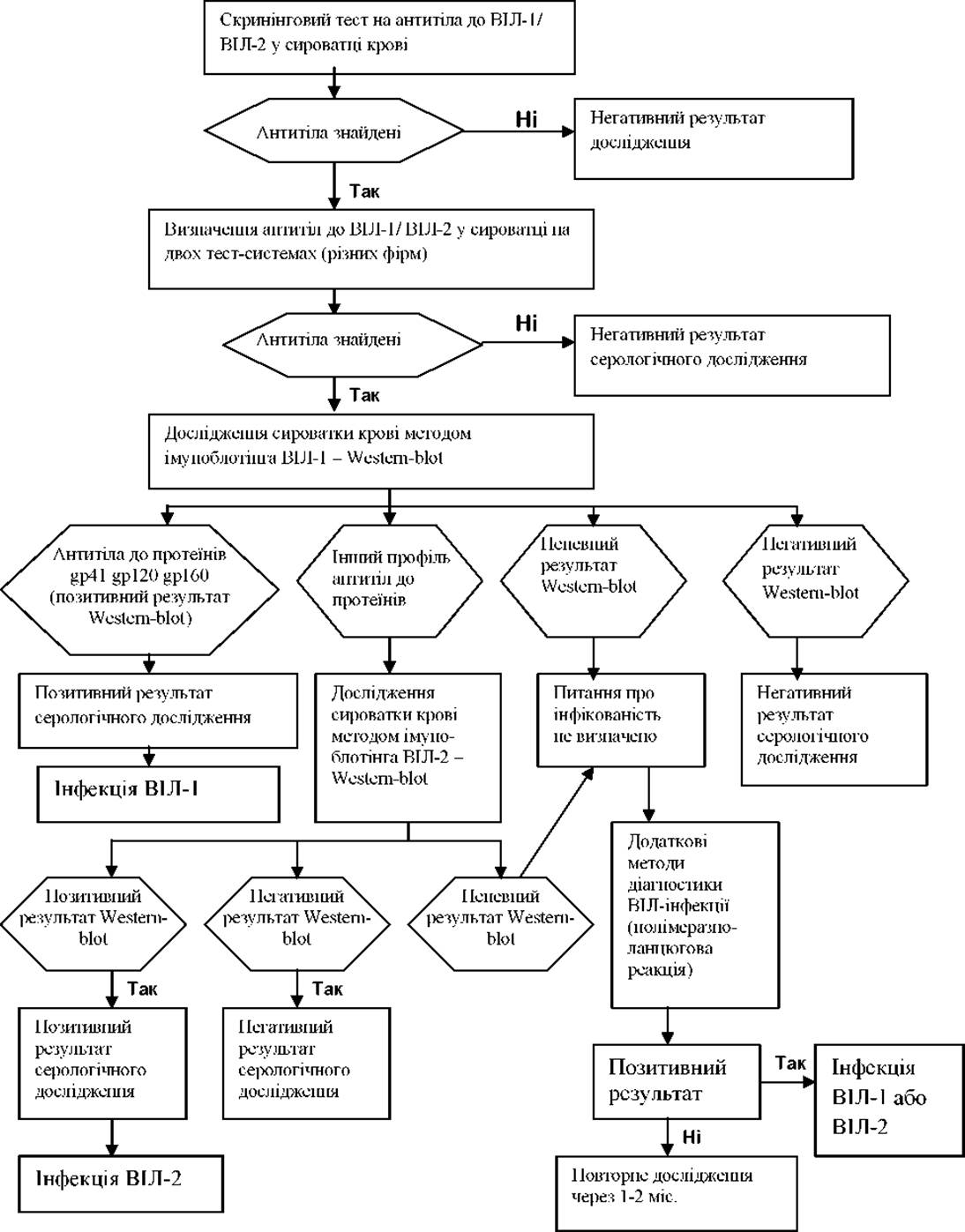
Схема 1. Алгоритм діагностики ВІЛ-інфекції
Антиретровірусні хіміопрепарати
Основними принципами терапії хворих на ВІЛ-інфекцією є наступні:
1. Своєчасність початку етіотропної терапії.
2. Індивідуальний підбір препаратів.
3. Комбінована терапія в адекватних дозах високоактивними антиретровірусними препаратами, що придушують реплікацію ВІЛ до її максимального зниження.
4. Одночасне призначення декількох високоактивних антиретровірусних препаратів, до яких немає перехресної стійкості.
5. ВІЛ-інфікованим жінкам варто призначати оптимальну антиретровірусну терапію навіть під час вагітності.
6. Рання діагностика й своєчасне лікування вторинних захворювань.
Антиретровірусні препарати (АРВП) застосовують для терапії і профілактики ВІЛ-інфекції. Існує 3 класи АРВП: 1) нуклеозидні інгібітори зворотної транскриптази ВІЛ; 2) ненуклеозидні інгібітори зворотної транскриптази ВІЛ; 3) інгібітори протеази ВІЛ.
Загальні показання до застосування АРВП:
1. Лікування інфекції, викликаної ВІЛ-1 і ВІЛ-2 (зидовудин, фосфазид, ставудин, диданозин, зальцитабін, ламівудин, абакавір).
2. Профілактика перинатальної ВІЛ-інфекції (зидовудин, фосфазид).
3. Химіопрофілактіка ВІЛ-інфекції у новонародженого (зидовудин).
4. Химіопрофілактіка парентерального зараження ВІЛ (зидовудин, фосфазид, ставудин, диданозин, ламівудин, абакавір).
Призначений препарат не виліковує від СНІДу і не попереджає зараження ВІЛ, проте сприяє зменшенню розмноження вірусу і захищає імунну систему від пошкодження. Це призводить до повільнішого розвитку проявів, характерних для СНІДу і ВІЛ-інфекції. Необхідно дотримувати режиму лікування, не пропускати дозу і приймати її через рівні проміжки часу, своєчасно звертатися до лікаря для проведення аналізів крові. У разі пропуску дози прийняти її якнайскоріше; не приймати, якщо майже наступив час прийому наступної дози; не подвоювати дозу. Повідомляти лікаря про всі нові симптоми.
Нуклеозидні інгібітори зворотної транскриптази (НІЗТ) ВІЛ. До даного класу АРВП відносять: аналоги тимідину (зидовудин, ставудин), аналог аденіну (диданозин), аналоги цитидину (зальцитабін, ламівудин) і аналог гуаніну (абакавір).
Механізм дії. В основі структури всіх НІЗТ лежить один з аналогів природного нуклеозиду (тимідин, аденін, цитидин або гуанін), що обумовлює загальну властивість метаболітів кожного з препаратів блокувати зворотну транскриптазу ВІЛ і вибірково інгібувати реплікацію вірусної ДНК. Під дією відповідних ферментів препарати метаболізуються з утворенням трифосфатів, які і проявляють фармакологічну активність. Здатність препаратів цієї групи інгібувати зворотну транскриптазу ВІЛ у сотні разів вища, ніж здатність пригнічувати ДНК- полімеразу людини. НІЗТ активні в інфікованих ВІЛ Т-клітинах і макрофагах, пригничують ранні стадії життєвого циклу вірусу.
Ненуклеозидні інгібітори зворотної транскриптази (ННІЗТ) ВІЛ. До даної групи відносяться невірапін та іфавіренц.
Механізм дії. Молекули ННІЗТ безпосередньо з’єднуються з активним центром зворотної транскриптази і блокують процес зворотної транскрипції. Вони пригнічують ранні стадії життєвого циклу вірусу, тому активні відносно гострих інфікованих клітин.
Спектр активності. Клінічне значення має активність ННІЗТ відносно ВІЛ-1. У той же час, проти ВІЛ-2 препарати даної групи неактивні.
Показання: комбінована терапія інфекції, викликаної ВІЛ-1 (невірапін, іфавіренц); профілактика передачі інфекції, викликаної ВІЛ-1, від матері до новонародженого (невірапін); хіміопрофилактика парентерального зараження ВІЛ (іфавіренц).
Невірапін викликає руйнування каталітичної ділянки зворотної транскриптази ВІЛ-1. Блокує активність РНК- і ДНК-залежної полімерази. Не пригничує зворотну транскриптазу ВІЛ-2 і людські a-, ß-, у- або сігма-ДНК-полімерази. При монотерапії швидко і практично завжди розвивається стійкість вірусів. Активний в гостро інфікованих ВІЛ Т-клітинах, пригнічує ранні стадії життєвого циклу вірусу. У комбінації із зидовудином зменшує число вірусів у сироватці і збільшує кількість СD4-клітин; уповільнює прогресування захворювання.
Іфавіренц - селективний ННІЗТ ВІЛ-1. Пригнічує активність ферментів вірусу, перешкоджає транскрипції вірусної РНК на комплементарному ланцюжку ДНК і вбудовуванню останньої в геном людини з подальшою трансляцією ДНК на мессенджері РНК, що кодує білки ВІЛ. У терапевтичних концентраціях не пригнічує клітинні a-, ß-, y- і сігма-ДНК-полімерази людини. При монотерапії резистентність вірусу розвивається протягом декількох тижнів. Активний у гостро інфікованих ВІЛ Т-клітинах, пригнічує ранні стадії життєвого циклу вірусу.
Інгібітори протеази ВІЛ. До інгібіторів протеази ВІЛ відносяться саквінавір, індинавір, ритонавір, нелфінавір і ампренавір.
Механізм дії. Протеаза ВІЛ - фермент, необхідний для протеолітичного розщеплювання поліпротеїнових попередників вірусу на окремі білки, що входять до складу ВІЛ. Розщеплювання вірусних поліпротеїнів украй важливе для дозрівання вірусу, здатного до інфікування. Інгібітори протеази блокують активний центр ферменту і порушують утворення білків вірусного капсиду. Препарати цієї групи пригнічують реплікацію ВІЛ, зокрема при резистентності до інгібіторів зворотної транскриптази. В результаті пригноблення активності ВІЛ-протеази формуються незрілі вірусні частинки, нездатні до інфікування інших клітин.
Спектр активності. Клінічне значення має активність інгібіторів протеази проти ВІЛ-1 і ВІЛ-2.
Показання: лікування ВІЛ-інфекції у складі комбінованої терапії; хіміопрофілактика парентерального зараження ВІЛ.
Основні характеристики і особливості застосування антиретровірусних препаратів для профілактики і лікування ВІЛ і СНІД представлені в табл. 10.
Таблиця 10
Основні характеристики і особливості застосування антиретровірусних препаратів
Міжнародна назва |
Форма препарату |
Режим дозування |
Нуклеозидні інгібітори зворотної транскриптази ВІЛ |
||
Зидовудин |
Капс. 0,1 г; 0,25 г Розчин для прийому всередину 10 мг/мл у флак. по 20 мл Розчин для ін’єкцій 10 мг/мл у флак. по 20 мл |
Терапія ВІЛ-інфекції Всередину Дорослі: 0,6 г/добу в 2-3 прийоми Дети 6 тижнів-12 років: 160 мг/м2 кожні 8 год. (480 мг/м2/добу). Профілактика перинатальної ВІЛ-інфекції Вагітні, інфіковані ВІЛ: 0,1 г 5 разів на добу всередину до початку пологів, під час пологів - 2 мг/кг в/в протягом 1-ої години, потім в/в 1 мг/кг/год до відрізання пуповини. Новонароджені: 2 мг/кг кожні 6 год. протягом перших 6 тижнів життя. |
Фосфазид |
Табл. 0,2 г; 0,4 г |
Всередину Терапія ВІЛ-інфекції Дорослі: 0,6-1,2 г/добу в 2 прийоми. Діти: 10-20 мг/кг/добу в 2 прийоми. Профілактика професійного зараження ВІЛ Дорослі: 0,6 г кожні 12 годин протягом 4 тижнів (починати не пізніше ніж через 3 доби після можливого інфікування) |
Ставудин |
Капс. 15 мг; 20 мг; 30 мг; 40 мг |
Всередину Дорослі та підлітки: маса тіла від 60 кг - 20 мг кожні 12 год.; до 60 кг - 15 мг кожні 12 год. Діти: маса тіла від 30 кг - 15 мг кожні 12 год.; до 30 кг - 1 мг/кг кожні 12 год. |
Діданозин |
Табл. розчинні 0,025 г; 0,05 г; 0,1 г; 0,15 г Капсули сповільненого вивільнення 0,125 г; 0,2 г; 0,25 г; 0,4 г Порошок д/сусп. д/прийому всередину 0,1 г; 0,167 г; 0,375 г |
Всередину Дорослі: маса тіла до 50 кг - 0,125 г (таблетки) і 0,167 г (порошок); 50-74 кг - 0,2 г і 0,25 г (відповідно); більше 75 кг - 0,3 г і 0,375 г (відповідно) кожні 12 год. Капс. - 1 раз на добу: маса тіла від 60 кг - 0,4 г; до 60 кг - 0,25 г. Діти: 120 мг/м2 кожні 12 год. |
Зальцитабін |
Табл. 0,375 мг; 0,75 мг |
Всередину Дорослі і діти старше 12 років: 0,75 мг кожні 8 годин або 1,125 мг кожні 12 год. |
Абакавір |
Табл. 0,3 г Сусп. д/прийому всередину 20 мг/мл у флаконах по 240 мл |
Всередину Дорослі і підлітки старше 16 років: 0,3 г кожні 12 год. Діти 3 міс.-16 років: 8 мг/кг кожні 12 год. (але не більше 0,6 г/добу) |
Ламівудин/зидовудин |
Табл. 0,15 г + 0,3 г |
Всередину Дорослі і діти старше 12 років: 1 табл. кожні 12 год. |
Невірапін |
Табл. 0,2 г Сусп. д/прийому всередину 10 мг/мл у флак. по 240 мл |
Всередину Терапія ВІЛ-інфекції Дорослі: 0,2 г/добу протягом 14 днів, далі 0,2 г кожні 12 год. Діти: 2 міс-8 років - 4 мг/кг/добу в 1 прийом протягом 2 тижнів, далі 7 мг/кг кожні 12 год.; старше 8 років - 4 мг/кг/добу в 1 прийом протягом 2 тижнів, далі 4 мг/кг кожні 12 год. Максимальна добова доза в будь-якій віковій групі - 0,4 г. Профілактика передачі ВІЛ від матері до дитини Однократно матері під час пологів 0,2 г, а потім 2 мг/кг новонародженого протягом 3-х діб після народження. |
Іфавіренц |
Капс. 0,05 г; 0,1 г; 0,2 г |
Всередину Дорослі: 0,6 г 1 раз на добу. Діти старше 3 років: маса тіла 13-15 кг - 0,2 г/добу; 15-20 кг - 0,25 г/добу; 20-25 кг - 0,3 г/добу; 25-32 кг - 0,35 г/добу; 32-40 кг - 0,4 г/добу |
Інгібітори протеази ВІЛ |
||
Саквінавір |
Капс. тверді 0,2 г Капс. м’які 0,2 г |
Всередину Дорослі: капс. тверді. - 0,6 г кожні 8 год. капс. м’які - 1,2 г кожні 8 год. При сполученні з іншими інгібіторами протеази доза може бути зменшена. |
Індинавір |
Капс. 0,4 г |
Всередину. Дорослі: 0,8 г кожні 8 год. |
Рітонавір |
Капс. 0,1 г Розчин д/прийому всередину 80 мг/мл |
Всередину Дорослі: 0,6 г кожні 12 год. Щоб поліпшити переносимість, спочатку застосовують 0,3 г кожні 12 год., потім кожен день дозу збільшують на 0,1 г до досягенння стандартної дози. Діти старше 2 років: 0,4 г/м2 кожні 12 год. При поганій переносимості - 0,25 г/м2, з наступним збільшенням дози кожні 2-3 дні на 50 мг/м2 до досягнення стандартної дози. |
Нелфінавір |
Табл. 0,25 г Пор. д/сусп. д/прийому всередину 50 мг/мл |
Всередину Дорослі и діти старше 13 років: 0,75 г кожні 8 год. Діти до 13 років: 20-30 мг/кг кожні 8 год. |
Ампренавір |
Капс. 0,05 г; 0,15 г Розчин д/прийому всередину 15 мг/мл |
Всередину Дорослі, підлітки старше 13 років і пацієнти масою тіла більше 50 кг: 1,2 г (капс.) або 1,4 г (розчин) кожні 12 год. Діти 4-12 років і пацієнти масою тіла до 50 кг: капс. - 20 мг/кг кожні 12 год. або 15 мг/кг кожні 8 год.; розчин - 22,5 мг/кг кожні 12 год. або 17 мг/кг кожні 8 год. |
З метою підвищення ефективності терапії для лікування СНІДу призначають комбінації антиретровірусних препаратів.
Як стартова терапія рекомендують комбінації наступних груп препаратів:
1) інгібітор протеази + нуклеозидний інгібітор зворотної транскриптази;
2) ненуклеозидний інгібітор зворотної транскриптази + нуклеозидний інгібітор зворотної транскриптази;
3) два нуклеозидні інгібітори зворотної транскриптази;
4) ненуклеозидний інгібітор зворотної транскриптази + другий ненуклеозидний інгібітор зворотної транскриптази.
Найбільш часті ускладнення антиретровірусної терапії: лактат-ацидоз і стеатоз печінки (виникають при лікуванні нуклеозидними інгібіторами зворотної транскриптази); гіперглікемія і цукровий діабет або погіршення перебігу вже наявного цукрового діабету (виникає при лікуванні інгібіторами протеази); порушення ліпідного обміну, ліподистрофія (виникають при лікуванні інгібіторами протеази і ненуклеозидними інгібіторами зворотної транскриптази); висипання на шкірі (виникають при лікуванні ненуклеозидними інгібіторами зворотної транскриптази).
Завдання для заключного контролю знань
11. Як впливає стрес на імунні реакції?
A. Пригнічує реакції Т-ланки імунної системи.
B. Стимулює реакції Т-ланки імунної системи.
C. Пригнічує реакції В-ланки імунної системи.
D. Стимулює реакції В-ланки імунної системи.
12. Вкажіть абсолютну ознаку, на підставі якої можна ставити діагноз СНІДу.
A. Клінічні прояви опортуністичних інфекцій.
B. Лімфопенія при хелперно-супресорному коефіцієнті менше 1.
C. Підвищена концентрація імуноглобулінів класів G i A.
D. Ослаблені реакції на загальнопоширені антигени.
E. Саркома Капоши у осіб молодше 60 років.
13. Які препарати відносяться до противірусних, що застосовують при СНІДі?
A. Азидотимідін, рибавірин, ацикловір.
B. Сурамін, аденинарабіозид, анкаміцин.
C. Гетерополіаніон-23, фосфоноформат.
D. Жоден з перерахованих.
E. Усі перераховані препарати.
14. Які імуномодулюючі препарати застосовуються для лікування СНІДу?
A. Левамізол.
B. Ізопринозин.
C. Тимозин, тимопептін.
D. Імрег, інтерлейкін-2.
E. Усі перераховані препарати недоцільно застосовувати при СНIДі.
15. Інженер, який 3 роки працював за контрактом в Африці, останні 2 роки почував себе задовільно, госпіталізований у пульмонологічне відділення зі скаргами на загальну слабкість, нічну пітливість, сухий непродуктивний кашель. В аналізі крові виявлена лімфопенія. Вкажіть найбільш доцільну діагностичну тактику.
A. Тест на відновлення нітросинього тетразолію.
B. Визначення активності комплементу.
C. Визначення фагоцитарного індексу.
D. Пошук антитіл до ВІЛ у тесті ELISA та методом імуноблотінгу.
E. Пошук активності лейкоцитів.
16. Імунна відповідь у хворих вірусною інфекцією характеризується:
A. Збільшенням вироблення інтерферону.
B. Активацією цитотоксичних Т-лімфоцитів.
C. Прискореним виробленням імуноглобулінів A, M, G.
D. Формуванням клітин пам’яті.
E. Жодним з перерахованих.
17. Які захворювання, спричинені грибками, характерні для хворих, інфікованих ВІЛ?
A. Кандидоз з ураженням шкіри ступнів, кистей i завушних складок.
B. Кандидоз з ураженням стравоходу.
C. Кріптококоз з ураженням легень, центральної нервової системи або дисемінована інфекція.
D. Усі вказані захворювання i прояви.
18. Вкажіть клінічні стадії розвитку СНІДу:
A. Інкубаційний період.
B. Синдром генералізованої лімфоаденопатії.
C. СНІД-асоційований комплекс.
D. СНІД.
E. Жоден з перерахованих періодів не є стадією СНІДу.
19. Які симптоми характерні для СНІД-асоційованого комплексу?
A. Генералізована лімфоаденопатія.
B. Втрата маси тіла.
C. Пітливість, лихоманка, кашель.
D. Діспепсія.
E. Лейко-, лімфо-, тромбоцитопенія, порушення клітинного імунітету.
F. Жодна з перерахованих ознак.
20. Пацієнт, який пройшов 5 років тому курс лікування з приводу вогнищевого туберкульозу легень, звернувся у ПТД для зняття з обліку. При контрольному обстеженні встановлено, що раніше позитивна реакція Манту стала негативною. Вважати...
A. Хворий одужав від туберкульозу.
B. Зберігається активний туберкульозний процес.
C. Хворому показана вакцинація БЦЖ.
D. Має місце імунодефіцитний стан (можливо, СНІД).
Вірні відповіді на питання: 11 - AC; 12 - E; 13 - ABC; 14 - ABCD; 15 - D; 16 - BC; 17 - BC; 18 - ABCD; 19 - ABCDE; 20 - D.