Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Вторичная структура белков
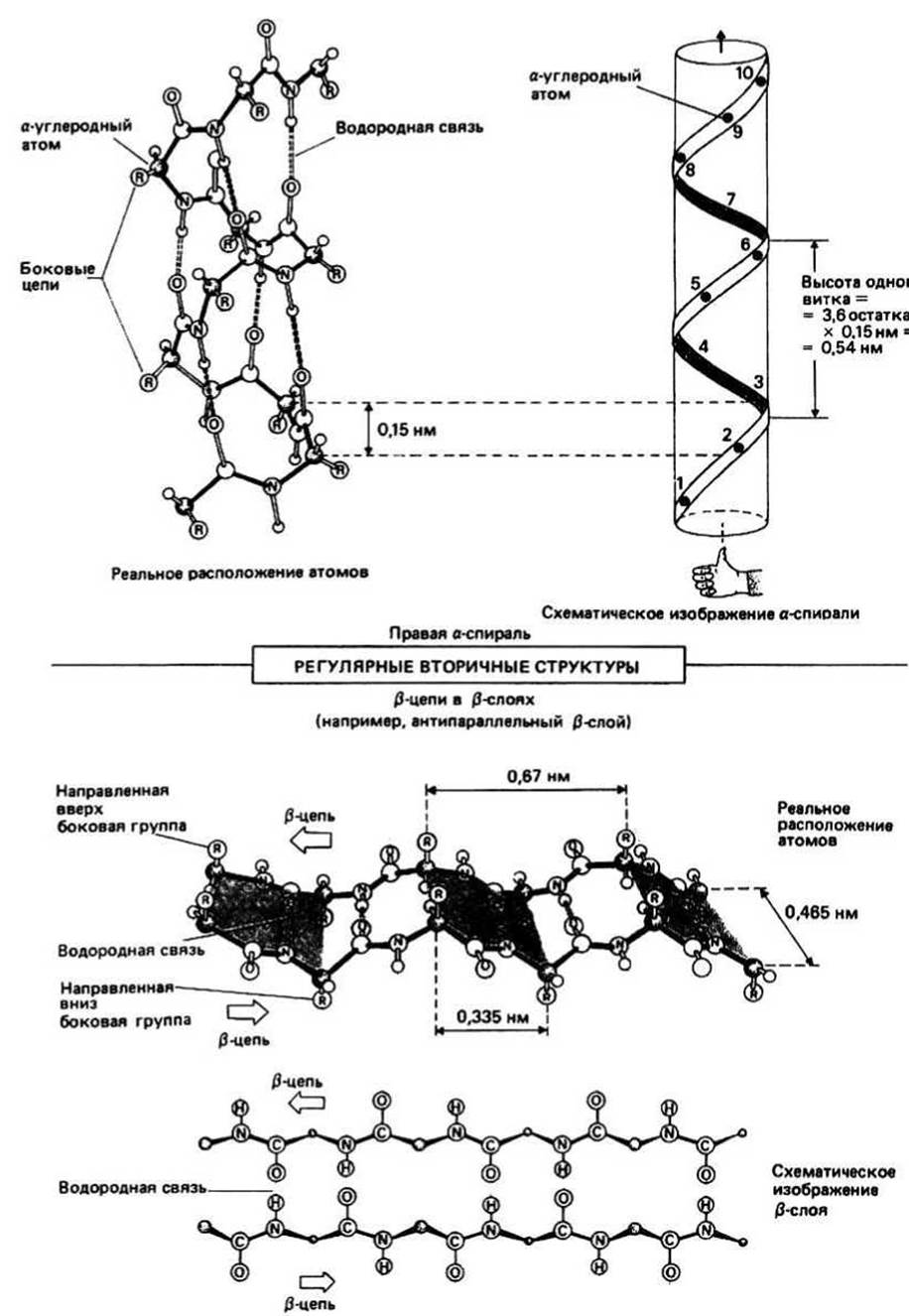
Рис. 9.1.
Под вторичной структурой участка полипептидной цепи понимают конформацию основной цепи этого фрагмента без учета конформации боковых групп. Согласно более раннему определению, употребляемому иногда и сейчас, вторичная структура — это те сегменты полипептидной цепи, которые участвуют в формировании регулярной сетки водородных связей. При некоторых конформациях образуются регулярные повторяющиеся структуры, стабилизированные водородными связями между >N—Н- и >С=О-группами основной цепи (например, а-спираль, ß-слой, коллагеновая спираль).
Регулярная или спиральная, вторичная структура образуется тогда, когда у всех остатков значения углов ф и Ψ одинаковы. При этом основная цепь у каждого Са-атома поворачивается на один и тот же угол. Любую спираль можно рассматривать как результат наматывания цепи на боковую поверхность воображаемого цилиндра. Спираль характеризуется числом повторяющихся единиц (остатков), приходящихся на один виток (обозначается n), и расстоянием между соседними остатками вдоль оси спирали (d). Высота одного витка (р) равна произведению n на d. Спирали могут быть правыми и левыми. Утверждение, что какая-то спираль является правой, означает, что если вытянутый вперед большой палец правой руки направить вдоль оси спирали, то расположенные перпендикулярно ему зажатые в кулак остальные пальцы будут указывать направление хода цепи.
Цопни и Корм в 1951 г. предположили, что в белках должны встречаться два типа регулярной структуры — а-спираль (n = 3,6) и ß-структура (п = 2). Эта догадка основывалась, во-первых, на известных данных о размерах пептидной группы и ее плоском строении, а во-вторых, на том, что оптимальные условия для образования водородной связи N—Н- - О реализуются в том случае, когда все три атома, N, Н и О, лежат на одной прямой. Именно способностью полипептидной цепи принимать форму а-спирали и ß-структуры удалось объяснить результаты экспериментов по изучению дифракции рентгеновских лучей на волокнах фибриллярного белка кератина (гл. 11), находящегося соответственно в а - и ß-формах (отсюда и название — а - и ß-структуры). а -Спираль и ß-структура являются энергетически наиболее выгодными конформациями, поскольку обе они стабилизированы водородными связями (гл. 7) между >N—H- и >С=О-группами основной цепи. Кроме того, и а-спираль, и ß -структура дополнительно стабилизируются благодаря плотной упаковке атомов основной цепи, которые подогнаны друг к другу, как кусочки одной картинки-головоломки.
В правой а -спирали ф = -57°, Ψ = -47°. Число остатков на виток (n) равно 3,6, расстояние между соседними остатками вдоль оси спирали (d) — 0,15 нм, а высота одно витка (р) составляет 0,54 нм (= 3,6х 0,15 нм). Каждая >С=О-группа образует водородную связь с
четвертой по ходу цепи >N—Н-группой. Регулярность структуры означает, что все >N—H- и >С=О-группы, за исключением находящихся на концах спирали, могут образовывать водородные связи. а-Спираль по форме напоминает прутик, в котором стебель — это основная цепь, а торчащие в разные стороны ветки - боковые цепи (R-группы).
ß-Слой формируется из двух или более ß -структурных участков полипептидной цепи, называемых ß- участками. В каждом ß-участке полипептидная цепь почти полностью вытянута; при этом >N—H- и >С=О-группы ориентированы примерно перпендикулярно направлению ß-участка и могут образовывать водородные связи с соседними участками. В результате из нескольких ß-участков образуется структура, которая в грубом приближении оказывается плоской, напоминающей лист. Однако из-за того что плоскости пептидных групп в каждом ß -участке наклонены поочередно в разные стороны относительно направления ß-участка, плоский ß-слой приобретает складчатую форму. Если двигаться вдоль одного из ß-участков, составляющих ß-слой, то боковые группы будут выступать по очереди то с одной, то с другой стороны ß-слоя.
Параллельная и антипараллельная ß-структуры. Существуют два разных варианта образования водородных связей между тяжами в составе р-слоя. Каждому варианту соответствует свои значения углов ф и Ψ. В параллельном ß-слое (ф = - 119°, Ψ = 113°) соседние ß-участки направлены в одну сторону (рис. 9.2), а в антипараллельном (ф = -139°, Ψ = 135°) — в противоположные (рис. 9.1).
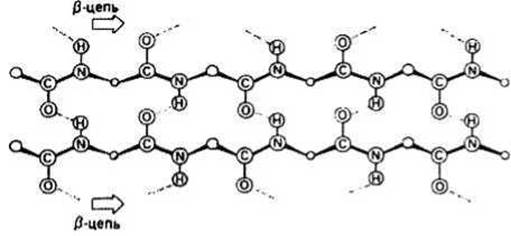
Рис. 9.2. Параллельный ß-слой.
Коллагеновая спираль представляет собой третий тип регулярной вторичной структуры со значениями углов ф = —60°, Ψ= 140°. В такой конформации находится основная часть полипептидной цепи фибриллярного белка коллагена (гл. 11).
Большинство глобулярных белков имеет а-спиральные и/или ß-структурные участки. а-Спирали обычно состоят из 6—24 остатков, соответственно длина их варьирует от 0,9 до 2,4 нм. Значения углов ф и Ψ в спирали всегда немного отличаются от стандартных. Иногда несколько остатков принимают конформацию спирали 310, отличную от конформации ос-спирали. На один виток спирали 310 приходится 3 остатка, а водородные связи в ней образуются между n и n — 3 по ходу цепи остатками. Участки ß-слоя, как правило, состоят из 3—10 остатков и имеют длину от 1,0 до 3,3 нм. Типичный (3-слой содержит от 2 до 10 р-участков. В одних ß-слоях все участки уложены параллельно друг другу, в других все соседние ß-тяжи антипараллельны. Кроме того, иногда в одном и том же слое присутствуют оба типа укладки. Так же как и в случае а-спирали, реальная конформация ß-слоя может несколько отличаться от стандартной.
ß-Изгиб - это еще один тип вторичной структуры, встречающийся во многих глобулярных белках в тех местах, где направление полипептидной цепи меняется на противоположное. Данная структура часто рассматривается как связующее звено между двумя уложенными антипараллельно ß-участками в составе ß-слоя. На рис. 9.3 приведен пример ß-изгиба из четырех остатков с одной водородной связью между >С=О-группой остатка 1 и >N—Н-группой остатка 4. В белках обнаруживаются и другие типы ß-изгибов. В отличие от а-спирали, коллагеновой спирали и ß - слоя в ß-изгибе значения углов ф и Ψ у разных остатков неодинаковы. ß-Изгибы обычно находятся у поверхности белковой глобулы.
Предсказать, какие участки молекулы глобулярного белка будут иметь регулярную вторичную структуру, основываясь на данных об их аминокислотной последовательности, можно с точностью около 70%. Одни остатки (например, Glu, Met, Ala и Leu) часто встречаются в а -спиралях, в то время как другие (Gly и Pro) — значительно реже. Что касается пролина (Pro), то этот остаток может находиться в а-спирали лишь в одном из первых трех положений, поскольку в остальных позициях наличие ковалентной связи между боковой цепью пролинового остатка и атомом азота основной цепи не позволяет >N—Н-группе образовать водородную связь. Некоторые остатки предпочитают находиться в ß-участках (например, Val, He, Туг и Phe), тогда как остатки Asp и Glu принимают эту конформацию довольно редко. Такие данные о встречаемости различных остатков в разных типах вторичной структуры используются при предсказании локализации в белке а - и ß-участков.
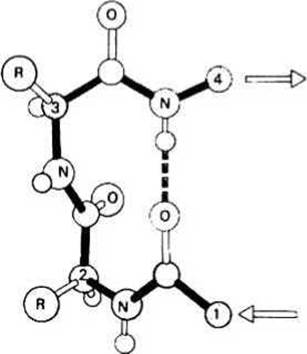
Рис. 9.3. р - Изгиб.