Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Белки в роли переносчиков: глобины
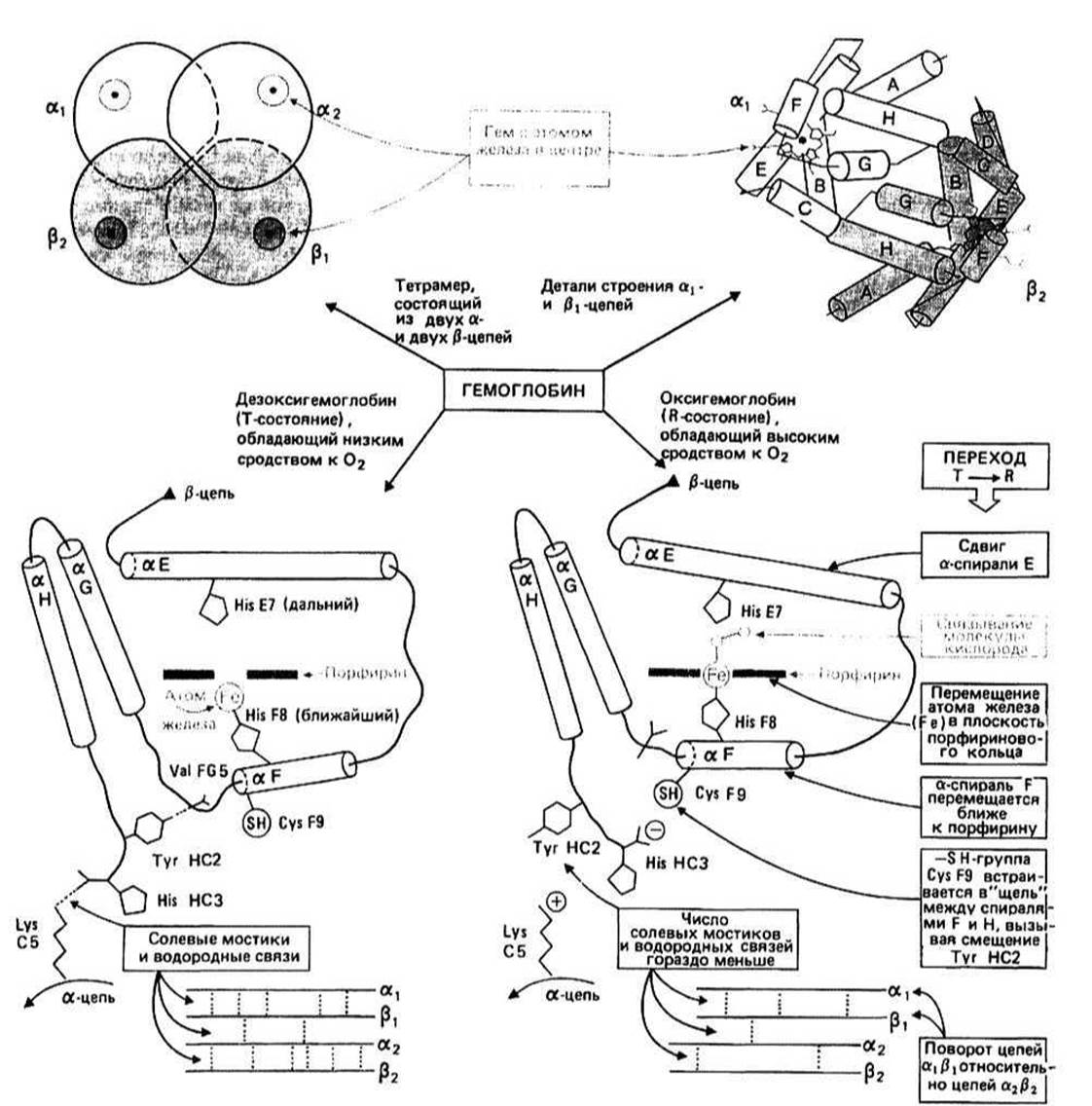
Рис. 15.1.
Гемоглобин - это белок, переносящий кислород от легких к тканям и осуществляющий транспорт углекислого газа от тканей обратно к легким. Гемоглобин локализован в красных кровяных клетках — эритроцитах. Молекула гемоглобина состоит из четырех полипептидных цепей - двух идентичных ос-цепей (обозначаемых а1 и а2) и двух идентичных р-цепей (обозначаемых р1 и р2). Каждая цепь связана с особой группой — гемом.
Миоглобин — это белок, переносящий кислород в мышечных клетках. Он состоит из одной полипептидной цепи иимеет один гем.
Аминокислотная последовательность миоглобина отличается от последовательностей как а-, так и ß- цепей гемоглобина, однако между всеми тремя последовательностями имеется определенное сходство (гл. 16). В каждой цепи содержится примерно 140—150 остатков.
Используя метод рентгеноструктурного анализа, Кендрью и Перутц с сотрудниками определили пространственные структуры миоглобина и гемоглобина.
Третичная структура а- и ß-цепей гемоглобина и цепи миоглобина оказалась сходной. Во всех трех поли пептидах около трех четвертей остатков входит в состав ос-спиралей. Все три цепи состоят из шести длинных ос-спиральных сегментов, обозначаемых А, В, Е, F, G и Н, в каждом из которых находятся от 10 до 25 остатков (гл. 10). В области между спиралями В и Е структура цепей различается. В миоглобине имеются две дополнительные а-спирали, С и D, которые в цепях гемоглобина либо отсутствуют, либо деформированы. Общая укладка а-спиралей во всех трех цепях настолько похожа, что принято говорить о «глобиновом типе сворачивания». Соседние вдоль цепи а-спирали связаны перемычками из нескольких остатков. Эти перемычки имеют нерегулярные конформации. В глобинах остатки иногда обозначаются согласно тому, какое место по порядку они занимают и в какой а-спирали. Например, HisF8 р-цепи — это восьмой остаток в а-спирали F, ValFG5 — пятый остаток перемычки между ос-спиралями F и G, а ТугНС2 — это второй остаток в С-концевом нерегулярном участке, расположенном за а-спиралью Н.
Гем состоит из атомов углерода, азота и водорода, образующих плоское кольцо, называемое порфирином. В центре этого кольца находится атом железа, связанный с атомами кольца четырьмя из шести своих возможных координационных связей.
К гему примыкают два остатка His. Ближайший гистидин (HisF8) связан с атомом железа через пятую координационную связь. По шестой связи присоединен кислород.
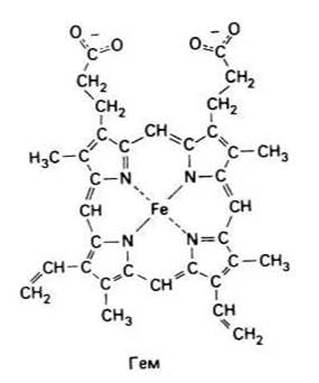
Рис. 5.2.
Дальний гистидин (HisE7) располагается с противоположной стороны порфиринового кольца по отношению к HisF8 и не образует связи с гемовым железом - здесь должно остаться достаточно свободного пространства для размещения кислорода.
Дезоксигемоглобин — это гемоглобин, не связанный с кислородом. В дезоксигемоглобине атом железа находится вне плоскости порфиринового кольца и, кроме того, имеется несколько солевых мостиков и водородных связей, которых нет в оксигенированной форме белка. Некоторые из этих связей образуются между атомами одной и той же цепи (например, водородная связь между ОН-группой ТуrНС2 и карбонильным кислородом ValFG5 р-цепи), другие — между атомами, принадлежащими различным цепям (например, солевой мостик между LysC5 ос-цепи и концевой СОО-группой р-цепи).
Оксигемоглобин — это гемоглобин, связанный с кислородом. Кислород присоединен по шестой координационной связи атома железа гема и располагается рядом с дальним остатком гистидина. При связывании кислорода атом железа перемещается в плоскость порфиринового кольца. Одновременно с этим происходят и некоторые другие информационные изменения, в том числе сдвиг Е- и F-спиралей (рис. 15.1). Основная перестройка происходит в четвертичной структуре гемоглобина — а1 и ß1 цепи поворачиваются как единое целое относительно а2- и ß2 -цепей. В результате всех этих изменений в оксигемоглобине оказывается меньше солевых мостиков, чем в дезоксигемоглобине.
Связывание кислорода миоглобином и гемоглобином можно описать с помощью кривых связывания, представленных на рис. 15.3. Степень оксигенации гемогрупп зависит от концентрации присутствующего в среде кислорода (на графике концентрация кислорода выражена в виде его парциального давления). Для миоглобина график представляет собой гиперболу, что и следует ожидать при простом одноэтапном связывании. Однако в случае гемоглобина график имеет S-образную форму; это говорит о наличии эффекта положительной кооперативности, т. е. о том, что после оксигенации одной или большего числа субъединиц сродство остальных субъединиц к кислороду возрастает.
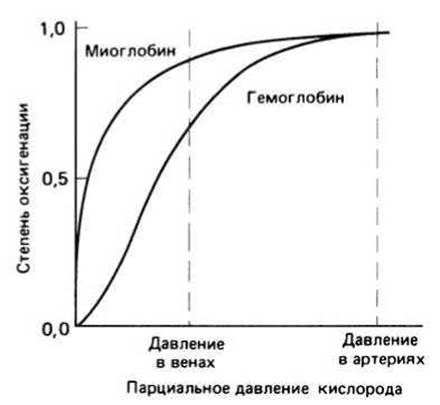
Рис. 5.3.
S-образность кривой связывания кислорода гемоглобином объясняет, каким образом в тканях происходит освобождение кислорода из этого белка. Уменьшение парциального давления кислорода при переходе от артерий к венам приводит к снижению степени оксигенации от почти 100% до примерно 75%. Кислород, диссоциировавший из комплекса с гемоглобином в венах, подхватывается миоглобином, имеющим к нему большее сродство.
Кооперативные эффекты связывания кислорода гемоглобином можно объяснить в рамках симметричной модели Моно, Уаймена и Шанжё (гл. 13). Действительно, как и предполагается в модели, гемоглобин может находиться в двух состояниях, различающихся взаимным расположением субъединиц и числом межсубъединичных контактов. Структура белка в одном из состояний соответствует структуре дезоксигемоглобина, а в другом — структуре оксигемоглобина. В первом состоянии белок обладает меньшим сродством к кислороду и имеет больше солевых мостиков и водородных связей, чем во втором. Согласно модели Моно, Уаймена и Шанжё, первое состяние гемоглобина — это Т-форма (tense-state), а второе — R-форма белка (relaxed-state).
Положение равновесия между T- и R-формами зависит от концентрации кислорода — чем она выше, тем в большей степени равновесие сдвинуто в сторону R- формы. Пусть какая-то молекулы гемоглобина не связана с кислородом и при этом находится в Т-состоянии. Связывание молекулы кислорода одной из цепей вызывает информационные изменения в гемогруппе этой цепи и далее во всей субъединице. Эти изменения увеличивают вероятность перехода всей молекулы гемоглобина из Т- в R-состояние. Связывание второй и третьей молекул кислорода еще больше увеличивает эту вероятность. Оказавшись в R-форме, гемоглобин еще легче связывает последнюю, четвертую молекулу кислорода. В результате гораздо более вероятно, что молекула гемоглобина не будет связывать ни одной или связывать четыре молекулы кислорода, чем какое-либо промежуточное их число.
Эффект Бора, заключающийся в высвобождении протонов при присоединении кислорода к гемоглобину, очень важен для транспорта углекислого газа из тканей к легким.
Дифосфоглицерат(ДФГ), обнаруживаемый в эритроцитах, участвует в регуляции процесса присоединения кислорода к гемоглобину. ДФГ легко образует комплекс с дезоксигемоглобином, связываясь в щели между двумя ß-цепями, но обладает низким сродством к оксигемоглобину. Поэтому присутствие ДФГ в высоких концентрациях уменьшает сродство гемоглобина к кислороду и вызывает высвобождение кислорода в ткани.
Гемоглобин плода человека (фетальный гемоглобин) отличается от гемоглобина взрослых тем, что в нем две ß-цепи заменены двумя у-цепями. Гемоглобин плода связывает ДФГ менее сильно, чем дезоксигемоглобин взрослых, и поэтому имеет более высокое сродство к кислороду. В результате, когда кровь плода обогащается кислородом за счет материнской крови, что имеет место в плаценте, кислород переходит от матери к плоду с высокой эффективностью.