Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Первичная структура белков
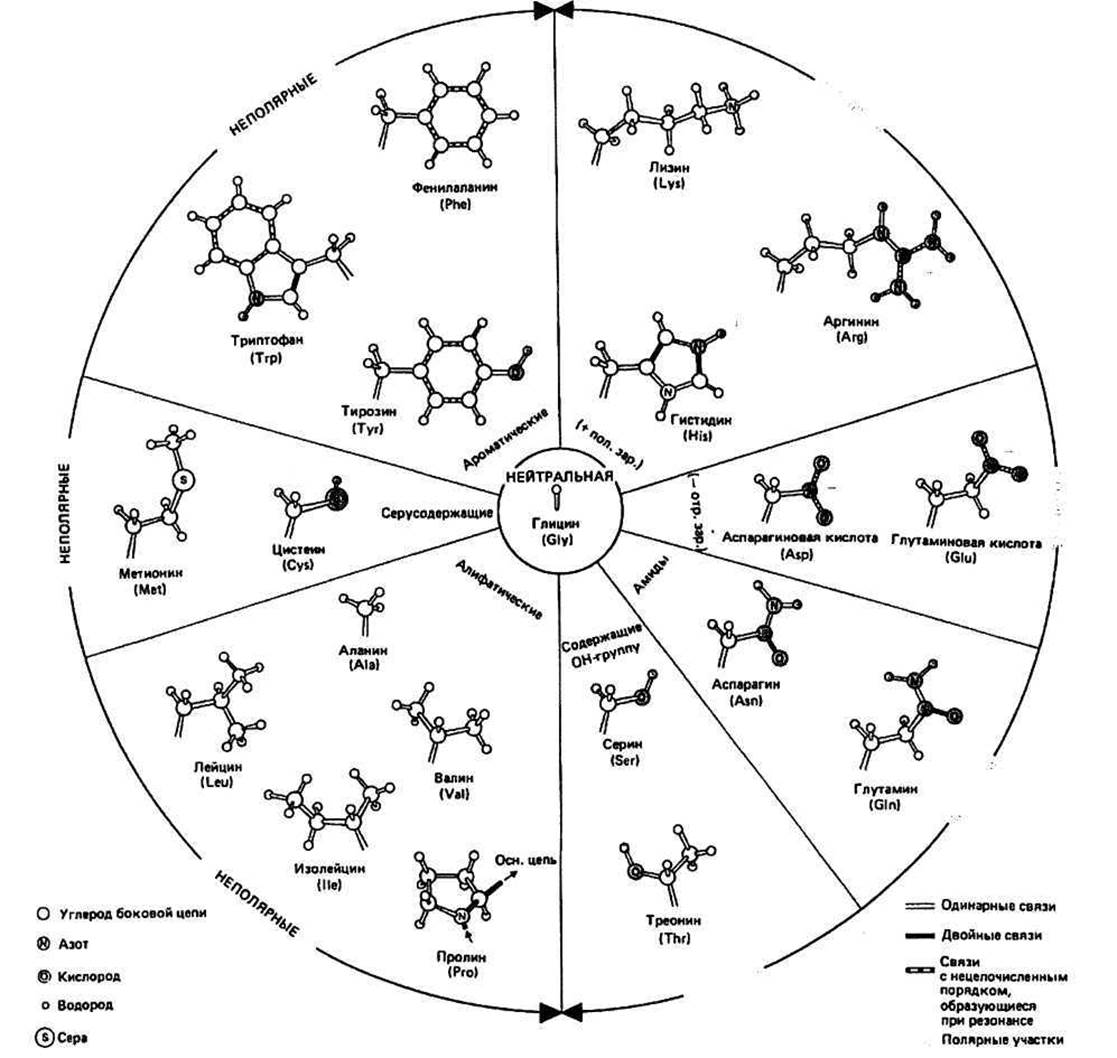
Рис. 6.1. Двадцать наиболее часто встречающихся боковых цепей.
Белки — один из основных классов биологических макромолекул. Широкий диапазон выполняемых ими функций находит отражение в огромном разнообразии их химических структур и пространственных форм. Глобулярные белки, которые в грубом приближении могут быть представлены в виде сфер, принимают участие в специфических процессах, таких как катализ (гл. 12, 13, 14), транспорт (гл. 15) или регуляция (гл. 28). Фибриллярные белки (гл. 11), например коллаген, кератины и фиброин шелка, сильно вытянуты и из-за присущей им эластичности или жесткости часто играют структурную роль.
Четыре уровня структурной организации белков
При описании того или иного белка обычно пользуются терминами первичная, вторичная, третичная и четвертичная структура. Под первичной структурой понимают химическую формулу белка, изображаемую в виде линейной последовательности аминокислотных остатков. Терминами вторичная, третичная и четвертичная структура обозначают различные уровни организации этой линейной последовательности в пространстве (гл. 9, 10).
Аминокислотные остатки, последовательно соединенные друг с другом, являются главными компонентами белков. Каждый остаток имеет константную (т. е. одинаковую для всех остатков) часть и, за исключением двух концевых остатков, связан с двумя другими таким образом, что формируется непрерывная, неразветвленная цепь, которая называется основной цепью белковой молекулы. К каждому ос-углеродному атому (сс-углероду, или С") основной цепи присоединены вариабельные части аминокислотных остатков (боковые, или R-группы). В белках, как правило, встречается 20 разных R-гpyпп.
Свободная аминокислота отличается от аминокислотного остатка наличием дополнительного атома водорода на одном конце (а следовательно, присутствием аминогруппы —NH2) и дополнительной гидроксильной группы (—ОН) на другом конце (а следовательно, наличием — СООН, или карбоксильной группы) (рис. 6.2).
Пептидная связь образуется в результате реакции конденсации между аминогруппой одной свободной аминокислоты и карбоксильной группой другой (или между аминогруппой свободной аминокислоты и карбоксильным концом полипептида). При этом выделяется вода. Таким образом, свободные аминокислоты представляют собой мономеры, из которых путем поликонденсации строится полимер — молекула белка. Полипептидная связь синтезируется в результате повторяющихся актов образования пептидной связи.
На одном конце цепи находится свободная —NH2-группа (это N-конец), а на другом — свободная —СООН-группа (это С-конец).
Аминокислотной последовательностью называется порядок расположения остатков вдоль полипептидной цепи. Обычно в белковых молекулах насчитывается 40 или более остатков, хотя встречаются полипептиды, состоящие из 1000 и более аминокислотных остатков. Значительная вариабельность последовательностей обеспечивает большое разнообразие структур и функций белков. Поскольку полипептиды построены в основном из 20 разных аминокислот, для белка, содержащего 100 остатков, возможно 20100 (т. е. примерно 10130) различных вариантов последовательности. Классификация боковых групп основана на различии их свойств в обычных физиологических условиях, т. е. при рН около 7. Полярные отрицательно заряженные — Asp" и Glir — имеют отрицательно заряженную СОО- группу. Будучи в СООН- (т. е. в протонированной) форме, они могут вести себя как кислоты. Полярные положительно заряженные — Arg+, His+ и Lys+ — несут положительный заряд вследствие протонирования атома азота. В депротонированной форме они могут проявлять свойства оснований. У полярных незаряженных — Asn, Gin, Ser и Thr — имеются поляризованные ковалентные связи и, следовательно, электроотрицательные и электроположительные участки. Неполярные, или гидрофобные, — Ala, Cys, He, Leu, Met, Phe, Pro, Trp, Туг и Val — содержат объемные алифатические или ароматические углеводородные цепи. Гидрофобные свойства Cys, Trp и Туг слегка ослабляются из-за наличия полярных групп (—SH, >NH и —ОН соответственно). Нейтральные остатки представлены одним Gly, боковая группа которого — атом водорода.
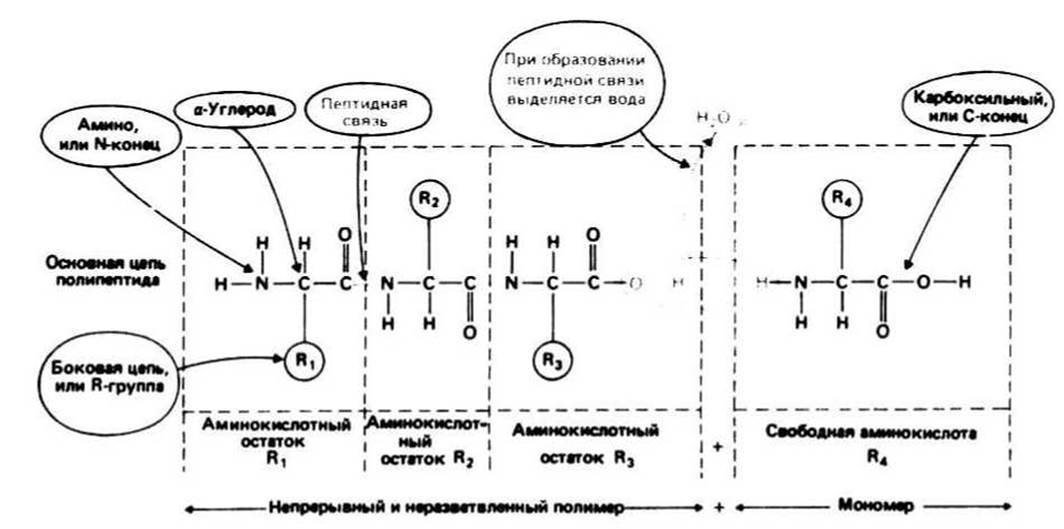
Рис. 6.2.
Дисульфидным мостиком называется ковалентная связь, соединяющая либо две части одной и той же полипептидной цепи, либо два разных полипептида. Дисульфидный мостик образуется при окислении двух остатков цистеина (т. е. при отщеплении водорода от двух реакционноспособных сульфгидрильных групп —SH). Новый остаток носит название цистин.
Пролин — необычный остаток, поскольку один конец его боковой группы ковалентно связан с Са-атомом, а другой - с N-атомом основной цепи того же остатка, в результате чего образуется кольцо.
Стереоизомерия характерна для всех аминокислот, за исключением Gly. Асимметричным является Сватом, так как с ним связаны четыре разные химические группы. В этом случае для каждой аминокислоты существуют две возможные конфигурации, известные под названием D- и L- форм (их называют также энан-тиомерами или стереоизомерами). Раствор одного из стереоизомеров поворачивает плоскость поляризации света в одном направлении, а раствор другого — в противоположном. Этот эффект носит название оптической активности. В белках встречаются только L-изомеры. Чтобы различить D- и L-конфигурации, нужно посмотреть в направлении от атома водорода к Сжатому и «прочесть» по часовой стрелке три оставшиеся при Са-атоме группы — тогда в случае L-формы группы СО, R и N составят слово CORN. Боковые группы Thr и Не имеют дополнительный оптический центр — Р- углеродный атом, связанный с ос-углеродом основной цепи.
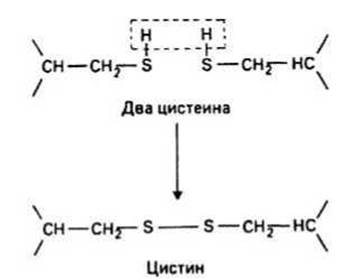
Рис. 6.3.
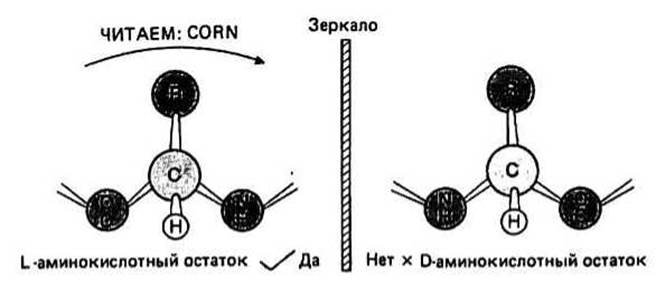
Рис. 6.4.