Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Энергия и силы
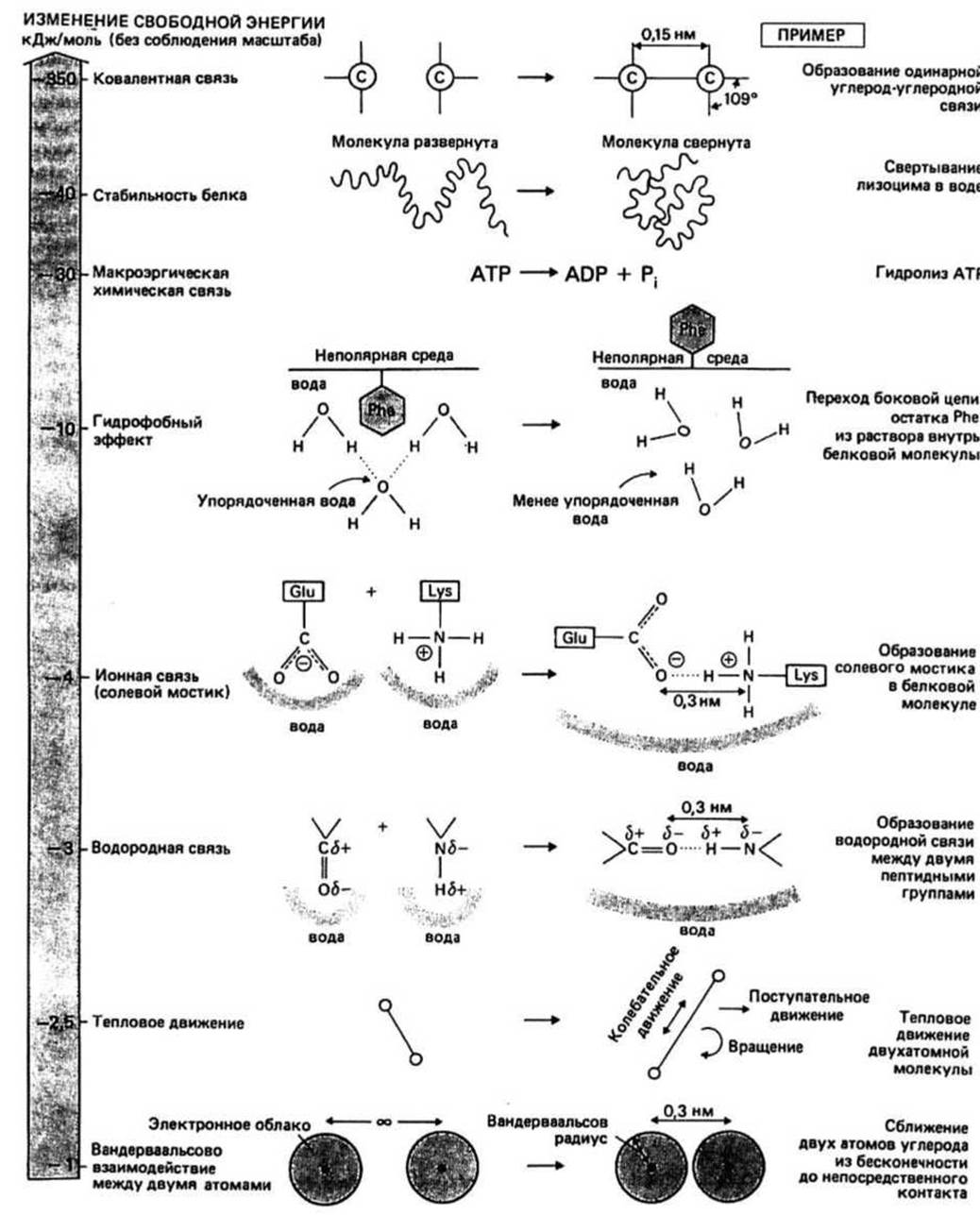
Рис. 7.1.
Свободная энергия — это величина, которую можно определить как ту часть внутренней энергии химической системы, за счет которой может совершаться работа над окружающей средой. Чтобы выяснить, будет ли данный процесс идти самопроизвольно, находят изменение свободной энергии (общепринятое ее обозначение ∆G) между конечным и начальным состояниями рассматриваемой системы (∆G = Gконечн — Gначалье). Если ∆G - отрицательная величина, система будет совершать работу самопроизвольно (подобно грузу, поднятому на некоторую высоту и готовому упасть); если же ∆G > 0, система не будет совершать работу без дополнительного притока энергии извне. Когда ∆G = 0, система находится в состоянии термодинамического равновесия. AG измеряется в джоулях (или килоджоулях) на моль вещества (Дж/моль или кДж/моль).
∆G =∆Н - T∆S— соотношение, указывающее на наличие двух составляющих ∆G при постоянной температуре T (по шкале абсолютных температур Кельвина). Одна из них — это изменение энтальпии (∆H), которое можно приравнять изменению потенциальной энергии рассматриваемой системы: этот параметр связан с энергетическим состоянием молекул в данной химической системе. Другой параметр — изменение энтропии (∆S) - с точностью до множителя T является мерой энергии, которую нельзя использовать для совершения полезной работы. Сама энтропия (S) возрастает с увеличением беспорядка в системе и является мерой ее неупорядоченности. Таким образом, ∆S - величина положительная, если система становится менее упорядоченной (гл. 44).
∆G° химической реакции называется стандартным изменением свободной энергии и представляет собой такое значение ∆G, когда концентрация каждого из исходных реагирующих веществ до начала реакции составляет 1 моль ∙ л-1; при этом все реагенты, включая продукты реакции, находятся в стандартных условиях. Для реакции, протекающей в стандартных условиях, ∆G° связано с константой равновесия K’ соотношением ∆G° = — RTlnK’ где R — универсальная газовая постоянная, Т — абсолютная температура. Биохимики часто пользуются несколько модифицированной формой AG°, которая обозначается символом ∆G°'(ra. 44).
Ковалентная связь— это химическая связь между атомами в молекуле. Связывание осуществляется путем обобществления электронов, принадлежавших одному или нескольким атомам. Ковалентные связи относятся к прочным связям: AG их образования составляет примерно -300т - 400 кДж/моль. Чтобы столь большая энергия не растрачивалась впустую, любой биохимический процесс организован так, что разрыв какой-либо ковалентной связи неизменно энергетически сопряжен с образованием другой ковалентной связи.
Аденозинтрифосфат (АТФ) служит источником энергии для очень многих биохимических реакций.
Его строение описано в гл. 17. В связях —Р—О—Р— запасена значительная энергия. Отщепление концевой (в данном случае у-) фосфатной группы посредством гидролиза с образованием аденозиндифосфата (ADP) и неорганического фосфата (Psi) характеризуется ∆G° = —30 кДж/моль:
АТР ↔ ADP + Рі
Примерно такое же количество энергии высвобождается и при отщеплении второго (т. е. (3-) фосфата. Вся эта энергия может пойти на обеспечение какой-нибудь биохимической реакции, в том числе такой, которая не протекает самопроизвольно в обычных условиях. Рассмотрим реакцию типа X ± Y, для которой ∆G° составляет, скажем, +20 кДж/моль. Если превращение X в Y сопряжено с гидролизом АТР, то суммарная реакция будет иметь вид
АТР + X ↔ ADP + Pi + Y,
и для нее ∆G°≈ (—30 + 20) кДж/моль = —10 кДж/моль, т. е. в стандартных условиях реакция будет идти самопроизвольно.
Нековалентный тип связи относится к взаимодействию между атомами, не связанными ковалентно друг с другом. Эти взаимодействия будут рассмотрены нами в дальнейшем на примере структуры белка, однако они встречаются и в других биологических молекулах. Поскольку нековалентные взаимодействия происходят не в вакууме, а в растворе, при их оценке необходимо учитывать влияние растворителя.
Стабильность свернутой молекулы белка в растворе относительно такого состояния белка, когда его цепь развернута, составляет обычно около —40 кДж/моль (например, для молекулы лизоцима). Это означает, что при переходе каждого моля лизоцима из развернутого состояния в свернутое высвобождается 40 кДж энергии.
Электростатические эффекты составляют значительную часть энтальпийного вклада нековалентных взаимодействий в А (7. Разноименные заряды притягиваются друг к другу; для них, таким образом, энергетически выгодно сближение. Согласно закону Кулона, энергия взаимодействия между двумя зарядами q1 и q2, удаленными друг от друга на расстояние г, прямо пропорциональна отношению
q1q2/εr,
где е — диэлектрическая проницаемость соответствующей среды (е служит мерой способности данной среды экранировать заряженные атомы). В вакууме е=1, внутри молекулы белка она равна примерно 4, а в воде е = 80. Пользуясь законом Кулона, можно показать, что сближение положительного и отрицательного элементарных зарядов из бесконечности до расстояния 0,3 нм сопровождается термодинамически выгодным изменением свободной энергии, равным примерно —500 кДж/моль в вакууме, —125 кДж/моль внутри белковой молекулы и —6 кДж/моль в воде.
Ионная связь, (соленой мостик) образуется при сильном сближении (0,3 нм) двух атомов с разноименными зарядами. В самой белковой молекуле группа —СОО- боковой цепи остатка глутаминовой кислоты и группа —NH+3 боковой цепи остатка лизина могут взаимодействовать между собой подобно низкомолекулярным ионам соли, образуя солевой мостик. Если, однако, такого мостика не образуется, боковые цепи могут взаимодействовать с растворителем; при этом свободная энергия системы также убывает. Поэтому образование солевого мостика, хотя и выгодно термодинамически, характеризуется ∆С, составляющим всего лишь около —4 кДж/моль, что гораздо меньше величины, следующей из закона Кулона.
Водородные связи. Когда атом водорода связывается с электроотрицательным атомом типа кислорода или азота, происходит смещение электронов, приводящее к появлению дробного положительного заряда (обозначаемого δ+) на атоме водорода и дробного отрицательного заряда (обозначаемого δ-) на его партнере. При этом образуется электрический диполь, который может взаимодействовать с другими диполями. Связь такого типа называется водородной. В молекулах белка группы >N—H и >С=О основной цепи часто участвуют в образовании водородных связей. ∆G образования водородной связи в вакууме составляет примерно — 20 кДж/моль. Но те же группы >N—Н и >С=О белковой молекулы могли бы взаимодействовать с окружающими их молекулами воды, что также термодинамически выгодно, поэтому величина ∆G образования водородной связи в молекуле белка составляет около —3 кДж/моль.
Вандерваальсовы силы заставляют атомы притягиваться друг к другу Такие силы притяжения между атомами возникают, в частности, из-за наличия взаимодействий между флуктуирующими электрическими диполями, образуемыми электронным облаком и положительным ядром каждого атома. Однако два атома могут сближаться лишь до тех пор, пока их электронные облака не начнут перекрываться; дальнейшее сближение приводит к возникновению сильного отталкивания. Энергия такого взаимодействия описывается выражением
А/r12 - В/r6
где А и В — постоянные, зависящие от рода атомов. Таким образом, ввиду конкуренции двух взаимно противоположных эффектов — эффекта притяжения (— В/r6) и эффекта отталкивания (А/r12) — естественно предположить, что существует какое-то оптимальное (равновесное) расстояние между двумя атомам. Это приводит к понятию эффективного радиуса атома, называемого обычно вандерваальсовым.
Структура воды вокруг молекулы заметно сказывается на энтропии системы. Обычно молекулы воды движутся в растворе и вступают во взаимодействие друг с другом путем образования и разрыва водородных связей. Когда же молекулам воды приходится принимать достаточно жесткую конфигурацию, подобную структуре льда, упорядоченность возрастает, что термодинамически невыгодно из-за убывания энтропии.
Гидрофобный эффект — это тенденция неполярных групп ассоциировать друг с другом, чтобы избежать контакта с водой. В результате такой ассоциации происходит нарушение структуры воды, вследствие чего энтропия системы возрастает. Выражение неполярный характер имеют алифатические и ароматические боковые цепи аминокислотных остатков белков (гл. 6) и основания нуклеиновых кислот (гл. 17).
Тепловое движение — это хаотическое движение атомов и молекул, определяющее температуру системы. Доля (/) молекул, у которых тепловая энергия больше некоторого произвольно взятого значения Е, дается уравнением Больцмана:
f = exp (-E/RT),
где R — универсальная газовая постоянная, Т — абсолютная температура. Таким образом, доля молекул с энергией, большей RT (= 2,5 кДж/моль при комнатной температуре), равна ехр(—1), или 0,37. Поэтому энергия связей должна превышать 2,5 кДж/моль, иначе они будут легко рваться и вновь образовываться в результате теплового движения. Таким образом, связи, обусловленные вандерваальсовыми силами, а иногда и водородные связи и солевые мостики, непрерывно рвутся и снова восстанавливаются.