Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Мембранные белки
Строение трансмембранных доменов
Трансмембранные а-спирали. У водорастворимых белков обнаружены сотни определённых белковых мотивов (или повторов). В отличие от них количество "стандартных" мотивов в интегральных мембранных белках достаточно невелико. Чаще других встречается трансмембранная а-спираль.
Интегральные белки, содержащие трансмембранные а-спиральные домены, удерживаются в мембране благодаря гидрофобному взаимодействию со специфическими липидами, а также, возможно, ионному взаимодействию с полярными головками фосфолипидов.
Наглядным примером такого рода белков является гликопротеин А, основной белок плазматической мембраны эритроцитов. Его трансмембранным доменом является одна а-спираль (рисунок 36).
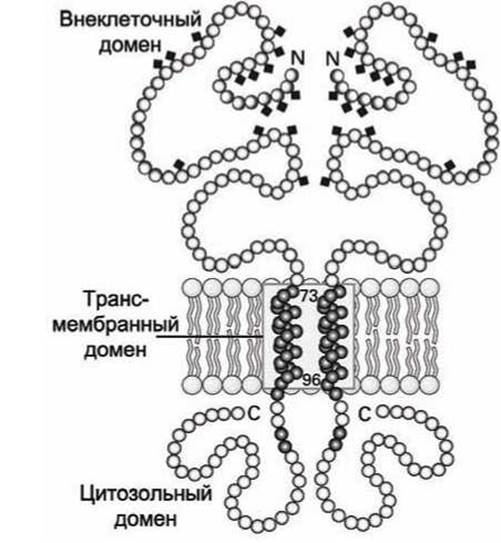
Рисунок 36 - Схема димера гликопротеин А
Обычно трансмембранная а-спираль состоит из 20-25 гидрофобных аминокислот. У гликопротеина А трансмембранная а-спираль состоит из 23 аминокислот. Длина такой спирали составляет порядка 3,75 нм, что хороню согласуется с данными о толщине липидного бислоя.
В а-спирали гидрофобные аминокислотные радикалы ориентированы наружу и взаимодействуют с гидрофобным липидным окружением, а карбонильные (С=0) и имино-(NH) группы, которые формируют внутри-спиральные водородные связи, расположены внутри а-спирали и экранированы от липидной среды аминокислотными остатками. Энергетически выгодно двум гликопротеинам А образовать димер за счёт формирования мотива "скрученная спираль" (coiled-coil) трансмембранными спиралями.
Такая димеризация белков за счёт формирования скрученных спиралей является распространённым явлением. Например, многие мембранные рецепторы активируются только после димеризации.
Существует обширное "семейство" (более 150) интегральных мембранных белков, характеризующихся наличием семи трансмембранных а-спиралей. К таким "семиспиральным" многопроходным белкам относятся G-протеин-связанные рецепторы, играющие ключевую роль в клеточной сигнализации.
Общие принципы построения белков этого семейства иллюстрирует структура бактериородопсина (рисунок 37), который выполняет функцию фоторецептора в определённых бактериях.
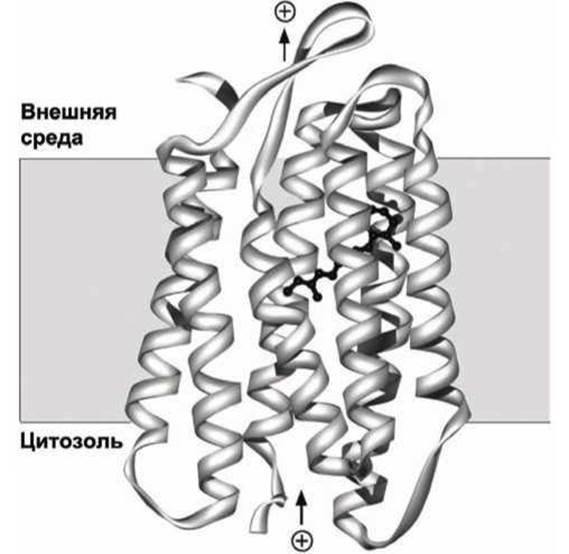
Рисунок 37 - Схема бактериородопсина. Молекула ретиналя изображена чёрным цветом
К одной из трансмембранных а-спиралей ковалентно присоединена молекула ретиналя. В результате поглощения кванта света молекула ретиналя изменяет конформацию (рисунок 38), что стимулирует конформационный переход в белковой молекуле, в результате чего происходит транслокация одного протона из цитозоля через мембрану во внеклеточное пространство.
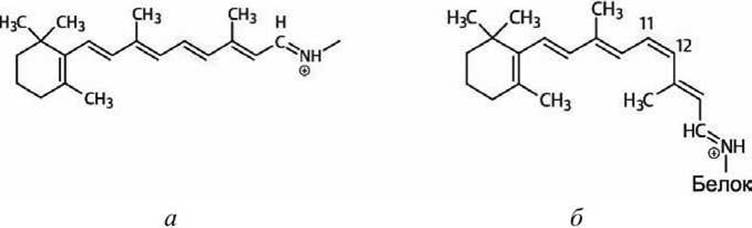
Рисунок 38 - Конформации молекулы ретиналя: а - полностью-транс-ретиналь, б-1 цис-ретиналь
Бактериородопсин работает как протонный насос, создавая за счёт энергии света градиент концентрации протонов на мембране. Этот протонный градиент используется затем для синтеза АТФ мембранными F0F1комплексами (АТФ-синтазами). Экспериментальное определение атомной структуры трансмембранного домена показало, что, действительно, практически все аминокислоты на периферии трансмембранного домена бактериородопсина являются гидрофобными и взаимодействуют с углеводородной внутренней частью липидного бислоя.
Другим важным классом интегральных мембранных белков являются ионные каналы, структура и функции которых будут подробно рассмотрены в гл. 13.
Ионные каналы являются преимущественно тетрамерными белками. Каждая из четырёх субъединиц имеет как минимум две трансмембранные а-спирали, а все вместе а-спирали всех субъединиц формируют селективный водный канал, который пропускает только ионы данного типа.
Аминокислоты, которые "выстилают" этот канал, являются полярными и гидрофильными, а периферические аминокислоты трансмембранного домена ионного канала, так же как и в случае бактериородопсина, являются гидрофобными.
Во многих ионных каналах воздействие внешних факторов, таких как связывание с лигандом, изменение мембранного потенциала, механическое воздействие, приводит к изменению взаимного расположения а-спиралей, что используется для регулировки потока ионов через мембрану.
Трансмембранные ß-структуры. Класс интегральных белков порины радикальным образом отличается от рассмотренных выше трансмембранных белков (рисунок 39, 40).
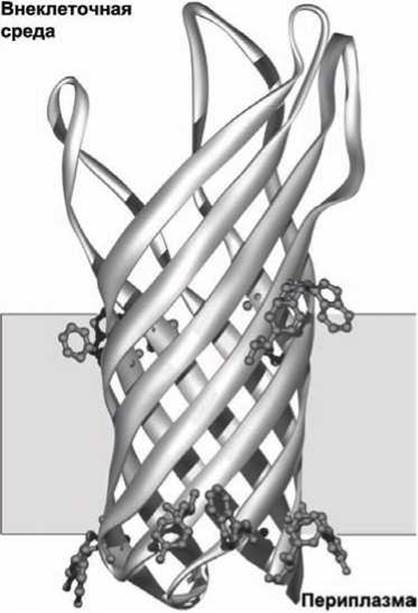
Рисунок 39 - Схема субъединицы порина ОmрХ клеточной стенки Е. coli
Несколько типов поринов обнаружены как в наружной клеточной стенке грамм-отрицательных бактерий, таких как is. coli, так и во внешних мембранах митохондрий и хлоропластов. Клеточная стенка защищает кишечные бактерии от опасных внешних факторов (например, от антибиотиков, солей желчных кислот, протеаз), но она проницаема для малых водорастворимых молекул: пропускает внутрь питательные вещества, а наружу - продукты жизнедеятельности бактерии. Порины в клеточной стенке Е. coli (рисунок 39) пропускают внутрь дисахариды и фосфаты.
Полипептидные последовательности поринов состоят преимущественно из полярных аминокислот и не содержат сплошных гидрофобных сегментов, которые характерны для интегральных белков с трансмембранными а-спиралями.
Порины являются тримерными белками, состоящими из трёх идентичных субъединиц. Каждая из субъединиц образована шестнадцатью ß-структурами, которые формируют цилиндрическую конструкцию с каналом по центру (рисунок 39). В отличие от обычных водорастворимых глобулярных белков у порина гидрофобная наружная поверхность и гидрофильная внутренняя часть цилиндра, в этом смысле порины представляют собой "вывернутые наизнанку" глобулярные белки. В мономере порина в каждой из ß-структур наружу ориентированы гидрофобные аминокислотные остатки, которые все вместе образуют гидрофобный пояс, опоясывающий белковый мономер по периметру.
Аминокислотные остатки, которые ориентированы внутрь канала являются преимущественно гидрофильными, они выстилают пору, через которую малые водорастворимые молекулы могут проходить через мембрану. Две цепочки ароматических (содержащих углеродные циклы) аминокислот, показанных на рисунке 39, и алифатические (нециклические) аминокислоты в составе ß-структур помогают правильно ориентировать порин в мембране.
На рисунке 40 представлена схема ещё одного бактериального порина, находящегося в наружной мембране бактерии Rhodopseudomonas blastica. Этот порин построен из шестнадцати ß-форм вторичных структурных сегментов полипептидной белковой цепи, которые образуют цилиндрическую пору - пассивный канал во внешней мембране бактерии. Пора проходит по оси такого цилиндра.
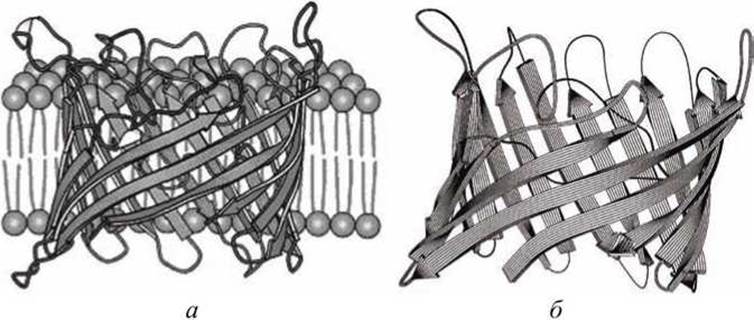
Рисунок 40 - Структура бактериального порина Rhodopseudomonas blastica: а - интегрированный в биомембрану порин, б - пространственное расположение шестнадцати ß-форм вторичных структурных сегментов белковой цепи порина
Плазматические мембраны животных клеток содержат водные каналы, которые называются аквапорины. Подобно большинству интегральных мембранных белков аквапорины имеют множественные трансмембранные а-спирали. Поэтому, несмотря на своё название, аквапорины отличаются от поринов как по структуре, так и функционально - они пропускают через себя только молекулы воды.