Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Мембранные белки
Взаимодействие белков с мембраной и цитоскелетом
Липид-связанные белки и углеводородные якоря. В эукариотических клетках определённые ковалентно присоединённые липиды фиксируют ("ставят на якорь" (anchor), "заякоривают") некоторые белки на одной из поверхностей плазматической мембраны или на определённых внутриклеточных мембранах. У таких белков, которые поставлены на липофильный якорь, липидная углеводородная цепь погружена в липидный бислой, но сам белок не погружается в мембрану.
Мембранными якорями являются жирные кислоты (ацильные остатки пальмитиновой (С16) или миристиновой (С14) кислоты) или изопреноиды (пренильные остатки фарнезол (С15) или геранилгераниол (С10)). Кроме того, используется гликозилированный фосфатидилинозитол (glycosylphosphatidylinositol, GPI) (рисунок 41).
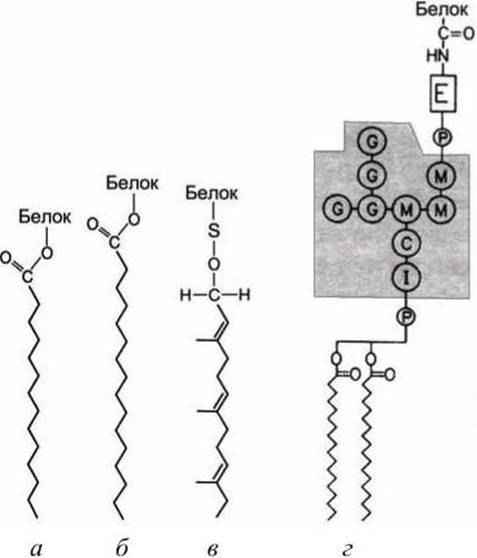
Рисунок 41 - Липофильные якоря: а - миристиновый; б - пальмитиновый; в - фарнезольный; г - GPI-якорь. Серыми кружками обозначены: I - инозит; М - манноза; С - N-ацетилглюкозамин; G - галактоза; Е - этаноламин
По типу используемых липофильных якорей липид-связанные белки разделяют на три группы.
1. Цитозольные белки первой группы присоединяют к глицину (Gly) на N-конце белковой цепи жирнокислотную ацильную группу (например, миристат или пальмитат), которая и погружается в липидный монослой на цитозольной стороне плазматической мембраны (рисунок 42, ацилирование). Связывание белков первой группы может играть важную роль в функционировании данного белка. Например, белок v-Src, мутантная форма тирозин-киназы, становится онкогеном и может трансформировать клетку, только если у него миристилирован (ацилирован) N-конец.
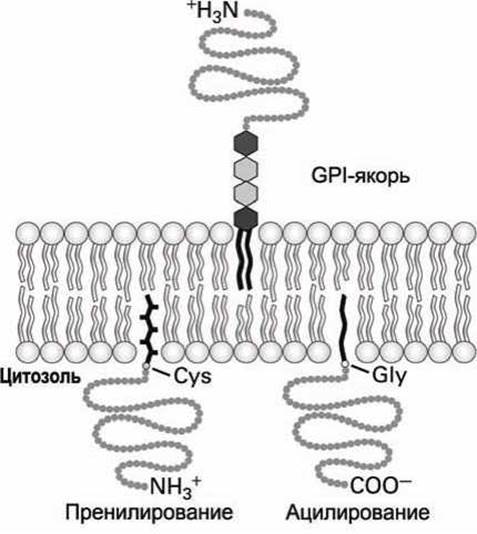
Рисунок 42 - Связывание белков на мембране с помощью липидных якорей
2. Цитозольные белки второй группы фиксируются на цитозольной стороне мембраны с помощью ненасыщенной жирнокислотной ацильной группы (изопреноидной цепи), которая присоединена к цистеину (Cys) белка на (или вблизи) С-конца (рисунок 39, пренилирование).
В этих белках фарнезол (С15) или геранилгераниол (С20) связываются тиоэфирной связью с тиольной (-SH) группой цистеина. Эти пренильные якоря синтезируются из изопрена.
В некоторых случаях, для того, чтобы упрочнить связь белка с мембраной, к соседнему цистеину белка присоединяется вторая геранилгеранильная или пальмитатная группа. Таким двойным якорем, например, удерживается на цитозольной стороне плазматической мембраны сигнальный ГТФазный белок Ras. Другой пример использования двойного якоря - связывание на цитозольной стороне мембран внутриклеточных везикул ГТФазного белка Rab, который участвует в процессе слияния мембран.
3. Некоторые поверхностные белки клетки и сильно гликозилированные протеогликаны внеклеточного матрикса связываются с экзоплазматической стороной плазматической мембраны липофильным якорем третьего типа - гликофосфатидилинозитолом (GPI-якорь) (рисунок 42). Точная структура GPI-якоря варьируется в широких пределах в клетках разного типа, но в нем обязательно есть фосфатидилинозитол (PI), чьи два жирнокислотных хвоста и встраиваются в мембрану, фосфоэтаноламин, который ковалентно присоединяет якорь к С-концу белка и несколько сахарных остатков. Один из примеров организации GPI-якоря приведён на рисунке 41.
В целом ряде экспериментов было доказано, что наличие GPI-якоря является необходимым и достаточным условием для связывания белка с мембраной. Например, фермент фосфолипаза С (рисунок 28) разрезает связь фосфат-глицерол и в фосфолипидах, и в GPI-якорях. Обработка клеток фосфолипазой С приводит к отделению с поверхности клеток таких GPI-заякоренных белков, как Thy-І и PLAP (рисунок 33).
Как отмечалось выше, PLAP концентрируется на более упорядоченных мембранных островковых микродоменах, обогащённых сфинголипидами и холестеролом (рисунок 33). Хотя PLAP и другие GPI-заякоренные белки расположены по другую сторону мембраны от ацил-заякоренных белков, оба типа мембранных белков концентрируются в липидных островках. В отличие от них пренилированные белки в липидных островках не обнаружены.
Асимметрия интегральных белков и гликолипидов. Липид-заякоренные белки являются одним из примеров мембранных белков, которые асимметрично локализованы по отношению к двум сторонам (цитозольной и экзоплазматической) клеточной мембраны.
Каждый класс трансмембранных белков также имеет особую ориентацию по отношению сторонам мембраны - есть части белковой молекулы, которые всегда ориентированы в цитозоль, и есть - которые всегда ориентированы в экзоплазматическое пространство. Такая асимметрия в ориентации относительно мембраны определяет отличие в свойствах мембранного белка по разные стороны от мембраны.
До сих пор не зарегистрирован ни один случай флип-флопа интегральных белков. Поэтому такая асимметрия мембранного белка, которая возникает сразу после его синтеза на мембранах эндоплазматического ретикулума, сохраняется на протяжении всей жизни этого белка.
Многие белки содержат углеводные цепочки, ковалентно связанные с серинами, треонинами или аспарагинами белка. Такие гликопротеины ориентированы так, что углеводные цепи всегда расположены с экзоплазматической стороны (рисунки 35 и 36).
Аналогично и гликолипиды, в которых углеводные цепи, присоединённые к глицероловому или сфингозиновому основаниям, всегда расположены с экзоплазматической стороны мембраны, а углеводные цепочки торчат наружу от мембраны.
Особенно много гликопротеинов и гликолипидов на плазматической мембране эукариотических клеток. Но их нет на внутренней мембране митохондрии, на ламеллах хлоропластов, и на некоторых других внутриклеточных мембранах.
Поскольку углеводные цепи гликопротеинов и гликолипидов плазматической мембраны расположены в экзоплазматическом пространстве, с ними могут взаимодействовать компоненты внеклеточного матрикса, лектины (фитоагглютинины), факторы роста, антитела и другие внеклеточные образования.
Взаимодействие с цитоскелетом. Экспериментально было показано (см. например, рисунок 21), что многие интегральные и липид-связанные белки активно участвуют в быстрой латеральной диффузии вдоль мембраны. В зависимости от типа клетки от 30% до 90% всех интегральных белков свободно диффундируют в плазматической мембране.
Скорость латеральной диффузии белков в чистом липидном бислое сравнима со скоростью диффузии липидов. Однако скорость диффузии белков в плазматической мембране живой клетки обычно в 10-30 раз ниже, чем скорость диффузии тех же белков в составе искусственной липосомы.
Такое снижение скорости диффузии мембранных белков в живой клетке объясняется их взаимодействием с неподвижным подмембранным цитоскелетом. Некоторые белки постоянно связаны с этой цитоскелетной сетью - эти белки совершенно неподвижны в мембране. Что же касается мобильных мембранных белков, то они тормозятся вследствие постоянного процесса разрыва и восстановления слабых нековалентных связей с подстилающим мембрану цитоскелетом в ходе диффузии белков вдоль мембраны.