Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Мембранные белки
Липид-связывающие мотивы
Периферические белки связываются с мембраной как посредством ассоциации с интегральными белками, так и непосредственно, связываясь с липидами бислоя (рисунок 35).
Сравнение генов различных периферических белков выявило наличие в их структуре нескольких характерных липид-связывающих мотивов, некоторые из которых перечислены в таблице 4.
Таблица 4 - Липид-связывающие мотивы
|
Мотив |
Лиганд |
Белки |
|
PH |
РIР2, РIР3 |
Фосфолипаза Сy1, протеин-киназа В, плекстрин (pleckstrin) |
|
С2 |
Кислотные фосфолипиды |
Протеин-киназа С, PI-3-киназа, фосфолипаза, PTEN-фосфолипаза |
|
Анкериновый повтор |
PS |
Анкерин (ankyrin) |
|
FERM |
РIР2 |
Белок полосы 4,1, эзрин (ezrin), радиксин (radixin), моэзин (moesin, ERM) |
В таблице производные фосфатидилинозитола обозначены РIР2 и РIР3 (рисунок 43), PI-3 обозначает фермент фосфатидилинозитол-3-киназа, PS - фосфатидилсерин, а PH - плекстриновую гомологию.
Так, например, плекстриновый гомологический (PH) домен, который связывает два типа фосфорилированных фосфатидилинозитолов (РIР2 и РIР3), является одиннадцатым из наиболее часто встречающихся белковых доменов в геноме человека. Этот домен был первоначально обнаружен в плекстрине - белке тромбоцитов.
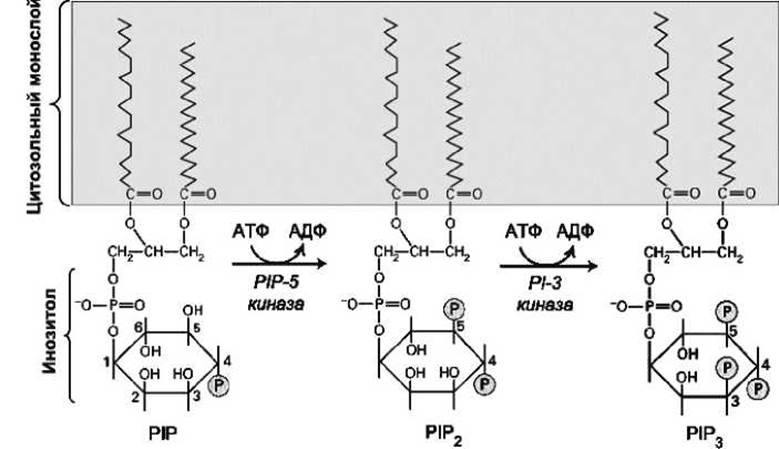
Рисунок 43 - Фосфорилированные производные фосфатидилинозитола (РІ): PIP - фосфатидилинозитол-4-фосфат, РIР2 - фосфатидилинозитол-4,5-бисфосфат, РІР3- фосфатидилинозитол-3,4,5-трисфосфат
Высокая частота, с которой этот мотив встречается в геноме человека, указывает на то, что локализованные вблизи мембраны белки выполняют много важных функций.
Другие характерные липид-связывающие мотивы: домен С2, домен анкеринового повтора и FERM-домен.
Домен С2, который первоначально бьл обнаружен в составе протеин-киназы С, является мембран-связывающим доменом у многих киназ, фосфатаз и фосфолипаз.
Фосфолипазы являются примером водорастворимых ферментов, которые активизируются в результате соединения с полярными головками мембранных фосфолипидов. Фосфолипазы гидролизуют различные межатомные связи в полярной головке (рисунок 28). Эти ферменты играют важную роль в процессах деградации повреждённых или ненужных клеточных мембран и являются активным веществом во многих змеиных ядах.
Механизм действия фосфолипазы А2 (рисунок 44) иллюстрирует процесс обратимого связывания водорастворимого фермента с мембраной и катализа реакций на границе между водным раствором и липидной фазой.
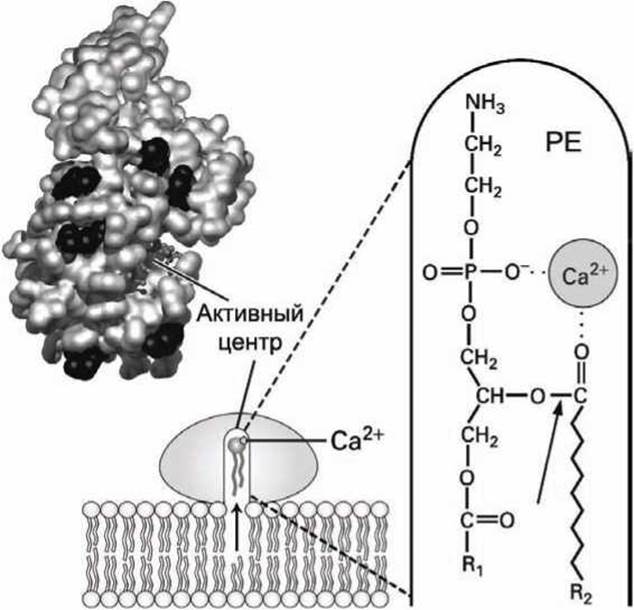
Рисунок 44 - Схема фосфолипазы A2. Стрелкой указана гидролизуемая связь
Находясь в водном растворе, активный центр фосфолипазы А2, содержащий ион Са2+, находится в теле фермента в глубине белкового каталитического канала, поверхность которого образована гидрофобными аминокислотами. Фермент имеет наибольшее сродство к бислою, состоящему из отрицательно заряженных фосфолипидов, например, из фосфотидилэтаноламинов. Такое сродство обеспечивают положительно заряженные лизины и аргинины, которые окружают вход в каталитический канал фосфолипазы А2 (обозначены черным цветом на рисунке 44). Электростатическое связывание фосфолипазы А2 с мембраной индуцирует конформационное изменение в белковой глобуле, которое фиксирует фермент на головках фосфолипидов и открывает гидрофобный канал.
В результате тепловой диффузии фосфолипид заходит из бислоя в канал, где он, благодаря электростатическому взаимодействию отрицательно заряженных групп головки фосфолипида с ионом Са2+, связывается в активном центре фермента и правильно ориентирует атакуемую связь (показана стрелкой на рисунке) относительно каталитически активных аминокислот фосфолипазы А2.
Контрольные вопросы и задания
1. Какие белки называют мембранными?
2. Какие выделяют три типа мембранных белков?
3. Из каких структурных частей состоят интегральные мембранные белки?
4. Какие элементы вторичной структуры содержат трансмембранные домены интегральных белков?
5. Как присоединяются к мембране липид-связанные мембранные белки?
6. Как связываются с мембраной периферические мембранные белки?
7. Какие особенности строения трансмембранных а-спиралей интегральных мембранных белков?
8. В чём состоит преимущество димеризации трансмембранных а-спиралей двух молекул гликопротеина А?
9. Как строение трансмембранного домена бактериородопсина определяет функциональные свойства этого белка?
10. Какова роль трансмембранных а-спиралей в функционировании ионных каналов?
11. В чём отличие строения трансмембранных доменов интегральных мембранных белков поринов от других мембранных белков?
12. Какие функциональные группы называют липофильными якорями?
13. На какие три группы разделяют липид-связанные белки по типу используемых липофильных якорей?
14. В чём заключается асимметрия интегральных белков и гликолипидов?
15. В чём причина низкой скорости диффузии мембранных белков по сравнению со скоростью диффузии молекул липидов в биомембранах?
16. Какова функция липид-связывающих мотивов в структуре периферических мембранных белков?
17. Каким образом биомембраны активизируют водорастворимые ферменты фосфолипазы?