Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Пассивный трансмембранный транспорт
Облегчённая диффузия
Облегчённая диффузия в биологических мембранах происходит при участии молекул переносчиков. Разделяют облегчённую диффузию с помощью подвижных молекул переносчиков и с помощью неподвижных молекул-переносчиков, фиксированных определённым образом поперёк мембраны.
Примером подвижной молекулы-переносчика является - валиномицин [L-лактат - L-валин - D-окси-изовалериановая кислота - 0-валин]3 - подвижный переносчик ионов калия. Молекула валиномицина имеет форму манжетки, устланной внутри полярными группами, а снаружи неполярными (рисунок 53).
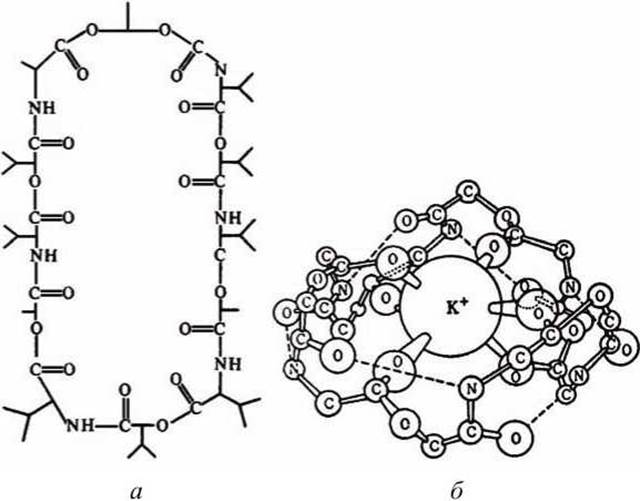
Рисунок 53 - Строение молекулы валиномицина: а - химическая формула, б - ван-дер-ваальсовая модель комплекса валиномицина с ионом калия
В силу особенности своего химического строения валиномицин, во-первых, способен образовывать комплекс с ионами калия, попадающими внутрь молекулы-манжетки (ион калия фиксируется в центре за счёт ион-дипольного взаимодействия с участием карбонильных групп пептида), и, во-вторых, валиномицин растворим в липидной фазе мембраны, так как снаружи его молекула неполярна. Молекулы валиномицина, оказавшиеся у поверхности мембраны, могут захватывать из окружающего раствора ионы калия. Диффундируя в мембране, молекулы переносят калий через мембрану, и некоторые из них отдают ионы в раствор по другую сторону мембраны.
Перенос калия валиномицином может происходить через мембрану в обе стороны. Поэтому, если концентрации калия по обе стороны мембраны одинаковы, поток калия в одну сторону будет такой же, что и в другую, и в результате переноса калия через мембрану не будет.
Но если с одной стороны концентрация калия больше, чем с другой, то поток калия в сторону уменьшения концентрации будет больше, чем в противоположную.
Облегчённая диффузия, таким образом, происходит от мест с большей концентрацией переносимого вещества к местам с меньшей концентрацией.
Облегчённой диффузией объясняется также перенос через биологические мембраны аминокислот, сахаров и других биологически важных веществ.
Выделяют четыре отличия облегчённой диффузии от простой.
1. Перенос вещества с участием переносчика происходит значительно быстрее.
2. Облегчённая диффузия обладает свойством насыщения (рисунок 54) - при увеличении концентрации с одной стороны мембраны плотность потока вещества возрастает лишь до некоторого предела, когда все молекулы переносчика уже заняты.
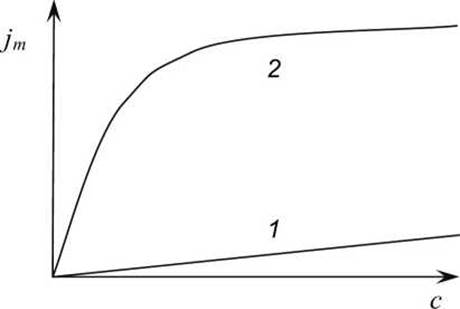
Рисунок 54 - Зависимость плотности потока jm веществ через биологическую мембрану в клетку в зависимости от концентраций с этих веществ во внеклеточной среде: 1 - при простой диффузии; 2 - при и облегчённой диффузии
3. При облегчённой диффузии наблюдается конкуренция переносимых веществ в тех случаях, когда переносчиком переносятся разные вещества; при этом одни вещества переносятся лучше, чем другие, и добавление одних веществ затрудняет транспорт других; так, из сахаров глюкоза переносится лучше, чем фруктоза, фруктоза лучше, чем ксилоза, а ксилоза лучше, чем арабиноза, и т. д.
4. Есть вещества, блокирующие облегчённую диффузию - они образуют прочный комплекс с молекулами переносчика, например, флоридзин подавляет транспорт сахаров через биологическую мембрану.
Если транспорт какого-либо вещества через биологическую мембрану обладает этими особенностями, можно предположить, что имеет место облегчённая диффузия.
Разновидностью облегчённой диффузии является транспорт с помощью неподвижных молекул-переносчиков, фиксированных определённым образом поперёк мембраны.
Трансмембранный транспорт глюкозы. Облегчённая диффузия глюкозы и других малых гидрофильных молекул через мембрану обеспечивается белками-унипортёрами.
Один из наиболее изученных унипортов это белок-транспортёр глюкозы GLUT1. Белки GLUT1 были выделены из мембран эритроцитов. Большинство клеток млекопитающих используют белки GLUT1 для доставки в цитозоль растворённой в крови глюкозы, экспрессируя соответствующий ген GLUT1.
Как и другие унипортёры, GLUT1 может принимать два конформационных состояния: в одном состоянии центр связывания глюкозы экспонирован наружу с экзоплазматической стороны мембраны, во втором состоянии центр связывания глюкозы экспонирован внутрь клетки с цитозольной стороны мембраны. На рисунке 55 представлен цикл работы такого глюкозного унипорта. Унипорт GLUT1 может также осуществлять транспорт глюкозы из цитозоля, если концентрация глюкозы в цитозоле выше, чем во внеклеточном пространстве.
В геноме человека обнаружено двенадцать генов, кодирующих гомологичные унипорты GLUT1— GLUT12, трансмембранные домены которых чрезвычайно подобны, и все они сформированы подобным образом из двенадцати трансмембранных а-спиралей, состоящих преимущественно из гидрофобных аминокислот. Однако некоторые а-спирали содержат в своём составе серин, аспарагин, треонин и глутамин, которые, участвуя в формировании водородных связей с гидроксильными группами глюкозы, формируют центры связывания глюкозы в унипортах.
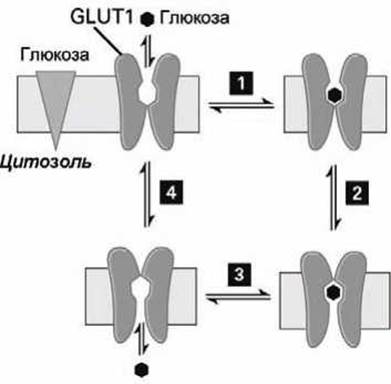
Рисунок 55 - Цикл работы унипорта-транспортёра глюкозы. Треугольником обозначен градиент концентрации глюкозы
Гены глюкозных унипортов экспрессируются в различных клетках различных тканей, и синтезированные унипорты отличаются эффективностью трансмембранного переноса глюкозы.
Так, например, GLUT2 экспрессируется в клетках печени (гепатоцитах) и в секретирующих инсулин ß-клетках поджелудочной железы, и эффективность переноса глюкозы унипортом GLUT2 в два раза выше, чем унипортом GLUT1 (который работает в мембранах эритроцитов). В гепатоцитах эта "избыточная" глюкоза преобразуется в гликоген, а в ß-клетках избыток глюкозы запускает механизм секреции в кровь гормона инсулина, который ещё более снижает концентрацию глюкозы в крови, стимулируя механизмы транспорта глюкозы в цитозоль клеток мускулатуры и ингибируя синтез глюкозы в печени.
Другая изоформа глюкозного унипорта - белок GLUT4 экспрессируется только в клетках жировой ткани и в мышечных клетках, а унипорт GLUT5 переносит фруктозу вместо глюкозы.
Функционирование транспортных белков возможно исследовать только в составе мембраны. Большинство клеточных мембран содержат слишком много различных интегральных белков, чтобы можно было изучать работу только одного из них. Для исследования белков-транспортёров используют два метода.
1. Методами генной инженерии значительно повышают уровень экспрессии данного белка-транспортёра и затем сравнивают скорость трансмембранного переноса соответствующего метаболита в исходной и в генетически модифицированной системах.
2. Экстрагируют и очищают исследуемый белок, а затем интегрируют его в чистый липидный бислой, например, в мембрану липосомы (рисунок 56).
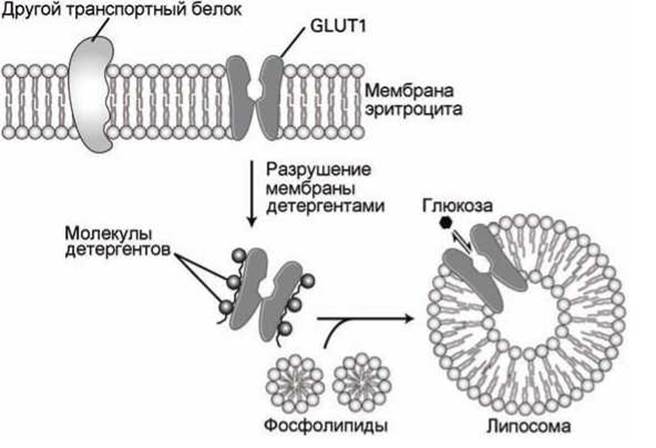
Рисунок 56 - Перенос транспортного белка GLUT1 из биомембраны в липосому