Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Пассивный трансмембранный транспорт
Поры в липидном бислое
Липидный бислой составляет основу любой клеточной мембраны. Непрерывность его определяет барьерные и механические свойства клетки. В процессе жизнедеятельности непрерывность бислоя может нарушаться с образованием структурных дефектов - сквозных гидрофильных пор. Образование таких пор оказывает влияние на все функции клеточной мембраны, связанные с её проницаемостью.
Кроме того, липидные поры являются активными участниками мембранных механизмов отклика клетки на стрессовые воздействия внешних сил.
Как в любом реальном кристалле, в пленке из фосфолипидов могут быть дефекты, в месте расположения которых и развиваются основные события структурных перестроек. Виды дефектов многообразны, но мы рассмотрим только один дефект бислоя - дефект типа сквозной гидрофильной поры (рисунок 57).
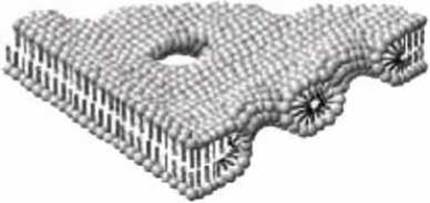
Рисунок 57 - Бислойная липидная мембрана с липидными порами
В бислойной липидной пленке клеточной мембраны поры появляются (если исключить чисто механические повреждения) в результате
1) тепловых флуктуации поверхности бислоя;
2) электрического пробоя;
3) замораживания пленки;
4) действия поверхностно-активных веществ;
5) осмотического давления;
6) перекисного окисления липидов.
Один из наиболее типичных и хорошо изученных примеров дестабилизации биологических мембран - гемолиз эритроцитов. Это явление включает на начальном этапе набухание клеток в гипотонической среде в результате действия сил осмотического давления. Во время набухания клетки мембрана растягивается, что обусловливает рост мембранного натяжения.
При определённом пороговом уровне натяжения появляются гидрофильные липидные поры. Размеры пор достаточны для выхода молекул гемоглобина и низкомолекулярных веществ. Это приводит к снижению разности осмотического давления, что в свою очередь вызывает уменьшение натяжения мембраны и поры залечиваются. Белки цитоскелета позволяют эритроциту сохранить форму, при этом образуется так называемая тень эритроцита. Тень сохраняет осмотическую активность, и таким образом процесс дестабилизации приобретает циклический характер.
При отсутствии цитоскелета или при его недостаточном развитии механическая прочность клетки целиком определяется судьбой липидных пор. Если пора имеет размер меньше критического, то она залечивается. В противном случае неограниченный рост поры приводит к разрушению мембраны.
Рассмотрим модель липидной поры (рисунок 58). Будем считать, что боковая поверхность поры имеет форму кругового цилиндра. Предположим, что боковая поверхность цилиндра изогнута и имеет радиус кривизны h/2. Радиус поры равен r. Липидный бислой в целом является плоским, а пора имеет два радиуса кривизны h/2 и 2.
Искривление поверхности на границе раздела липид-вода сопровождается появлением добавочного давления, называемого лапласовым и равного
![]()
где а - межфазное (поверхностное) натяжение внутри поры; г - радиус кривизны.
В рассматриваемой модели таких радиусов два (h/2 и r) и, следовательно, два давления. Одно из них р(h/2) способствует расширению, а другое р(r) - сжатию поры. Дальнейшая судьба поры зависит от соотношения этих двух давлений. Если p(h/2)>р(r), пора будет расширяться, а если р(h/2) меньше р(r), то пора будет затекать.
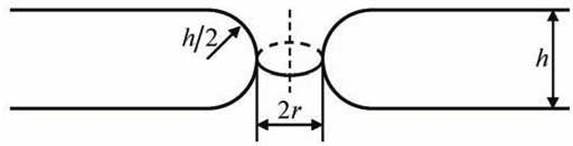
Рисунок 58 - Модель гидрофильной липидной поры: h - толщина липидного бислоя; h/2 - радиус кривизны стенки внутри поры; r - радиус поры
Таким образом, на границе поры действуют две противоположные силы, одна из которых - краевое линейное натяжение периметра поры - способствует росту поры, а вторая сила - поверхностное натяжение бислоя - вызывает сжатие поры.
Энергия кромки поры пропорциональна первой степени радиуса и увеличивает суммарную энергию, энергия поверхностного натяжения пропорциональна квадрату радиуса и снижает суммарную энергию. В результате суммарная энергия Е(r) равна
![]()
где первый член определяется энергией кромки поры с линейным натяжением у, а второй - энергией поверхностного натяжения σ.
Вид кривой на рисунке 56 указывает на существование неустойчивого равновесия в точке максимума с критическими значениями энергии (Е*) и радиуса (r*).
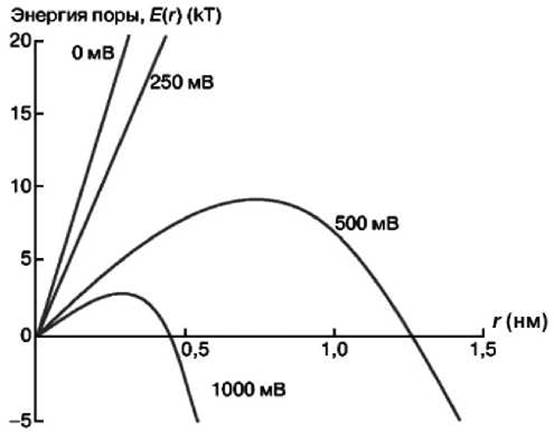
Рисунок 59 - Зависимость энергии поры от её радиуса при различных значениях мембранного потенциала
В точке равновесия (экстремум функции) ![]() и уравнение превращается в тождество: 0 = 2πy-2πσr*, откуда можно определить критический радиус поры
и уравнение превращается в тождество: 0 = 2πy-2πσr*, откуда можно определить критический радиус поры ![]()
Высота энергетического барьера после подстановки r* в yравнение Е(r) = 2πrу-πr2σ будет равна ![]()
С учётом неустойчивости равновесия можно утверждать, что появление пор с r > r* будет сопровождаться разрывом мембраны в результате неограниченного роста поры.
Напротив, при r < r* пора будет затекать, и стабильность мембраны сохранится.
Таков количественный критерий стабильности липидной бислойной мембраны.
Липидные поры при стрессовых воздействиях. Биологические мембраны находятся под действием электрического поля большой напряжённости, создаваемого диффузией ионов через мембрану и электрогенными ионными насосами. Поскольку разность потенциалов между цитоплазмой и внеклеточной средой достигает порядка 0,1 В, а толщина мембраны не превышает 10 нм, то напряжённость поля равна 107 В/м.
Таким образом, мембрана является более совершенным электрическим изолятором, чем многие жидкие изоляторы, применяемые в технике. В некоторых случаях мембранный потенциал в живой клетке может быть выше и достигать 0,2 В (пресноводные водоросли, бактерии, энергизированные митохондрии).
В возбудимых нервных и мышечных клетках происходит кратковременная реполяризация мембраны с ростом амплитуды потенциала. Однако пробой клеточной мембраны собственным мембранным потенциалом маловероятен.
В то же время рост мембранного потенциала в результате воздействия внешним электрическим полем может достигать величины, превышающей пороговую для электрического пробоя. При этом появляются структурные дефекты типа сквозных липидных пор.
Разработанная методика электрического пробоя клеточных мембран получила название электропорации и широко применяется в биотехнологии.
В физике под электрическим пробоем понимают резкое увеличение силы электрического тока в первоначально слабопроводящей среде. В живой клетке такой средой служит липидный бислой.
В этом случае формула зависимости энергии поры от её радиуса должна быть изменена путем введения дополнительного члена, отражающего вклад электрического поля,
![]()
![]()
εводы и εмембраны - диэлектрические проницаемости воды и мембраны соответственно; φ - мембранный потенциал; С0 - ёмкость единицы площади мембраны, не содержащей дефектов.
Зависимость энергии поры от её радиуса для этого случая приведена на рисунке 59, на котором представлено семейство кривых, построенных по полученному уравнению для различных значений мембранного потенциала.
Чем больше мембранный потенциал, тем меньше значение энергии поры и тем больше смещается максимум кривой к началу координат.
С увеличением радиуса энергия поры должна, с одной стороны, расти, поскольку увеличивается периметр поры, а, с другой стороны, одновременно энергия должна уменьшаться пропорционально росту поверхностного натяжения мембраны и мембранного потенциала. В результате (рисунок 59), появляется кривая с максимумом, что позволяет количественно оценить критические параметры мембраны: критический радиус поры и высоту энергетического барьера.
Высота энергетического барьера с учётом поля равна
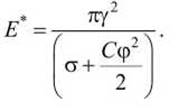
Можно видеть, что с ростом мембранного потенциала и поверхностного натяжения высота барьера снижается.
Критический радиус поры может быть рассчитан по формуле
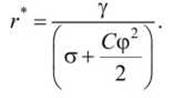
Величина критического радиуса также уменьшается с ростом а и φ. Из формулы следует, что зависимость параметров критической поры от мембранного потенциала становится заметной лишь при значительном превышении электрической составляющей над величиной поверхностного натяжения.
Расчёты показывают, что для липидного бислоя в жидкокристаллическом состоянии критическая величина мембранного потенциала не может быть меньше 0,23 В.
Стабильность бислойных мембран определяется вероятностью появления пор критического радиуса. Очевидно, что любой фактор, снижающий высоту энергетического барьера, будет увеличивать эту вероятность. К таким факторам следует отнести
1) снижение краевой энергии поры;
2) рост поверхностного натяжения;
3) рост мембранного потенциала.
Как видно из рисунка 59, рост пробойного напряжения до 1 В сопровождается смещением критического радиуса к значениям меньшим 0,5 нм, что близко радиусам природных ионных каналов клеточной мембраны. Отсюда следует, что электрический пробой сопровождается появлением широкого спектра липидных пор различного радиуса, включая поры с радиусом ионоселективных белковых каналов.
В настоящее время метод воздействия внешним электрическим полем является одним из основных в современной биотехнологии. Известно его применение с целью увеличения пористости мембран (электропорация), введения ДНК (электротрансфекция), освобождение клеток от крупных молекул (электропермеабилизация), слияния клеток (электрослияние).
Температурная обработка бислойных липидных мембран существенно влияет на энергетику порообразования, поскольку фазовый переход сопровождается значительным изменением поверхностного натяжения. Так, например, для гидрированного яичного лецитина при замораживании поверхностное натяжение а возрастало от 1,1∙1 (Г3 до 5,6 ∙ 10-3 Н/м.
С учётом этого по формуле Е(r) = 2πrу-πr2σ была рассчитана зависимость энергии поры от её радиуса в жидкой и твёрдой мембране (рисунок 60).
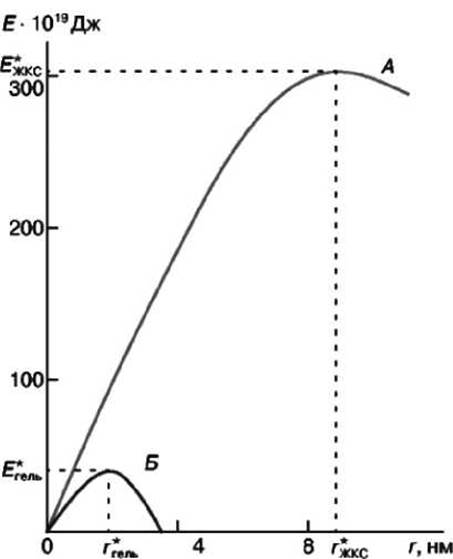
Рисунок 60 - Зависимость энергия поры от её радиуса в жидкокристаллическом состоянии (А) и гель-состоянии (Б) мембранных липидов
Как следует из рисунка 60, критический радиус поры в гель-состоянии значительно меньше по сравнению с жидкокристаллическим состоянием и по абсолютной величине не превышает 2 нм. Сохранение длительной устойчивости липидного бислоя в гель-состоянии свидетельствует о том, что существующие поры и поры, возникающие при фазовом переходе (жидкокристаллическое состояние) - (гель состояние), имеют размеры меньше 2 нм.
Сравнение рисунков 59 и 60 демонстрирует высокую эффективность метода температурной обработки бислойных липидных мембран с целью получения липидных пор с такими же параметрами, как и при электрическом пробое.
Действительно, замораживание мембранных липидов в ходе фазового перехода (который для многих насыщенных липидов происходит при комнатной температуре) эквивалентно электрическому пробою мембраны внешним электрическим полем напряжением 0,5 В. В то же время очевидно, что электрические воздействия более удобны с точки зрения калибровки силы воздействия и его длительности.
С точки зрения проницаемости липидные поры принципиально отличаются от белковых каналов своим происхождением и исключительной динамичностью.
В то время как белковые каналы имеют строго определённые размеры, сохраняющиеся в течение всей жизни клетки, размеры липидных пор в процессе затекания изменяются в широких пределах. Однако эта изменчивость не безгранична. Если радиус поры меньше критического, то пора в процессе затекания должна пройти все промежуточные радиусы и достигнуть минимального размера.
Вопрос о возможности полного затекания липидных пор остаётся открытым. Предполагается, что полному затягиванию поры препятствуют мощные силы гидратации, проявляющиеся при сближении стенок гидрофильных пор.
Липидные поры в отличие от белковых ионных каналов не обладают выраженной избирательностью, что коррелирует с их сравнительно большими исходными размерами.
Ясно, однако, что в процессе затекания липидные поры могут достигать сколь угодно малых размеров, в том числе сравнимых с размерами белковых ионных каналов, что может приводить к перераспределению ионных токов в мембране, например, при возбуждении.
Известно далее, что после выключения стрессового воздействия бислойная липидная мембрана может вернуться в состояние с низкой проводимостью, что подразумевает достижение порами размера, недостаточного для прохождения гидратированных ионов.
Таким образом, гидрофильные липидные поры универсальны в том отношении, что могут быть использованы клеткой для транспорта высокомолекулярных веществ, ионов и молекул воды.
Исследования проницаемости липидных пор развиваются в настоящее время в двух направлениях: в первом исследуются максимально большие поры, во втором, наоборот, - липидные поры минимального радиуса.
В первом случае речь идёт об электротрансфекции - способе введения в живые клетки или липосомы молекул ДНК с целью переноса и внутриклеточного введения чужеродного генетического материала. Оказалось, что внешнее электрическое поле высокой напряжённости способствует проникновению гигантской молекулы ДНК внутрь мембранной оболочки.
Максимальный размер критической поры соответствует жидкокристаллическому состоянию бислоя липидов в отсутствие внешнего электрического поля и равен 9 нм. Наложение внешнего электрического поля напряжённостью 100 кВ/м понижает критический радиус поры до 1 нм за время 0,2 с. Поскольку при этом мембраны не разрушаются, то размер липидных пор в них не превышает, очевидно, этого нижнего предела.
Парадокс состоит в том, что эффективный диаметр статистического клубка ДНК, которая должна попасть внутрь частицы, достигает 2000 нм. Поэтому очевидно, что молекула ДНК должна проникать через мембрану в виде расплетенной одиночной нити. Известно, что конец нити имеет диаметр 2 нм и может войти в пору. Однако свободная диффузия нити ДНК в поре при этом вряд ли возможна. В настоящее время механизм этого процесса до конца не ясен.
Предполагается, в частности, что:
1) молекула ДНК способна расширить пору и таким образом проскользнуть через мембрану;
2) проникновению ДНК могут способствовать дополнительные силы электрофореза и электроосмоса с учётом суммарного отрицательного заряда молекулы ДНК;
3) не исключено, также, что поры с фиксированными в них концами молекулы ДНК играют роль якоря, удерживающего молекулу в определённом месте у везикулы на поверхности мембраны, а сам процесс переноса является разновидностью пиноцитоза.
Контрольные вопросы и задания
1. Протекание каких трёх видов процессов обеспечивается селективной проницаемостью биомембран?
2. В чём состоит отличие электрохимического потенциала от химического потенциала?
3. Запишите уравнения Теорелла и Нернста-Планка.
4. Перечислите виды пассивного трансмембранного транспорта.
5. Какие вещества могут диффундировать через липидный бислой вследствие пассивной (обычной) диффузии?
6. Каким образом мелкие полярные молекулы (например, молекулы воды) диффундируют через биомембрану?
7. Каким образом кинки переносят молекулы воды через мембрану?
8. Какие выделяют виды мембранных белков-транспортёров?
9. Какие существуют три вида ионных насосов?
10. Какова характерная скорость переноса ионов через мембрану ионным насосом?
11. Какова характерная скорость переноса молекул и ионов через мембрану белковым каналом?
12. Какие существуют три схемы трансмембранного транспорта с помощью переносчиков-транспортёров?
13. Какие мембранные транспортёры называют котранспортёрами?
14. В чём отличие в работе активных транспортёров (ионных насосов) от вторичных активных транспортёров?
15. Какова характерная скорость переноса молекул через мембрану вторичными активными транспортёрами?
16. В чём сходство и различие простой диффузии и облегченной диффузии?
17. Какие существую две разновидности облегчённой диффузии?
18. Перечислите основные отличия облегчённой диффузии от простой.
19. Приведите примеры белков-транспортёров глюкозы семейства GLUT.
20. Какие два основных метода используются для исследования функционирования белков-транспортёров?
21. Каким образом наличие липидных пор влияет на стабильность биомембран?
22. В результате каких внешних воздействий в мембране могут образовываться липидные поры?
23. Какова роль липидных пор в гемолизе эритроцитов?
24. Перечислите основные параметры модели гидрофильной липидной поры.
25. Каков количественный критерий стабильности липидной бислойной мембраны?
26. Запишите выражение для высоты энергетического барьера липидной поры.
27. Запишите выражение для критического радиуса поры.
28. При каких стрессовых воздействиях размеры липидных пор могут превысить критическое значение?
29. Что называется электропорацией биомембраны?
30. Как изменяется величина критического радиуса поры при переходе из жидкокристаллического в гель-состояние?
31. В чём состоит принципиальное отличие липидных пор от белковых каналов с точки зрения проницаемости?
32. Что называется электротрансфекцией биомембраны?
33. Какие выделяют три разновидности механизма трансфекции ДНК через биомембрану?