Биологические мембраны - А. Н. Огурцов 2012
Электрогенез биомембран
Ионные каналы
Мембранные каналы и переносчики как ферменты
До сих пор мы рассматривали работу мембранных транспортных белков на микроскопическом молекулярном уровне. Оказывается, что применение прямо противоположного, феноменологического, способа описания транспортных мембранных процессов позволяет экспериментально определять многие параметры транспортных белков, даже не проводя микроскопические исследования методами молекулярной биологии.
Кинетическую теорию переходного состояния Эйринга и Поляни, используемую в ферментативном катализе, успешно применяют для описания различных транспортных систем, в том числе для количественного описания работы молекул-переносчиков и ионных каналов.
В основе этого подхода лежит предположение о том, что система может находиться в нескольких дискретных состояниях, каждому из которых соответствует стандартное значение электрохимического потенциала. При этом взаимные переходы между двумя состояниями происходят с преодолением энергетических барьеров и константы скоростей переходов зависят от высоты этих барьеров.
На рисунке 99 представлена схема ионного канала и соответствующие профили свободной энергии.
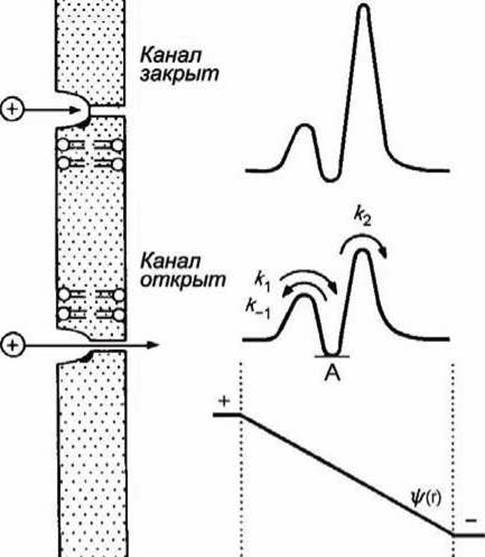
Рисунок 99 - Изменение профиля свободной энергии иона в ионном канале при деполяризации мембраны
Эти профили соответствуют случаю, когда в канале имеется единственное место связывания, локализованное где-то вблизи от входа в канал. Глубина впадины (точка А) отвечает слабому связыванию.
При наличии трансмембранной разности потенциалов на профиль свободной энергии накладывается профиль электрического потенциала ψ/(r). В этом случае высота энергетических барьеров, соответствующих k1 и k2, будет меньше, и скорость транспорта катионов через канал увеличится. Минимумы на кривых изменения свободной энергии соответствуют местам связывания транспортируемых веществ. Можно предположить, что канал или переносчик имеет одно или несколько мест связывания переносимых веществ.
При достаточно высоких концентрациях переносимого вещества все эти места оказываются занятыми, и скорость переноса достигает своего максимального значения wmax, равного максимальной скорости работы фермента.
Примем для простоты, что ионы изначально присутствуют только с одной стороны мембраны, внутри канала имеется единственное место связывания, и что ионы не могут свободно проникать внутрь канала или покидать его.
Случай, когда внутри канала имеется много мест связывания, по которым ион может последовательно передаваться, формально сводится к ситуации, когда в канале есть единственное место связывания, и кинетика работы такого фермента сводятся к стационарной кинетике Михаэлиса-Ментен [9].
Если принять, что мембранный потенциал φM равен нулю, то такую "ферментативную реакцию" можно представить следующим образом
![]()
где Е - канальный белок (фермент) в "открытом" состоянии; Sin и Sout - транспортируемое вещество (субстрат) внутри и снаружи мембраны; ES - комплекс субстрата с местом связывания внутри канала.
На рисунке 99 показаны профили свободной энергии для закрытого и открытого каналов.
Ионные каналы в модели Михаэлиса-Ментен. Для феноменологического рассмотрения процесса переноса иона сквозь мембрану необязательно знать микроскопический механизм блокирования канала, который, например, может заключаться в изменении пространственного положения а-спирали или какой-либо боковой цепи мембранного белка.
Достаточно предположить, что кинетика переноса ионов белком- переносчиком (или белком - ионным каналом) описывается моделью ферментативной кинетики, простейшей из которых является модель Михаэлиса-Ментен [9].
Тогда скорость транспорта ионов (число транспортируемых ионов в единицу времени) будет подчиняться уравнению Михаэлиса
![]()
где
![]()
- константа Михаэлиса; [E]0, - суммарная концентрация переносчиков (ионных каналов, ионных насосов и т. д.).
Рассмотрим два предельных случая.
1. Избыток субстрата [s] ≫ KМ, при котором все места связывания заняты ([E]0≈ [ES]), и скорость достигает своего максимального значения, определяемого высотой энергетического барьера для выхода их канала
![]()
2. Низкая концентрация субстрата [S] ≪ КM, при которой наблюдается линейная зависимость скорости от концентрации субстрата
![]()
Полученное уравнение хорошо описывает работу большинства (если не всех) ионных каналов.
Необходимо отметить, что даже для такого простого случая константа скорости - это не истинная микроскопическая константа скорости, а комбинация констант скоростей
![]()
Таким образом, измеряемая константа скорости, которая определяет скорость транспорта по открытому ионному каналу, содержит информацию о кажущемся сродстве иона к месту связывания (КM) и о числе превращения (числе оборотов) k2.
В отсутствие потенциала на мембране эта константа скорости прямо связана с проницаемостью, обусловленной единичным каналом.
Если правый (рисунок 99) барьер мал (k2≫ k-1), то константа скорости транспорта будет равна k1 - константе скорости второго порядка для иона, входящего в канал. Лимитирующим фактором для этой реакции может служить диффузия, при этом k1 будет составлять
![]()
Если правый (рисунок 99) энергетический барьер велик (k2≪ k-1), то константа скорости транспорта будет равна произведению ![]()
Зависимость скорости транспорта от величины мембранного потенциала определяется проводимостью. Это легко понять, если посмотреть, как падение напряжения на мембране влияет на индивидуальные константы скоростей k1, k-1, k2.
Если на профиль свободной энергии наложить прямую, изображающую линейное изменение потенциала в мембране (рисунок 99), то величина энергетических барьеров, отвечающих k1 и k2, уменьшится, а k-1 - увеличится (напомним, мы рассматриваем перемещение катиона).
Простые модели типа Михаэлиса-Ментен не предсказывают линейной (т. е. омической) зависимости тока от напряжения, наблюдаемой экспериментально. Однако в такие модели можно ввести дополнительные энергетические барьеры, после чего кривая зависимости плотности потока ионов от величины мембранного потенциала становится близкой к линейной.
Феноменологическая кинетическая модель Михаэлиса полезна также и при исследовании ионной селективности каналов.
Селективность - это способность канала пропускать некоторые ионы лучше, чем другие; её можно количественно охарактеризовать как отношение проницаемостей или проводимостей для сравниваемых ионов.
Поскольку в выражение для константы скорости транспорта ![]() входят как k1, так и k2, то причиной селективной ионной
входят как k1, так и k2, то причиной селективной ионной
проводимости может служить как более низкий энергетический барьер на входе в канал (k1), так и более низкий барьер для перемещения внутри канала (k2) для определённого типа ионов.
Например, если у входа в канал имеются отрицательные заряды или диполи, то скорость транспорта анионов может уменьшиться, т. е. канал окажется катионселективным. Такая картина наблюдается для нескольких рецепторных канальных белков и грамицидина А.
Размеры переносимых веществ также влияют на скорость транспорта. Если размер молекулы переносимого вещества больше, чем диаметр канала, то это вещество не сможет попасть в канал (эффект молекулярного сита).
И, наконец, селективность может быть связана с различием в скоростях переноса разных ионов внутри канала. Например, в случае селективного Nа+-канала энергетический барьер для переноса этого иона внутри канала существенно ниже, чем для других ионов, таких, как К+, что ведет к увеличению проводимости по Na+.
Маловероятно, чтобы причиной ионной селективности было увеличение сродства иона к каналу. Такое изменение, соответствующее увеличению глубины впадины на профиле потенциала (на рисунке 99 соответствующая точка отмечена буквой А), должно было бы приводить к уменьшению скорости выхода иона из канала, т. е. к уменьшению
максимального потока через канал, а также к уменьшению концентрации иона, необходимой для насыщения канала, т. е. к уменьшению КM. Однако значения КM для тех каналов, которые преимущественно пропускают Na+ или К+, достаточно высоки (200-300 мМ), что выше обычных физиологических концентраций этих ионов.
Мембранные переносчики. Рассмотрим простой переносчик с одним местом связывания, транспортирующий молекулы через мембрану. Рисунок 100 иллюстрирует трансформации трансмембранного профиля свободной энергии при работе активного переносчика.
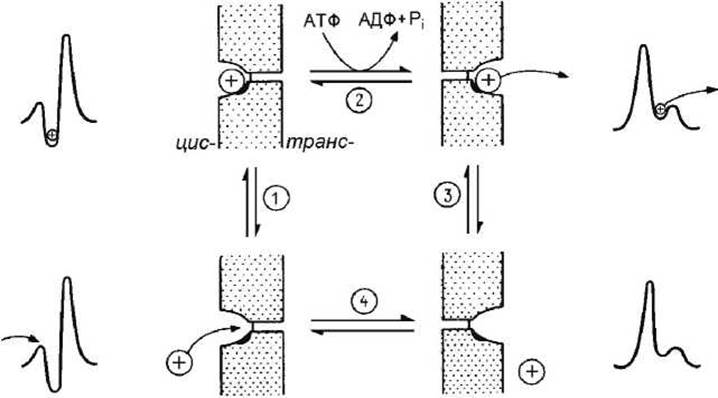
Рисунок 100 - Цикл работы активного переносчика
Рассмотрим четыре состояния белка-переносчика
1) белок обращен внутрь/связан с субстратом,
2) обращен внутрь/не связан с субстратом,
3) обращен наружу/ связан с субстратом,
4) обращен наружу/не связан с субстратом.
Тогда транспорт можно представить в виде следующей последовательности четырёх элементарных обратимых стадий (рисунок 100).
1. Субстрат связывается с участком, обращённым к одной стороне мембраны (определяемой, как цис-сторона).
2. Происходит конформационное изменение, существенно уменьшающее кинетический барьер для перемещения иона к выходу из канала и увеличивающее энергетический барьер для движения в обратном направлении. Это конформационное изменение может быть спонтанным или может происходить с потреблением энергии (например, энергии гидролиза АТФ). Участок переносчика со связанным субстратом оказывается теперь обращённым к противоположной стороне мембраны (определяемой, как транс-сторона).
3. Субстрат высвобождается из комплекса с переносчиком и выходит на противоположной стороне мембраны. Для активных переносчиков сродство субстрата к белку ниже, когда место связывания обращено к транс-стороне мембраны.
4. Происходит конформационное изменение, возвращающее белок-переносчик к исходной конформации, в которой место связывания вновь обращено к цис-стороне.
На рисунке 101 представлена кинетическая схема, соответствующая схеме на рисунке 100, для конкретного случая работы мембранных белков пермеаз (см. п. 7.6), обеспечивающих облегчённую диффузию ионов, аминокислот и сахаров.
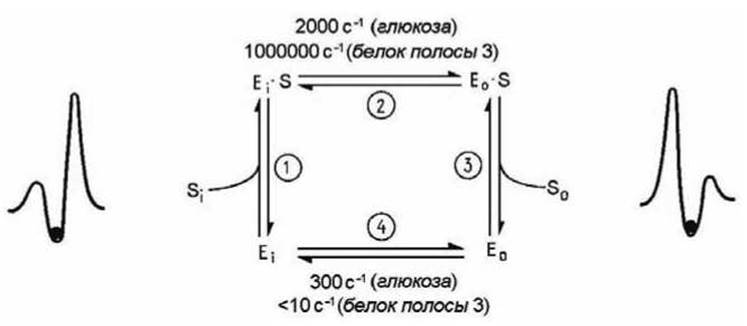
Рисунок 101 - Цикл работы пермеазы
Пермеаза спонтанно переходит из состояния Еi, при котором место связывания обращено внутрь клетки, в состояние Е0 с местом связывания, обращённым наружу, причём этот переход не влияет на сродство переносчика к связываемому субстрату. На рисунке 101 приведены значения скоростей взаимопревращений для переносчика глюкозы из эритроцитарной мембраны (при 23°С) и белка, осуществляющего обмен анионов (белок полосы 3 эритроцитов) (37°С). В обоих случаях субстрат увеличивает скорость конформационного перехода 2. Реакция 4 для "незагруженного" белка полосы 3 протекает очень медленно, поэтому данный белок катализирует только обмен анионов.
Ключевым моментом в работе всех переносчиков является наличие высокого энергетического барьера, для преодоления которого соответствующие белки должны претерпеть конформационные изменения. Если для этого необходима энергия, то система может работать как активный переносчик (пример - Са2+-насос, транспортирующий ионы Са2+ за счёт энергии гидролиза АТФ). Если для конформационного перехода необходимо, чтобы молекула переносимого вещества была связана с белком, т. е. стадия 4 отсутствует, то белок будет катализировать только обмен вещества через бислой, поскольку он не может изомеризоваться в "незагруженной" форме (пример - белок полосы 3 эритроцитов).
Для описания работы ионных каналов и различных видов переносчиков разработано много моделей и схем. Хотя кинетическая теория переходного состояния имеет определённые ограничения, особенно в том, что касается кинетических свойств каналов, но её применение упрощает решение многих сложных задач и позволяет единым образом подходить к рассмотрению различных транспортных механизмов, особенно в случаях, когда нет детальной информации о молекулярной структуре транспортных белков мембран.
Анализ стационарного состояния. Для кинетической характеристики транспортных систем, которые катализируют облегчённую диффузию или активный транспорт, могут использоваться различные подходы к анализу стационарного состояния. Все эти подходы основаны на измерении скорости переноса растворимых веществ через мембрану, но при разных условиях.
В качестве примера мы рассмотрим эксперименты, которые проводились на пермеазах, встроенных в мембранные везикулы. Обычно для такого рода измерений используют радиоактивные метки. Ключевым моментом является то, что пермеаза должна не только переносить вещество через бислой (цис → транс), но также и возвращаться обратно (транс → цис). Скорость транспорта может зависеть от любой из этих стадий. Опишем вкратце некоторые подходы к анализу.
1. Субстрат присутствует только с одной стороны мембраны (цис). Начальная скорость транспорта измеряется для однонаправленного потока. Важно, что для обеспечения постоянного потока транспортируемого вещества переносчик (пермеаза) должен вернуться свободным. Измеряют поток как функцию [S]цис для процесса, протекающего в любом направлении (например, для переноса вещества внутрь везикул или для выведения его из везикул).
2. Равновесный обмен. Субстрат присутствует в одинаковой концентрации с обеих сторон мембраны, но радиоактивная метка - только с одной стороны (цис). В этом случае пермеаза может возвращаться, будучи связанной с немеченым веществом. Измеряют поток как функцию [S].
3. Меченый субстрат находится с цис-стороны мембраны, а в насыщающей концентрации он присутствует на противоположной (транс) стороне. Измеряют поток как функцию [5]. Как и в первом случае, при этом регистрируют однонаправленный поток (цис → транс). Такой поток называют также встречным, поскольку меченое вещество переносится против своего химического градиента.
4. Удельная радиоактивность субстрата с обеих сторон мембраны одинакова. В насыщающей концентрации субстрат находится на транс-стороне, а [S]цис изменяется. В этом случае измеряют суммарный перенос, поскольку радиоактивное вещество пересекает мембрану в обоих направлениях. При таких условиях измерения состояние системы близко к равновесному.
Во всех случаях определяют wmax и КM, которые при этом не обязательно совпадают для разных подходов. Для разных моделей можно получить кинетические уравнения для стационарного состояния и проверить их.
Как и в классических работах по энзимологии, очень полезным может оказаться использование ингибиторов. При этом ингибиторы можно вводить с любой стороны мембраны, что позволяет получить дополнительную информацию.
Контрольные вопросы и задания
1. Какие ионные каналы называются нерегулируемыми?
2. Сколько белковых субъединиц формируют калиевый канал?
3. Какие элементы вторичной структуры субъединиц ионных каналов формируют фильтр селективности?
4. Что обеспечивает селективность калиевого канала?
5. Опишите двухцентровую модель проводимости калиевого канала.
6. В чем суть пэтч-метода исследования ионных каналов?
7. Сравните четыре стандартных варианта пэтч-регистрации активности ионных каналов.
8. Как изменяется трансмембранный профиль свободной энергии при открытии ионного канала?
9. Каким образом схема ![]() описывает работу ионного канала?
описывает работу ионного канала?
10. Запишите уравнение Михаэлиса и поясните входящие в него параметры.
11. Чем определяется селективность ионного канала в модели Михаэлиса-Ментен в случае [S] ≪ КM?
12. Какие четыре элементарные обратимые стадии составляют кинетическую схему цикла работы мембранного переносчика в представлении мембранных транспортёров как ферментов?
13. Какие четыре подхода используются при кинетическом анализе стационарного состояния транспортных мембранных систем?