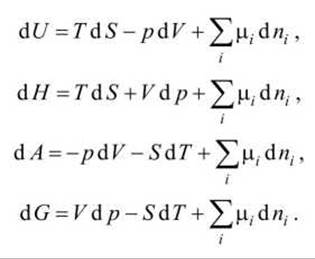Биологические мембраны - А. Н. Огурцов 2012
Электрогенез биомембран
Неравновесная термодинамика биомембран
Термодинамические потенциалы
В термодинамике вводятся особые функции состояния системы, убыль которых в обратимом процессе, протекающем при постоянстве определённой пары термодинамических параметров, равна максимальной полезной работе.
По аналогии с механикой, где работа постоянно действующих потенциальных сил определяется не зависящей от пути разностью потенциалов этих сил в начальном и конечном состояниях системы, в термодинамике эти функции называются термодинамическими потенциалами. Они являются частным случаем так называемых характеристических функций.
Характеристической функцией называется функция состояния, посредством которой (и её частных производных разных порядков по соответствующим переменным), могут быть наиболее просто и притом в явном виде выражены все термодинамические свойства системы (p,V,T,S,...).
Естественными переменными называются термодинамические параметры, при постоянстве пары которых убыль термодинамического потенциала в обратимом процессе равна максимальной работе.
В зависимости от условий протекания процесса различают четыре термодинамических потенциала:
1) изохорно-изотермический потенциал - свободная энергия Гельмгольца А;
2) изобарно-изотермический потенциал - свободная энергия Гиббса G;
3) изохорно-изоэнтропийный потенциал - внутренняя энергия U;
4) изобарно-изоэнтропийный потенциал - энтальпия Н.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала. Это уравнение можно записать в четырёх эквивалентных формах
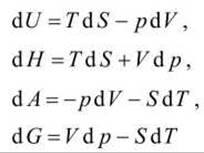
(только для закрытых систем, в которых совершается только механическая работа расширения).
Связь между термодинамическими потенциалами
G = U - TS + pV = H - TS = A + pV
наглядно представлена на рисунке 164.
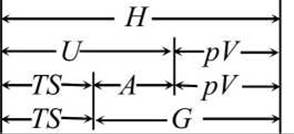
Рисунок 164 - Схема соотношений между термодинамическими потенциалами
Для систем переменного состава число молей компонентов системы также является параметром состояния.
Химическим потенциалом компонента μі называется производная от термодинамического потенциала по числу молей этого і -го компонента - он является парциальным мольным значением термодинамического потенциала
![]()
где nj - постоянное количество всех компонентов, кроме одного - того компонента, изменение которого рассматривается (j ≠ i).
Величина р, в отличие от U,H,A,G точно отвечает понятию потенциала, так как по своему смыслу потенциал не зависит от количества вещества, в то время как U,H,A,G являются экстенсивными свойствами.
Используя химический потенциал, можно переписать основное уравнение термодинамики в виде