ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 11. ИСПОЛЬЗОВАНИЕ МИКРООРГАНИЗМОВ В ПРОИЗВОДСТВЕ МЕДИЦИНСКИХ ПРЕПАРАТОВ И В ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЯХ
Микроорганизмы и продукты их жизнедеятельности широко используются для диагностики, лечения и предупреждения заболеваний. Помимо вакцин, иммунных сывороток и антибиотиков многие другие препараты давно вошли в медицинскую практику. Производятся и разрабатываются новые биологически активные вещества с использованием рекомбинантных штаммов микроорганизмов, полученных методами гентической инженерии (гл. 8, 9). Микроорганизмы используют в аналитических целях при определении мутагенной активности химических веществ, витаминов, аминокислот и т. п. Они служат моделью для испытания влияния на метаболизм некоторых фармацевтических продуктов.
11.1 Медицинские препараты, производимые микроорганизмами
Декстраны вырабатываются молочнокислыми бактериями рода Leuconostoc (L. dextranicum и L. mesenteroides) при росте на сахарозе в качестве источника углерода. Это полимеры, содержащие остатки глюкозы, соединенные α-1,6-связями с вариабельной молекулярной массой от 15000 до 20000000 Да (рис. 64).
Рис. 64. Структура декстрана.
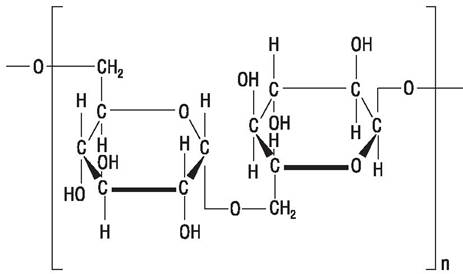
В медицинских целях может быть использован декстран с определенной молекулярной массой. Его получают путем кислотного гидролиза высокополимеризованного декстрана или используя низкомолекулярные декстраны — предшественники, которые добавляют в культуральную среду. Они служат центрами полимеризации, позволяя получить декстран с низкой молекулярной массой.
Декстраны выпускают в промышленных масштабах и используют как заменители плазмы. Они могут вводиться внутривенно, а также применяться местно при лечении язв и ожогов. В последнем случае они образуют гидрофильную пленку, которая абсорбирует эксудаты. Комплекс железа гидроксида с декстраном с молекулярной массой 5000-7000 Да используют внутривенно при лечении железодефицитной анемии в случаях, когда оральная терапия неэффективна или не может быть применена. Натриевая соль сернокислых эфиров декстрана (натрия декстрансульфат) обладает свойствами антикоагулянта подобно гепарину и применяется внутривенно [11, 13].
Декстраны как плазмозаменители должны иметь молекулярную массу от 40.000 до 300.000 Да. Полимеры с меньшей молекулярной массой быстро выводятся из организма, с большей — потенциально опасны, поскольку могут накапливаться в организме. На практике выпускают инфузионные растворы со средней молекулярной массой 40000, 70000 и 110000 Да.
Растворы содержат 6-10% декстрана, 0,9% натрия хлорида и 5% глюкозы в воде. Их стерилизуют автоклавированием и испытывают на пирогенность, токсичность и стерильность.
Из декстранов готовят сефадексы, которые широко используют в хроматографической практике.
11.2 Витамины, аминокислоты и органические кислоты
Данные соединения, продуцируемые микроорганизмами и применяющиеся в производстве фармацевтических препаратов, представлены в таблице 22. Они получаются методами биотехнологии, развитие которой позволяет постоянно расширять этот ассортимент и делать его более доступным для практики.
Таблица 22. Некоторые БАВ, продуцируемые микроорганизмами
БАВ |
Продуцент |
1 |
2 |
Витамины |
|
Рибофлавин (В2) |
Eremothecium ashbyii Aschbya gossypii Bacillus subtilis (мутантный штамм) |
Цианкобаламин (В12) |
Propionibacterium freudenreichii P shermanii Brevibacterium flavum Pseudomonas denitrificans |
Streptomyces olivaceus Micromonospora spp. |
|
Аскорбиновая кислота (С) |
Acetobacter xylinum A. suboxydans (превращение D- сорбита в L-сорбозу) |
Каротиноиды |
Blakeslea trispora Choanephora cucurbitarum |
Аминокислоты |
|
Глутаминовая кислота Глутамин, пролин L-аланин, L-валин |
Corynebacterium glutamicum |
Лизин |
Corynebacterium spp. Brevibacterium spp. |
L-изолейцин |
Brevibacterium flavum |
L-орнитин |
Arthrobacter spp. Brevibacterium spp. Corynebacterium spp. |
L-гистидин, |
мутанты C. glutamicum |
L-аргинин |
B. flavum, Bacillus subtilis |
L-треонин, L-триптофан |
рекомбинантные штаммы Escherichia coli |
L-цитрулин |
Ауксотрофные мутанты C. glutamicum, Bacillus subtilis |
Органические кислоты Молочная |
Lactobacillus delbrueckii L. bulgaricum, L. brevis Rhizopus oryzae |
Глюконовая |
Gluconobacter suboxydans Aspergillus niger |
Масляная |
Clostridium butiricum |
Пропионовая |
Propionibacterium shermanii P freudenreichii |
Койевая |
Aspergillus oryzae |
2-кетоглюконовая |
Pseudomonas fluorescens |
5-кетоглюконовая |
Gluconobacter suboxydans |
Винная |
то же |
Пировиноградная |
Pseudomonas aeruginosa |
Уксусная |
Acetobacter spp. |
Лимонная |
Aspergillus niger |
11.3 Железохелирующие агенты
При росте на среде с дефицитом железа многие микроорганизмы продуцируют вещества, способные связывать железо, обычно это феноляты или гидроксаматы, которые называют сидерофорами. Активный продуцент сидерофора десферроксамина (рис. 65) — Streptomyces pilosus.
Рис. 65. Структура десферроксамина и его хелатного комплекса.
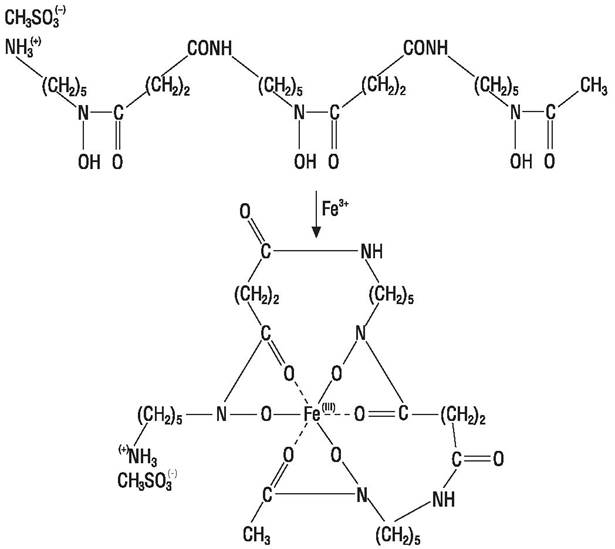
Десферроксамин (десферол) — активный антидот, который применяется при остром отравлении железом. Последнее может возникать, например, у детей при использовании железа сульфата для лечения неосложненного дефицита этого элемента. Десферол имеет высокое сродство к железу (константа связывания порядка 1030), его комплекс с металлом водорастворим и хорошо выводится из организма. При гемолитической анемии, например, талассемии десферол используют совместно с переливанием крови, чтобы поддержать нормальный уровень железа и гемоглобина в крови. Десферол выпускают в форме стерильного порошка, вводят путем инъекций или орально при остром отравлении железом, чтобы удалить его из кишечника.
Сидерофоры перспективны при лечении злокачественных и вирусных заболеваний. Рaracoccus denitrificans продуцирует сидерофоры, угнетающие рост опухолевых клеток и репликацию РНК вирусов. Это действие связано с тем, что в среде создается дефицит железа, необходимого для этих процессов.
11.4 Ферменты
Микроорганизмы продуцируют ферменты, которые используются как терапевтические вещества или в диагностических целях. Последние будут рассмотрены ниже.
Стрептокиназа, продуцируемая стрептококками, способна трансформировать плазминоген в плазмин - протеазу, вызывающую растворение сгустков крови. Ее применяют при лечении глубоких венозных острых артериальных тромбозов и острой легочной эмболии. Возможно применение этого фермента при инфаркте миокарда.
Стрептодорназа, также вырабатываемая стрептококками, способствует разжижению гноя. Это дезоксирибонуклеаза, гидролизующая дезоксирибонуклеопротеин и ДНК, обусловливающие вязкость гноя. Совместное применение стрептокиназы и стрептодорназы эффективно при заболеваниях грудной полости, сопровождающихся образованием сгустков крови и гноя, и при лечении гнойных ран.
Оба фермента получают при культивировании непатогенных штаммов стрептококков на среде с избытком глюкозы. Ферменты выделяют из культуральной жидкости и выпускают в инъекционной форме.
L-аспарагиназу продуцируют E. coli и Erwinia carotovora. Фермент используют при химиотерапии некоторых форм лейкемии. L-аспарагиназа отщепляет одну аминогруппу от аспарагина, превращая его в аспарагиновую кислоту. Избирательность действия фермента определяется потребностью некоторых форм опухолевых клеток в аспарагине, тогда как нормальные клетки в аспарагине не нуждаются.
Нейраминидазу получают при культивировании Vibrio cholera. Фермент отщепляет остатки N-ацетилнейраминовой кислоты, входящей в мембрану некоторых опухолевых клеток, повышая таким образом их антигенную активность. Может быть использован при лечении некоторых форм лейкемии.
β-лактамазы, инактивирующие пенициллины и цефалоспорины, используются при определении стерильности этих антибиотиков (см. ниже) или при микробиологическом анализе клинического материала от больных, получающих эти антибиотики. В терапевтических целях их используют в случае тяжелой аллергической реакции на β-лактамные антибиотики. Фермент вводят внутримышечно или внутривенно совместно с другими препаратами (адреналин, антигистаминные средства).
11.5 Микробная трансформация лекарственных веществ.
11.5.1 Микробная трансформация
Ферментные системы микроорганизмов позволяют осуществлять химические превращения биологически активных веществ с целью получения лекарственных препаратов. Подобные реакции в условиях химического синтеза проходят обычно в жестких условиях температуры и рН и являются многостадийными. Микробная трансформация осуществляется в физиологических условиях, что позволяет сохранить активность продукта, и обычно проходит в одну стадию.
Впервые преимущества микробной трансформации были обнаружены при получении стероидных препаратов. Одной из необходимых стадий этого процесса является гидроксилирование молекулы предшественника в определенном положении. Этой способностью обладают многие микроорганизмы. На рис. 66 показан пример биологической трансформации с участием Rhizopus nigricans. Иммобилизованные клетки используют для биотрансформации стероидов, антибиотиков, для получения антивирусного препарата аденинарабинозида. Процесс включает трансгликолизирования.
Рис. 66. Трансформация прогестерона ферментной системой Rhizopus nigricans
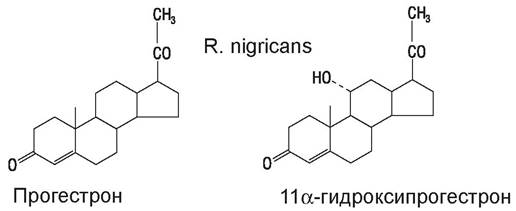
Найдены штаммы микроорганизмов, способные превращать гидрокортизон и кортизон соответственно в преднизолон и преднизон путем дегидрогенирования и т. д.
В процессах биотрансформации могут быть использованы иммобилизованные в полимерном гелевом матриксе клетки, а также мембранные системы, которые позволяют вести процесс непрерывно и упрощают очистку продукта. Иммобилизованные клетки используют для биотрансформации стероидов, антибиотиков, для получения антивирусного препарата аденинарабинозида. Процесс получения последнего вещества включает реакцию трансгликозилирования (урациларабинозид + аденин ^ аденинарабинозид), которую осуществляют клетки Enterobacter aerogenes, иммобилизованные в полиуретане.
В производстве антибиотиков необходимой стадией получения некоторых пенициллинов является гидролиз бензилпенициллина до 6-аминопеницил- лановой кислоты с помощью микробной пеницил- линацилазы. При этом хорошие результаты дает использование рекомбинантных штаммов с высокой ферментативной активностью. Иммобилизация клеток увеличивает их стабильность и повышает выход продукта.
11.5.2 Инсектициды
Энтомопатогенные бактерии, вирусы и грибы могут быть использованы для борьбы с вредными насекомыми. Методы биологической защиты от насекомых экологически более безопасны, чем методы химической защиты. Однако, к микроорганизмам, предлагаемым для этой цели предъявляются строгие требования их безопасности для млекопитающих и растений.
Наиболее изучены токсины Bacillus thuringiensis. Токсин δ — это протеин, который содержится в спорах в форме кристаллических включений, активен против личинок Lepidopterae(молей, бабочек). Активация токсина происходит при его ограниченном гидролизе в кишечнике личинок, после чего стенки кишечника разрушаются, что сопровождается гибелью насекомых. Инсектицидный препарат выпускают в форме порошка, содержащего споры и кристаллы токсина. Он не токсичен для человека и животных и применяется для защиты урожая от гусениц. Найден новый штамм B. thuringiensis, 5-токсин которого имеет более широкий спектр действия и активен против Coleoptera (жуков) в большей степени, чем Lepidoptera и Díptera (мух и комаров).
Второй токсин B. thuringiensis — β-токсин действует на все перечисленные семейства насекомых, это адениннуклеотид, возможно, аналог АТФ, который конкурентно ингибирует ферменты, участвующие в гидролизе АТФ. Он токсичен для млекопитающих, поэтому в производстве инсектицида используют штамм B. thuringiensis, который продуцирует только 5-токсин.
11.6 Использование микроорганизмов и их продуктов в лабораторных исследованиях
11.6.1 Определение витаминов и аминокислот
В качестве тест-культур используют ауксотрофные штаммы микроорганизмов, т. е. такие, для которых определяемое вещество является необходимым фактором роста. Питательная среда должна содержать все необходимые для тест-организма вещества, помимо определяемого. Последнее вносят в лунки агаризованной среды в чашках Петри. В определенных границах диаметр зоны роста культуры вокруг лунки будет пропроционален концентрации фактора роста, которую определяют с помощью стандартной кривой. Этот метод в основном используют при анализе витаминов т. к. аминокислоты обычно определяют химическими методами.
11.6.2 Фенилкетонурия
Это врожденное нарушение метаболизма, при котором организм не способен к конверсии избытка фенилаланина (ФА) в тирозин, необходимый для биосинтеза тироксина, адреналина и норадреналина. Диагностическим признаком заболевания является присутствие фенилпировиноградной кислоты (ФПВК) в моче и повышенный уровень ФА и ФПВК в крови. Больному назначают диету с низким содержанием ФА. Без принятия необходимых мер развивается слабоумие. Для диагностики фенилкетонурии предложено использовать Bacillussubtilis, рост которой на минимальной среде подавляется β-2-тиенилаланином (thyenil), но восстанавливается в присутствии ФА или ФПВК. Исследуемые образцы крови или мочи наносят на диски фильтровальной бумаги, которые помещают на засеянную среду в чашках Петри. При положительном результате отмечают зоны роста микроорганизма вокруг дисков. Диаметр зон пропорционален содержанию исследуемых веществ, количество которых определяют по стандартной кривой.
11.6.3 Определение канцерогенов и мутагенов
Все химиотерапевтические препараты должны проходить проверку на мутагенную, потенциально канцерогенную активность. Для этой цели предложен быстрый метод с использованием мутантных штаммов Salmonella typhimurium. Эти штаммы имеют мутации в гистидиновом опероне и не могут синтезировать гистидин. Две дополнительные мутации увеличивают чувствительность тест-системы. Первая определяет нарушение структуры липополисахарида клеточной стенки, в результате которого повышается ее проницаемость для больших гидрофобных молекул. Вторая мутация нарушает систему репарации ДНК, в результате чего невозможно восстановление структуры ДНК после воздействия мутагена.
Тест-культуру смешивают с испытуемым веществом в расплавленной (45°C) агаризованной среде минимального состава и выливают на чашку Петри. Поверх наносят слой агаризованной среды, содержащей следы гистидина и позволяющей клеткам пройти несколько циклов деления, что необходимо для выявления действия некоторых мутагенов. После 48-часовой инкубации при 37°C подсчитывают колонии-ревертанты и сравнивают их количество с результатами посева на контрольной чашке, не содержащей мутагена. Колония-ревертант — это потомство клетки, мутировавшей к дикому типу и способной синтезировать гистидин (расти на минимальной среде).
11.6.4 Использование микробных ферментов при определении стерильности
При испытании эффективности стерилизации в составе тест-систем используют спорообразующие микроорганизмы. При определении стерильности препаратов антибиотиков применяют микробные ферменты, инактивирующие эти вещества. Мембранная фильтрация, которую также используют для этой цели, имеет такие недостатки, как возможность случайного микробного загрязнения фильтров и адсорбция антибиотика на фильтре с последующим попаданием его в питательную среду. Применение инактивирующих ферментов является более надежным методом. Для инактивации пенициллинов и цефалоспоринов предложено использовать соответствующие β-лактамазы. Хлорамфеникол возможно инактивировать ацетил- трансферазой. Аминогликозиды — путем ферментного фосфорилирования, ацетилирования или аденилирования. Фармакопея рекомендует использовать только β-лактамазы, остальные методы пока не нашли широкого применения.
11.6.5 Применение иммобилизованных ферментов
Применение иммобилизованных ферментов представляется перспективным для создания тест-систем для клинического анализа. Например, глюкозооксидазу, применяемую при определении глюкозы в крови, получают при культивировании Aspergillus niger. Предложен способ иммобилизации этого фермента на платиновом электроде, который может измерять потребление кислорода при окислении глюкозы. Однако, эта система имеет ряд недостатков, которые предстоит устранить до внедрения ее в практику.
11.6.6 Использование микроорганизмов как модельных систем при исследовании метаболизма лекарственных веществ
Лекарственные вещества проходят тщательные испытания их эффективности и токсичности, в том числе исследуют пути их метаболизма в организме млекопитающих: возможные химические превращения, распределение в органах и тканях, скорость выведения из организма и т. д. Эти испытания проводят на животных, в меньшей степени используют микросомальные системы, культуры тканей, перфузированные органы. Предложено использовать микробные клетки как модель метаболизма in vitro, поскольку имеется сходство между некоторыми ферментными системами микроорганизмов и печени человека. Большое преимущество таких моделей — их относительно низкая стоимость и возможность получать метаболиты в количествах, достаточных для анализа. Для создания модельных систем проводят скрининг большого количества микроорганизмов на их способность метаболизировать данное вещество. Выбранный штамм выращивают в колбах на качалках, куда вносят исследуемое вещество и через определенные промежутки времени отбирают пробы, определяя в них присутствие метаболитов лекарственного вещества. При необходимости процесс масштабируют с целью получения большого количества метаболитов для изучения их структуры и биологической активности.