ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 15. УСТОЙЧИВОСТЬ МИКРООРГАНИЗМОВ К ХИМИОТЕРАПЕВТИЧЕСКИМ ВЕЩЕСТВАМ
15.1 Клеточные и молекулярные механизмы устойчивости
Устойчивость к химиотерапевтическим веществам (ХТВ) определяется комплексом структурных и метаболических особенностей микроорганизма. Различают естественную (природную) и приобретенную резистентность. Последняя имеет огромное значение в практике антимикробной терапии. По мере внедрения нового ХТВ наблюдается короткий период, в течение которого препарат эффективно используется в широких масштабах, далее появляется все большее количество устойчивых микроорганизмов, в результате чего ценность данного ХТВ резко падает. Например, вскоре после внедрения в практику пенициллина только 8% штаммов золотистого стафилококка было к нему устойчиво, сейчас это число превышает 75%. Популяции устойчивых микроорганизмов обычно формируются среди возбудителей госпитальных инфекций. Скорость развития резистентности и ее механизмы зависят от видовой принадлежности микроорганизма.
Механизмы резистентности микроорганизмов к ХТВ могут быть связаны со следующими факторами:
1) наличие барьеров проницаемости;
2) активный выброс ксенобиотика из клетки;
3) наличие инактивирующих ферментов;
4) отсутствие или модификация мишени.
15.1.1 Различия в проницаемости клеточных мембран
Различия в проницаемости клеточных мембран определяют разную устойчивость грамположительных и грамотрицательных бактерий к биоцидам. Последние, как правило, более устойчивы, что определяется защитной функцией трудно проницаемой внешней мембраны. Поры мембраны и формирующие их белки порины обеспечивают свободную диффузию гидрофильных молекул с массой до 600-700 Да. Диффузия гидрофобных антибиотиков через поры затруднена. Резистентность Pseudomonas aeruginosa даже к гидрофильным биоцидам определяется особенностями ее внешней мембраны, липополисахарид наружной части которой экранирует поры.
Резистентность также может быть связана с нарушением системы транспорта биоцидного агента в клетку и обеспечиваться специальной системой выброса ксенобиотиков. Такая система имеется в клетках млекопитающих и обнаружена у бактерий в форме специфических белков — помп, представленных как одиночными белками — транспортерами цитоплазматической мембраны, так и функционально связанными группами транспортеров, периплазматических белков и поринов внешней мембраны.
Более сложная система существует у грамотрицательных бактерий, что связано с необходимостью переноса через внешнюю мембрану. Системы мембранного транспорта, обеспечивающие выброс антимикробных соединений из клетки, активируются в большинстве случаев энергией трансмембранного градиента протонов и требуют участия АТФ.
15.1.2 Ферменты, инактивирующие антибиотики
Многие микроорганизмы вырабатывают ферменты, специфически инактивирующие антибиотики путем их разрушения или химической модификации. (5-лактамазы гидролизуют пенициллины и цефалоспорины (рис. 24, 27). Они синтезируются многими грамположительными и грамотрицательными бактериями. Фермент может быть конститутивным (у Proteusspp, Pseudomonas aeruginosa, Klebsiella spp, Neisseria gonorrheae) или индуцибельным (у Staphylococcus aureus, Serratia spp. и др.). β лактамазы разного происхождения существенно различаются по молекулярной массе и аминокислотному составу.
Некоторые производные пенициллина и цефалоспорина (см. выше) устойчивы к в-лактамазам [29]. Кроме того, удается преодолеть устойчивость, вводя антибиотики совместно с ингибиторами лактамаз, например, клавулоновой кислотой (рис. 67).
Рис. 67. Клавулоновая кислота.
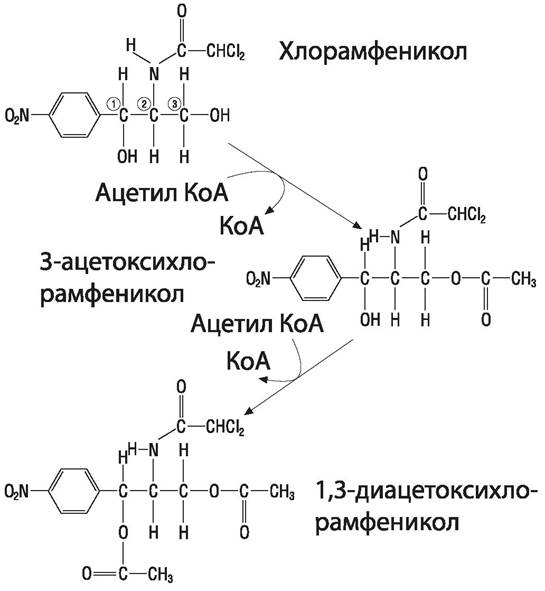
Хлорамфеникол инактивируется резистентными штаммами бактерий (Salmonella spp, Haemophilus influenzae и др.) путем ацетилирования (рис. 68). Ацетилтрансфераза, осуществляющая эту реакцию, индуцибельна у грамположительных бактерий и конститутивна у грамотрицательных.
Рис. 68. Инактивация хлорамфеникола путем двухстадийного ацетилирования с участием ацетил-трансферазы.
Аминогликозидные антибиотики инактивируются путем ацетилирования аминогруппы, а также путем аденилирования или фосфорилирования некоторых гидроксильных групп. Большая часть аминогликозидов является субстратом для более чем одного инактивирующего фермента в периплазматическом пространстве или на внешней поверхности цитоплазматической мембраны. Полусинтетический аминогликозид амикацин устойчив к действию многих, но не всех инактивирующих ферментов.
Модификация мишени, приводящая к потере чувствительности к антибиотику, определяется природой взаимодействующих структур. У Е. coli замена только одной аминокислоты в белке 30 S субъединицы рибосомы делает микроорганизм устойчивым к стрептомицину. Подобный механизм резистентности описан у Streptococcus faecalis и Staphylococcus aureus.
Устойчивость к метициллину, цефалоспоринам и монобактамам связана с присутствием в микробных клетках пенициллинсвязывающего белка, имеющего сродство и к другим β-лактамам, которые индуцируют его синтез.
Устойчивость к эритромицину зависит от модификации 50 S субъединицы рибосомы (определенных белков или 23 S РНК, входящих в ее состав), что снижает аффинитет антибиотика к рибосоме.
Триметоприм, который в клинике часто используют в сочетании с сульфонамидом сульфаметаксозолом, является ингибитором бактериальной дигидрофолатредуктазы — ключевого фермента метаболизма фолиевой кислоты. Резистентные штаммы синтезируют дигидрофолатредуктазу, устойчивую к действию антибиотика.
Устойчивость к триметоприму часто сочетается с устойчивостью к сульфонамидом, связанной с модификацией мишени последних — дигидроптероат синтетазе (ДПС). Кроме того, некоторые резистентные к этим препаратам микроорганизмы (Staphylococcus aureus) продуцируют необычно большое количество п-аминобензойной кислоты, которая конкурентно вытесняет сульфонамид из активного центра ДПС.
Резистентность к рифамицину определяется модификацией мишени антибиотика — ДНК-зависимой РНК-полимеразы, к налидиксовой кислоте — модификацией ДНК-гиразы.
15.2 Генетические основы устойчивости
Гены, определяющие устойчивость к ХТВ, могут составлять часть бактериальной хромосомы либо располагаться на плазмидах и транспозонах. Плазмиды, несущие эти гены, обозначаются как R-фактор (R-плазмиды). Они обладают не только внутривидовой, но и межвидовой трансмиссивностью, т. е. способны к горизонтальному переносу, приводящему к распространению резистентности от бактерий одного рода, вида или штамма к другим. R-плазмида определяет множественную устойчивость микроорганизмов, поскольку содержит гены, кодирующие фаноры устойчивости к разнообразным ХТВ. Транспозоны — мобильные генетические элементы, способствуют обмену информацией между плазмидами и хромосомой. В бактериальной клетке постоянно происходит перераспределение локализации генов резистентности: чем более важен ген для обеспечения жизнеспособности клетки, тем менее вероятно, что он может длительное время сохраняться вне хромосомы. Кроме того, локализация генов резистентности до некоторой степени отражает ее биохимические механизмы. Например, устойчивость пневмококков к сульфамидам связана с хромосомной мутацией гена ДПС, устойчивость к стрептомицину — с мутацией хромосомного гена, кодирующего определенный белок рибосомы, тогда как R-плазмида несет гены, контролирующие синтез ферментов, инактивирующих антибиотики (β-лактамазы, ацетилазы, фосфорилазы, аденилазы и др.).
Геномы бактерий часто являются мозаичными, т. е. содержат вставки чужеродной ДНК различной протяженности. Мозаичность возникает в результате горизонтального переноса генов путем генетической рекомбинации (трансформации, трансдукции, конъюгации). Наиболее часто такая мозаичность обнаруживается среди генов, определяющих факторы вирулентности, и генов устойчивости к лекарственным препаратам и связана с существованием генных кассет. Кассеты с генами резистентности к антибиотикам являются самыми маленькими по размеру мобильными генетическими элементами. Они содержат один ген и специфическую последовательность, выполняющую функцию рекомбинационного сайта. Кассеты являются дискретными генетическими элементами, объединенными в более крупную мобильную структуру — интегрон. Кассетный ген обычно не содержит промотора, и его экспрессия зависит от промотора интегрона.
Гены, кодирующие резистентность, могут стабильно существовать, будучи невостребованными, т. е. в отсутствие селективного давления, это подтверждается существованием устойчивых к биоцидам штаммов в природных субстратах, не содержащих ХТВ. Однако не исключается возможность, что факторами отбора могут быть и другие вещества, например, тяжелые металлы, т. к. гены резистентности могут быть интегрированы в генные кассеты (кластеры), являющиеся оперонами, соединяющими гены устойчивости ко многим неблагоприятным факторам. Сохранению генов резистентности в природе благоприятствует широкий круг их хозяев, способность к взаимодействию которых столь выражена, что селекция, определяющая приспособляемость, должна была происходить задолго до эры антибиотиков, созданной человеком (например, в почвенном биоценозе, содержащем продуценты антибиотиков).
Наряду с известными ранее способами горизонтального переноса генов резистентности описан новый механизм передачи генов — ретранспорт, на первом этапе которого трансмиссивная плазмида донора проникает в клетку-реципиент и интегрирует с мобилизуемой ею плазмидой; на втором этапе она возвращается в клетку донора, обогащенная новыми генами. Мобилизуемыми элементами могут быть не только плазмиды, но и сегменты хромосомы, которые вырезаются с участием конъюгативных транспозонов.
15.3 Пути и способы предотвращения развития микробной резистентности к ХТВ
Развитие микробной резистентности и широкое ее распространение требует постоянного поиска новых антимикробных препаратов. Активные исследования, проводимые с начала эры антибиотиков, привели к тому, что скрининг с целью поиска нового продуцента часто заканчивается открытием «старого» антибиотика. Поэтому в настоящее время разрабатываются новые направления поиска:
1) препаратов, воздействующих на мишени, которые претерпели модификацию под действием «старых» антибиотиков;
2) ингибиторов ферментов, инактивирующих антибиотики;
3) веществ, подавляющих активный выброс антибиотика из клетки патогена;
4) против новых мишеней, например, ферментов, участвующих в синтезе белка и пептидогликана;
5) новая техника скрининга «in vivo gene expressing technology» против тех процессов микроорганизма, которые имеют место в организме больного, но не наблюдаются in vitro,например, синтез некоторых полисахаридов, факторов адгезии, ферментов патогенности и т. п. Для выявления генов, кодирующих эти процессы, сравнивают РНК-транскрипты, образующиеся in vivo и in vitro. С помощью обратной транскриптазы получают тотальную ДНК, которую исследуют в реакции гибридизации с библиотекой генов данного микроорганизма. Цель скрининга — идентификация новых генов и поиск способов инактивации их экспрессии. Наиболее перспективные мишени, не имеющие аналогов у эукариот — факторы вирулентности и механизмы регуляции их экспрессии. Последние включают распознавание условий среды (рецепцию), передачу сигнала от рецептора геному и синтез соответствующего фактора вирулентности.
Перспективны также разработки по созданию препаратов, блокирующих адгезию, систему секреции, и систему регуляции транскрипции. Один из универсальных регуляторов последней — механизм чувства кворума у микроорганизмов. Его принцип — активация транскрипции специфических генов при достижении порогового уровня связывания белка — активатора транскрипции с низкомолекулярным аутоиндуктором. Этот механизм обеспечивает быстрый рост культуры при больших посевных дозах и участвует в экспрессии факторов вирулентности. Ингибиторы детерминант вирулентности, вероятно, будут иметь низкую активность in vitro и, что ценно, не будут действовать на микроорганизмы, лишенные факторов вирулентности, т. е. на нормальную микробиоту.
В качестве химиотерапевтических веществ предлагают использовать фрагменты белковых факторов врожденного иммунитета, причем видоспецифических, т. е. не являющихся чужеродными. Одним из таких факторов может быть рекомбинантный фрагмент белка нейтрофилов человека, нейтрализующий эндотоксин грамотрицательных бактерий и обладающий антимикробным действием.
Поиск новых антимикробных средств предусматривает характеристику не только генома, но и протеома, т. е. всех без исключения белков клетки для определения ее состояния в любой момент. Протеомика характеризует фенотип клетки на любой стадии клеточного цикла и в любых внешних условиях, таким образом, дает необходимые знания для таргетного скрининга — поиска препаратов, направленных на определенную мишень (target).