МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ II - А. В. ПИНЕВИЧ - 2007
ГЛАВА 13. УГЛЕРОДНАЯ АВТОТРОФИЯ
Все живое вещество в конечном счете в значительной части своей массы происходит из угольной кислоты атмосферы или из угольной кислоты, растворенной в воде, так как это единственные источники, из которых оно извлекает ему углерод.
В. Н. Вернадский. Очерки геохимии. Лекции, прочитанные в Академии наук в Петрограде в 1921 г.
Углеродная автотрофия находится в эпицентре субстратного питания. От способности синтезировать органические вещества (которые непосредственно используются в качестве строительного материала или запасаются для целей энергетического и/или конструктивного метаболизма) зависят биоразнообразие, численность и, в конечном счете, глобальная роль углеродных автотрофов.
При фотосинтезе углеродная автотрофия сочетается с фототрофией, или ассимиляцией свободной энергии квантов электромагнитного поля. При хемосинтезе она сочетается с хемолитотрофией, или ассимиляцией энергии, освобождающейся при окислении неорганических субстратов.
Два типа автотрофного питания, фотосинтез и хемосинтез, обеспечивают прокариотам независимость от экзогенных органических субстратов. Благодаря своей трофической автономии фото- и хемосинтезирующие прокариоты распространены практически повсеместно и достигают высокой численности там, где их развитие не ограничивается условиями внешней среды, прежде всего ресурсами энергии и неорганического углерода. Характерным примером служат «цветения» цианобактерий.
На первый взгляд, это должно привести к абсолютному биосферному доминированию фото- и хемосинтетиков, однако в действительности это не так. Напротив, биоразнообразие облигатных фото- и хемосинтезирующих прокариотов (например, цианобактерий и нитрификаторов) уступает биоразнообразию прокариотов, обладающих метаболизмом смешанного типа (фотомиксотрофов, хемолитомиксотрофов, фотогетеротрофов и хемолитогетеротрофов), у которых использование энергии света или энергии неорганических субстратов по-разному сочетается с утилизацией органических веществ. Оно тем более уступает биоразнообразию факультативных или облигатных хемоорганогетеротрофов.
Здесь нет противоречия — углеродная миксотрофия или углеродная гетеротрофия физиологически гибче, чем облигатная углеродная автотрофия, которая парадоксально сочетает в себе «самостоятельность» с «неполноценностью».
Облигатные углеродные автотрофы по той или иной причине не способны использовать экзогенные органические субстраты или же отравляются продуктами их катаболизма. Такой дефект у них генетически детерминирован. В разных случаях это связано:
— с отсутствием одного или нескольких ключевых ферментов, участвующих в катаболизме органических субстратов (например, α-кетоглутаратдегидрогеназы — ключевого фермента цикла Кребса; см. раздел 11.4.2.1);
— с отсутствием регуляции активности ключевых катаболических ферментов на уровне транскрипции (например, глюкозо-6-Р-дегидрогеназа, ключевой фермент гексозомонофосфатного пути Варбурга-Диккенса-Хоррекера, синтезируется конститутивно и в небольшом количестве, независимо от концентрации глюкозы во внешней среде; см. раздел 11.3.2.3);
— с отсутствием транспортных систем, доставляющих в цитоплазматический компартмент органические субстраты (например, нет фосфотрансферазной системы, используемой для импорта сахаров; см. раздел 9.1.1);
— с отсутствием транспортных систем для экскреции побочных продуктов катаболизма органических субстратов (например, пирувата, накопление которого в цитоплазме приводит к эндогенной интоксикации).
Итак, углеродные автотрофы, которые расположены в основании пищевой пирамиды, менее разнообразны по сравнению с прокариотными консументами. Однако это не означает, что углеродная автотрофия сводится к единственному биохимическому механизму.
13.1. Механизмы углеродной автотрофии
Углеродная автотрофия осуществляется при помощи разных механизмов. По физиологической сути они равноценны, однако в разной степени представлены в мире прокариотов.
Для строгого доказательства того, что исследуемый объект обладает тем или иным механизмом углеродной автотрофии, требуется выполнить целый ряд условий:
— иметь в своем распоряжении чистую культуру;
— показать, что рост является автотрофным или миксотрофным;
— молекулярно-биологическим способом (доказательство наличия гена) и биохимическим способом (наблюдение за специфической реакцией) выявить ключевой фермент;
— на основе изотопных, колориметрических или хроматографических методов идентифицировать продукт ассимиляции неорганического углерода;
— доказать, что данный механизм углеродной автотрофии является единственным или сочетается с другими механизмами.
Ниже мы убедимся в том, что соблюсти все эти условия трудно, и не всегда это удается сделать.
Углеродная автотрофия основана на системе взаимосвязанных анаболических реакций.
Вначале С1-блок ковалентно соединяется с органическим акцептором или другим С1-блоком, причем в подавляющем большинстве случаев это происходит ферментативным путем.
Специфика механизма углеродной автотрофии связана прежде всего с типами С1-блока, органического акцептора и «конденсирующего» фермента. В частности, от исходного уровня восстановленности С1-блока зависит, потребуется ли восстановитель при осуществлении того или иного типа углеродной автотрофии. В одних
случаях для активации образующихся интермедиатов может расходоваться энергия АТФ, а в других случаях это не нужно. Наконец, при использовании разных механизмов углеродной автотрофии образуются разные типы конечных продуктов.
Тип акцептора для C1-блока. Среди механизмов ассимиляции неорганического углерода различают циклы и пути.
Биохимический смысл цикла (англ. cycle) заключается в том, что акцептором Ci-блока служит органическое соединение, которое включается в состав продукта ассимиляции и поэтому должно возобновляться. В настоящее время известны пять циклов автотрофной ассимиляции углерода:
— цикл Ивенса-Бьюкенена-Эрнона;
— цикл Фукса-Холо;
— цикл Квайла;
— цикл О’Коннора-Хэнсона;
— цикл Кельвина-Бенсона-Бэссема.
Напротив, биохимический смысл пути (англ. pathway) заключается в том, что органические акцепторы не включаются в состав продукта ассимиляции, а лишь выполняют роль переносчика С1-блока на отдельных этапах его восстановления, после чего он конденсируется с другим С1-блоком (или два С1-блока соединяются непосредственно, без участия акцептора). В настоящее время известны два пути автотрофной ассимиляции углерода:
— путь Вулфа;
— путь Вуда-Льюнгдала.
Тип акцептируемого C1-блока. Мы уже говорили о том, что C1-блоки, используемые при углеродной автотрофии, различаются по степени восстановленности углерода (см. раздел 9.2.3).
Максимально окислен углерод в диоксиде (СО2) и его физиологическом эквиваленте, бикарбонате (НСО3). Менее окислен углерод в карбоксиде (СО), еще меньше — в формальдегиде (НСНО), тогда как в метальной группе, входящей в состав метана или соединений типа СН3—X-R (где X — атом азота, кислорода или серы), он наиболее восстановлен.
Уровень восстановленности углерода в органических молекулах соответствует уровню восстановленности углерода в формальдегиде или метальной группе. Поэтому при использовании в качестве С1-блока соединений приведенного ряда потребность в доноре электронов прогрессивно убывает.
Связь с энергетическим метаболизмом. Хотя все известные системы углеродной автотрофии преследуют одну и ту же цель — биосинтез органических веществ из неорганических, они различаются по метаболической стратегии.
Прежде всего, циклы углеродной автотрофии затрачивают энергию, а пути углеродной автотрофии поставляют энергию.
13.2. Циклы углеродной автотрофии
Циклы углеродной автотрофии всегда затрачивают метаболическую энергию для активации акцептора С1-блока, а также (если требуется) с целью активации некоторых интермедиатов. При этом расходуется только одна из двух форм ассимилированной энергии — энергия фосфагена, причем только АТФ.
Регенерация АТФ осуществляется при помощи АТФ-синтазы. Для этого используется энергия, предварительно ассимилированная при фототрофии или хемолитотрофии в форме Pmf(Smf).
Циклы углеродной автотрофии различаются по «энергоемкости». Среди них есть и относительно высокозатратные, и те, которые потребляют относительно меньше энергии.
Рассмотрим подробно каждый из них, особо обращая внимание на следующие вопросы:
— распространение цикла в мире прокариотов;
— ключевые ферменты цикла;
— промежуточные реакции цикла;
— расход энергии;
— природа восстановителя и его расход;
— конечный продукт цикла;
— предполагаемое место цикла в эволюции метаболических систем.
В завершение мы приведем сводную характеристику всех известных циклов для того, чтобы сделать более удобным сравнение их специфики, а также физиологической эффективности.
13.2.1 Восстановительный цикл карбоновых кислот, или цикл Ивенса-Бьюкенена-Эрнона
Гипотеза о возможности функционирования восстановительного цикла карбоновых кислот была выдвинута в 1966 г. на основе исследований, проведенных американскими микробиологами Ивенсом (М. С. W. Evans), Бьюкененом (В. В. Buchanan) и Эрноном (D. I. Аrnоn) на зеленой аноксигенной фототрофной бактерии Сglorobium limicola (фила BXIChlorobi). Однако решающие фактические доказательства его существования были получены только в 1980 г. в опытах немецкого биохимика Георга Фукса (G. Fuchs) с использованием меченых атомов.
Помимо С. limicola этот цикл обнаружен у хемолитотрофных бактерий, в частности водородных бактерий Aquifex pyrophilus и Hydrogenobacter thermophilus (фила BI Aquificae), а также у сульфатредуцирующих бактерий, например, Desulfobacter (фила ВХII Proteobacteria).
Кроме того, он встречается у хемолитотрофного археота Sulfolobus acidocaldarius, окисляющего серу кислородом, и Thermoproteus neutrophilus, восстанавливающего серу водородом (фила AI Crenarchaeota).
Цикл Ивенса-Бьюкенена-Эрнона оказался первым примером цикла автотрофной ассимиляции углерода, который прокариоты используют вместо классического цикла Кельвина-Бенсона-Бэссема (см. раздел 13.2.5). Его часто называют «обращенным циклом Кребса». Это справедливо лишь с оговоркой. Действительно, в цикл Ивенса-Бьюкенена-Эрнона входят те же обратимые реакции, что и в цикл Кребса, и он может быть «запущен в обратную сторону» для окисления ацетата у той же бактерии. Однако в него входят две уникальные необратимые реакции — АТФ-цитратлиазная и α-кетоглутарат-синтазная.
Пируватдекарбоксилазная реакция с участием ферредоксина, приводящая к расщеплению пирувата в бесклеточных препаратах диазотрофной бактерии Clostridium pasteurianum,была обнаружена Мортенсоном в 1962 г. Обратную реакцию, которая катализируется пируватсинтазой, открыл Бьюкенен в 1964 г.:
ацетил-СоА + СО2 + 2Fdred + 2Н+ —> пируват + СоА + 2Fdox.
ацетил-СоА + CO2 + 2Fdred + 2H+ —> пируват + СоА + 2Fdox
Вначале она была обнаружена у хемогетеротрофных почвенных бактерий из р. Clostridium. Через два года ее нашли у аноксигенных фототрофов Chlorobium limicola, Chromatium vinosum и Rhodospirillum rubrum.
Вместе с аналогичной реакцией ферредоксинзависимого карбоксилирования сукцинил-СоА, катализатором которой является α-кетоглутарат-синтаза
сукцинил-СоА + СО2 + 2Fdred + 2Н+ —> α-кетоглутарат + СоА + 2Fdox,
пируватсинтазная реакция служит основой для особого цикла ассимиляции неорганического углерода — восстановительного цикла карбоновых кислот.
В зависимости от имеющихся у клетки ресурсов восстановителя и АТФ, а также в соответствии с общей направленностью биосинтетических процессов цикл Ивенса- Бьюкенена-Эрнона может протекать по основному или длинношунтированному варианту (рис. 145).
Рис. 145. Восстановительный цикл карбоновых кислот, или цикл Ивенса-Бьюкенена-Эрнона. 1 — АТФ-цитратлиаза; 2 — аконитатгидратаза; 3 — изоцитратдегидрогеназа; 4 —α-кетоглутаратсинтаза; 5 — сукцинил-СоА-синтаза; 6 — сукцинатдегидрогеназа; 7 — фумаратгидратаза; 8 — малатдегидрогеназа; 9 — пируватсинтаза; 10 — фосфоэнолпируваткарбоксилаза.
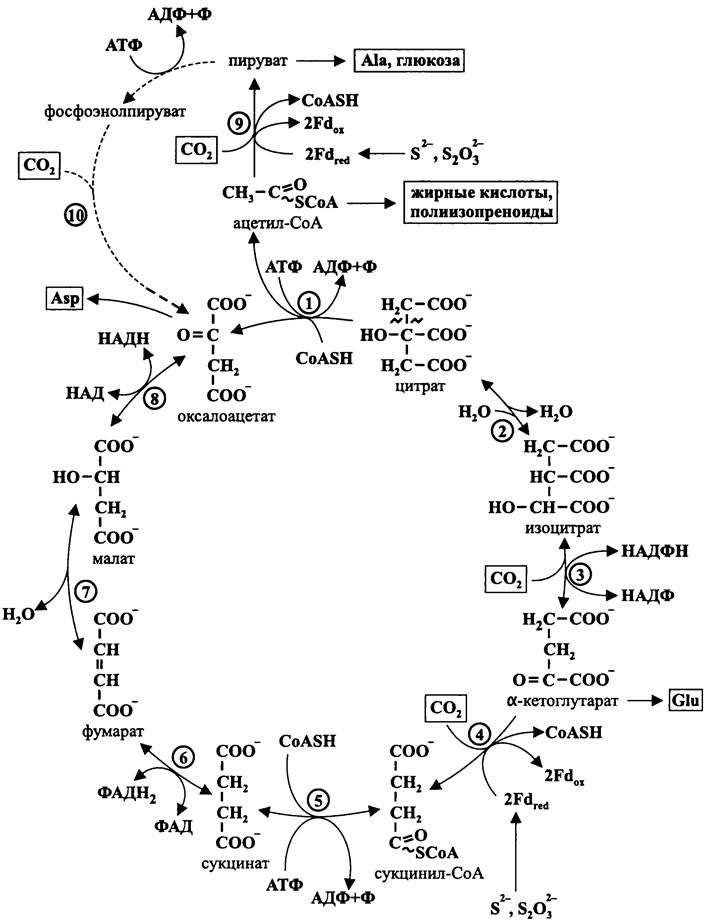
Основной вариант. В данном случае цикл «начинается» с оксалоацетата, который под воздействием НАДН-зависимой малатдегидрогеназы восстанавливается в L-малат. Затем стереоспецифичная фумаратгидратаза (фумараза) преобразует L- малат в фумарат. Далее из фумарата с помощью мембраносвязанной ФАДН2-зави- симой сукцинатдегидрогеназы образуется сукцинат (электроны для восстановления ФАД поступают из убихинонного пула).
На следующем этапе сукцинат с помощью сукцинил-СоА-синтетазы превращается в сукцинил-СоА. Для этого используется CoASH и гидролизуется одна молекула АТФ.
Ключевой реакцией цикла Ивенса-Бьюкенена-Эрнона является восстановительное карбоксилирование сукцинил-СоА, в результате чего образуется а-кетоглутарат. Специфическим восстановителем в данной реакции служит Fdred, а терминальным донором электронов для его возобновления — сульфид (S2-) или тиосульфат (S2O2-3).
После этого α-кетоглутарат восстановительно карбоксилируется в изоцитрат. В качестве донора электронов используется НАДФН, который регенерируется в НАДФ: ферредоксин-оксидоредуктазной реакции.
Затем с помощью аконитатгидратазы изоцитрат изомеризуется в цитрат; интермедиатом в этой реакции является трикарбоновая кислота cis-аконитат.
Вторая ключевая реакция цикла Ивенса-Бьюкенена-Эрнона — это расщепление цитрата на ацетил-СоА и оксалоацетат, которое осуществляется при помощи АТФ- цитратлиазы. При этом используется CoASH и гидролизуется одна молекула АТФ (рис. 145).
АТФ-цитратлиаза, катализирующая расщепление цитрата на оксалоацетат и ацетил-СоА (согласно уравнению реакции: АТФ + цитрат + СоА —> оксалоацетат + ацетилСоА + АДФ + Ф), широко распространена у эукариотов, в частности животных, растений и плесневых грибов.
Обнаружить АТФ-цитратлиазу в клетках С. limicola не удавалось в течение пятнадцати лет (что ставило под сомнение само существование замкнутого восстановительного цикла карбоновых кислот), пока Р. Н. Ивановский не выяснил, что для сохранения активности этого фермента на всех этапах выделения необходимо использовать восстановительный агент дитиотреитол (англ. dithiothreitol) в относительно высокой (>5 мМ) концентрации.
Прокариотная АТФ-цитратлиаза имеет молекулярную массу 240 кДа и в качестве кофактора использует катионы Мg2+.
Таким образом, в основном варианте цикла Ивенса-Быокенена-Эрнона происходят два карбоксилирования (С4 —> С5 и С5 —> С6), в результате чего образуется цитрат. Цитрат расщепляется на двухуглеродный конечный продукт, ацетил-СоА, и при этом регенерируется оксалоацетат. Общее уравнение цикла в данном случае выглядит следующим образом:
2СO2 + 2Fdred + НАДФН + НАДН + ФАДН2 + 2АТФ + СоАSН —> ацетил-СоА + 2Fdох + НАДФ + НАД + ФАД + 2АДФ + 2Ф + Н2O.
Ацетил-СоА-шунт. В отличие от основного варианта цикла Ивенса- Бьюкенена-Эрнона, в шунтированном варианте все «начинается» с ацетил-СоА. По ходу цикла происходят четыре карбоксилирования (С2 —> С3, С3 —> С4, С4 —> С5 и С5 —> С6). Два первых карбоксилирования (С2 —> С3, С3 —> С4), отсутствующие в основном варианте цикла, связаны соответственно с превращением ацетил-СоА в пируват и фосфоэнолпирувата в оксалоацетат. Остальные два карбоксилирования такие же, как в основном варианте цикла (С4 —> С5 и С5 —> С6).
При расщеплении цитрата образуется четырехуглеродный конечный продукт — оксалоацетат — и регенерируется ацетил-СоА. Общее уравнение цикла в данном случае выглядит следующим образом:
4СO2 + 4Fdred + НАДФН + НАДН + ФАДН2 + ЗАТФ + СоАSН —> оксалоацетат + 4Fdох + НАДФ + НАД + ФАД + ЗАДФ + ЗФ + Н2O.
Таким образом, в цикле Ивенса-Быокенена-Эрнона в роли С1-блока выступает СO2, и используются четыре органических акцептора — двухуглеродный (ацетил-СоА), трехуглеродный (фосфоэнолпируват), четырехуглеродный (сукцинил-СоА) и пятиуглеродный (α-кетоглутарат). В цикле участвуют три типа низкопотенциального восстановителя: Fdred(-420 мВ), НАДФН (-320 мВ), НАДН (-320 мВ) и ФАДН2 (-120 мВ), а также 2-3 молекулы АТФ на одну молекулу образующегося органического продукта.
Оксалоацетат, конечный продукт основного варианта цикла Ивенса-Быокенена- Эрнона, и его интермедиаты служат предшественниками при биосинтезе двух аминокислот — аспарагиновой и глутаминовой, а также используются при биосинтезе жирных кислот и полиизопреноидов (см. разделы 15.1.1 и 15.2.1). Шунтированный вариант позволяет дополнительно синтезировать аланин из пирувата и осуществлять глюконеогенез.
Эволюционные взаимоотношения восстановительного цикла карбоновых кислот (цикла Ивенса-Бьюкенена-Эрнона) и окислительного цикла карбоновых кислот (циклаКребса). Мы уже упоминали о том, что ацетатсин- тезирующий цикл Ивенса-Бьюкенена-Эрнона рассматривают как обращенный цикл Кребса, в котором происходит полное окисление ацетата, (см. раздел 11.4.2.1). Однако так можно сказать, лишь имея в виду онтогенез. Филогенетическое взаимоотношение этих циклов, по-видимому, противоположное, т. е. цикл Ивенса-Бьюкенена- Эрнона был эволюционным предтечей цикла Кребса.
Высказываются несколько общих доводов в пользу данного предположения. Во-первых, цикл Ивенса-Бьюкенена-Эрнона существует у наиболее архаичных бактерий, а также встречается у архей, что позволяет считать его свойством общего предка двух прокариотных доменов. Во-вторых, на смену умозрительным построениям А. И. Опарина-Дж. Холдейна (J. Haldane) об эволюционной первичности гетеротрофного питания приходит идея об эволюционной первичности углеродной
автотрофии. Втретьих, цикл Ивенса-Бьюкенена-Эрнона, основанный на ферредоксинзависимом карбоксилировании, может функционировать только у облигатно анаэробных прокариотов, которые занимают редуцирующие ниши реликтового типа. Вчетвертых, завершенный цикл Кребса широко распространен у филогенетически «молодых» бактерий-консументов.
Выяснить эволюционную иерархию метаболических систем намного сложнее, чем воссоздать эволюционное древо путем оценки гомологии рДНК. Одной из причин служит относительная легкость горизонтального переноса генов домашнего хозяйства (см. I том учебника) как на внутридоменном уровне, так и между отдельными доменами.
13.2.2. β-Оксипропионатный цикл, или цикл Фукса-Холо
По современным данным, такой цикл углеродной автотрофии встречается довольно редко. Он обнаружен у зеленой нитчатой бактерии Chloroflexus aurantiacus (фила ВVI Chlorofiexi), а также у трех представителей филы АI Crenarchaeota — Acidianus infernus, Metallosphaera sedula и Sulfolobus metallicus.
В 1989 г. немецкий микробиолог Холо (Н. Ноlо) обнаружил, что при фотоавтотрофном росте С. aurantiacus клетки экскретируют в культуральную среду β- оксипропионат. Это позволило предположить, что β-оксипропионат служит интермедиатом в ранее неизвестном цикле ассимиляции неорганического углерода. За период 1992-2002 гг. немецкий биохимик Фукс в общих чертах реконструировал систему реакций, лежащих в основе данного цикла. Ценный вклад в его изучение внес русский микробиолог Р. Н. Ивановский.
Этот цикл имеет три основные особенности, по которым он принципиально отличается от других механизмов углеродной автотрофии:
— во-первых, малонил-СоА за два этапа восстанавливается в β-оксипропионат, а затем за три этапа превращается в пропионил-СоА (рис. 146);
— во-вторых, продуктом цикла является глиоксилат, который образуется в результате асимметричного расщепления малил-СоА (вторым продуктом расщепления является ацетил-СоА);
— втретьих, окончательно не выяснена дальнейшая судьба продукта ассимиляции (глиоксилата).
Цикл «начинается» с того, что ацетил-СоА карбоксилируется биотинзависимой (см. рис. 82) ацетил-СоА-карбоксилазой. При этом используется энергия гидролиза АТФ. Образовавшийся малонил-СоА восстанавливается в β-оксипропионат. По этому промежуточному продукту весь цикл несправедливо называется «β-оксипропио- натным», или «3-гидроксипропионатным». Правильно было бы использовать термин «малонил-СоА-цикл», по первому продукту акцептирования неорганического углерода в форме бикарбоната (НСО-3).
Уникальный фермент цикла Фукса-Холо, бифункциональная малонил-СоА-редуктаза, работает в два этапа. Сначала образуется свободный полуальдегид малоновой кислоты, а затем он восстанавливается в β-оксипропионат. В обоих случаях расходуется НАДФН (рис. 146). Фермент представляет собой гомодимер молекулярной массой 300 кДа; предполагают, что большой С-концевой домен обладает альдегиддегидрогеназной, а малый N-концевой домен — алкогольдегидрогеназной активностью. Малонил-СоА-редуктаза не содержит кофакторов, однако стимулируется катионами Fе2+ и Мg2+.
Рис. 146. β-оксипропионатный цикл, или цикл Фукса-Холо. 1 — ацетил-СоА-карбоксилаза; 2 — малонил-СоА-редуктаза; 3 — β-оксипропионил-СоА-синтетаза; 4 — β-оксипропионил-СоА-дегидратаза; 5 — акрилоил-СоА-редуктаза; 6 — пропионил-СоА- карбоксилаза; 7 — метилмалонил-СоА-эпимераза; 8 — метилмалонил-СоА-мутаза; 9 — сукцинил- СоА: L-малат-СоА-трансфераза; 10 — сукцинатдегидрогеназа; 11 — фумаратгидратаза; 12 — L-малил-СоА-лиаза.
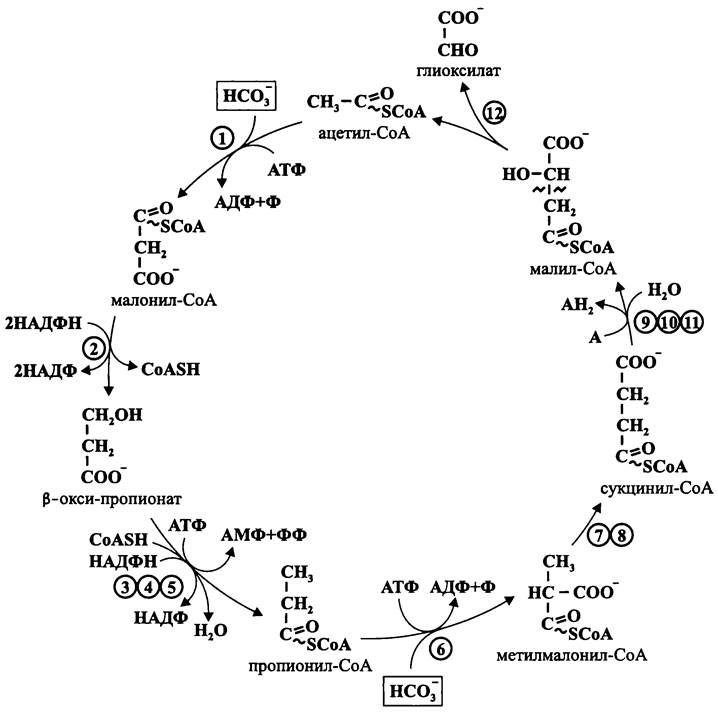
Образование пропионил-СоА из β-оксипропионата осуществляется с помощью трех ферментов. Вначале под воздействием синтазы он переводится в активированную форму — β-оксипропионил-СоА (с использованием АТФ, который гидролизуется до АМФ и пирофосфата). Затем дегидратаза отщепляет воду от β-оксипропионил-СоА, и образуется акрилоил-СоА. Наконец, НАДФН-зависимая редуктаза восстанавливает акрилоил-СоА в пропионил-СоА.
Пропионил-СоА карбоксилируется в метилмалонил-СоА, для чего используется вторая молекула бикарбоната и гидролизуется третья молекула АТФ.
Затем метилмалонил-СоА изомеризуется в сукцинил-СоА с помощью двух ферментов — эпимеразы и мутазы. Этот путь тривиален, поскольку с его помощью многие прокариоты ассимилируют пропионат.
Из сукцинил-СоА в три этапа образуется малил-СоА. Сперва СоА передается от сукцинил-СоА на L-малат. Образовавшийся сукцинат обычным путем окисляется в фумарат с помощью сукцинатдегидрогеназы (акцептор электронов еще не идентифицирован). Фумарат гидратируется в L-малат, который получает СоА от сукцинил-СоА.
Наконец, малил-СоА с помощью лиазы расщепляется на ацетил-СоА и глиоксилат, и цикл замыкается.
Общее уравнение цикла выглядит следующим образом:
2НСО3 + 3АТФ + 3НАДФН + А —> НСНО + 2АДФ + АМФ + 2Ф + ФФ + 3НАДФ + АН2 + Н2O + 2OН-,
где А — неидентифицированный акцептор электронов.
Мы уже говорили о том, что путь включения глиоксилата в клеточный материал окончательно не выяснен. Предположение, что он восстановительно аминируется в глицин, было скоро отвергнуто.
В 2002 г. группа Фукса получила данные о том, что ассимиляция глиоксилата протекает за несколько этапов (рис. 147).
Рис. 14 7. Путь ассимиляции глиоксилата у Chloroflexus aurantiacus. 1 — метилмалил-СоА-синтаза; 2 — мезаконил-СоА-гидратаза; 3 — мезаконат: цитрамалат-СоА-трансфераза; 4 — мезаконатгидратаза; 5 — цитрамалил-СоА-лиаза.
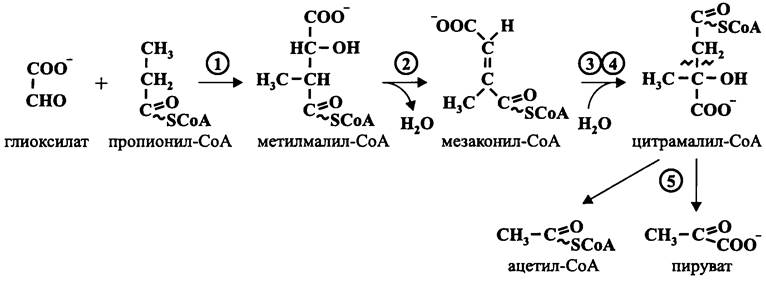
Вначале при помощи синтазы он конденсируется с пропионил-СоА с образованием метилмалил- СоА. После этого дегидратаза отщепляет воду от метилмалил-СоА, и образуется мезаконил-СоА. Затем мезаконил-СоА превращается в цитрамалил-СоА при помощи мезаконат: цитрамалат-СоА- трансферазы и мезаконатгидратазы. На последнем этапе лиаза расщепляет цитрамалил-СоА на ацетил-СоА и пируват. Полученные продукты тривиальным путем превращаются в аминокислоты, жирные кислоты и моносахара.
В 1993 г. Р. Н. Ивановский предложил схему альтернативного цикла автотрофной ассимиляции углерода, осуществляемого С. aurantiacus. В данном случае ацетил- СоА восстановительно карбоксилируется в пируват, который затем превращается в малат (см. рис. 145, реакции 9, 10 и 8). На завершающей стадии малат расщепляется на ацетил-СоА и глиоксилат.
13.2.3. Рибулозомонофосфатный цикл, или цикл Квайла
Рибулозомонофосфатный цикл существует у Methylobacter capsulatus, Methylococcus capsulatus, Methylomonas rubrum и других метанотрофов типа-1, которые принадлежат к филе ВХIIProteobacteria (см. раздел 11.4.4.2). Основные детали этого цикла были выявлены с начала 1960-х годов английскими микробиологами из Шеффилда и Варвика, прежде всего Квайлом (J.R. Quayle) и его сотрудниками.
В цикле Квайла клеточный углерод является продуктом ассимиляции формальдегида НСНО, т. е. неорганического субстрата, уровень восстановленности углерода в котором соответствует таковому в молекуле углевода (СН2O)n.
В природных условиях данный субстрат образуется в результате монооксигеназного окисления метана с последующим дегидрированием метанола (см. раздел 11.4.4.2).
Формальдегид — это высоко реакционноспособное соединение, и он токсичен для всех живых организмов. Однако метанотрофы адаптированы к формальдегиду, поскольку способны быстро его утилизировать.
Формальдегид используется в метаболизме метанотрофов одновременно в качестве источника энергии и строительного материала.
Рибулозомонофосфатный цикл состоит из трех основных этапов:
— акцептирование С1-блока;
— расщепление продукта акцептирования;
— регенерация акцептора.
Первый этап осуществляется путем конденсации трех молекул формальдегида с тремя молекулами рибулозо-5-фосфата, в результате чего образуются три молекулы гексозы — D-эритро-L-глицеро-3-гексулозо-6-фосфата (рис. 148). Путем изомеризации они превращаются в три молекулы фруктозо-6-фосфата.
Одна из трех молекул фруктозо-6-фосфата изомеризуется в глюкозо-6-фосфат. В результате уже знакомых нам реакций окислительного гексозомонофосфатного пути Энтнера-Дудорова (см. раздел 11.3.2.2 и рис. 87) глюкозо-6-фосфат превращается в 2-кето-3-дезокси-6-фосфоглюконат, из которого под воздействием альдолазы образуются молекула пирувата и молекула глицеральдегид-3-фосфата. Пируват фосфорилируется в фосфоэнолпируват, а тот, в свою очередь, гидратируется в 2- фосфоглицерат. Это соединение является продуктом цикла, и оно используется для образования клеточного материала.
Рис. 148. Рибулозомонофосфатный цикл, или цикл Квайла. 1 — 3-гексулозофосфат-синтаза; 2 — фосфо-3-гексулоизомераза; 3 — фосфоглюкоизомераза; 4 — глюкозо-6-фосфат-дегидрогеназа; 5 — фосфоглюконат-дегидратаза; 6 — альдолаза; 7 — фосфоэнолпируват- синтетаза; 8 — фосфопируват-гидратаза; 9 — транскетолаза; 10 — трансальдолаза; 11 — фосфопентоэпимераза; 12 — фосфопентоизомераза.
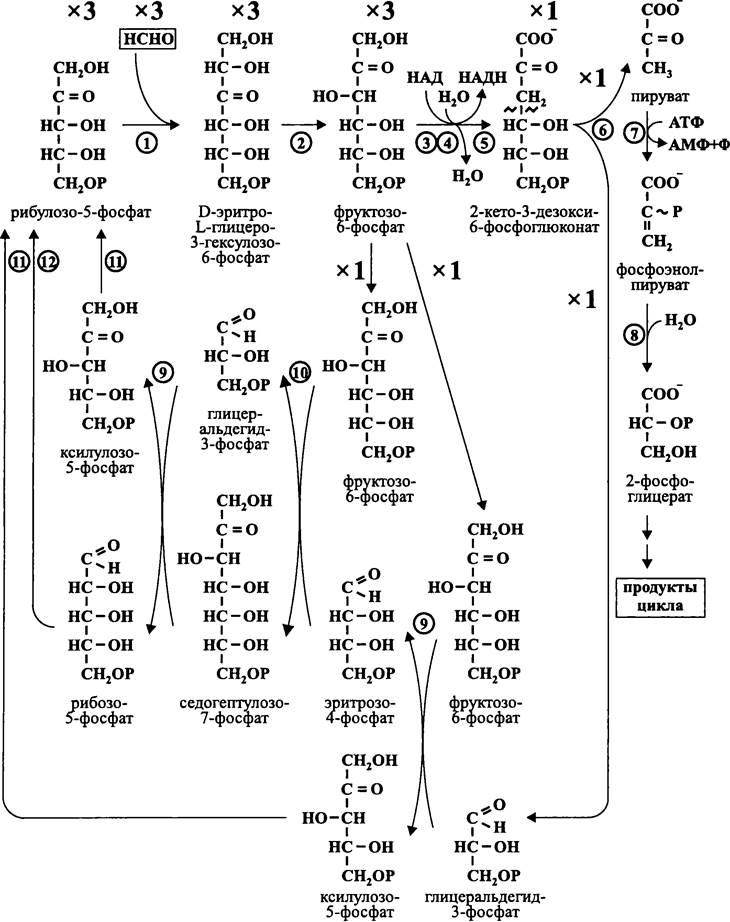
Две оставшиеся молекулы фруктозо-6-фосфата (2 х С6) вместе с молекулой глицеральдегид-3-фосфата (С3) используются для регенерации акцептора (З х С5). Это осуществляется в ходе реакций, уже знакомых нам по окислительному гексозомоно- фосфатному пути Варбурга-Диккенса-Хореккера (см. раздел 11.3.2.3 и рис. 102) — транскетолазной, трансальдолазной, фосфопентоэпимеразной и фосфопентоизомеразной.
Общее уравнение цикла Квайла выглядит следующим образом:
3НСНО + НАД + АТФ + Н2О —> 2-фосфоглицерат + НАДН + АМФ + Ф.
Интермедиатами цикла являются трех-семи углеродные сахара. Примечательно, что в нем не расходуется, а образуется восстановитель (НАДН), который используется в конструктивных процессах.
У факультативных метанотрофов типа-1 имеется альтернативный, более редкий вариант рибулозомонофосфатного цикла.
Одна из трех молекул фруктозо-6-фосфата не окисляется в 2-кето-3-дезокси-6-фосфоглюконат, а фосфорилируется во фруктозо-1,6-бисфосфат. Затем, как при гликолизе (см. раздел 11.3.2.1 и рис. 86), она расщепляется альдолазой на глицеральдегид-3-фосфат и диоксиацетонфосфат.
Диоксиацетонфосфат окисляется в 1,3-бисфосфоглицерат, а тот превращается в 2-фосфоглицерат (при этом фосфорилируется молекула АДФ). Две оставшиеся молекулы фруктозо-6-фосфата вместе с молекулой глицеральдегид-3-фосфата используются для регенерации акцептора — рибулозомонофосфата.
Общее уравнение цикла Квайла в данном случае выглядит следующим образом:
3НСНО + НАД + Н2О + Ф —> 2-фосфоглицерат + НАДН.
Необходимо подчеркнуть, что в этом варианте цикла Квайла не расходуется, а образуется восстановитель (НАДН), а энергия АТФ вообще не затрачивается.
Несостоятельную идею о том, что растения образуют углеводы путем конденсации формальдегида, впервые высказал немецкий химик Адольф фон Байер (А. Bayer, Нобелевская премия по химии, 1905 г.). Русский химик А. М. Бутлеров в начале 1860-х годов синтезировал из формальдегида сахароподобное вещество, которое он назвал «метиленитаном». И хотя впоследствии оказалось, что путь углерода в растительном фотосинтезе совершенно иной, а использование формальдегида метанотрофами не приводит к прямому образованию гексоз, перед нами один из любопытных примеров диалектики естествознания.
13.2.4. Сериновый цикл, или цикл О’Коннора-Хэнсона
Сериновый цикл имеется у Methylocystis sp., Methylosinus trichosporium, Methylovibrio soehngenii и других факультативных метанотрофов типа-II, которые принадлежат к филе ВХIIProteobacteria (см. раздел 11.4.4.2).
Ключевой фермент этого цикла, оксипируват-редуктаза, был впервые обнаружен Квайлом в 1970 г. Однако «персональное» название сериновый цикл получил в честь английских биохимиков О’Коннора (М. L. O’Connor) и Хэнсона (R. S. Hanson), которые в 1970-1980 гг. внесли решающий вклад в изучение энзимологии метанотрофов типа-Н. В частности, они охарактеризовали другой ключевой фермент этого цикла — серин-оксиметил-трансферазу.
Как и в рибулозомонофосфатном цикле Квайла, в сериновом цикле О’Коннора- Хэнсона ассимилируется формальдегид. Однако помимо него используется еще один C1-блок, а именно СО2.
Формальдегид первоначально акцептируется неферментативным путем. Акцептором служит тетрагидрофолат, в результате чего образуется N-формил-Н4фолат (см. рис. 122).
Первый энзиматический шаг осуществляется при помощи ключевого фермента — серин-оксиметил-трансферазы, переносящего формильную группу от N-формил-Н4фолата на глицин с образованием серина (рис. 149). Этот фермент тривиален, его использует для биосинтеза серина и пуриновых оснований большинство бактерий, но только у метанотрофов он занимает центральное место в конструктивном метаболизме.
Аминогруппа от серина передается глиоксилату. Катализатором этой реакции служит серин: глиоксилат-аминотрансфераза, а ее продуктами — соответственно оксипируват и глицин.
Вторым ключевым ферментом данного цикла служит растворимая НАДН-зависимая оксипируват-редуктаза, восстанавливающая оксипируват в глицерат. Затем
глицерат фосфорилируется в 2-фосфоглицерат, который частично идет на образование продуктов цикла, а частично используется для регенерации акцептора формильной группы — глицина (рис. 149).
Рис. 149. Сериновый цикл, или цикл О’Коннора-Хэнсона. I — основной (восстановительный) цикл; II — вспомогательный (окислительный) цикл; 1 — серин- оксиметил-трансфераза; 2 — серин: глиоксилат-аминотрансфераза; 3 — оксипируват-редуктаза; 4 — глицераткиназа; 5 — фосфопируват-гидратаза; 6 — фосфоэнолпируват-карбоксилаза; 7 — малатдегидрогеназа; 8 — малат-тиокиназа; 9 — малил-СоА-лиаза; 10 — цитратсинтаза; 11 — аконитаза; 12 — изоцитратлиаза; 13 — сукцинатдегидрогеназа; 14 — фумараза; 15 — малатдегидрогеназа.
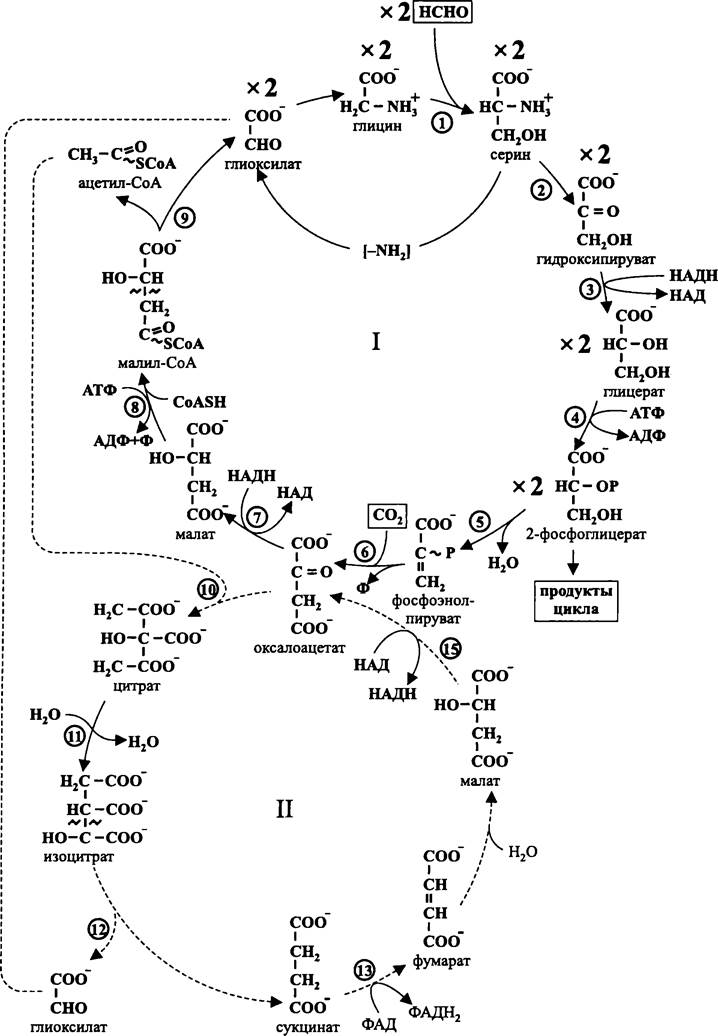
Из второй молекулы 2-фосфоглицерата под воздействием фосфопируват-гидратазы образуется фосфоэнолпируват, который карбоксилируется в оксалоацетат, а тот восстанавливается в малат. Затем малат переводится в активированную форму — малил-СоА. Под воздействием лиазы малил-СоА расщепляется на ацетил-СоА и глиоксилат, и цикл замыкается.
Способ образования второй молекулы глиоксилата долго оставался под вопросом. В конце концов выяснилось, что для этого другой продукт малил-СоА-лиазной реакции — ацетил-СоА — «пропускается» через окислительный цикл карбоновых кислот (рис. 149, II). Этот вспомогательный цикл у метанотрофов состоит из тривиальных реакций, уже знакомых нам по описанию циклов Кребса и Ивенса-Бьюкенена-Эрнона. В результате него образуется ключевой интермедиат серинового цикла — глиоксилат. Кроме того, выигрывается восстановитель в форме НАДН и ФАДН2.
Интермедиатами цикла О’Коннора-Хэнсона являются аминокислоты глицин и серин, а также предшественник аспарагиновой кислоты — оксалоацетат. Другой интермедиат, ацетил-СоА, расходуется при биосинтезе жирных кислот и полиизопреноидов.
Общее уравнение цикла О’Коннора-Хэнсона выглядит следующим образом:
2НСНO + СO2 + 2НАДН + ФАД + ЗАТФ —> 2-фосфоглицерат + 2НАД + ФАДН2 + 3АДФ + 2Ф.
После превращения 2-фосфоглицерата в 3-фосфоглицерат он может использоваться в разнообразных биосинтезах, в том числе при глюконеогенезе.
13.2.5. Восстановительный пентозофосфатный цикл, или цикл Кельвина-Бенсона-Бэссема
По своему значению для первичной продукции данный цикл занимает ведущее положение в биосфере. Среди всех циклов и путей автотрофной ассимиляции углерода он распространен наиболее широко. Он универсален для всех типов ассимилирующих пластид. У прокариотов, помимо фототрофных и хемолитотрофных представителей филы ВХIIProteobacteria, он имеется у всех представителей филы ВХ Cyanobacteria и, возможно, у некоторых экстремально галофильных и экстремально термофильных архей.
RuBisCO. Ключевым ферментом цикла Кельвина-Бенсона-Бэссема является бифункциональная рибулозо-1,5-бисфосфат-карбоксилаза/оксигеназа (англ. ribulose 1,5-bisphosphatecarboxy lase/oxygenase, RuBisCO). В первом томе учебника мы уже останавливались на некоторых особенностях этого фермента, в частности рассматривали его компартментализацию в карбоксисомах.
У разных живых организмов существуют две молекулярные формы RuBisCO — I и II. Форма I состоит из восьми больших (англ. large, L; 55 кДа) и восьми малых (англ. small, S; 15 кДа) субъединиц. Форма II состоит только из двух больших субъединиц, которые сильно отличаются по аминокислотной последовательности от больших субъединиц формы I.
В настоящее время секвенированы около 800 индивидуальных генов rbcL, и на основе полученных данных построено филогенетическое древо RuBisCO. Форма I представлена на нем двумя ветвями — «зеленой» (цианобактерии, ряд αβy-протеобактерий, пластиды зеленых водорослей) и «красной» (ряд αβ-протеобактерий, пластиды криптофитных и бурых водорослей). Форма II представлена отдельной ветвью (ряд αβy-протеобактерий, пластиды динофлагеллят). Таким образом, филогения RuBisCO по результатам секвенирования гена rbcL не согласуется с филогенией ее владельцев, реконструированной на основе анализа последовательности гена 16S рРНК (см. I том учебника). Возможно, что в ходе эволюции ген rbcL подвергался «горизонтальному» переносу.
Форма II в аэробных условиях неэффективна, поскольку ее сродство по отношению к СО2 значительно меньше, чем по отношению к О2. Это дает основание считать форму II более архаичной, и, вероятно, она была эволюционным предшественником формы I.
RuBisCO впервые выделили как «фракцию I» из листьев табака в 1947 г. американские биохимики Уилдмэн (S. G. Wildman) и Боннэр (J. Bonner). Через несколько лет американские биохимики Кельвин (М. Calvin, Нобелевская премия по химии, 1961 г.), Бенсон (A. A. Benson) и Бэссем (J. A.Bassham), а также их английские коллеги Рэкер (Е.Racker) и Хореккер (В. L. Ногескег) установили, что этот фермент катализирует реакцию карбоксилирования рибулозо-1,5-бисфосфата с последующим расщеплением шестиуглеродного интермедиата на две молекулы 3-фосфоглицерата.
В начале 1970-х годов американские биохимики Огрен (W. L. Ogren) и Толберт (N.E.Tolbert) выяснили, что, наряду с карбоксилазной активностью, рибулозо-1,5-бисфосфат-карбоксилаза обладает оксигеназной активностью — рибулозо-1,5- бисфосфат присоединяет молекулу кислорода, и затем пятиуглеродный интермедиат расщепляется на молекулу 3-фосфоглицерата и молекулу 2-фосфогликолата.
При взаимодействии высокореактивной 2,3-эндиольной формы рибулозо-1,5-бис- фосфата (см. ниже) с RuBisCO образуются не только интермедиаты карбоксилазной и оксигеназной реакций, но и ряд минорных продуктов — рибулозо 1,5-бисфосфат и ксилулозо-1,5-бисфосфат (в результате протонирования в положении 3), а также 3-кетоарабинитол-1,5-бисфосфат (в результате протонирования в положении 2).
Благодаря способности одновременно катализировать карбоксилазную и окси- геназную реакции RuBisCO является главным действующим лицом в двух взаимно конкурирующих физиологических процессах — цикле восстановления углерода и цикле окисления углерода.
Первый цикл лежит в основе глобальной первичной продукции, и благодаря ему СО2 используется для биосинтеза углеводов (одновременно с этим газообразный СО2 удаляется из атмосферы, что уменьшает парниковый эффект). Второй цикл физиологически непродуктивен и резко снижает эффективность автотрофного роста, однако он неизбежен в аэробных условиях.
Соотношение восстановительного и окислительного циклов варьирует у разных организмов и определяется способностью RuBisCO взаимодействовать преимущественно с СО2 или О2 (фактор субстратной специфичности т), а также зависит от клеточных механизмов, концентрирующих СО2 в зоне активного центра.
Из-за оксигеназной реакции может теряться до 50% связанного углерода, хотя существуют физиологические механизмы, препятствующие этому негативному явлению (см. ниже).
Недостаток RuBisСО заключается не только в способности катализировать физиологически непродуктивную оксигеназную реакцию. Для этого фермента характерно очень низкое сродство к главному субстрату, СО2 (Кm >150 мкМ). Наконец, это самый «медленный» из всех известных ферментов. Его молярная активность (частное от деления максимальной скорости реакции Vmах, выраженной в молях переработанного субстрата • мин-1 на число молей фермента) составляет ~50. Иными словами, одна молекула RuBisСО за одну секунду «фиксирует» только одну молекулу СО2. Для сравнения укажем, что молярная активность одного из самых эффективных ферментов, карбоангидразы (катализирует реакцию СО2 + ОН-⇄ НСО-3), составляет ~3 • 107. Очень низкое «число оборотов» RuBisСО компенсируется высоким удельным содержанием этого фермента в прокариотных клетках и пластидах (до 50% растворимого белка), что в пересчете на его глобальное количество составляет 108 т, или по 20 кг на каждого жителя Земли.
Карбоксилазная реакция (рис. 150, А) осуществляется в пять этапов:
— спонтанная энолизация, связанная с депротонированием в положении 3 и появлением нуклеофильного центра в положении 2, в результате чего образуется высокореактивная 2,3-эндиольная форма рибулозо-1,5-бисфосфата;
— ферментативное карбоксилирование 2,3-эндиольной формы рибулозо-1,5-бис- фосфата с образованием шестиуглеродного интермедиата, 2-карбокси-3-кето-D- арабинитол-1,5-бисфосфата (англ. 2-сагbоху-3-кеto-D-аrabinitol 1,5-bisphosphate, СКАВР);
— спонтанная гидратация 3-кето-формы СКАВР, в результате чего образуется следующий шестиуглеродный интермедиат, 2-карбокси-3-ди-ол-D-рибитол-1,5-бис- фосфат (англ. 2-сагbоху-3-di-ol-ribitol 1,5-bisphosphate, СDRВР);
— спонтанное расщепление СDRВР, приводящее к образованию карбоаниона 3-фосфоглицерата в положении 2, а также молекулы 3-фосфоглицерата;
— спонтанное протонирование карбоаниона, в результате чего образуется вторая молекула 3-фосфоглицерата.
Помимо того, что RuBisСО связывает СО2 в карбоксилазной реакции, этот фермент в обязательном порядке активируется «не субстратным» АСO2, который образует карбамат с остатком Lys-201 в составе L-субъединицы: RuBISCO-NH+3 +AСO2 —> RuBisСО-NH-АСОO- + 2Н+. Эта регуляторная реакция требует присутствия катионов Мg2+ и катализируется RuBisСО-активазой.
Оксигеназная реакция (рис. 150, Б) осуществляется в три этапа:
— спонтанная энолизация, связанная с депротонированием в положении 3 и появлением нуклеофильного центра в положении 2;
— ферментативное оксигенирование 2,3-эндиольной формы рибулозо-1,5-бисфосфата с образованием пятиуглеродного интермедиата, 2-перокси-3-кето-D-рибитол- 1,5-бисфосфата (англ. 2-регоху-3-кеtо-D-ribitol 1,5-bisphosphate, РKRB);
— спонтанное расщепление РКRB, приводящее к образованию молекулы 2-фосфогликолата и молекулы 3-фосфоглицерата.
Рис. 150. Карбоксилазная (А) и оксигеназная (Б) реакции, осуществляемые рибулозо-1,5-бисфосфат-карбоксилазой/оксигеназой. СКАВР — 2-карбокси-3-кето-D-арабинитол-1,5-бисфосфат; СDRBР — 2-карбокси-3- ди-ол-D-рибитол-1,5-бисфосфат; РКRB — 2-перокси-3-кето-D-рибитол-1,5-бисфосфат.
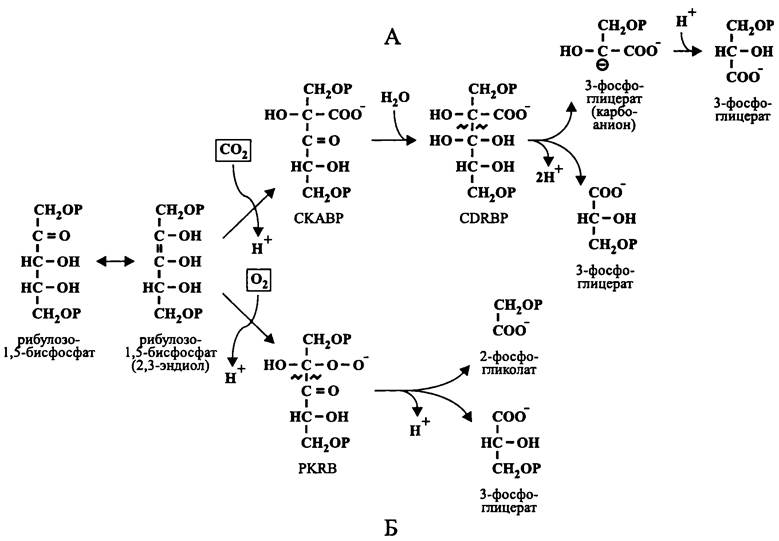
Оксигеназная реакция, которую катализирует RuBisСО, происходит без участия кофакторов, которые обычно требуются для активации кислорода (в частности, редокс-активных металлических центров; см. раздел 11.4.6.1). Как уже указывалось, ее предпосылкой служит высокая реакционная способность 2,3-эндиольной формы рибулозо-1,5-бисфосфата.
Молекула кислорода в невозбужденном состоянии триплетна (поскольку она содержит два неспаренных электрона с одинаковыми спинами), и поэтому ее непосредственное присоединение по ковалентной связи, образованной электронами с противоположными спинами, находится под спиновым запретом. В случае RuBisСО проблема инверсии спина, по-видимому, решается путем промежуточного образования свободных радикалов рибулозо-1,5-бисфосфата и молекулярного кислорода.
Цикл восстановления углерода. Основные его детали были реконструированы в 1946-1956 гг. Мелвином Кельвином с сотрудниками.
Он начинается с того, что три молекулы рибулозо-1,5-бисфосфатакарбоксилиру- ются при помощи RuBisСО, и образуются шесть молекул 3-фосфоглицерата, которые фосфорилируются киназой в шесть молекул 1,3-бисфосфоглицерата (рис. 151). После этого НАДФ-зависимая дегидрогеназа восстанавливает их в шесть молекул глицеральдегид-3-фосфата. Одна из них покидает цикл и используется при биосинтезе клеточного материала.
Рис. 151. Восстановительный пентозофосфатный цикл, или цикл Кельвина-Бенсона- Бэссема. 1 — фосфорибулокиназа; 2 — рибулозо-1,5-бисфосфат-карбоксилаза/оксигеназа; 3 — фосфоглицерат-киназа; 4 — триозофосфат-дегидрогеназа; 5 — триозофосфат-изомераза; 6 — альдолаза; 7 — фосфатаза; 8 — транскетолаза; 9 — фосфопентоэпимераза; 10 — фосфопентоизомераза.
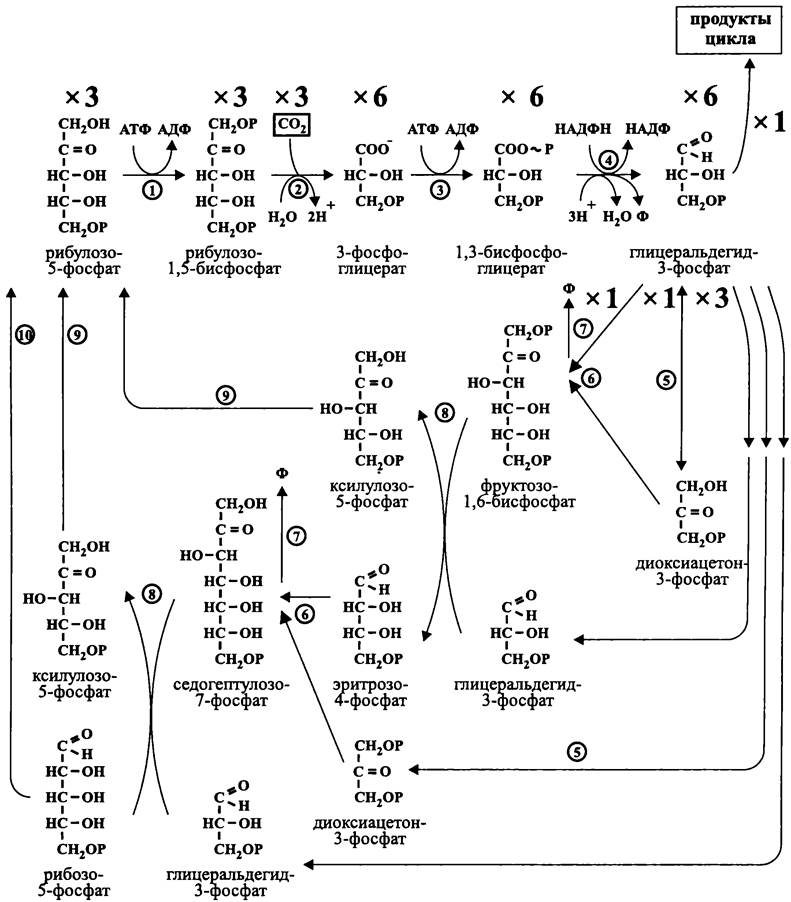
Остальные пять молекул глицеральдегид-3-фосфата (5 х Сз) расходуются для регенерации акцептора (3 х С5). Это происходит в ходе реакций, уже знакомых нам по гликолизу (см. раздел 11.3.2.1 и рис. 86), а также по окислительному гексозомоно- фосфатному пути Варбурга-Диккенса-Хореккера (см. раздел 11.3.2.3 и рис. 102) — альдолазной, транскетолазной, фосфопентоэпимеразной и фосфопентоизомеразной.
Общее уравнение цикла Кельвина-Бенсона-Бэссема выглядит следующим образом:
3СO2 + 6НАДФН + 9АТФ + 12Н+ —> глицеральдегид-3-фосфат + 6НАДФ + 9АДФ + 8Ф + ЗН2O.
Продукт цикла, глицеральдегид-3-фосфат, может использоваться в разнообразных биосинтезах, в первую очередь при глюконеогенезе.
Цикл окисления углерода. Как уже отмечалось, в результате оксигеназной реакции RuBisСО поглощается кислород, а углерод выделяется в ви-
де СO2. По этим признакам газообмена данный процесс у фотосинтетиков назван фотодыханием (англ. photosperation), а у хемосинтетиков хемодыханием (англ. chemorespiration).
У так называемых «Сз-растений» фотодыхание усиливается при относительно низком содержании СО2 и относительно высоком содержании кислорода. Этот процесс компартментализован сразу в трех органеллах — хлоропласте, пероксисоме и митохондрии. До 75% образовавшегося 2-фосфогликолата возвращаются в цикл Кельвина-Бенсона-Бэссема с помощью энергозависимого «гликолатного» пути.
В самом общем виде последовательность событий при фотодыхании выглядит следующим образом. Образовавшийся в хлоропласте 2-фосфогликолат дефосфорилируется в гликолат, который экспортируется в пероксисому. Там он при помощи оксидазы превращается в глиоксилат, который переаминируется с серином с образованием глицина. Затем глицин экспортируется в митохондрию, где из двух его молекул (с потерей СО2 и NH3) образуется молекула серина. Из митохондрии серин экспортируется в пероксисому, где он переаминируется с глицином и превращается в гидрокси- пируват. Гидроксипируват восстанавливается в глицерат, который экспортируется в хлоропласт. Наконец, глицерат превращается в 3-фосфоглицерат, и тот направляется в восстановительный цикл.
В отличие от большинства растений, прокариоты обладают эффективными механизмами для концентрирования СО2, и поэтому у них скорость карбоксилазной реакции выше, чем оксигеназной. Тем не менее, в аэробных условиях наряду с 3-фосфоглицератом всегда образуется 2-фосфогликолат, что приводит к неизбежной потере акцептированного углерода.
Гликолатный путь у прокариотов выражен слабо или вообще отсутствует. Вместо него функционирует другой механизм, лучше всего изученный у цианобактерий (рис. 152).
Рис. 152. Пути углерода при фотодыхании и хемодыхании. 1 — рибулозо-1,5-бисфосфат-карбоксилаза/оксигеназа; 2 — фосфогликолат-фосфатаза; 3 — гликолат- дегидрогеназа; 4 — синтаза тартронового полуальдегида; 5 — глицератдегидрогеназа; 6 — глицераткиназа.
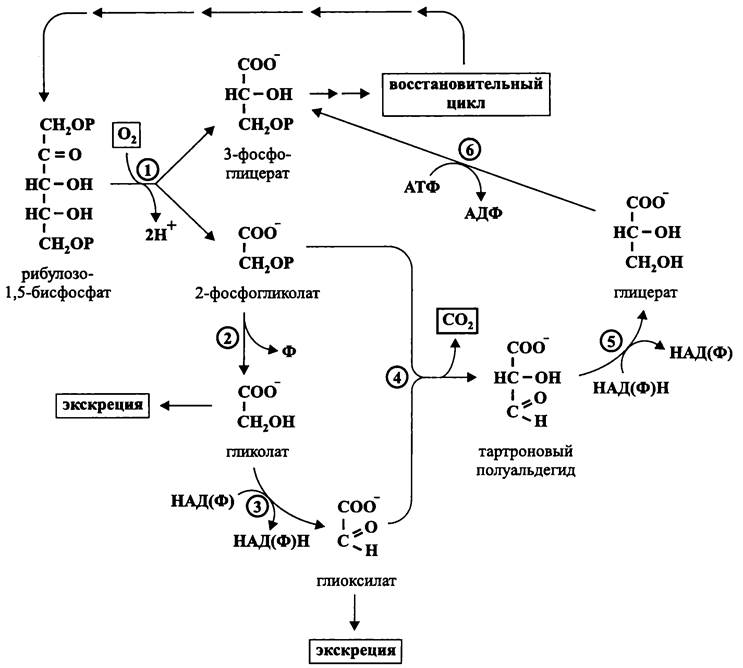
Под воздействием фосфатазы 2-фосфогликолат теряет фосфорильную группу и либо экскретируется, либо окисляется особой дегидрогеназой в глиоксилат, который частично экскретируется, а частично взаимодействует с гликолатом с образованием тартронового полуальдегида. Последний восстанавливается в глицерат, а тот фосфорилируется в 3-фосфоглицерат, который поступает в восстановительный цикл.
Цикл Кельвина-Бенсона-Бэссема у архей. Вопрос о существовании данного цикла у архей еще открыт. В 1990 г. у экстермального галофила Halobacterium mediterranei (фила АIIEuryarchaeota) были обнаружены два ключевых фермента этого цикла — фосфорибулокиназа и RuBisСО, но их активность оказалась крайне низкой. В 2003 г. было показано, что гипертермофилы Pyrodictium abyssii и Р. occultum (фила АI Crenarchaeota) содержат термостабильную RuBisСО. Однако у них не удалось выявить второй ключевой фермент — фосфорибулокиназу.
Эволюционные взаимоотношения цикла Кельвина-Бенсона-Бэссема, цикла Варбурга-Диккенса-Хореккера и цикла Квайла. По аналогии с восстановительным циклом трикарбоновых кислот Ивенса-Бьюкенена-Эрнона, который рассматривают как обращенный окислительный цикл трикарбоновых кислот Кребса (см. раздел 13.2.1), восстановительный пентозофосфатный цикл Кельвина- Бенсона-Бэссема считают обращенным пентозофосфатным циклом Варбурга- Диккенса-Хореккера. Это справедливо лишь в онтогенетическом плане. Филогенетическое взаимоотношение этих циклов, по-видимому, противоположно, т. е. цикл Кельвина-Бенсона-Бэссема был эволюционным предтечей цикла Варбурга- Диккенса-Хореккера.
Существуют два основных довода в пользу данного предположения. Во-первых, ключевые ферменты цикла Кельвина-Бенсона-Бэссема имеются у наиболее архаичных бактерий (в частности, цианобактерий), а также у архей, что позволяет считать его физиологическим свойством общего предка двух прокариотных доменов. Во-вторых, судя по глобальному родословному древу (см. I том учебника), более архаичные бактерии — преимущественно автотрофы, а менее архаичные бактерии — преимущественно гетеротрофы.
Эволюционная иерархия рибулозобисфосфатного цикла Кельвина-Бенсона-Бэссема и рибуло- зомонофосфатного цикла Квайла также стоит под вопросом. Поскольку в первом из них используется более сложный ферментативный аппарат, предполагается, что этот цикл был эволюционно вторичным.
13.2.6. Сравнение циклов автотрофной ассимиляции углерода
Таким образом, в настоящее время известны пять циклов автотрофной ассимиляции углерода (табл. 15).
Таблица 15. Важнейшие характеристики циклов автотрофной ассимиляции углерода
Цикл |
Распространение |
Акцептор C1-блока |
C1-блок |
Конечный продукт |
Затрата энергии (моль АТФ на моль конечного продукта) |
Затрата восстановителя (моль е- на моль конечного продукта) |
Ивенса-Бьюкенена- Эрнона (основной вариант) |
Aquifex pyrophilus, Hydrogenobacter thermophilus (BI Aquificae); Chlorobium limicola (BXI Chlorobi), Desulfobacter sp. (BXIIProteobacteria); Sulfolobusacdocaldarius, Thermoproteusneutrophilus (AICrenarchaeota) |
Сукцинил-СоА; α-кетоглутарат |
CO2 |
Ацетил-СоА |
2 |
8 |
Ивенса- Бьюкенена- Эрнона (ацетил- СоА-шунт) |
To же |
Сукцинил-СоА; α-кетоглутарат |
СО2 |
Оксалоацетат |
3 |
10 |
Фукса-Холо |
Chloroflexus aurantia- cus (BVI Chloroflexi); Acidianus infemus, Metallosphaera sedula, Sulfolobus metallicus (AI Crenarchaeota) |
Ацетил-СоА, пропионил-СоА |
НСО-3 |
Глиоксилат |
3 |
6 |
Квайла (основной вариант) |
Methylobacter capsulatus, Methylococcus capsulatus, Methylomonas rubrum и др. метанотрофытипа-1 (BXII Proteobacteria) |
Рибулозо-5-фосфат |
НСНО |
2-фосфоглицерат |
1 |
0 |
Квайла (альтернативный вариант) |
To же |
Рибулозо-5-фосфат |
НСНО |
2-фосфоглицерат |
0 |
0 |
О’Коннора- Хэнсона |
Methylocystis sp., Mehylosinustrichospo- rium, Methylovibriosoehngenii и др. метанотрофы типа-II (BXIIProteobacteria) |
Глицин, фосфоэнолпируват |
НСНО, CO2 |
2-фосфоглицерат |
3 |
6 |
Кельвина-Бенсона- Бэссема |
BX Cyanobacteria(все представители); BXII Proteobacteria(фототрофные и хемолитотрофные представители) |
Рибулозо- 1,5-бисфосфат |
CO2 |
Глицеральдегид-3-фосфат |
9 |
12 |
Два из них, а именно восстановительный цикл карбоновых кислот и рибулозомонофосфатный цикл, существуют в альтернативных вариантах. Возможно, что альтернативными вариантами представлен еще один цикл, β-оксипропионатный.
Не исключено, что помимо рассмотренных циклов в природе существуют и другие. В этом плане особо интересны экстремально термофильные археи. Есть данные, указывающие на возможность того, что у Sulfolobus brierleyi имеется особый вариант восстановительного цикла карбоновых кислот.
Распространение. Самым распространенным является цикл Кельвина- Бенсона-Бэссема. За ним с большим отрывом следуют циклы Квайла, О’Коннора-Хэнсона и Ивенса-Бьюкенена-Эрнона. Самым редким, по-видимому, является цикл Фукса-Холо.
Акцепторы С1-блока. Формально их можно отнести к трем группам:
— неактивированные аминокислоты (глицин, α-кетоглутарат);
— СоА-активированные органические кислоты (ацетил-СоА, пропионил-СоА, сукцинил-СоА);
— фосфорил-активированные органические кислоты и сахара (фосфоэнолпируват, рибулозо-5-фосфат, рибулозо-1,5-бисфосфат).
Как видно из приведенного перечня, в большинстве случаев активация акцептора необходима. Реже она не нужна (при восстановительном карбоксилировании α- кетоглутарата или оксиметилировании глицина).
С1-блоки. Как известно, углеродные автотрофы могут использовать в качестве энергетических и конструктивных субстратов разнообразные С1-соединения. Степень восстановленности углерода в этих субстратах возрастает в ряду СO2(НСO-3, НСОО-) —> СО —> НСНО —> СН3-.
Однако непосредственное акцептирование С1-блока осуществляется только в трех формах: СО2, НСО3- и НСНО. Поскольку в последнем случае углерод находится на уровне восстановленности в углеводе, это предопределяет тип образующегося конечного продукта, а также затраты энергии и восстановителя на его образование.
Конечные продукты. В ходе циклов автотрофной ассимиляции углерода могут образовываться три типа конечных продуктов, которые идут на построение разного клеточного материала:
— ацетил-СоА (используется для биосинтеза жирных кислот и полиизопреноидов);
— глиоксилат и оксалоацетат (используются для биосинтеза жирных кислот, полиизопреноидов и аминокислот);
— 2-фосфоглицерат и глицеральдегид-3-фосфат (используются для биосинтеза углеводов).
В первом и втором случаях существуют предпосылки для активного синтеза белка и, следовательно, для быстрого роста и размножения. В третьем случае создаются условия для запасания резервных полигликозидов.
Затраты энергии. Самым «расточительным» является цикл Кельвина- Бенсона-Бэссема (9 молекул АТФ на одну молекулу конечного продукта). В остальных случаях расход АТФ составляет 1-3 молекулы. Особое положение занимает альтернативный вариант цикла Квайла, протекающий с нулевым балансом энергии (расход одной молекулы АТФ на фосфорилирование фруктозо-6-фосфата компенсируется фосфорилированием одной молекулы АДФ на уровне субстрата).
Затраты восстановителя. Наибольшее количество низкопотенциальных электронов (в расчете на молекулу конечного продукта) затрачивается в цикле Кельвина-Бенсона-Бэссема (12). За ним следуют циклы Ивенса-Бьюкенена-Эрнона (8-10), Фукса-Холо и О’Коннора-Хэнсона (по 6). Цикл Квайла вообще является «нерасточительным», поскольку в нем не расходуется восстановитель.
Простое утилитарное объяснение, почему бактерия или археот обладают тем или иным циклом, отсутствует. Например, самый неэффективный цикл Кельвина- Бенсона-Бэссема распространен наиболее широко. По-видимому, решающее значение имеет не тип используемого цикла, а комплекс эволюционно приобретенных физиологических свойств, позволяющих прокариотным организмам занимать определенные экологические ниши.
13.3. Пути углеродной автотрофии
За счет катаболических процессов, например, брожения, энергия ассимилируется. Это очевидно и не нуждается в комментариях.
В свою очередь, общеизвестно, что анаболические процессы, например, фотосинтез, требуют энергетических затрат. Поэтому предположение о том, что энергию при углеродной автотрофии можно не расходовать, а наоборот — извлекать, на первый взгляд, кажется парадоксальным.
Однако существуют два механизма углеродной автотрофии, когда при ассимиляции С1-блоков прокариоты не только не расходуют энергию, но, напротив, получают энергетический выигрыш.
13.3.1. Восстановительный ацетил-коэнзимный путь метаногенов, или путь Вулфа
Этот путь имеется у метаногенных архей (фила АII Euryarchaeota). Кроме того, им обладают автотрофные сульфатредуцирующие археи, относящиеся к роду Archaeoglobus (фила АIIEuryarchaeota).
Основные этапы глобального метаболического пути метаногенеза, где конструктивные процессы тесно переплетены с энергетическими, были выяснены в 1960-е годы американским биохимиком Ральфом Вулфом.
Чтобы не повторяться, мы отсылаем читателя к разделу 11.4.5.4, в котором уже были рассмотрены промежуточные реакции пути Вулфа, позволяющие метаногенным археям ассимилировать энергию в форме Рmf и Smf.
С формальной точки зрения автотрофный ацетогенез — это простейший путь сборки «минимальной» органической молекулы из двух С1-блоков: метальной [СН3-] и карбонильной группы [СО]:
СO2 + 6Н+/6е- —> [СН3-] + СоАSН} —> СН3СО ≈ SСоА.
СO2 + 2Н+/2е- —> [СО]
У метаногенных архей для восстановления обеих молекул СO2 используется молекулярный водород.
Источником метильной группы служит конечный продукт из II цикла «гидрогенотрофного» метаногенеза — N-метил-H4МРТ (см. раздел 11.4.5.4, а также рис. 116 и 118). От него метальная группа передается белку C/Fe-SP (см. раздел 11.4.5.5),
который представляет собой гетеродимер субъединиц молекулярной массой 60 и 58 кДа. С большой субъединицей связан один [Fe4S4]-кластер, а с малой — корриноид, сходный по строению с кобальт-порфиноидным кофактором N-метил-H4МРТ: CoM-SH-метилтрансферазы (см. рис. 80). Атом кобальта непосредственно служит мишенью для метилирования.
Передача метальной группы происходит при помощи N-метил-H4МРТ: C/Fe-SP-метилтрансферазы — гомодимерного белка, не имеющего простетических групп. Как и в случае N-метил-Н4МРТ: СоМ-SН-метилтрансферазной реакции, эта реакция экзергонична, и свободная энергия ассимилируется в форме Smf (см. раздел 10.4.10).
Источником карбонильной группы служит бифункциональный фермент CO-дегидрогеназа. Он одновременно с этим выполняет функцию ацетил-СоА-синтазы (англ. СО dehydrogenase/acetyl-CoA synthase, COD/AS).
Этот фермент может действовать и в катаболическом направлении, расщепляя ацетат на метильную и карбонильную группы (вторая затем окисляется до СО2). Таким путем используют ацетат в качестве ростового субстрата ацетотрофные, или ацетокластические метаногенные археи, а также гетеротрофные сульфатредуцирующие бактерии.
COD/AS имеет гетеротримерную структуру (αβ)3. Молекулярная масса субъединиц составляет 89 и 19 кДа. На каждый мономер αβ приходится два [Fe4S4]- кластера и два [Fe4S4]-кластера.
COD/AS превращает СО2 в ферментносвязанную карбонильную группу. Восстановление осуществляется с помощью ферредоксина, а тот получает электроны от uptake-тидрогеназы(см. раздел 11.4.4.4). Альтернативным источником карбонильной группы может быть свободный монооксид углерода СО.
Предполагается, что COD/AS содержит три сайта (X, Y и Z), предназначенные соответственно для метильной группы, карбонильной группы и CoASH. В конечном счете, из двух C1-блоков и CoASH образуется СН3СО~SСоА.
Общее уравнение пути автотрофного ацетогенеза выглядит следующим образом:
2СO2 + 8Н+/8е- + CoASH —> CH3CO~SCoA + 3H2O.
В дальнейшем с помощью ферредоксинзависимой пируватсинтазы ацетил-СоА восстановительно карбоксилируется в пируват (см. раздел 13.2.1).
Если иметь в виду расход восстановителя, то автотрофный ацетогенез — это довольно «расточительный» путь, поскольку в нем расходуются 8 молей высокопотенциальных электронов в расчете на моль конечного продукта. Однако физиологическая эффективность данного пути повышается за счет того, что в нем попутно ассимилируется энергия в форме Smf
13.3.2. Восстановительный ацетил-коэнзимный путь ацетогенов, или путь Вуда-Льюнгдала
Этот автотрофный путь биосинтеза ацетата имеется у облигатно анаэробных хемолитотрофных бактерий и, возможно, у термоацидофильных архей. Он был расшифрован американскими микробиологами Вудом и Люнгдалом (L. С. L. Ljungdahl) в середине 1980-х годов при изучении облигатно анаэробной бактерии Clostridium thermoaceticum (фила ВХIIIFirmicutes). В настоящее время показано, что этот путь широко распространен у сильно дивергировавших бактерий, относящихся к филам ВХIII Firmicutes (Acetitomaculum, Acetobacterium, Acetohalobium, Acetonema, Caloramator, Clostridium, Desulfobacterium, Eubacterium, Moorella, Natroniella, Oxobacter, Ruminococcus, Sporomusa, Syntrophococcus, Thermoanaerobacter), BXVII Spirochaetes (Treponema) и BXIX Acidobacteria (Holophaga).
Во избежание повторов мы, как и в предыдущем случае, отсылаем читателя к разделу 11.4.5.5, где уже были рассмотрены промежуточные реакции, с помощью которых ацетогены ассимилируют энергию.
Принцип биосинтеза ацетил-СоА у ацетогенных бактерий аналогичен принципу биосинтеза метана у метаногенных архей. Это сборка «минимальной» органической молекулы из двух Ci-блоков: метильной группы [СН3-] и карбонильной группы [СО].
Более того, конкретными деталями путь Вуда-Льюнгдала напоминает путь Вуда.
В обоих случаях диоксид углерода, акцептированный в виде карбоксильной группы, за три этапа восстанавливается до метильной группы (см. рис. 123):
(1) СОО- + Н+/2е- —> -СНО + Н2O, -СНО —> =СН- + Н2O;
(2) =СН- + 2Н+/2е- —> -СН2-;
(3) -СН2- + 2Н+/2е- —> -СН3.
В обоих случаях карбонильная группа образуется путем восстановления водородом диоксида углерода или, в качестве альтернативы, путем ассимиляции свободного монооксида углерода.
Однако, в отличие от метаногенов, которые используют для переноса C1-группы три переносчика поочередно (метанофуран, тетрагидрометаноптерин и СоМ; см. рис. 116), у ацетогенов переносчик C1-группы только один (тетрагидрофолат; см. рис. 122).
При биосинтезе ацетата ацетогенами, как и при биосинтезе ацетата метаногена- ми, происходит реакция трансметилирования. Во время нее тоже ассимилируется энергия в форме Smf. Донором электронов при ацетогенезе, как и при метаногенезе, служит Н2, который окисляется с помощью uptake-гидрогеназы.
COD/AS ацетогенов имеет тримерный состав (αβ)з, молекулярная масса субъединиц составляет 77 и 71 кДа. На мономер αβ приходятся два [Fе4S4]-кластера, два [Fе3NiS4]-кластера и один атом цинка. Гены, кодирующие две субъединицы, входят в состав геномного островка, отвечающего за автотрофный биосинтез ацетата.
Донором метильного фрагмента для биосинтеза ацетата является гомолог белка C/Fe-SP метаногенов, который состоит из субъединиц молекулярной массой 55 и 34 кДа. Однако он получает метальную группу с помощью метилтрансферазы не от N-метил-H4МРТ, а от N-метил-H4фолата.
Ацетил-СоА-путь ацетогенов, как и ацетил-СоА-путь метаногенов, завершается образованием ацетил-СоА. Однако «судьба» этого конечного продукта различна. Метаногены полезно используют весь эндогенный ацетат, тогда как ацетогены частично выделяют его в окружающую среду.
13.4. Разнообразие механизмов автотрофной ассимиляции углерода при хемосинтезе и фотосинтезе
Если мы еще раз проанализируем содержимое таблицы 15, то увидим, что хе- молитотрофия сочетается с пятью циклами автотрофной ассимиляции углерода, а фототрофия — только с тремя циклами (у фототрофов отсутствует цикл Квайла и цикл О’Коннора-Хэнсона).
С чем связана неспособность фототрофов ассимилировать формальдегид? Может быть, решающее значение имеет принадлежность к аэробам? Ведь метанотрофы, которые получают формальдегид из метана — это облигатно аэробные бактерии (см. раздел 11.4.4.2). В то же время единственными аэробами среди фототрофов являются цианобактерии, однако они пользуются циклом Кельвина-Бенсона-Бэссема. Если исходить из гипотезы, что рибулозобисфосфатный цикл в ходе эволюции произошел от рибулозомонофосфатного (см. раздел 13.2.5), возникает и другое предположение: архаичные цианобактерии могли ассимилировать формальдегид, а их потомки утратили это свойство.
Однако истинная причина, скорее всего, заключается в том, что метанотрофы стали использовать в конструктивных целях один из промежуточных продуктов энергетического метаболизма, формальдегид, причем фактором отбора в данном случае оказались экзогенные ресурсы метана. Цианобактерии сделали ставку на фототрофию и использование пусть «невыгодного», но свободно доступного конструктивного субстрата, диоксида углерода.
Что касается путей автотрофной ассимиляции углерода, то ими обладают только две группы прокариотов: гидрогенотрофные метаногенные археи и ацетогенные бактерии.
Причина отсутствия этих путей у фототрофов, видимо, та же самая, что и причина отсутствия у них циклов Квайла и О’Коннора-Хэнсона.
Автотрофный биосинтез ацетата основан на водородной литотрофии и использовании в конструктивных целях одного из промежуточных продуктов энергетического метаболизма (в случае метаногенов это N-метил-H4МРТ, а в случае ацетогенов — N-метил-Н4фолат). В то же время у фототрофов энергетический метаболизм связан с использованием фоторецепторных систем, и он предоставляет широкие возможности для «невыгодной» ассимиляции диоксида углерода.
Таким образом, можно сделать окончательный вывод, что механизмы углеродной автотрофии при хемосинтезе более разнообразны, чем при фотосинтезе.
В связи с вопросом о двух формах RuBisCO (см раздел 13.2.5) мы говорили о том, что молекулярная филогения не позволяет реконструировать эволюционную связь между путями конструктивного метаболизма.
В частности, бывает так, что близкородственные организмы обладают разными механизмами углеродной автотрофии. Например, виды Desulfobacter используют восстановительный цикл карбоновых кислот, а виды Desulfobacterium — восстановительный ацетилкоэнзимный путь, хотя те и другие относятся к классу «Deltaproteobacteria». В то же время, ацетилкоэнзимный путь имеется у представителей разных порядков филы АII Euryarchaeota.
В большинстве случаев в разные циклы входят одни и те же обратимые реакции, а те, в свою очередь, катализируются ферментами, гены которых могли передаваться «горизонтальным» путем.
В завершение данного раздела следует отметить, что иногда (правда, исключительно редко) один и тот же микроорганизм не ограничивается единственным циклом автотрофной ассимиляции углерода. Например, Methylococcus capsulatus штамм
Bath одновременно обладает ключевыми ферментами сразу трех циклов — цикла Квайла, О’Коннора-Хэнсона и Кельвина-Бенсона-Бэссема.
* * *
На этом мы оставляем тему, посвященную углеродной автотрофии, и переходим к другому типу трофической автономии прокариотных организмов, а именно к азотной автотрофии.