МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ II - А. В. ПИНЕВИЧ - 2007
ГЛАВА 14. АЗОТНАЯ АВТОТРОФИЯ
The alder, whose fat shadow nourisheth — each plant set neere to him long flourisheth.
(Ольха, что кормит землю своей тучной сенью — близ от нее все долго и пышно растет).
William Browne of Tavistock (1613)
Азот принадлежит к числу незаменимых биогенных элементов. Он входит в универсально распространенные макромолекулы — нуклеиновые кислоты и белки, представляя соответственно 13 и 15% их молекулярной массы.
Все живые организмы подразделяются на азотных гетеротрофов, и азотных автотрофов. Первые получают связанный азот в составе органических веществ или простых минеральных ионов — аммония (NH+4) и нитрата (NO-3). Вторые обладают способностью самостоятельно превращать молекулярный азот (N2) в аммоний, а затем путем аминирования внедрять его в скелет органических молекул. Напомним, что такой процесс известен под названиями «азотная автотрофия», или «диазотрофия», а прокариотные организмы, которые его осуществляют, называются диазотрофами (см. раздел 9.2.3).
Диазотрофы обеспечивают самих себя связанным азотом, а также обогащают им окружающий экоценоз. Это происходит либо путем использования их мортмассы другими живыми организмами, либо благодаря экспорту аммиака или аминокислот.
Ярким примером трофических взаимоотношений, основанных на диазотрофии, является «актиноризоидный» внутриклеточный симбиоз с участием актинобактерии Frankia (табл. 16), которая образует клубеньки на корнях более чем двухсот видов двудольных растений из родов Ainus, Саsuarina, Ceanothus, Comptonia, Eleagnus и Myrica. Побочным результатом этого симбиоза является повышение плодородия окружающей почвы, и поэтому неслучайно в качестве эпиграфа к данной главе взяты поэтические строки Уильяма Брауна.
Таблица 16. Диазотрофы и их свойства, существенные для диазотрофии
Фила |
Род(а) с диазотрофными представителями |
Метаболизм |
Отношение к кислороду |
Способ существования |
ВVI Chloroflexi |
Oscillochloris |
Фотолитоавтотроф (аноксигенный) |
Анаэроб |
Свободноживущий |
ВХ Сyanobacteria |
Аnabaena, Аnabaenopsis, Аphanizomenon, Сalothrix, Сhlorogloeopsis, Chroococcidiopsis, Сyanospira, Сyanothece, Суlindrospermopsis, Cylindrospermopsis, Dermocarpa, Fiscerella, Gloeocapsa, Gloeothece, Leptolyngbun, Lyngbya, Microcoleus, Myxosarcina, Pleurocapsa, Nodularia, Nostoc, Nostochopsis, Oscillatoria, Plectonema, Рseudanabaena, Rivularia, Scytonema, Stigonema, Symploca, Synechococcus, Synechocytis, Tolypothrix, Trichodesmium, Хеnococcus |
Фотолитоавтотрофы (оксигенные) |
Аэробы |
Свободноживущие или экзоцитобионты |
ВХI Chlorobi |
Chlorobium, Сhloroherpeton |
Фотолитоавтотрофы (аноксигенные) |
Анаэробы |
Свободноживущие |
ВХIIProteobacteria |
Аmoebobacter, Сhromatium, Ectothiorhodospira, Lamprobacter, Rhodobacter, Rhodocyclus, Rhodomicrobium, Rhodopila, Rhodopseudomonas, Rhodopseudomonas, Thiocapsa, Тhiocystis |
Фотолитоавтотрофы или фотоорганогетеротрофы (аноксигенные) |
Анаэробы |
Свободноживущие |
Bradyrhizobium |
Квази-фототроф (аноксигенный) |
Аэроб |
Эндоцитобионт |
|
ВХIIProteobacteria |
Beggiatoa, Methylobacter, Methylococcus, Methylocystis, Methylomonas, Methylosinus, Thiobacillus |
Хемолитоавтотрофы |
Аэробы |
Свободноживущие |
ВХIIProteobacteria |
Acetobacter, Agrobacterium, Alcaligenes, A quaspiril lum, Azomonas, Azorhizobium, Azospirillum, Azotobacter, Beijerinckia, Bradyrhizobium, Campylobacter, Citrobacter, Derxia, Desulfobacter, Desulfovibrio, Enterobacter, Erwinia, Herbaspiril lum, Klebsiella, Mycoplana, Pseudomonas, Rhizobium, Vibrio, Xanthobacter |
Хемооргано- гетеротрофы |
Аэробы, факультативные анаэробы или анаэробы |
Свободножи- вущие, экэо- цитобионты или эндоцито- бионты |
BXIII Firmicutes |
Heliobacillus, Heliobacterium, Heliophilum, Heliorestis |
Фотолитогетеротрофы (аноксигенные) |
Анаэробы |
Свободноживущие |
Bacillus, Clostridium, Desulfotomaculum, Mycobacterium, Propionispira |
Хемооргано-гетеротрофы |
Анаэробы или факультативные анаэробы |
Свободноживущие |
|
BXIV Actinobacteria |
Frankia |
Хемооргано-гетеротроф |
Аэроб |
Эндоцитобионт |
All Euryarchaeota |
Methanobacterium, Methanocaldococcus, Methanococcus, Methanolobus, Methanosarcina, Methano spirillum |
Хемолитоавтотрофы |
Анаэробы |
Свободноживущие |
14. 1. Диазотрофы
Азотные автотрофы, или диазотрофы ежегодно связывают ~1,5 • 108 т газообразного азота, что в полтора раза превышает общий результат азотфиксации в ходе природных абиотических процессов и на основе химической промышленности. Благодаря диазотрофам инертный азот, поступающий в атмосферу при дыхательной денитрификации (см. раздел 11.4.6.2), возвращается в биологический круговорот.
Разрыв прочной тройной связи в молекуле N2 происходит в очень жесткой физико-химической среде. В частности, оксиды азота образуются при сильных электрических разрядах, а синтез аммиака в производственном процессе Фрица Габера (F. Наbег, Нобелевская премия по химии, 1918 г.) протекает при давлении 10-100 мПа и температуре 400-600°С в присутствии железного катализатора.
В природе не существует ферментативного процесса, который позволял бы переводить атмосферный азот в оксиды. Однако есть ферментативный процесс, приводящий к восстановлению молекулярного азота. Он осуществляется в мягких физиологических условиях с помощью специфичных по отношению к молекулярному
азоту ферментов — N2аз, или нитрогеназ (англ. nitrogenase; от nitrogenium — латинское название химического элемента азота).
Нитрогеназа является ключевым ферментом диазотрофии. Чаще всего ее гены расположены на хромосоме; они высококонсервативны и гомологичны у эволюционно дистанцированных объектов, даже у представителей разных доменов, что указывает на высокую вероятность их «горизонтального» переноса.
В 1885 г. немецкие агрохимики Гельригель (H. Hellriegel) и Вильфарт (H.Wilfarth) установили, что бобовые растения могут расти в отсутствии азотных удобрений, довольствуясь атмосферным азотом, который «фиксируют» почвенные микроорганизмы. В 1888 г. голландский микробиолог Мартинус Бейеринк доказал мутуалистическую природу этой ассоциации и впервые выделил прокариотных эндоцитобионтов — клубеньковых бактерий из рода Rhizobium. В 1902 г. С. Н. Виноградский открыл первого представителя свободноживущих анаэробных диазотрофов, почвенную бактерию Clostridium pasteurianum, и тогда же Бейеринк и Ван Дельден (A. van Delden) обнаружили первого представителя свободноживущих аэробных диазотрофов, почвенную бактерию Azotobacter chroococcum.
В 1928 г. Древис (К. Drewes) впервые показал, что цианобактерии (в ту пору их еще называли «сине-зелеными водорослями») могут использовать атмосферный азот. К середине 1950-х годов Фогг (G. Fogg) установил, что способностью к диазотрофии обладают около двадцати видов нитчатых цианобактерий, образующих гетероцисты. Примерно в это же время Ховард Гест выяснил, что диазотрофия распространена и у аноксигенных фототрофов — пурпурных бактерий.
На протяжении 1960-х годов было установлено, что диазотрофами могут быть не только цианобактерии, образующие гетероцисты, но и ряд нитчатых цианобактерий, не образующих гетероцист, а также некоторые одноклеточные цианобактерии.
Список диазотрофов постепенно расширялся, и в 1984 г. он пополнился двумя видами метаногенных архей — Methanococcus thermolithotrophicus и Methanosarcina barkeri, а позднее и другими.
Критериями, определяющими способность к диазотрофии (реализованную или потенциальную), являются:
— рост на среде без связанного азота;
— положительный тест на биосинтез этилена из ацетилена;
— включение метки из 15N2;
— связывание молекулярных зондов (ДНК-гибридизация in situ, иммуноэлектронная микроскопия);
— положительная PCR-реакция с использованием праймеров для структурных генов нитрогеназы.
В настоящее время по одному или нескольким из этих критериев к диазотрофам можно отнести представителей девяносто семи прокариотных родов (девятнадцати родов аноксигенных фототрофных бактерий, тридцати четырех родов цианобактерий, одного рода квази-фототрофных бактерий, семи родов хемолитоавтотрофных бактерий, тридцати родов хемоорганогетеротрофных бактерий и шести родов метаногенных архей (табл. 16).
14.2. Нитрогеназа
Главным субстратом нитрогеназы является молекулярный азот, который она восстанавливает до двух молекул аммиака (N2 + 6Н+/6е- —> 2NН3). Для этой реакции нужен сильный восстановитель, пул которого пополняется в процессах литотрофии и органотрофии (см. раздел 9.2.4).
Обычно таким восстановителем является железосерный белок ферредоксин (см. раздел 10.4). У цианобактерий при железном голодании взамен образуется кислый
флавопротеин — флаводоксин (англ. flavodoxin, Flvd). Он имеет молекулярную массу 18 кДа и в качестве простетической группы содержит ФМН (см. рис. 105). Подобно ферредоксину, флаводоксин является сильным восстановителем, и редокс- потенциал его восстановленной формы варьирует от -370 до -450 мВ.
Кроме того, для действия нитрогеназы необходима энергия, освобождающаяся при гидролизе АТФ. Побочным субстратом нитрогеназы служат протоны, т. е. этот фермент одновременно выполняет роль гидрогеназы, на что уходят ~25% всего израсходованного восстановителя и энергии.
Суммарное уравнение смешанной нитрогеназно-гидрогеназной реакции выглядит следующим образом:
N2+ 8Н+/8е- + 16MgАТФ + 2Н+ —> 2NH+4 + Н2 + 16MgAДФ + 16Ф.
Обязательными условиями для функционирования нитрогеназы являются:
— образование бинарного комплекса, состоящего из двух чувствительных к кислороду металлопротеинов;
— отсутствие кислорода или предотвращение его контакта с нитрогеназой;
— поступление молекулярного азота;
— использование сильного восстановителя (-400 мВ);
— использование АТФ в форме магниевой соли (MgАТФ).
Биосинтез нитрогеназы, а также снабжение ее восстановителем и энергией требуют значительных метаболических затрат, которые оправданны только в отсутствии связанного азота и при условии, что этот чувствительный к кислороду фермент не требует слишком интенсивного обновления. Поэтому неудивительно, что экспрессия структурных генов находится под жестким регуляторным контролем.
14.2.1. Строение нитрогеназы
Все известные в настоящее время нитрогеназы представляют собой коричневые растворимые бинарные металлопротеины.
Первый компонент нитрогеназы называется «динитрогеназой» (англ. dinitrogenase). Именно он содержит активный центр, восстанавливающий субстрат(ы). Второй компонент нитрогеназы называется «редуктазой динитрогеназы» (англ. dinitrogenase reductase). Его функция — снабжать динитрогеназу низкопотенциальными электронами.
В природе существуют, по меньшей мере, три нитрогеназы (одна основная и две «альтернативные»). Все они кодируются гомологичными структурными генами, однако различаются по ферментативным свойствам.
Нитрогеназа-1, или «молибденовая» нитрогеназа. Эта нитрогеназа имеется у подавляющего большинства диазотрофов. Лучше всего она охарактеризована на примере энтеробактерии Klebsiella pneumoniae (рис. 153).
Рис. 153. Железосерные кластеры, входящие в состав нитрогеназы, и редокс- превращения с их участием. Греческие буквы указывают на принадлежность аминокислотных остатков к субъединицам Fе-белка или МоFе-белка, арабские цифры — положение в полипептидной цепи.
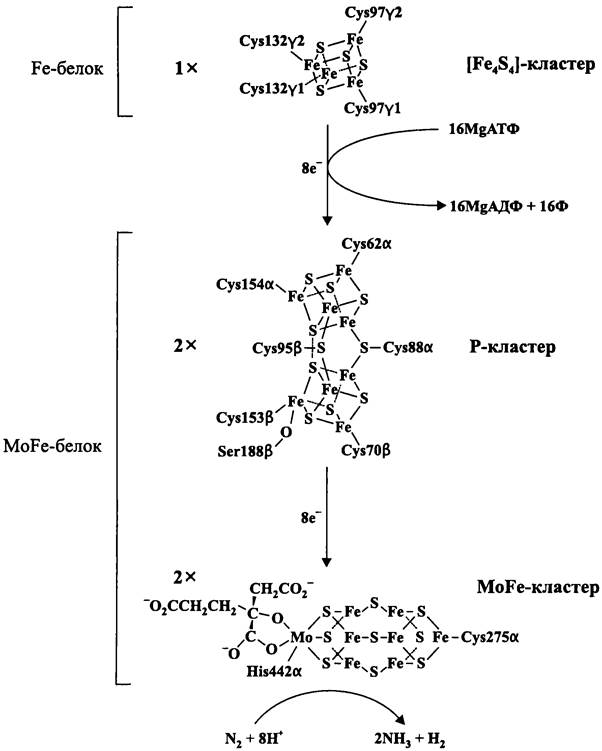
Редуктаза динитрогеназы, она же «железопротеин» или «Fe-белок» (англ. Fe- protein), представляет собой гомодимер, состоящий из двух y-субъединиц (30 кДа; ген nifH). Fe-белок содержит один [Fе4S4]-кластер, который лигандируется четырьмя консервативными аминокислотными остатками Cys-97y1, Cys-97y2, Cys-132y1 и Cys-132y2. Этот кластер переносит за один раз по электрону и существует в степенях окисления +1/+2 (редокс-потенциал пары -350 мВ).
Динитрогеназа в данном случае обозначается как «молибден-железопротеин», или «MoFe-белок» (англ. MoFe-protein). MoFe-белок представляет собой гетеротетрамер, состоящий из двух α-субъединиц (60 кДа; ген nifD) и двух β-субъединиц (60 кДа; ген nifK). Он содержит два [Fe8S8]-клacтepa (или P-кластера; от англ. paired — двойной) и два гетерометаллических [Fe7MoS9]-кластepa. P-кластер лигандируется шестью консервативными аминокислотными остатками Cys-62α, Cys-88α, Cys-154α, Cys-70/5, Cys-95β и Cys-153β, а также консервативным аминокислотным остатком Ser-188β. MoFe-кластер содержит органический компонент в виде аминокислотного остатка гомоцитрата (2-оксо-1, 2, 4-трикарбоксибутановой кислоты) и лигандируется двумя консервативными аминокислотными остатками Cys-275α и His-442α. MoFe- кластер переносит за один раз по электрону и существует в степенях окисления +2/+3 (редокс-потенциал от -320 до -430 мВ).
Молибденовые нитрогеназы высококонсервативны. В модельном опыте можно реконструировать активный голокомплекс, комбинируя динитрогеназу и редуктазу динитрогеназы, выделенные из совершенно разных объектов.
Нитрогеназа-2, или «ванадиевая» нитрогеназа. При делеции структурных генов nifHDK и/или в отсутствии в среде молибдена некоторые диазотрофные бактерии, например, Azotobacter vinelandii, A. chroococcum, Anabaena sp. ATCC 29413 и C. pasteurianum, а также археот Methanosarcina barkeri экспрессируют альтернативную нитрогеназу-2, или «ванадиевую» нитрогеназу.
В данном случае динитрогеназа-2, или «VFe-белок» представляет собой гетерогексамер из двух α-субъединиц (60 кДа; ген vnfD: от англ. vanadium nitrogen fixation), двух β-субъединиц (60 кДа; ген vnfK) и двух дополнительных δ-субъединиц (13 кДа; ген vnfG). Динитрогеназа-2, по-видимому, содержит два двойных [Fe8S8]- кластера и один гетерометаллический [Fe7VS9]-кластер. Редуктаза динитрогеназы- 2, или димерный Fe-белок (30 кДа; ген vnfH) содержит один [Fe4S4]-кластер.
Нитрогеназа-3, или «железная» нитрогеназа. При делеции структурных генов nifHDK и/или при одновременном отсутствии в среде молибдена и ванадия A. vinelandii, а также пурпурная бактерия Rhodobacter capsulatus экспрессируют альтернативную нитрогеназу-3, или «железную» нитрогеназу. В данном случае динитрогеназа состоит из двух α-субъединиц (60 кДа; ген anfD; от англ. alternative nitrogen fixation), двух β-субъединиц (60 кДа; ген anfK) и двух дополнительных δ- субъединиц (15 кДа; ген anfG). Динитрогеназа-3, скорее всего, содержит три двойных [Fe4S4]-кластер. Редуктаза динитрогеназы-3, или димерный Fe-белок (30 кДа; ген anfH) содержит один [Fe4S4]-кластер.
Генетика диазотрофии. Наиболее изученным в генетическом отношении диазотрофом является бактерия К. pneumoniae. В ее хромосоме имеется участок размером 23 т. п. н., представляющий собой nif-регулон (от англ. nitrogen fixation), т. е. кластер из двадцати генов диазотрофии, объединенных в семь оперонов. Помимо структурных генов нитрогеназы (nifHDK), сюда относятся:
— гены, отвечающие за активацию Fe-белка (nifМ), за биосинтез [Fe7MoS9]-кластера (nifQVBENH) и за поступление низкопотенциальных электронов (nifJF);
— гены, кодирующие фактор созревания Fe-белка (nifM);
— позитивный регулятор (nifА);
— негативный регулятор (nifL);
— несколько открытых рамок считывания (nifT, nifY, nifU, nifS и nifZ).
Аналогичным образом организованы nif-регулоны у A. vinelandii и A. chroococcum.
Нитрогеназный кластер в хромосоме цианобактерии Anabaena sp. РСС 7120 имеет следующую структуру: nifB-fdxN-nifS -nifU - nifH- nifD-nifK - nifE-nifN- nifX - ОRF3- mfW- О RF1 - QKF2-fd. xH (гены fdxH и fdxN кодируют два ферредоксина, первый из которых передает электроны нитрогена- зе). Все эти гены объединены, как минимум, в четыре оперона — nifB-fdxN-nifSU, nifHDK, ORF1- ORF2 и fdxH.
Как уже указывалось, гены субъединиц нитрогеназы и гены биосинтеза металлокластеров нитрогеназы высококонсервативны, причем некоторые из них — это гены-паралоги, возникшие в результате дупликации с последующей позиционной реорганизацией. Их эволюционное происхождение неизвестно, хотя ген nifU (iscU), ответственный за биосинтез железосерных кластеров, явно принадлежит к числу предковых.
14.2.2. Субстраты и механизм действия нитрогеназы
Нитрогеназа способна одновременно восстанавливать три «физиологических» субстрата.
Важнейший из них — это молекулярный азот (N2). В итоге его восстановления образуется две молекулы аммиака NH3. Они спонтанно протонируются, превращаясь в два катиона аммония NH+4 (N2 + 6Н+/6е- —> 2NH3; 2NH3 + 2Н+ —> 2NH4).
Второй физиологический субстрат нитрогеназы — это протоны (Н+). В результате их восстановления образуется молекулярный водород (2Н+ + 2е- —> Н2). Восстановление протонов всегда идет бок о бок с восстановлением молекулярного азота и происходит даже при давлении последнего >5 • 103 кПа (50 атм). Это физиологически непродуктивный процесс, и лишь благодаря тому, что образующийся водород окисляется с помощью uptake-гидрогеназы (см. раздел 11.4.4.4), диазотрофным бактериям удается частично восполнить потерю энергии и восстановителя.
Минорный физиологический субстрат нитрогеназы — это молекулярный водород (Н2). В активном центре нитрогеназы он расщепляется на два атома водорода, после чего каждый из них восстанавливается до молекулы водорода (Н2 —> 2Н; 2Н + 2Н+/2е- —> 2Н2). При экспериментальном использовании тяжелого дейтерия (D) вместо легкого протия (Н) продуктом такой обменно-восстановительной реакции становится «гибридный» водород (D2 —> 2D; 2D + 2Н+/2е- —> 2HD).
В качестве «нефизиологических» субстратов нитрогеназы используется ряд низкомолекулярных соединений, содержащих двойную или тройную связь между атомами азота и/или углерода. Это азид N-3, ацетилен С2Н2, диазирин СН2<(N=N), метилизоцианид СН3—CN, оксид азота N2O, цианамид H2N-CN, цианид CN-, циклопропен СН2 <(СН=СН) и этилен С2Н4(последний только в случае Мо-независимых нитрогеназ).
В методическом плане наибольший интерес представляет восстановление ацетилена в этилен и этилена в этан, содержание которых можно с высокой точностью измерить на газовом хроматографе.
Когда Мо-нитрогеназа использует молекулярный азот и/или побочные субстраты, она последовательно катализирует три окислительно-восстановительные реакции:
— одноэлектронное восстановление Fe-белка низкопотенциальными редокс-белками ферредоксином или флаводоксином (in vivo) или дитионитом (in vitro);
— перенос электрона от Fe-белка к MoFe-белку, сопряженный с гидролизом двух молекул MgATO;
— восстановление субстратов, связанных с MoFe-белком.
При действии Мо-нитрогеназы в оптимальных условиях на образование из молекулы N2 двух молекул NH3 расходуются шесть «низкопотенциальных» электронов и 16 молекул MgATФ, причем побочным продуктом обязательно становится молекула водорода.
Модель функционирования Мо-нитрогеназы, наиболее аргументированная теоретически и лучше всего объясняющая эмпирические данные, была разработана в первой половине 1980-х годов. В ее основе лежат два взаимосвязанных цикла редокс- превращений— «Fe-цикл» и «MoFe-цикл».
Fe-цикл (рис. 154). Он обеспечивает перенос одного электрона от восстановленного Fe-белка к MoFe-белку.
На первом этапе (рис. 154,1) восстановленный комплекс Fе-белок(MgАТФ)2 связывается с МоFе-белком. Ассоциация двух компонентов нитрогеназы является относительно медленным процессом и занимает ~0,15 с.
На втором этапе (рис. 154, 2) происходит гидролиз двух молекул MgАТФ, и сразу после этого — перенос одного электрона на МоFе-белок, причем при комнатной температуре данные процессы необратимы.
Рис. 154. «Fе-цикл», или редокс-цикл редуктазы динитрогеназы. D — донор электрона.
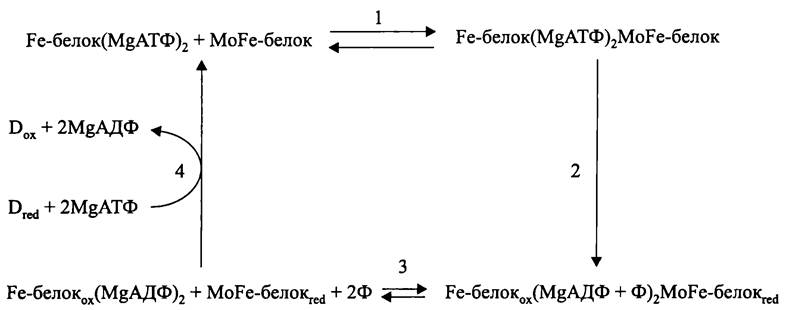
(MgАТФ)2 связывается с консервативным мотивом G-Х-G-Х-Х-G-К-S в молекуле Fе-белка. За счет энергии, освобождающейся при гидролизе терминальной фосфоангидридной связи в двух молекулах АТФ, апопротеин изменяет свою конформацию. Благодаря этому редокс-потенциал [Fе4S4]-кластера понижается до -450 мВ, т. е. Fе-белок приобретает более сильные восстановительные свойства. Это очень существенный момент. Он объясняет, почему для биологического восстановления молекулярного азота необходима энергия (ведь, как известно, «химическая» реакция N2 + ЗН2 —> 2NH3 экзергонична).
Третий этап (рис. 154, 3) является лимитирующим по скорости. Он связан с обратимой диссоциацией Fe-бeлкa(MgAДФ)2(2Ф) из комплекса с восстановленным МоFе- белком.
На завершающем четвертом этапе (рис. 154, 4) происходит восстановление Fе-белкa(MgAДФ)2, после чего две молекулы MgAДФ освобождаются, а их место занимают две молекулы MgATФ. Предполагается, что данная схема справедлива и по отношению к V-нитрогеназе.
МоFе-цикл (рис. 155). Он состоит из восьми последовательных восстановительных стадий. Каждая из них сопряжена с отдельным Fe-циклом, который выполняет роль донора электронов.
Двойные [Fе8S8]-кластеры, или Р-кластеры, видимо, не участвуют в связывании и восстановлении молекулы N2, а только передают электроны реакционным центрам — гетерометаллическим [Fе7МоS9]-кластерам. Связи Fе-Н, временно образующиеся в [Fe7МоS9]-кластерах, накапливают восстановительные эквиваленты, в то время как молибден служит участком связывания и активации молекулярного азота.
Молекула N2 поочередно присоединяет к себе три пары Н+/е-. В конечном счете, высвобождаются две молекулы NН3. Наиболее вероятным интермедиатом этого
Рис. 155. «MoFe-цикл», или цикл восстановления молекулы N2с помощью динитрогеназы. E1— E7 — промежуточные состояния динитрогеназы.
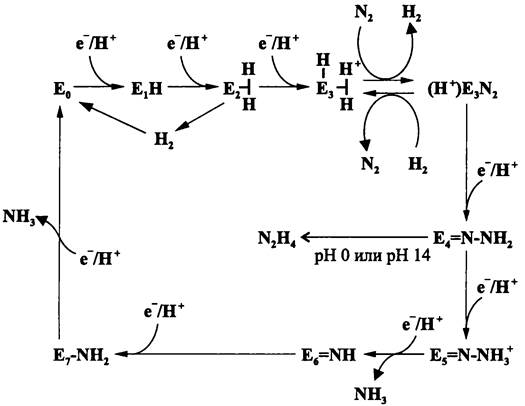
восстановительного процесса служит связанный гидрид азота (=N—NH2), из которого под воздействием кислот или щелочей образуется гидразин NH2—NH2.
Тот факт, что существуют три разные нитрогеназы, использующие соответственно Fе/Мо, Fе/V или только Fе, наводит на мысль, что во всех случаях ядром активного центра является именно железо.
14.2.3. Регуляция нитрогеназы
Нитрогеназа служит мишенью для разнообразных регуляторных воздействий. Некоторые из них носят общий характер (например, при «железном стрессе»), другие специфичны (например, при молибденовом голодании). Наибольшее значение имеет негативная регуляция нитрогеназы связанным азотом, а также кислородом.
Негативная регуляция нитрогеназы связанным азотом. Все диазотрофы по соображениям метаболической экономии предпочитают молекулярному азоту связанный азот, входящий в состав минеральных ионов или органических молекул, например аминокислот.
Биосинтез нитрогеназы начинает репрессироваться, когда содержание связанного азота в окружающей среде превышает специфичную для данного объекта минимальную величину (в случае аммония или нитрата пороговая концентрация составляет ~5 мМ). Кроме того, биосинтез нитрогеназы регулируется эндогенным аммонием. Это осуществляется на транскрипционном уровне через посредство ключевой системы ассимиляции аммония GS-GOGАТ (см. ниже).
Активность уже имеющейся нитрогеназы регулируется аммонием за счет посттранскрипционной модификации структуры α-субъединиц, из которых состоит редуктаза динитрогеназы.
Негативная регуляция кислородом. Мощным негативным регулятором нит- рогеназы является молекулярный кислород. Еще в начале 1930-х годов на примере свободноживущих диазотрофов из рода Azotobacter было показано, что количество ассимилированного молекулярного азота возрастает на порядок при двадцатикратном уменьшении парциального давления кислорода (от 20 до 1 кПа, соответственно от 2 • 10-1 до 10-2 атм).
В начале 1970-х годов выяснилось, что факультативные анаэробы (например, Bacillus polymyxa и Klebsiella pneumoniae) или микроаэрофилы (например, Mycobacterium flavum)образуют нитрогеназу только в анаэробных или микроаэробных условиях, т. е. без кислорода или при его низком парциальном давлении. В аэробной среде эти бактерии могут расти только на среде, содержащей связанный азот.
14.2.4. Защита нитрогеназы
Причина негативного воздействия кислорода заключается в том, что он:
— репрессирует биосинтез апопротеинов нитрогеназы (гены nifHDK), взаимодействуя с регуляторным опероном nifAL;
— разрушает нитрогеназу за счет индуцированного протеолиза ее апопротеинов, а также путем окисления ее простетических групп, железосерных кластеров.
Первые опыты с бесклеточными препаратами диазотрофов, проведенные в начале 1960-х годов, указывали на восстановительный характер процесса, а также на то, что отвечающие за него ферментные системы крайне чувствительны к кислороду. Прямые доказательства этого были получены в середине 1960-х годов в опытах с очищенной нитрогеназой, которая инактивировалась в аэробных условиях независимо от того, был ли ее источником облигатный анаэроб (например, Clostridium pasteurianum) или облигатный аэроб (например, Azotobacter vinelandii).
Нитрогеназа чувствительна к кислороду независимо от типа метаболизма у конкретного ди- азотрофа. Например, и аноксигенные, и оксигенные фототрофы эффективнее ассимилируют N2 при низкой концентрации экзогенного кислорода (для последних дополнительную проблему представляет эндогенный кислород).
Кислород необратимо инактивирует оба компонента нитрогеназы. Особенно чувствительна к нему редуктаза динитрогеназы, которая наполовину инактивируется на воздухе за 0,5-2 мин; у более устойчивой динитрогеназы это происходит за 5-10 мин.
Окислительное и дестабилизирующее действие на нитрогеназу оказывает не «обычный» кислород, а его активные формы, участвующие в окислительном стрессе (англ. reactiveoxygen species, ROS; см. Ill том учебника). К ним относятся синглетный кислород 1О2*, супероксидный анион-радикал О-2, пероксид водорода Н2О2 и гидроксильный радикал ОН. При их взаимодействии с апопротеинами нитрогеназы образуются сшивки Cys-Cys и Tyr-Tyr, а отдельные аминокислотные остатки превращаются в карбонильные производные. Мишенью супероксидного анион-радикала являются [FenSn]-кластеры и MoFe-кластеры.
Таким образом, нитрогеназа и кодирующие ее генные структуры негативно регулируются или повреждаются при контакте с кислородом. Вне его влияния оказываются только те диазотрофы, которые относятся к облигатным анаэробам и занимают бескислородные, или аноксичные ниши. Те диазотрофы, которые являются факультативными анаэробами, микроаэрофилами или аэробами, а также цианобактерии- биопродуценты кислорода вынуждены использовать механизмы, так или иначе защищающие нитрогеназу от кислорода.
Механизмы защиты нитрогеназы. Как мы уже отмечали, нитрогеназа имеет консервативную структуру и универсально чувствительна по отношению к кислороду. В то же время механизмы защиты нитрогеназы очень разнообразны, причем многие диазотрофы обладают не одним, а двумя или несколькими из них.
Контроль диффузии кислорода. Это простейший механизм защиты нитрогеназы. Он направлен на то, чтобы уменьшить парциальное давление кислорода с помощью барьера на пути его проникновения в клетку из окружающей среды. Некоторые свободноживущие диазотрофные бактерии защищаются от притока кислорода за счет образования толстой капсулы, как Derxia gummosa. У нитчатых цианобактерий в оболочке гетероцисты имеется практически непроницаемый для кислорода «ламинарный» слой, состоящий из уникальных гликолипидов. Диффузия кислорода в гетероцисту из соседней вегетативной клетки контролируется тем, что они соприкасаются узким каналом (7 • 10-2 мкм2), который закрыт цианофициновой «пробкой».
Физиологическая защита. Под этим названием объединяются разные способы, с помощью которых клетки уменьшают концентрацию кислорода и/или ROS.
Первичная защита основана на удалении ROS, которые образуются фотосинтетическими и дыхательными системами при одноэлектронном восстановлении кислорода в прямой зависимости от его внутриклеточного парциального давления (см. III том учебника). К числу антиоксидантных ферментов относятся:
— супероксиддисмутаза (реакция 2О-2 + 2Н+ —> Н2О2 + О2);
— каталаза (реакция 2Н2О2 —> 2Н2О + О2);
— пероксидаза (реакция Н2О2 + DH2—> 2Н2О + D), где D — донор электронов.
Далее следует так называемая «дыхательная» защита. В частности, Azotobacter sp. отвечает на увеличение парциального давления кислорода усилением аэробного дыхания, что позволяет одновременно решить две задачи — связать кислород и ассимилировать больше энергии, необходимой для восстановления азота. Другой пример использования дыхательной защиты связан с гетероцистой, для которой характерна высокая скорость эндогенного дыхания.
Наконец, у всех аэробных диазотрофов имеется upíafce-гидрогеназа. Этот фермент катализирует окисление водорода (реакция Н2 —> 2Н+ + 2е-; см. раздел 11.4.4.4). Полученные электроны поступают в дыхательную цепь и восстанавливают кислород в соответствии с уравнением реакции гремучего газа 2Н2 + О2 —> 2Н2О. Скорость этой реакции не уступает скорости эндогенного дыхания за счет органических субстратов. С помощью uptake-гидрогеназы аэробные диазотрофы разом решают три задачи: (1) связывают кислород, т. е. используют дыхательную защиту; (2) компенсируют потерю восстановителя и энергии, которая вызвана «паразитическим» восстановлением Н+ до Н2 под действием нитрогеназы (см. раздел 14.2.2); (3) удаляют водород, который способен ингибировать нитрогеназу.
Конформационная защита. В условиях кислородного стресса у некоторых диазотрофов, например, Azotobacter sp., дыхательная защита иногда становится неэффективной, и нитрогеназа инактивируется. Однако после удаления кислорода не требуется синтез этого фермента de novo. В данном случае происходит только временная инактивация. Это связано с обратимым изменением конформации нитрогеназы, находящейся в комплексе с защитным Fе2S2-ферредоксином, или «железосерным белком-II Шетна» (назван по имени немецкого биохимика R.Shehtna, который впервые выделил его в 1968 г. из A. vinelandii). С помощью защитного белка-II Шетна редуктаза динитрогеназы переходит в окисленную форму, после чего образуется устойчивый к кислороду окисленный комплекс. При восстановлении комплекса он диссоциирует на нативную нитрогеназу и белок-II Шетна, и тогда нитрогеназная активность возобновляется.
Временная (темпоральная) защита. Она имеется у диазотрофных цианобактерий, которые осуществляют два антагонистичных процесса — диазотрофию и биосинтез кислорода при оксигенной фототрофии. Для выхода из, казалось бы, тупиковой ситуации эти процессы необходимо «развести» в пространстве или во времени.
По пути компартментализационной защиты пошли нитчатые цианобактерии, образующие гетероцисты (в этих дифференцированных клетках ФСII не функционирует или вообще отсутствует, в результате чего они не образуют кислород).
По пути темпоральной защиты пошли одноклеточные цианобактерии, а также нитчатые цианобактерии, не способные дифференцировать гетероцисты. Они осуществляют темпоральную защиту одним из двух способов. В первом случае (у одноклеточных штаммов, например, Synechococcus sp.) пик образования кислорода при оксигенной фототрофии приурочен к началу, а пик диазотрофии — к концу клеточного цикла. Во втором случае (у одноклеточных, а также у нитчатых
штаммов, например, Рlectonema sр.) диазотрофия происходит в темноте в отсутствии фототрофии; источником восстановителя и энергии служат запасные полисахариды, накопленные в предшествующий световой период.
В наиболее сложном положении оказались те цианобактерии, которым приходится защищать нитрогеназу и от атмосферного, и от эндогенного кислорода. Поэтому они используют сразу несколько систем защиты нитрогеназы.
Помимо перечисленных механизмов защиты нитрогеназы можно назвать еще один, которым обладают нитчатые, не образующие гетероцист штаммы цианобактерий (например, Рlectonema sр.). Он также относится к физиологической защите и заключается в том, что клетки начинают использовать другой тип биоэнергетики. Чтобы не выделять кислород на свету, они либо переходят от оксигенной фототрофии на фототрофию аноксигенного типа (или на фотогетеротрофию), либо от фототрофии на хемогетеротрофию аэробного дыхательного или бродильного типа.
14.2.5. Ассимиляция аммония
Из двух минеральных ионов, аммония и нитрата, первый является предпочтительным. Именно в этой степени восстановленности (-3) азот входит в состав большинства биомолекул. Чтобы превратить анион нитрата (азот в степени восстановленности +5) в аммоний, требуются восемь электронов.
Представители всех трех филогенетических доменов используют для ассимиляции эндогенного или экзогенного аммония две ферментные системы — глутаминсин- тетазную/глутаматсинтазную (GS-GOGAT) и глутаматдегидрогеназную (GDH).
Первая из них обладает высоким, а вторая — низким сродством к катиону NH4. Некоторые микроорганизмы, в частности пурпурная бактерия Rhodospirillum rubrum, содержат обе эти системы, другие только одну. Облигатно симбиотические бактерии (например, Borrelia burgdorferi, Chlamydia pneumoniae, Mycoplasma genitalium, Rickettsia prowazekii и Ureaplasmaurealyticum) лишены обеих систем и получают готовые продукты ассимиляции аммония от своих хозяев.
Ферменты, участвующие в системах GS-GOGAT и GDH, высококонсервативны. Одинаковые молекулярные формы встречаются у филогенетически удаленных объектов, и поэтому высока вероятность «горизонтального» переноса соответствующих генов.
Помимо GS-GOGAT и GDH, в ассимиляции аммония могут участвовать и другие ферментные системы, в частности аланиндегидрогеназная (восстановительное аминирование пирувата в аланин) и фумаразная (прямое аминирование фумарата в аспартат). Они слабо изучены и, скорее всего, выполняют в ассимиляции аммония минорную роль.
Глутаминсинтетаза/глутаматсинтаза (GS-GOGAT). Эта двухкомпонентная система широко распространена и у прокариотов, и у ядерных организмов.
Глутаминсинтетаза (англ. glutamine synthetase, GS) играет центральную роль в ассимиляции аммония. Она переносит катион NH4 на глутамат с образованием глутамина:
L-глутамат + NH+4 + АТФ —> L -глутамин + АДФ + Ф + Н2О.
У прокариотов этот фермент имеет молекулярную массу ~600 кДа и состоит из двенадцати идентичных субъединиц. Они попарно образуют шесть активных центров и каждый из них лигандирует два катиона Мn2+. Ядерные организмы, в частности высшие растения, содержат две разные глутаминсинтетазы, обе молекулярной массой ~400 кДа. Хлоропластный фермент кодируется единственным геном и состоит из восьми идентичных субъединиц, а цитозольный — 4-6 генами и может экспрессироваться в форме гомооктамера или гетерооктамера.
Глутамин: а-кетоглутарат-аминотрансфераза (англ. glutamine:2-oxoglutarate aminotransferase, GOG АТ) переносит аминогруппу от глутамина на α-кетоглутаровую кислоту с образованием двух молекул глутамата. В ходе этой реакции расходуются восстановительные эквиваленты донора DH2, в роли которого могут выступать НАДН, НАДФН или Fdred:
L-глутамин + α-кетоглутарат + DH2 —> 2 х L-глутамат + D.
У прокариотов этот фермент обычно представляет собой мономер молекулярной массой 150-250 кДа. Простетические группы у него отсутствуют, либо в качестве них используются ФАД, ФМН или Fе3S4-кластер. У растений имеются две изоферментные формы GOGAT, которые локализуются в пластидах разных тканей и в качестве восстановителя используют НАД(Ф)Н или Fdred.
Таким образом глутаминсинтетаза/глутаматсинтаза (GS-GOGAT) действует циклически в соответствии с суммарным уравнением:
NH4+ + α-кетоглутарат + DH2 + АТФ —> L-глутамат + D + АДФ + Ф + Н2О.
У трихомных цианобактерий при низком содержании связанного азота в окружающей среде образуются гетероцисты, или терминально дифференцированные клетки, в которых синтезируется нитрогеназа и создаются оптимальные условия для ее функционирования.
В данном случае компоненты цикла GS-GOGAT компартментализованы в клетках двух типов. Глутаминсинтетаза сосредоточена в гетероцистах, а глутаматсинтаза — в соседствующих с ними вегетативных клетках. Физиологический смысл данного явления заключается в том, что гетероцисты являются гетеротрофными клетками. Поэтому они должны импортировать акцептор аммония (глутамат) из автотрофных вегетативных клеток. Последние, в свою очередь, образуют кислород, что не позволяет им синтезировать нитрогеназу и исключает возможность ее функционирования. Поэтому они импортируют из гетероцист связанный азот (в форме глутамина).
Такая же компартментализация наблюдается у актинобактерий рода Frankia, которые образуют «везикулы» — функциональные аналоги гетероцист.
Глутаматдегидрогеназа (GDH). Эта однокомпонентная система обнаружена и у прокариотов, и у ядерных организмов. Хотя она менее распространена, чем система GS-GOGAT, до открытия последней ее считали ключевым ферментом ассимиляции аммония.
Глутаматдегидрогеназа (англ. glutamate dehydrogenase, GDH) катализирует обратимую реакцию восстановительного аминирования α-кетоглутарата или окислительного дезаминирования глутамата:
α-кетоглутарат + NH4+ + НАД(Ф)Н ⇄ L-глутамат + НАД(Ф) + Н2О.
GDH преимущественно катализирует реакцию дезаминирования и снабжает цикл Кребса α-кетоглутаратом. Тем не менее, у многих бактерий скорость восстановительной реакции выше, чем окислительной. В частности, у одноклеточной цианобактерии Synechocystis sp. PCC 6803 активность «аминирующей» GDH не уступает активности GS, а у экстремально термофильного археота Thermococcus profundus содержание этого фермента достигает ~10% суммарного клеточного белка.
У прокариотов GDH представляет собой тетрамер или гексамер молекулярной массой 200-300 кДа, лишенный простетических групп. Реже это негеминовый металлопротеин. Стимулирующий эффект на него оказывают катионы Са2+. У растений этот фермент содержится в митохондриях, пластидах или цитозоле.