МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 17. ОНТОГЕНЕЗ
17.4. Клеточное деление
В результате клеточного роста накапливаются конструктивные и энергетические ресурсы, а также создаются регуляторные предпосылки для клеточного деления, которое у прокариотов, в конечном счете, лежит в основе всех способов размножения.
Размножением, или пролиферацией (англ. proliferation; от лат. proles — потомство и fero — несу) называется самовоспроизведение особи, т. е. совокупность процессов, с помощью которых она приносит потомство. Прокариоты неспособны к половому размножению и размножаются только вегетативно: одноклеточные — делением, а нитчатые — фрагментацией трихома.
В том случае, когда особь представлена клеткой, размножение осуществляется за счет клеточного деления (англ, cell division), или просто деления. Для обозначения этого процесса также используются термины цитокинез (от греч. kitos — сосуд, в данном случае — клетка, и греч. kinesis — движение; в данном случае — изменение внешнего вида) и цитотомия (англ. cytotomy; от греч. kitos — сосуд, в данном случае клетка, и греч. tome — разрезание).
Если особью является трихом, деление клеток выполняет «ростовую» функцию, а размножение происходит путем фрагментации. Чаще всего материнский трихом фрагментируется на дочерние трихомы, реже (особенно в неблагоприятных условиях) — на отдельные клетки, из которых посредством деления регенерируются новые трихомы. Таким образом, трихом растет за счет роста и деления интеркалярных и/или терминальных клеток, а размножается в результате случайной или запрограммированной фрагментации.
Случайная фрагментация связана с внешним (а)биотическим воздействием на интеркалярную клетку. В основном это механический эффект, например, принудительный изгиб трихома. В свою очередь, запрограммированная фрагментация происходит в области некридия, или интеркалярной клетки, смерть которой наступила в результате апоптоза (см. ниже). При этом пустая оболочка разрывается либо в случайном месте на боковой стороне некридия, либо перфорируется по левой или правой цепочке субсептальных пор, пронизывающих муреиновый саккулус.
Общие сведения о клеточном делении у прокариотов. Завершающим этапом размножения особи-клетки служит клеточное деление — взаимное обособление сестринских цитоплазматических компартментов.
Способность к вегетативному размножению путем бинарного деления является неотъемлемым свойством прокариотов. Неслучайно в середине 1870-х гг. Фердинанд Кон отнес бактерий к группе «схизофитов», т. е. бинарно делящихся растений (см. I том учебника).
Клетки животных делятся перешнуровкой, при помощи сократительного кольца (англ. contractile ring). Оно состоит из актиновых микрофиламентов и физически связано с внутренней поверхностью СМ.
Клетки высших растений окружены жесткой целлюлозосодержащей стенкой и делятся с помощью клеточной пластинки (англ. cell lamina). Она образуется из фрагмопласта — совокупности везикул аппарата Гольджи, которые расположены на концах микротрубочек остаточного митотического веретена.
Прокариоты делятся с помощью особой органеллы — дивисомы (англ. divisome). Она формируется в сайте деления из белков деления нескольких типов (англ. division protein).
До середины 1960-х гг. допускали a priori, что бактерии, как и ядерные клетки, способны к митотическому делению. Неудивительно, что находились предубежденные исследователи, считавшие, что видят на световых микропрепаратах бактериальных клеток классические стадии митоза, в частности метафазу. И лишь с разработкой метода электронной микроскопии окончательно выяснилось, что бактериальный хроматин не подвергается обратимой конденсации, а сестринские хромосомы расходятся в отсутствии истинного митотического веретена.
По завершении цитокинеза у прокариотов обычно образуются две дочерние клетки, каждая из которых имеет один старый и один новый полюс. Для монтажа новых полюсов требуется локальная перестройка оболочки материнской клетки (СМ, муреинового саккулуса и — в случае грамотрицательных бактерий — ОМ), а также перегруппировка белковых субъединиц поверхностного S-слоя, если таковой присутствует.
Некоторые молекулярные компоненты цитокинетического аппарата у прокариотов универсальны и высоко консервативны, а некоторые (особенно те, которые используются на завершающих этапах цитокинеза) не универсальны или сильно дивергировали друг с другом.
Модельными объектами при изучении цитокинеза у прокариотов служат палочковидные бактерии Е. coli и В. subtilis. Цитокинез у бактерий иной формы, а также цитокинез у архей практически не изучен. Главным методом анализа является мутационный нокаут генов, кодирующих белки деления. Эти белки можно также визуализировать in situ при помощи иммуноэлектронной микроскопии, либо путем конструирования гибридов с зеленым флуоресцирующим белком (англ. green fluorescent protein; GFP) или другими флуоресцирующими белками.
Достоверно известна функция только двух белков деления. Первый из них — это прикрепленный к СМ белок FtsZ; он отвечает за образование перетяжки. Второй — это пенициллинсвязывающий белок FtsI; он отвечает за биосинтез септового муреина на новых клеточных полюсах.
При цитокинезе прокариотов последовательно решаются четыре задачи:
— выбирается сайт деления, обычно на экваторе клетки, посередине между сегрегированными сестринскими хромосомами;
— в сайте деления, непосредственно под СМ, собирается кольцо деления (Z-кольцо), состоящее из белка деления FtsZ;
— к Z-кольцу присоединяются «координирующий» белок FtsA и «якорный» белок ZipA, а затем поздние белки деления (англ. late division protein), связанные с внешними слоями клеточной оболочки или участвующие в биосинтезе септового муреина (англ. septal murein);
— создается граница между дочерними клетками, и у каждой из них формируется новый полюс.
Варианты клеточного деления. Для большинства бактерий характерно бинарное деление (англ. binary fission), или деление материнской клетки надвое (рис. 228, А). Различают бинарно-эквивалентное деление, когда дочерние клетки имеют равный размер и одинаковую форму, и бинарно-неэквивалентное деление, которое называется почкованием (англ. budding), когда дочерние клетки различаются по размеру, а иногда и по форме, причем меньшая из них называется почкой (англ. bud).
Рис. 228. Способы деления прокариотной клетки. А — бинарное эквивалентное деление (сверху) и бинарное неэквивалентное деление, или почкование (снизу); Б — тройственное деление; В — четвертное деление.
Прочерчены оси деления.
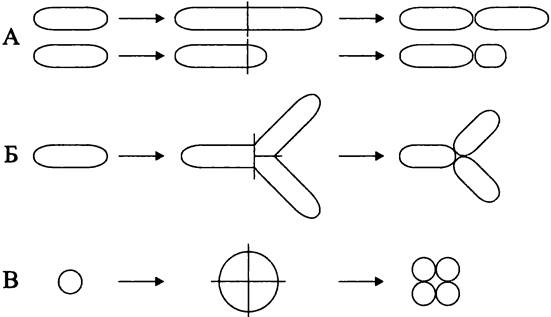
Исключительно редко у бактерий встречается тройственное деление (англ. ternary fission), или одновременное деление материнской клетки на три части (рис. 228, Б). В качестве примера можно назвать квази-фототрофную бактерию Сitromicrobium bathyomarinum (класс «Alphaproteobacteria»), а также зеленую аноксигенную фототрофную бактерию Pelodictyon spp. (фила BXI Chlorobi).
Уникальное четвертное деление (англ. tetrary fission), или деление материнской клетки на четыре части (рис. 228, В), наблюдается у хемогетеротрофной радиоустойчивой бактерии Deinococcus radiodurans (фила BIV «Deinococcus-Thermus»).
Разобщение клеточного деления с клеточным ростом: дробление. При бинарном, тройственном или четвертном делении бактерия, прежде чем поделиться, растет и увеличивается в размере. Только что образовавшиеся, или ювенильные дочерние клетки практически не отличаются по величине от зрелых неделящихся клеток. Иная картина наблюдается в случае дробления, которое редко встречается у бактерий, а у архей вообще не обнаружено.
При дроблении, или множественном делении (англ. multiple fission) материнская клетка образует 2n дочерних клеток (n = 3 - 10), значительно уступающих в размере зрелым неделящимся клеткам. Предварительно, по аналогии с бинарным, тройственным или четвертным делением, материнская клетка растет, однако деление происходит в отсутствии роста ювенильных дочерних клеток.
Способность к дроблению служит диагностическим признаком цианобактерий пор. Pleurocapsales. У них существуют альтернативные программы развития (рис. 229):
— зрелая клетка, или макроцит (англ. macrocyte; от греч. macros — большой и kitos — сосуд; в данном случае — большая клетка) проходит репликативно-ростовую фазу, превращается в материнскую клетку и делится бинарно; дочерние макроциты превращаются в материнские клетки и т. д.;
— макроцит, в остутствии ростовой фазы, дробится на дочерние клетки, или беоциты (англ. baeocyte; от греч. baios — маленький и kitos — сосуд; 6 данном случае — маленькая клетка), обладающие собственным чехлом или лишенные чехла; покинув чехол материнской клетки, или спорангий, беоциты превращаются в макроциты, размножающиеся бинарным делением либо путем дробления.
Рис. 229. Программы развития плеврокапсовых цианобактерий. А — дробление; Б — дробление в сочетании с бинарным размножением. 1 — макроцит; 2 — дробящийся макроцит (спорангий); 3 — беоцит, покидающий спорангий; 4 — бинарно делящийся макроцит; 5 — дочерняя клетка, образовавшаяся после бинарного деления.
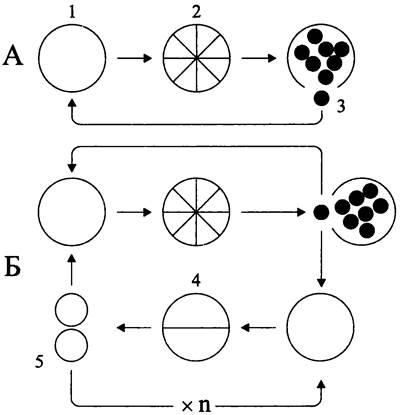
Одни плеврокапсовые цианобактерии реализуют только первую программу развития (рис. 229, А), другие используют обе программы — попеременно и в разном соотношении (рис. 229, Б).
Цитологический механизм дробления плеврокапсовых цианобактерий окончательно не выяснен. Скорее всего, происходит ряд измельчающих бинарных клеточных делений. Однако теоретически возможен и другой способ, когда образуется серия септ, одновременно разгораживающих материнскую клетку на 2n отсеков. В обоих случаях множественная репликация хромосомы материнской клетки должна сопровождаться точной сегрегацией сестринских хромосом между дочерними клетками.
Блокирование программы роста при дроблении, очевидно, происходит на генетическом уровне, и поиски соответствующего мастер-регулятора составляют отдельную проблему.
Биологический смысл дробления окончательно не ясен. Скорее всего, образование множества мелких клеток, которые в отстутствии чехла перемещаются путем скольжения, обеспечивает эффективное расселение на локальной территории.
17.4.1. Выбор сайта деления
При бинарном эквивалентном делении Z-кольцо, создающее границу между будущими дочерними клетками, полимеризуется на экваторе материнской клетки. Возникает вопрос, каким образом прокариоты узнают, где расположен их экватор?
Установлено, что положение экватора определяется по остаточному принципу — в результате двойного негативного контроля за сборкой Z-кольца: (1) со стороны сестринских нуклеоидов и (2) со стороны регулирующей системы MinCDE. Дополнительным негативным регулятором, который органичивает сборку Z-кольца областью экватора, служит белок ZulA.
Эффект расположения сестринских нуклеоидов (англ. nucleoid occlusion — «нуклеоид заслоняет»). Его смысл заключается в том, что сборка Z-кольца запрещается в тех участках под клеточной оболочкой, где концентрация ДНК достигает максимального уровня. Иначе говоря, цитокинез ингибируется там, где сестринские нуклеоиды (хромосомы) ближе всего подходят к СМ. Напротив, сборка Z-кольца разрешается в том месте, где концентрация ДНК минимальна.
В палочковидных клетках существуют три участка с минимальной концентрацией ДНК: экваториальная область между сегрегированными сестринскими хромосомами и оба клеточных полюса (рис. 230). Поэтому размещение потенциальных сайтов деления ограничивается экваториальной областью и полюсами. Реально из этих трех мест остается только экваториальная область, поскольку незаконное деление на полюсах предотвращается системой белков MinCDE (см. ниже).
Рис. 230. Деление «на замке» —двойной негативный контроль за сборкой Z-кoльцa (эффект расположения сестринских нуклеоидов; действие регуляторной системы МinСDЕ). Белые стрелки — экваториальная область деления.
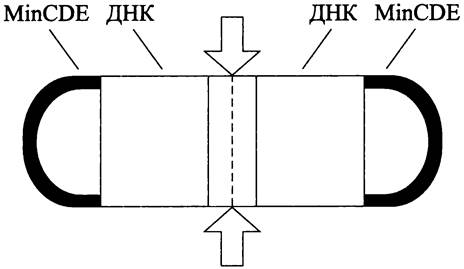
Поскольку экваториальная область, где концентрация ДНК минимальна, формируется после завершения очередного раунда репликации и расхождения сестринских хромосом (см. раздел 16.4-1 1 и 16.4-2.1), за счет эффекта nucleoid occlusion детерминируется не только место, но и время запуска клеточного деления.
Система белков MinCDE. При бинарном эквивалентном делении экваториальное положение Z-кольца определяется системой белков Min (сокр. англ. minicells; Z-кольцо min-мутантов закладывается на полюсе, в результате чего при делении, наряду с жизнеспособной клеткой с двумя хромосомами, образуется абортивная мини-клетка, или клетка без хромосомы).
Min-система Е. coli состоит из белков MinC, MinD и MinE. Сообща они препятствуют сборке Z-кольца на клеточных полюсах, а белок MinC служит ингибитором полимеризации белка FtsZ.
Белок MinC существует в димерной форме. Каждый из мономеров содержит по два квази-симметричных глобулярных домена, которые соединены гибким линкером; за димеризацию отвечает С-концевой участок.
N-концевой участок белка MinC содержит области гомологии со вторым белком кольца деления — FtsA, а также с белком SpoIIAA (от которого зависит субполярная закладка Z-кольца и асимметричное деление при дифференциации эндоспоры; см. раздел 17.5.2.2).
«Якорный» белок МinD обладает АТФазной активностью и существует в двух формах — АДФ-содержащей растворимой и АТФ-содержащей мембраносвязанной. Он способствует присоединению димеров белка МтС к внутренней поверхности СМ.
Белок МinЕ также образует димеры, за что отвечает его С-концевой участок. В свою очередь, N-концевой участок не позволяет белкам МinСD (ингибиторам сборки Z-кoльцa) занять экваториальное положение.
С помощью флуоресцентной микроскопии показано, что белки МinСDЕ осциллируют, попеременно с интервалом ~20 с собираясь в кластеры то на одном, то на другом клеточном полюсе. Благодаря таким перемещениям концентрация ингибиторного белка МтС становится минимальной в области клеточного экватора. В итоге клетка косвенно определяет положение своей продольной оси, перпендикулярно которой и проходит плоскость деления.
Схема осцилляций белков МinСDЕ выглядит следующим образом (рис. 231). АДФ-содержащая форма белка МinD находится в цитоплазме. В свою очередь, АТФ-содержащая форма белка МinD фиксируется в полярном участке СМ и связывает ингибиторный белок МтС. К ним присоединяется белок МтЕ и стимулирует АТФазную активность белка МinD. В результате этого АТФ- содержащая форма белка МinD превращается в АДФ-содержашую форму, которая теряет контакт с СМ и переходит в цитоплазму. Там АДФ обменивается на АТФ. Регенерированная АТФ-содержащая форма белка МinD образует кластер на удалении от белка МinЕ, т. е. на противоположном клеточном полюсе, и т. д.
Рис. 231. Осцилляция компонентов регуляторной Min-системы Е. coli. Объяснение в тексте.
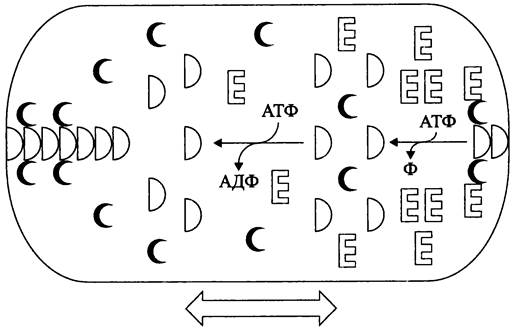
Показано, что кластеры АТФ-содержащей формы белка МinD полимеризуются в микрофиламенты, отходящие от полюса в той половине клетки, где на данный момент за счет осцилляций скапливается относительно меньше белка МтЕ.
Компоненты системы МinСDЕ имеются не у всех бактерий. В то время как белок МinD и его гомологи распространены очень широко, белок МinС встречается реже, а белок МinЕ еще более редок.
В случае В. subtilis и ряда других грамположительных бактерий белки МinСD не осциллируют, а постоянно заякорены на обоих полюсах с помощью белка DivIVА, что позволяет Z-кoльцy собираться посередине клетки; белок МinЕ в данном случае отсутствует. У ряда представителей рода Clostridium одновременно обнаружены белки DivIVA и MinE.
Наконец, некоторые бактерии, в частности грамположигельные кокки, вообще обходятся без системы белков Min.
Белок SulA. Третьим негативным регулятором образования Z-кольца служит белок SulA (сокр. англ. supressor of lon; мутации гена sulA супрессируют (подавляют фенотипическое проявление) мутации гена протеазы Lon (см. раздел 17.2.2), в результате которых клетки приобретают нитевидную форму). Транскрипция гена sulA индуцируется в стрессовых условиях при SOS-ответе (см. раздел 19.1). Продукт экспрессии этого гена ингибирует полимеризацию Z-белка, в результате чего цитокинез откладывается до завершения репарации ДНК. Целесообразность такой стратегии очевидна.
Выбор сайта деления у клеток сферической формы. Модель цитокинеза, предложенная для Е. coli и других палочек, не применима к сферическим бактериям, у которых число потенциальных плоскостей бинарного эквивалентного деления бесконечно велико. Разбраться в этом парадоксе предстоит в ходе будущих исследований.
17.4.2. Кольцо деления
Структурной основой цитоплазматического кольца деления, или Z-кольца служит белок FtsZ (сокр. англ. filamentous temperature-sensitive; из-за дефектов аппарата цитокинеза fts-мутанты не делятся при повышенной температуре, в результате чего гаплоидные палочки превращаются в нитевидные полиплоидные клетки). Под контролем этого белка находится также процесс образования органеллы деления — дивисомы.
Аминокислотная последовательность белка FtsZ на 10-18% сходна с аминокислотной последовательностью тубулина, и эти белки похожи по трехмерной струк-
туре. Подобно тубулину, белок FtsZ содержит характерный мотив GGGTGTG для связывания нуклеотидов и проявляет ГТФазную активность, а также способен к обратимой полимеризации.
Самосборка Z-кольца. Белок FtsZ Е. coli имеет молекулярную массу ~45 кДа. Его гомологи найдены практически у всех бактерий, за исключением Chlamydia trachomatis, а также у большинства архей, кроме представителей филы AI Crenarchaeota.
Белки FtsZ-типа широко распространены у пластид, произошедших от бактерий. Напротив, у митохондрий, также имеющих бактериальное происхождение, они встречаются крайне редко (см. ниже).
В 1991 г. американский микробиолог Джо Люткенхаус (J. Lutkenhaus) установил на примере Е. coli, что белок FtsZ образует в сайте деления микроскопическую кольцевую структуру. Позднее ее назвали Z-кольцом (англ. Z-ring).
Содержание белка FtsZ относительно велико, до 2 • 104 молекул на клетку. Если их условно выстроить цепью, она несколько раз обогнула бы клетку по экватору. Протофиламенты белка FtsZ, образующие Z-кольцо, сходны с протофиламентами тубулина по морфологии и по механизму ГТФ-зависимой самосборки. Между сетью протофиламентов, в которую входят 25% белка FtsZ, и его свободными олигомерами, состоящими из 10-15 субъединиц, происходит непрерывный обмен мономерами.
Z-кольцо образуется только по завершении репликации хромосомы, но независимо от сегрегации сестринских хромосом. Что служит сигналом к началу этого процесса, пока еще не выяснено.
Сборка Z-белка начинается в сайте нуклеации (англ. nucléation site) на одной из боковых сторон цитоплазматического цилиндра. Процесс полимеризации идет по кругу в двух взаимно противоположных направлениях до полного замыкания кольца, которое охватывает клетку изнутри в плоскости деления.
Механизм стягивания Z-кольца. Z-кольцо прикрепляется к СМ при помощи якорного белка Zip А (см. ниже). В ходе цитокинеза от СМ не требуется активных физических усилий, она пассивно инвагинирует в результате стягивания Z-кольца. Для описания этого процесса предложены три модели.
Согласно первой модели, микрофиламенты белка FtsZ при участии неидентифицированного «моторного» белка скользят относительно друг друга, что приводит к сужению Z-кольца. По второй модели, в «якорной» области Z-кольца происходит разборка микрофиламентов белка FtsZ, и связанная с ними СМ подтягивается к центральной оси клетки. В соответствии с третьей моделью, за счет энергии гидролиза ГТФ изменяется конформация микрофиламентов белка FtsZ — они изгибаются, и диаметр Z-кольца уменьшается. Ни одна из этих моделей еще не получила решающего подтверждения.
17.4.3. Самосборка дивисомы
Общепринятое название «дивисома» (англ. divisóme) предложил голландский микробиолог Наннэ Наннинга (N. Nanninga). Наряду с этим, но гораздо реже для обозначения органеллы цитокинеза используются термины септалъсома (англ. septalsome) или септатор (англ. septator).
Дивисома представляет собой мультимерную структуру, которая формируется в сайте деления на основе Z-кольца и состоит из белков деления нескольких типов.
Большинство из них содержит гидрофобные мембранные сегменты. К субъединицам 2-кольца непосредственно присоединяются белки FtsA и ZipA. Затем для активации процесса цитокинеза к ним подключаются белки FtsК, FtsQ, FtsL, FtsB, FtsW, FtsI и FtsN.
Белок FtsА. Наряду с белком FtsZ это второй цитоплазматический белок деления, не содержащий мембранных сегментов. Он гомологичен актину и, подобно актину, проявляет АТФазную активность, а также способен к обратимой полимеризации. Количественное соотношение белков FtsA и FtsZ в клетках Е. соli составляет 1:100. Это означает, что белок FtsА не образует замкнутого кольца, а распределяется в промежутках между протофиламентами белка FtsZ. Для В. subtilis относительное содержание белка FtsА на порядок выше.
Белок FtsА самым первым из белков деления связывается с Z-кoльцoм (рис. 232). Его предполагаемая функция — поспособствовать тому, чтобы все остальные белки деления включились в состав дивисомы. На это расходуется энергия АТФ.
Рис. 232. Взаимодействие Z-кольца с дивисомой и доменная структура белков деления Е. coli. СМ — цитоплазматическая мембрана; С и N — С- и N-концевые домены мономера белка FtsZ.
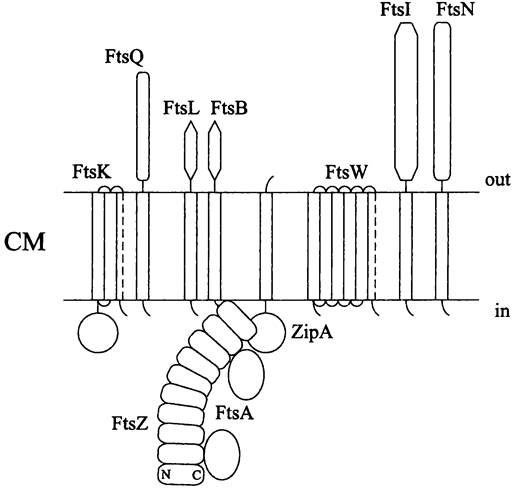
Якорный белок ZipА. Мы уже отмечали, что Z-кoльцo прочно связано с клеточной оболочкой. Это позволяет делящейся клетке — как бы с помощью ирисовой диафрагмы — сомкнуть инвагинацию СМ и взаимно обособить дочерние цитоплазматические компартменты.
В клетках Е. coli роль якоря, фиксирующего Z-кольцо на СМ, выполняет амфипатический белок ZipA (сокр. англ. Z-ring interacting protein). Он содержит N- концевой мембранный сегмент, соединенный гибкой перемычкой с большой цитоплазматической частью, состоящей из двух доменов.
Содержание белка ZipA на один-два порядка меньше, чем белка FtsZ. В сайте деления находятся только 30% его молекул, и они непрерывно обмениваются с остальными 70%, расположенными в других участках СМ.
У большинства бактерий функциональные эквиваленты белка ZipA не выявлены. Хотя в клетках В. subtilis содержится белок EzrA с аналогичной третичной структурой и таким же характером взаимодействия с мембраной, он непосредственно не участвует в цитокинезе, а служит негативным регулятором полимеризации Z- кольца (подобно белку MinE кишечной палочки).
Поздние белки деления. Для них характерно присутствие как минимум одного мембранного сегмента в сочетании с крупным цитоплазматическим или пери- плазматическим сегментом (рис. 232). Функция этих белков по большей части неизвестна, за исключением белка FtsK (который участвует в сегрегации сестринских хромосом), а также белка FtsI(который участвует в биосинтезе септового муреина, образующего перегородку между дочерними клетками).
В случае Е. coli и В. subtilis набор и порядок взаимодействия поздних белков деления сильно различаются. У кишечной палочки их сборка протекает в последовательности FtsK —> FtsQ —> FtsL/FtsB —> FtsW —> FtsI —> FtsN. Очередной белок включается в дивисому только следом за предыдущим. В отличие от этого, у В. subtilis белки DivIB, FtsL, DivIC, РВР-2В и FtsW собираются одновременно.
Белок FtsK. Этот консервативный белок содержит большой цитоплазматический сегмент и N-концевой сегмент, состоящий из четырех трансмембранных спиралей. Предполагается, что при сегрегации сестринских хромосом (см. раздел 16.4.2.1) С-концевой сегмент белка FtsK движется вдоль цепи ДНК и смещает ее в сторону от смыкающейся перегородки. Отметим, что у В. subtilis гомологом белка FtsK является белок SpoIIIE, который обеспечивает попадание одной из двух копий хромосомной ДНК внутрь формирующейся преспоры (см. раздел 17.5.2.2).
Белки FtsQ и DivIB. Белок FtsQ (~30 кДа), имеющийся у Е. coli, содержит единственный мембранный сегмент. Его гомологом у В. subtilis является белок DivIB. Возможно, оба они участвуют в биосинтезе септового муреина.
Белки FtsL/FtsB и DivIC. Небольшие белки FtsL/FtsB (~12 кДа), имеющиеся у Е. coli, содержат по одному мембранному сегменту. Предполагается, что они регулируют клеточное деление. У В. subtilis найдены два функционально сходных с ними и слабо гомологичных им белка (FtsB и DivIC).
Белок FtsW. Данный компонент дивисомы содержит десять мембранных сегментов и принадлежит к белковому семейству SEDS (сокр. англ. shape, élongation, division and sporulation). Возможно, он взаимодействует с белком FtsI и осуществляет таргетинг пенициллинсвязывающих белков, а также доставляет предшественников муреина на наружную поверхность СМ (см. I том учебника).
Белки FtsI и РВР-2b. Биосинтез септового муреина, входящего в состав перегородки между дочерними клетками и участвующего в образовании новых клеточных полюсов, осуществляется с помощью пенициллинсвязывающих РВР-белков (см. I том учебника и раздел 17.3.1). У многих бактерий, в том числе Е. coli, данную роль выполняет белок FtsI; его функциональным аналогом у В. subtilis служит белок РВР2b. N-концевой участок белка FtsI (50 а. о.) интегрирован в мембрану. На С-конце находится большой периплазматический сегмент из 300 а. о.; он содержит каталитический центр. Белок FtsI встраивает новые полигликановые цепи в муреиновый саккулус в соответствии с моделью «три в обмен на одну» (см. I том учебника).
Белок FtsN. Этот белок содержит N-концевой мембранный сегмент и большой периплазматический сегмент. Он не универсален и, кроме Е. coli, обнаружен только у немногих бактерий. Поскольку белок FtsN слабо гомологичен муреинамидазам, его функция может быть связана с локальным гидролизом септового муреина и расслоением поперечной стенки.
Белки деления у цианобактерий. Механизмы цитокинеза у прокариотов консервативны, однако встречаются исключения. Например, в геноме цианобактерий обнаружены ортологи восьми генов деления грамотрицательных и грамположительных бактерий — ftsl, pbp2b, ftsK, ftsL, ftsQ, divIB, ftsW и ftsZ, а также ортологи генов minCDE и sulA, продукты экспрессии которых регулируют сборку Z-кольца. В то же время у цианобактерий выявлены уникальные гены цитокинеза — ftn2 (zipN), ftn6 и cikA. Продукты их экспрессии локализуются в сайте деления, где они могут взаимодействовать с Z-кольцом и регулировать его поведение.
У некоторых штаммов цианобактерий цитокинез начинается еще до того, как сестринские хромосомы покидают сайт деления, что не согласуется с гипотезой nucleoid occlusion, предложенной для Е. coli и других хемотрофных бактерий (см. раздел 17.4.1). Могут быть две причины такого различия.
Во-первых, цианобактерии содержат много геномных эквивалентов, и поэтому у них репликация ДНК не сопряжена с цитокинезом. Во-вторых, между периферией клетки, где собирается Z-кольцо, и центрально расположенной хромосомой находится экран из фотосинтетических ламелл (тилакоидов).
17.4.4. Финал деления
На завершающем этапе деления образуется граница между дочерними клетками. В этот процесс вовлекаются все компоненты клеточной оболочки — СМ, ригидный слой и, в случае грамотрицательных бактерий, ОМ.
Если при росте палочковидных бактерий саккулус достраивается только по латеральной поверхности, а при росте бактерий сферической формы — равномерно по всей поверхности клетки, то при цитокинезе процесс реорганизации муреина переносится в узкую экваториальную зону, соответствующую сайту деления.
Картина деления грамотрицательных бактерий отличается от картины деления грамположительных бактерий (рис. 233). В первом случае деление происходит перетяжкой (англ. constriction) — на цилиндрической части материнской клетки образуется кольцевая бороздка, по мере углубления которой перемычка между дочерними клетками истончается. Во втором случае деление осуществляется путем септирования (англ. septation) — цилиндрическая часть материнской клетки остается внешне ровной, и дочерние клетки расходятся только после того, как автолизины расслаивают септу, или поперечную перегородку.
Рис. 233. Поведение клеточной оболочки при бинарном делении посредством образования перетяжки (А) и септы (Б). ОМ — наружная мембрана; II — муреиновый саккулус; СМ — цитоплазматическая мембрана.
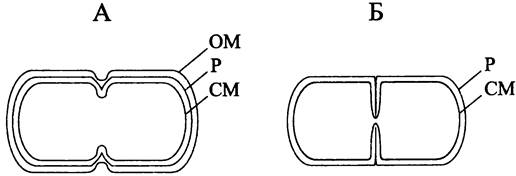
Как правило, клетки с относительно толстым ригидным слоем делятся перетяжкой, а если ригидный слой относительно тонкий — путем септирования. Наблюдаемое различие не обязательно носит альтернативный характер (встречаются промежуточные варианты) и связано с характером размещения муреина на новых клеточных полюсах. В обоих случаях СМ инвагинирует под воздействием белков деления, и лидирующий край кольцевой диафрагмы смыкается на длинной оси клетки.
Чтобы СМ смогла инвагинировать, ей необходимо преодолеть клеточный тургор, а также физическое сопротивление цитоплазматических структур. По-видимому, источником силы, направленной внутрь клетки, служит стягивание Z-кольца, а не врастание ригидного слоя (поскольку у микоплазм деление происходит в отсутствии клеточной стенки).
Особая ситуация наблюдается у бактерий рода Chlamydia, у которых альтернативой муреина служит периплазматический белковый саккулус (см. I том учебника). В данном случае Z-кольцо не образуется, т. е. механизм цитокинеза должен уникальным.
По завершении цитокинеза дивисома разбирается. Сценарий этого процесса еще не выяснен.
17.4.5. Деление митохондрий и пластид
Полуавтономные цитоплазматические органеллы ядерных клеток, митохондрии и «простые» пластиды, относятся к прокариотному морфотипу (см. I том учебника и раздел 20.4 настоящего тома) и эволюционно произошли от эндосимбиотических бактерий.
Предтечами митохондрий были фототрофные представители класса «Alphaproteobacteria», которые 1,5 млрд лет назад заняли такую специализированную нишу, как эукариотная клетка. Затем митохондриальные протисты вторично приобрели эндосимбионтов из числа представителей филы ВХ Cyanobacteria, которые превратились в «простые» хлоропласты (см. раздел 20.5.2.2).
Митохондрии и пластиды никогда не образуются de novo. Подобно своим бактериальным предкам, они размножаются бинарным делением, причем деление клетки-хозяина и деление органелл — это самостоятельные, хотя и взаимно координированные процессы.
Оболочка митохондрий и «простых» хлоропластов (произошедших непосредственно от цианобактерий) состоит из двух мембран, которые после сегрегации сестринских хромосом этих органелл участвуют в митокинезе (англ. mitochondriokinesis) и пластокинезе (англ. plastidokinesis).
Митокинез архаичных протистов. как и цитокинез бактерий, осуществляется с помощью Z- кольца. Митохондрии более прогрессивных протистов, а также митохондрии грибов, растений и животных Z-кольца не образуют, а взамен него используется кольцевая структура эукариотного типа.
Пластокинез сходен с цитокинезом прокариотной клетки, поскольку при нем используется Z- кольцо, а также белки MinDE.
Митокинез. Гомолог протеобактериального белка FtsZ сохранился только у протистов Cyanidioschizon merolae и Mallomonas splendens. Этот белок полимеризу- ется в матриксе митохондрии в кольцо, расположенное под внутренней мембраной оболочки этой органеллы. Над ним, тоже в митохондриальном матриксе, собирается вспомогательное MD-кольцо (сокр. англ. mitochondrion-dividing). Его состав и функция неизвестны.
В остальных случаях митокинез осуществляется с помощью гомологов динамина (англ. dynamin-related protein, DRP). Напомним, что в ядерной клетке динамин участвует в эндоцитозе и помогает клатрин-окаймленным везикулам отшнуровываться от поверхности СМ. DRP-белки обладают ГТФазной активностью и способны полимеризоваться в спиральные микрофиламенты. В отличие от Z-кольца и MD- кольца, DRP-кольцо размещается в цитозоле клетки-хозяина. Материалом для него служат белки Dnm1(в случае дрожжей) и Drp1 (в случае животных). Помимо белка Dnm1, у дрожжей имеются еще два белка, которые совместно запускают митокинез (Fis1 и Mdv1). Это периферические белки, связанные с внешней мембраной оболочки митохондрии.
Пластокинез. Ключевую роль в пластокинезе выполняют гомологи белка цианобактерий FtsZ. Они являются продуктами экспрессии двух ядерных генов-паралогов — ftsZ1и ftsZ2.Эти белки синтезируются хозяйскими рибосомами, и за счет удаляемой сигнальной последовательности, или N-концевого транзитного пептида импортируются в хлоропласт. Из них в строме хлоропласта (которая является эквивалентом прокариотной цитоплазмы) при содействии белков MinDE, а также белка ARC6 (гомолога цианобактериального белка Ftn2) полимеризуется Z-кольцо. Другими участниками этого процесса являются бактериальный белок SulA и уникальный растительный белок ARTEMIS.
После образования Z-кольца в строме пластиды собирается внутреннее PD-кольцо (сокр. англ. plastiddividing). Данные о составе и функции PD-кольца, как и для MD-кольца, еще не получены. В последнюю очередь в цитозоле клетки-хозяина собирается внешнее PD-кольцо. Материалом для него служит DRP-белок ARC5.
Дочерние пластиды обособляются в результате совместного стягивания всех трех колец, которые затем разбираются.
17.4.6. Деление архей
У многих видов архей из филы АII Euryarchaeota прямыми биохимическими методами, а также косвенным путем, на основе анализа полностью расшифрованных геномов, выявлен белок FtsZ. По аминокислотной последовательности он больше сходен с FtsZ-бeлкaми, чем с тубулином.
Некоторые виды архей содержат не один ген ftsZ, а два гена-паралога (ftsZ1 и ftsZ2). Среди бактерий такие дивергентные гены удалось обнаружить только у Sinorhizobium meliloti; кроме того, они имеются у пластид (см. выше). Смысл существования генов-паралогов ftsZ неясен; возможно, что они экспрессируются в разных условиях, или их продукты выполняют разную функцию. Из других белков, участвующих в цитокинезе архей и сходных с соответствующими бактериальными белками, выявлен только гомолог белка МinD.
Цитокинез архей из филы АII Euryarchaeota протекает в целом так же, как у бактерий (путем перетяжки или септированием), хотя встречаются интересные исключения.
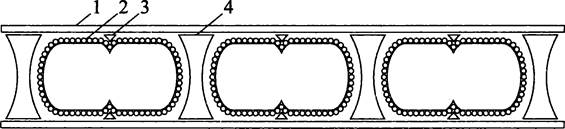
Метаногены Methanosaeta thermophila и Methanospirillum hungatei делятся не с помощью цитоплазматического, а с помощью экзоплазматического кольца.
Внешне эти археоты выглядят как слабо спирализованные палочки, что отражено в их родовых названиях (лат. saeta — грива и spira — завиток). Однако в действительности это не одна длинная клетка, а цепочка коротких палочек, разделенных двояковогнутыми прослойками, или спейсерными пробками (англ. spacer plug). Агрегат, состоящий из взаимно перемежающихся клеток и спейсерных пробок, одет общим чехлом, внешний диаметр которого составляет ~1 мкм, а длина ~150 мкм. Чехол, устойчивый к химическим реагентам, а также гидролитическим ферментам, образован димерами белка молекулярной массой 50 кДа, уложенными кольцами или образующими плотно сжатую спираль. Поскольку в данном случае стенка представлена эластичным S-слоем, состоящим из негликозилированных белковых протомеров молекулярной массой 100 кДа, форма клетки зависит не от нее, а от экзоскелета, т. е. от совокупности чехла и спейсерных пробок.
Материнская клетка перегораживается по экватору белковым кольцом деления (англ. division annulus), которое представляет собой спиральную ленту, образующуюся в зазоре между S-слоем и чехлом. Кольцо смыкается, как ирисовая диафрагма, в результате чего дочерние клетки принудительно обособляются друг от друга, и между ними образуется спейсер (рис. 234). Молекулярный состав кольца, деления, а также способ выбора сайта его сборки еще не выяснен.
Рис. 234. Деление Methanosaeta thermophila и Меthanospirillum hungatei.1 — чехол; 2 — S-слой; 3 — формирующееся кольцо деления; 4 — спейсерная пробка.
У представителей филы AI Crenarcliaeota гомологи белка FtsZ не обнаружены, и молекулярный механизм их цитокинеза неизвестен. Археи из рода Sulfolobus, обладающие эластичным ригидным слоем, делятся перетяжкой. В свою очередь, клетки Thermoproteus spp., имеющие более жесткий ригидный слой, делятся путем расщелкивания (англ. snapping division). Характерным признаком этого способа деления служит колебательное движение пары дочерних клеток, после чего их общая поперечная стенка резко расслаивается (отметим, что аналогичный тип деления известен у грамположительных бактерий из рода Corynebacterium; он приводит к образованию характерных агрегатов, в которых клетки расположены палисадами или в форме буквы V). Наконец, клетки Pyrobaculum spp. делятся еще не известным способом — без образования перетяжки, но и не путем септирования.