МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 17. ОНТОГЕНЕЗ
17.5. Клеточная дифференциация
В отличие от вегетативных клеток, дифференцированные клетки перестают, на время или окончательно, расти и размножаться делением. В таком непролиферативном состоянии они выполняют одну или несколько специализированных физиологических функций.
Дифференцированные клетки широко распространены у многоклеточных ядерных организмов, а также встречаются у некоторых протистов и прокариотов. Однако дифференцировка клеток и тканей многоклеточного организма существенно отличается от клеточной дифференциации (англ. cell differentiation) у одноклеточного организма.
В первом случае дифференцированные клетки входят в состав ткани или, при искусственно созданных условиях, образуют клеточную культуру. Во втором случае они, как правило, представляют собой индивидуальный организм.
Признаки дифференциации также имеются у гамет, которые формируются у размножающихся половым путем многоклеточных ядерных организмов и у некоторых протистов. Однако — в отличие от собственно дифференцированных клеток — гаметы выполняют не физиологическую, а генетическую функцию.
У прокариотов клеточная дифференциация может принимать разнообразные, порой весьма контрастные формы. В одних случаях в дифференцированных клетках начинают экспрессироваться структуры и появляются de novo функции, ранее отсутствовавшие у вегетативной особи. В других случаях биогенез той или иной структуры репрессируется, что приводит к временной или окончательной потере функции.
Дифференцированные клетки прокариотов можно подразделить на две группы.
К первой группе относятся метаболически активные дифференцированные клетки. Они характеризуются высоким уровнем метаболических процессов и относительно низкой устойчивостью к экстремальным факторам внешней среды.
Во вторую группу входят покоящиеся резистентные клетки. Для них характерен пониженный уровень генеральных метаболических процессов (вплоть до анабиотического состояния), что сочетается с относительно высокой устойчивостью к экологическим стрессам (вплоть до гиперрезистентности). Отдельные представители этой группы обладают растянутым клеточным циклом, рекордная продолжительность которого может достигать сотен тысяч и даже нескольких десятков миллионов лет.
17.5.1. Метаболически активные дифференцированные клетки
Дифференцированные клетки, относящиеся к данной группе, проявляют общую или специфически ориентированную метаболическую активность (в частности, они могут обладать способностью к диазотрофии: см. II том учебника), что позволяет объекту широко распределиться в пространстве и повышает его конкурентный потенциал.
17.5.1.1. Агенты распространения — беоциты и гормогонии
У прокариотов задача по пространственному распространению, т. е. физическому (не адаптационному!) проникновению в новые ниши, а также общему расширению ареала может решаться разными способами. Это свободный перенос через воздушную или водную среду, использование (а)биотических макроносителей и собственная активная подвижность.
Эффективность распространения тем выше, чем большее количество особей принимает в нем участие, а также чем выше их инвазивные свойства и жизнеспособность. Конечный успех ожидает либо покоящиеся резистентные клетки, либо физиологически активные клетки мелкого размера, который по понятным причинам способствует пространственному распространению и инвазии.
Физиологически активные агенты пространственного распространения бывают двух типов. Это либо вегетативные клетки ультрамикробактерий (см. I том учебника), либо дифференцированные клетки бактерий «обычного» размера, например, швермеры Rhodomicrobium vannielii и Caulobacter crescentus (их мы уже рассматривали в связи с вопросами, касающимися клеточного цикла; см. раздел 17.1.4). В настоящем разделе речь специально пойдет о двух физиологически активных агентах пространственного распространения цианобактерий — беоцитах и гормогониях.
Беоциты. О механизме образования беоцитов и их значении для пространственного распространения плеврокапсовых цианобактерий уже говорилось в разделе
17.4. Теперь остановимся на признаках их дифференциации.
Существует два типа беоцитов — подвижные и неподвижные. В первом случае они не имеют чехла, а во втором случае, как и материнские клетки, окружены чехлом. Беоциты в несколько раз меньше материнской клетки по диаметру и, соответственно, на два порядка уступают ей в объеме.
Какие стимулы способствуют переходу от обычного бинарного деления к дроблению с образованием беоцитов, неизвестно. Во всяком случае, в растущих культурах оба типа размножения наблюдаются одновременно.
По имеющимся данным, тилакоиды в беоцитах упакованы иначе, чем в вегетативных клетках; фикобилипротеины практически отсутствуют, а состав апопротеинов ФСII видоизменен.
Таким образом, признаки дифференциации беоцитов в первую очередь связаны с покровными структурами и фотосинтетическим аппаратом. Сходные изменения происходят при дифференциации акинет и гетероцист (см. ниже). Хотя адаптационные стратегии этих дифференцированных клеток различны, во всех трех случаях энергетический метаболизм разобщен с конструктивным метаболизмом.
Особенности фотосинтетического аппарата в беоцитах можно объяснить следующим образом: дробление опережает темп биосинтетических реакций, которые обеспечиваются ФСII и ее антенной — фикобилисомой. В качестве агентов пространственного распространения беоциты испытывают первоочередную потребность не в биосинтезах, а в энергии, которая в основном поступает от ФСI.
Гормогонии. В словаре альгологов гормогонием (греч. hormos — обрубок и gonos — рождение; в данном случае — особь, возникшая из части трихома) называется короткий и подвижный дочерний трихом, отделившийся от неподвижного и очехленного родительского трихома. Для микробиологов смысл данного термина иной: гормогоний — это короткий, (не)подвижный трихом, состоящий из клеток, которые мельче вегетативных, отличаются от них по форме и обладают признаками физиологической дифференциации. В данное определение также входит то, что в позднем гормогонии могут появляться гетероцисты, и его клетки часто содержат газовые везикулы (см. I том учебника).
Гормогоний образуется в результате серии «измельчающих» клеточных делений, что аналогично дроблению плеврокапсовых цианобактерий (см. раздел 17.4). Дифференциация сопровождается уменьшением гидрофобности клеточной поверхности и приобретением подвижности — флотационной (с помощью газовых везикул), твитчинга (с помощью фимбрий) и скользящей. Клетки гормогония уступают вегетативным клеткам по числу копий генома (в среднем 3,5 против 24).
Регуляция образования гормогониев. Существует пестрый набор индукторов, вызывающих образование гормогониев у разных представителей цианобактерий из Субсекций IV и V — от специфического термолабильного агента, который синтезируется клетками в стационарной фазе, до ряда общих физико-химических факторов и трофических условий (температура, отсутствие света или облучение красным светом длиной волны ~640 нм; лимитирование азотом, железом или фосфором). Отмечается также, что эндогенным триггером образования гормогониев служит переход пластохинонного пула в окисленное состояние (см. II том учебника).
Есть данные о том, что ген sigA (кодирует главный сигма-фактор) начинает сильнее экспрессироваться при образовании гормогониев. Альтернативные сигма-факторы, ассоциированные с данным типом дифференциации, не обнаружены.
17.5.1.2. Фабрики диазотрофии — диазоциты и гетероцисты цианобактерий, бактероиды клубеньковых бактерий и везикулы актинобактерий
Способностью к диазотрофии могут обладать как вегетативные, так и дифференцированные прокариотные клетки.
В первом случае используются собственные метаболические ресурсы диазотрофа; ему же, главным образом, и достаются продукты ассимиляции молекулярного азота (обычно это глутамин).
Во втором случае диазотроф вступает в мутуалистические взаимоотношения с вегетативными клетками, снабжающими его углеродными субстратами в обмен на продукты ассимиляции молекулярного азота.
Существует несколько типов таких специализированных фабрик диазотрофии. Одни из них способны дедифференцироваться, другие дифференцируются терминально и после завершения жизненного цикла подвергаются запрограммированной смерти.
В диазотрофной клетке содержится нитрогеназа, и создаются предпосылки для ее функционирования: (1) доступ N2 в качестве главного субстрата для восстановления; (2) поступление низкопотенциального восстановителя, в частности ферредокси- на или флаводоксина; (3) приток энергии в форме Mg-АТФ; (4) низкое парциальное давление О2.
Особое значение имеет поддержание режима аноксии, необходимого для обоих компонентов нитрогеназы — редуктазы динитрогеназы и динитрогеназы (см. II том учебника), поскольку этот фермент инактивируется молекулярным кислородом.
Диазоциты. Диазотрофные цианобактерии подразделяются на две группы — образующие гетероцисты (см. ниже) и не образующие гетероцист. Штаммы первой группы способны к диазотрофии в аэробной среде, и при отсутствии связанного азота ~7% вегетативных клеток дифференцируются в гетероцисты. Внутри гетероцист поддерживаются условия, близкие к анаэробным. Это совершенно необходимо для функционирования нитрогеназы (в отличие от вегетативных клеток, гетероцисты не образуют эндогенный О2, а от накопления экзогенного кислорода они защищены особым чехлом).
Вторая группа диазотрофных цианобактерий, в свою очередь, подразделяется на одноклеточные штаммы и нитчатые (трихомные) штаммы. Одноклеточные диазотрофные штаммы в принципе не способны превращаться в гетероцисты, но все же обладают разнообразными механизмами защиты нитрогеназы от кислорода (см. II том учебника). Нитчатые безгетероцистные штаммы также используют ряд механизмов защиты нитрогеназы в отсутствии клеточной дифференциации. Однако в отдельных случаях — примером служат штаммы Trichodesmium sрр. — при азотном голодании в центральной части трихома образуются 1-2 цепочки дифференцированных диазоцитов (англ. diazocyte). Подобно гетероцистам, диазоциты служат местом сосредоточения нитрогеназы и в аэробных условиях на свету восстанавливают молекулярный азот. Соответственно, они обладают рядом морфо-биохимических отличий от недиазотрофных вегетативных клеток — в них увеличивается количество тилакоидов, возрастает активность цитохромоксидазы и образуется глутаминсинтетаза. В диазоцитах выявлены гены, с которыми связана дифференциация гетероцист, например, гены ntcA, hanA, hetR, devR и patB (см. ниже). В отличие от гетероцист, диазоциты не дифференцируются терминально и могут возвращаться в вегетативное состояние. Их изучение еще только начинается; в частности, предстоит выяснить механизм, с помощью которого нитрогеназа защищается от кислорода.
Гетероцисты. При азотном голодании (<5 mM NH+4 или NO-3) нитчатые цианобактерии Субсекций IV и V образуют гетероцисты (англ. heterocyst; от греч. eteros — другой и kistis — пузырь; в данном случае — особенная циста). В этих дифференцированных клетках избирательно локализуется нитрогеназа, что доказано иммуноцитохимическим методом, а также при помощи молекулярного зондирования структурных генов nifHDK. После достижения порогового уровня связанного азота (чаще всего, аммония или нитрата) в качестве промежуточной стадии образуются прогетероцисты, которые через 6-12 ч можно отличить от вегетативных клеток по желтоватому цвету и повышенной зернистости; еще через 12-20 ч они начинают превращаться в зрелые гетероцисты. До появления активности нитрогеназы зрелые гетероцисты еще способны дедифференцироваться. Затем дифференциация становится необратимой, и по завершении клеточного цикла гетероциста обречена на старение и запрограммированную смерть.
Строение и физиологические свойства гетероцисты. Источником энергии для нитрогеназной реакции служит АТФ, продукт циклического фотофосфорилирования (относительное количество RC ФСI в гетероцисте выше, чем в вегетативной клетке) или окислительного фосфорилирования. Неудивительно, что по размеру ламеллярной системы гетероциста не уступает вегетативной клетке, хотя тилакоиды в ней приобретают иную конфигурацию (рис. 235). Донором электронов для нитрогеназы служит ферредоксин, восстанавливающийся в результате НАДФН: ферредоксин-оксидоредуктазной реакции. В свою очередь, НАДФН регенерируется при катаболизме импортируемых или запасных гексоз через окислительный пентозофосфатный цикл (см. ниже).
Рис. 235. Гетероциста с фланкирующими вегетативными клетками. СМ — цитоплазматическая мембрана; Т — тилакоид; PBS — фикобилисома; МР — микроплазмодесмы; HS — сотовидная структура; LL — ламинарный слой; HL — гомогенный слой; Р — пробка; CG — цианофициновая гранула; G — полигликозидные гранулы; CS — карбоксисома; [С] — связанный углерод (сахароза); [N] — связанный азот (глутамин). Не изображены: нуклеоид, муреиновый саккулус, ОМ и фибриллярный слой оболочки гетероцисты.
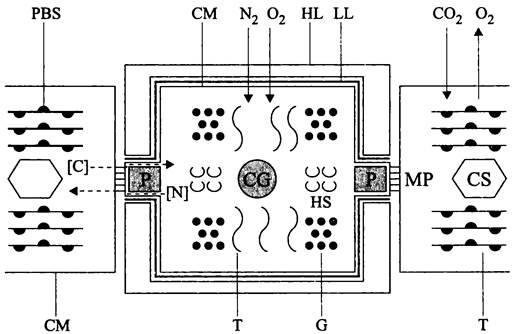
Гетероциста желтее вегетативных клеток, что связано с разрушением фикоби- липротеинов, а на светооптическом уровне выглядит зернистой из-за накопления запасных включений, в первую очередь цианофициновых гранул. На электронных микропрепаратах видно, что в цитоплазме гетероцисты содержится большое количество полиглюкозидных включений (рис. 235).
Как уже отмечалось, для функционирования нитрогеназы необходимо, чтобы в цитоплазме гетероцисты поддерживалось низкое парциальное давление кислорода. Для этого в гетероцисте прекращается эндогенное образование О2, и она имеет дело только с тем кислородом, который проникает в нее из соседних вегетативных клеток, а также с кислородом, поступающим в нее из окружающей среды.
Чтобы прекратить эндогенное образование кислорода, под воздействием индуцибельных протеаз в той или иной степени демонтируется основной светособирающий комплекс (фикобилисома) и ФСII. В обязательном порядке деградирует кислород- выделяющий комплекс.
Чтобы уменьшить диффузию кислорода из вегетативных клеток, площадь контакта гетероцисты с соседями уменьшается за счет образования «шейки» (рис. 235). Сверх этого, чтобы ограничить поступление кислорода через микроплазмодесмы, соединяющие гетероцисту с примыкающей вегетативной клеткой, внутри шейки образуется цианофициновая пробка (англ. plug; рис. 235).
В свою очередь, доступ экзогенного кислорода ограничивается за счет фильтрующих свойств ламинарного слоя чехла.
Гетероциста одета чехлом из трех слоев — внешнего (фибриллярного), промежуточного (гомогенного) и внутреннего (ламинарного). Фибриллярный и гомогенный слои состоят из гетерополисахарида, а ламинарный слой из гликолипидов; все они, особенно ламинарный слой, препятствуют поступлению наружного воздуха внутрь гетероцисты. Поскольку ван-дер-ваальсовы радиусы молекул азота и кислорода примерно одинаковы (1,5 и 1,4А), чехол ограничивает диффузию обоих газов. При их атмосферном соотношении 4:1 концентрация азота в цитоплазме гетероцисты не лимитирует диазотрофию, а остаточный кислород удаляется за счет эндогенного дыхания.
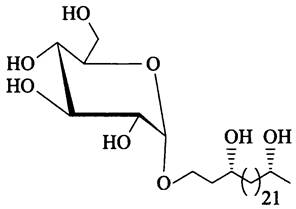
Гликолипиды ламинарного слоя имеют уникальное строение. Это простые эфиры глюкозы с неразветвленными 26-углеродными спиртами, содержащими 1-3 гидрокси-группы и, в некоторых случаях, оксо-группу. Среди них наиболее распространен 1-(О-α-D-глкопиранозил)-гексакозан- 3,25-ди-ол (рис. 236).
Рис. 236. Главный гликолипид, образующий ламинарный слой оболочки гетероцисты (1-(O-α-D-глюкопиранозил)- гексакозан-3,25-ди-ол).
Помимо вышеуказанных механизмов, которые служат для поддержания аноксичных условий в цитоплазме гетероцисты, для устранения кислорода, все-таки проникшего в гетероцисту, используется ряд дополнительных способов.
Важнейшим из них является дыхание, в ходе которого кислород при помощи цитохромоксидазы восстанавливается до воды. Особо богаты окислительными ферментами сотовидные мембранные агрегаты, расположенные на полюсах гетероцисты по соседству с шейками (рис. 235). Субстратом для дыхания, видимо, служит сахароза. Она поступает в гетероцисту из вегетативных клеток (гетероциста неспособна к углеродной автотрофии, поскольку самостоятельно не образует восстановителя и не содержит ферментов цикла Кельвина-Бенсона-Бэссема; см. II том учебника). Под воздействием инвертазы сахароза превращается в глюкозу и фруктозу, которые катаболизируются в пентозофосфатном цикле, а образующийся НАДФН окисляется дыхательной цепью (см. II том учебника). Еще одним субстратом для дыхания служит молекулярный водород, побочный продукт нитрогеназной реакции. Он окисляется uptake-гидрогеназой (см. II том учебника), которая восстанавливает НАДО; НАДФН, в свою очередь, передает электроны аэробной дыхательной цепи.
Чтобы предотвратить инактивацию нитрогеназы, в гетероцистах дополнительно используется кислородсвязывающий белок цианоглобин (англ. суanoglobin, GIbN). По функции он аналогичен леггемоглобину в клубеньках бобовых растений, который связывает кислород и доставляет его бактероидам (см. ниже).
Наконец, нитрогеназа сама себя защищает (англ. autoprotection). Соответствующий механизм связан с инактивацией кислорода в результате его неспецифического восстановления Fе-белком (см. II том учебника). При относительном избытке кислорода происходит одноэлектронное восстановление с образованием супероксидного анион-радикала O2-, а при относительном избытке Fе-белка — 2-х или 4-х электронное восстановление с образованием, соответственно, Н2О2 и Н2О.
Конечный продукт нитрогеназной реакции, аммоний, используется для синтеза глутамина из глутамата с помощью глутаминсинтетазы (GS), которая избирательно накапливается в гетероцисте. Глутамат, в свою очередь, поступает из вегетативных клеток, где он синтезируется с помощью глутаматсинтазы (GОGАТ; см. II том учебника). Таким образом, трихом цианобактерий, в котором гетероцисты сосуществуют с вегетативными клетками, можно уподобить многоклеточному организму, состоящему из взаимозависимых клеток двух типов.
Дифференциация гетероцист вызвана глобальными изменениями характера экспрессии генов, что связано не только с частично расшифрованным внутриклеточным ответом на азотное голодание, но и с таинственной системой межклеточных взаимоотношений. Важнейший вопрос, на который еще не получен ответ — как инициируется дифференциация и каким образом в ходе нее регулируется транскрипция?
Регуляция образования, гетероцист. Дифференциация у прокариотов обычно находится под контролем альтернативных сигма-факторов, которые определяют сродство РНК-полимеразы к промоторам стрессовых генов; самым ярким примером служит образование бактериальных эндоспор (см. раздел 17.5.2.2). Однако мутации по генам sigВ и sigС,кодирующим сигма-факторы, которые экспрессируются при азотном голодании, не приводят к потере способности образовывать функционально активные гетероцисты. Из генов шести известных сигма-факторов цианобактерий (sigA-sigF) ни один специфически не связан с дифференциацией гетероцист.
Ранний ответ на азотное голодание (0-0,5 ч) заключается в том, чтобы полностью использовать экзогенный связанный азот путем активации генов, отвечающих за поглощение и ассимиляцию нитрата. В ответ на возросший уровень а-кетоглутартата активируется ген ntcA (сокр. англ, nitrogen consumption). Его продуктом является глобальный регулятор — ДНК-связывающий белок NtcA. Он обеспечивает экспрессию комплекса генов, отвечающих за транспорт и восстановление нитрата, ассимиляцию аммония, дифференциацию гетероцист и диазотрофию. Белок NtcA авто- регулируется, связываясь с ДНК в upstream-положении от гена ntcA, а также взаимодействует с палиндромом GTA(Ns)TAC в промоторных участках генов nrtABCD (кодируют транспортер нитрата), nагВ (кодирует нитратредуктазу), шг.4 (кодирует нитритредуктазу), glnА (кодирует глута- минсинтетазу), petH (кодирует ферредоксин: НАДФ-оксидоредуктазу) и nifH (кодирует Fe-белок нитрогеназы).
Помимо указанных генов, белок NtcA активирует ген han А. Продукт этого гена, ДНК-связывающий белок lianА (сокр. англ. histone of Anabaena) является гомологом гистоноподобного HU- белка Е. coli (см. I том учебника). В свою очередь, белок НаnА каким-то образом активирует транскрипцию центрального участника регуляторного каскада — гена hetR.
Через 1-2 ч после начала азотного голодания повышается транскрипция гена hetR (сокр. англ. heterocyst), причем это происходит в прогетероцистах, которые регулярно распределены по трихому. В контроле экспрессии этого гена участвует белок NtcA, но косвенным образом, поскольку в его промоторах нет палиндрома GTA(Ns)TAC. В отличие от предыдущих регуляторов, белок HetR не является ДНК-связывающим белком, а представляет собой «сериновую» протеазу (с остатком Serl52 в активном центре). Мишенью для протеолиза служат белки, участвующие в дифференциации гетероцист.
Через 4 ч после начала азотного голодания индуцируются гены hetP и hetC. Мутации по ним блокируют образование гетероцист. Функция продукта гена hetP непонятна, и он не имеет гомологов среди известных белков. Функция продукта гена hetC также не выяснена, хотя установлено, что он гомологичен АВС-пермеазам (см. II том учебника).
Через 6 ч после начала азотного голодания, в строгой зависимости от экспрессии генов ntcA и hetR, начинает экспрессироваться ген devH (сокр. англ. development). Белок Devilгомологичен белку NtcA и, как и тот, принадлежит к числу ДНК-связывающих белков.
Как видно, многие актеры при дифференциации гетероцист известны, однако сценарий этого процесса ждет реконструкции.
Замечено, что некоторые гены, участвующие в образовании гетероцист, в том числе ген hetR, кодируют белки, гомологичные белкам двухкомпонентных сигнальных систем (см. раздел 18.2). Для сравнения, у энтеробактерий азотный метаболизм регулируется двухкомпонентной сигнальной системой NtrB/NtrC (см. раздел 18.3.2.3). В качестве стимула, сообщающего об азотном статусе клетки, используется продукт гена glnB — белок РII, который, в частности, контролирует экспрессию гена глутаминсинтетазы glnA. Гомологи белка РII обнаружены у цианобактерий и, возможно, каким-то образом участвуют в образовании гетероцист.
Регуляция паттерна распределения гетероцист. Помимо регуляции образования гетероцист регулируется паттерн их распределения (англ. pattern-рисунок), т. е. положение гетероцисты по отношению к соседним вегетативным клеткам и другим гетероцистам. Согласно имеющимся данным, за паттерн распределения гетероцист отвечают гены patA, patBи patС (сокр. англ. pattern). Их экспрессия начинается, соответственно, через 3-6, 3-6 и 12 ч после начала азотного голодания. Предполагается, что белки PatA и PatB по отдельности входят в двухкомпонентные сигнальные системы, которые в ответ на изменение уровня внутриклеточных хемоэффекторов регулируют транскрипцию генов, специфичных для гетероцисты. В свою очередь, продуктом гена patC является пептид, с помощью которого прогетероцисты, по-видимому, ингибируют дифференциацию соседних клеток.
Относительное количество гетероцист многократно возрастает у симбиотических цианобактерий, в частности у Nostoc sp. (см. раздел 20.3.3), и может достичь 30-80%. Налицо адаптивная коррекция регуляторных механизмов образования и паттерна распределения гетероцист, но каким образом это происходит, еще неизвестно.
Бактероиды. Бактероиды представляют собой дифференцированные клетки диазотрофных клубеноковых бактерий, в первую очередь, из рода Rhizobium — факультативных эндоцитобионтов бобовых растений. Дифференциация носит в основном терминальный характер (судя по способности образовывать колонии, жизнеспособность зрелых бактероидов не превышает 0,3%). Как правило, вегетативные ризобии инфицируют растительную ткань при помощи специального средства доставки — инфекционной нити (см. раздел 20.3.3). Она представляет собой наполненную ризобиями трубчатую инвагинацию СМ и клеточной стенки хозяина. Инфекционная нить распространяется по разросшейся под влиянием бактериальной инфекции ткани корневого кортекса, пронизывая ее клетки. Выход ризобиев из инфекционной нити в кортекс осуществляется на ее боковых сторонах в участках, не покрытых клеточной стенкой. Отделившиеся от инфекционной нити ризобии внедряются в полиплоидные клетки клубенька с помощью механизма, напоминающего эндоцитоз, что весьма необычно для растительной клетки, которая в норме не допускает прямого контакта между внешними объектами и своей СМ.
В ходе эндоцитоза ризобиальная клетка окружается перибактероидной мембраной и оказывается внутри перибактероидной вакуоли. На ранней стадии симбиоза вегетативные ризобии быстро размножаются на периферии хозяйской клетки; вместе с ними увеличивается в размере и перибактероидная вакуоль. После ее фрагментации образуются мелкие вакуоли с 1-2 бактериальными клетками, равномерно распределяющиеся в цитоплазме. В результате этого на долю бактероидов приходится 25-50% массы клубенька.
На более поздней стадии симбиоза вегетативные ризобии дифференцируются в бактероиды (англ. bacteroid). Диаметр бактероидов достигает 20 мкм, соответственно, по объему они в несколько раз больше вегетативной клетки; они часто имеют специфическую X- или Y-образную форму. Хотя при дифференциации бактероидов скорость синтеза белка возрастает, в зрелых бактероидах содержание ДНК увеличивается, а количество рибосом, наоборот, уменьшается. Бактероиды окружены истонченной осмо чувствительной стенкой, у них изменяется конфигурация нуклеоида, а в цитоплазме накапливаются запасные включения - гликогеновые, полифосфатные и полигидроксиалканоатные гранулы (см. I том учебника). Наконец, у бактероидов изменяется состав терминального участка дыхательной цепи, что повышает ее сродство к кислороду: взамен цитохромоксидазы аа3 появляются альтернативные авток- сидабельные цитохромы с-типа (с 552 и с 554, а также цитохромы Р-420, Р-428 и Р-450). Необходимость этого вызвана тем, что для интерьера клубенька характерно крайне низкое парциальное давление кислорода (~10 нМ). В зрелых бактероидах синтезируется нитрогеназа, содержание которой составляет 10-12% суммарного растворимого белка.
Бактероиды и перибактероидные вакуоли образуют специализированную органеллу диазотрофии — симбиосому (англ. symbiosome). Поскольку в полости, ограниченной перибактероидной мембраной, содержится ряд ферментов, в частности α- маннозидаза II и протеазы, симбиосому можно рассматривать в качестве гидролитического компартмента, интерьер которого нейтрализуется аммонием — продуктом секреции бактероидов.
Перибактероидная мембрана служит границей, отделяющей бактероиды от хозяйской клетки. Через нее осуществляется встречный импорт — хозяин получает аммоний и гем, служащий простетической группой леггемоглобина, а бактероид взамен получает углеродный субстрат и молекулярный кислород, необходимые для регенерации восстановителя и АТФ.
Бактероиды обладают системой импорта дикарбоновых кислот. При диазотрофии либо непосредственно используются эти продукты растительного фотосинтеза, либо мобилизуются запасные полигидроксиалканоаты самой бактерии.
С учетом чувствительности нитрогеназы к кислороду, его доставка к дыхательной цепи осуществляется по принципу «низкая концентрация-активный приток». В качестве переносчика кислорода используется леггемоглобин (от лат. Leguminosae — сем. бобовых), содержание которого достигает 25-30% белка инфицированной клетки. Этот гемпротеин гомологичен гемоглобину и миоглобину. Он обладает исключительно высоким сродством к кислороду (50%-ное насыщение при парциальном давлении 0,55 мМ). Аполеггемоглобин (~150 а. о.; 16 кДа) синтезируется на рибосомах шероховатой ЭПС клетки хозяина. В свою очередь, дефицит кислорода, который начинают ощущать на себе пребактериоды, стимулирует в них синтез гема. Гем экспортируется через оболочку бактерии и перибактероидную мембрану в цитоплазму растительной клетки, где присоединяется к апопротеину. Готовый леггемоглобин остается в хозяйской цитоплазме и контактным путем доставляет кислород к поверхности бактероида, так что цитоплазма бактерии, где находится нитрогеназа, остается аноксичной.
Вышеупомянутые ризобии (от греч. riza — корень и bios — жизнь; живущее в корне), или классические клубеньковые бактерии вступают в эндоцитобиоз с травянистыми бобовыми растениями, вызывая у них образование диазотрофных корневых клубеньков. Однако у некоторых деревянистых бобовых растений, в том числе Aeschynomene spp., диазотрофные клубеньки образуются не на корнях, а в основании стебля, которое регулярно подтапливается в половодье. В данном случае эндоцитобионтами являются аноксигенные фототрофные бактерии Bradyrhizobium spp., названные фоторизобиями (англ. photosynthetic rhizobia). Наиболее изученным среди них является штамм BTAi 1, эндосимбионт Aeschynomene indica. При аэробном гетеротрофном росте в условиях периодического освещения он образует мембранные антенны с бактериохлорофиллом а и реакционные центры RCII-типа (такие же, как у пурпурных бактерий; см. II том учебника).
После проникновения в клетки кортекса палочковидные фоторизобии окружаются перибактероидной мембраной и превращаются в сферические бактероиды диаметром 2,5-3,5 нм. Каждая симбиосома содержит Г-2 бактероида, которые имеют многочисленные хроматофоры и большое количество гранул резервных полигидроксиалканоатов. В отличие от поверхностных клеток зеленого клубенька, внутренние инфицированные клетки лишены хлоропластов, и концентрация кислорода в них не превышает 5 нМ.
Как и в случае классического ризобиального симбиоза, хозяин снабжает бактероиды дикарбоновыми кислотами, которые служат источником электронов для дыхательной цепи. С целью транспортировки кислорода к бактероидам используется леггемоглобин.
Предполагается, что эффективность данного бобово-ризобиального симбиоза связана с тем, что фотосинтетический аппарат бактероида поставляет АТФ для нитрогеназы, а восстановитель она получает от клетки-хозяина.
Везикулы актинобактерий. Представители рода Frankia, названного в честь швейцарского микробиолога Франка, соавтора термина «симбиоз» (см. главу 20), относятся к числу высших актинобактерий. Они образуют только субстратный мицелий, на котором в терминальном, латеральном или интеркалярном положении появляются многорядные спорангии с неподвижными спорангиоспорами. Франкии способны к диазотрофии в свободном состоянии или в симбиозе с древесными покрытосеменными растениями, относящимися к 194 видам 24 родов 8 семейств 7 порядков, в том числе с болотным миртом Myrica gale L. и серой ольхой Alnus incana Mnch.
Симбиоз с участием актинобактерий рода Frankia, или актиноризоидный эндосимбиоз морфологически выражается в образовании корневых клубеньков на среде, не содержащей связанного азота (или на среде с аминокислотами, которые не разлагаются с образованием аммония). Клубеньки состоят из клеток кортекса, колонизированных гифами мицелия. В отличие от ризобиев, гифы Frankia spp. проходят сквозь клеточную стенку кортикальной клетки; затем ее мембрана инвагинирует, и вокруг ветвящейся гифы снова начинает формироваться клеточная стенка. Таким образом, гифы находятся не в перибактероидной вакуоли, а инкапсулируются внутри материала клеточной стенки.
На концах или на укороченных боковых ветвях гиф образуются провезикулы (англ. provesicle) — изолированные септой сферические клетки диаметром 1,5-2 мкм. Они вскоре превращаются в светопреломляюшие везикулы (англ. vesicle) диаметром 2-4 мкм, что связано с образованием наружного чехла и внутренних перегородок.
Зрелые везикулы снабжены утолщенной септой, или «ножкой», имеют сферическую, грушевидную, булавовидную или нитевидную форму и служат местом сосредоточения нитрогеназной активности. Отдельные везикулы могут образовываться ex plantae, в том числе в недиазотрофных условиях. Ключевые ферменты ассимиляции аммония — глутаминсинтетаза и глутаматсинтаза — компартментализованы, соответственно, в везикуле и вегетативных гифах по аналогии с тем, как это осуществляется у гетероцист и вегетативных клеток трихома цианобактерий.
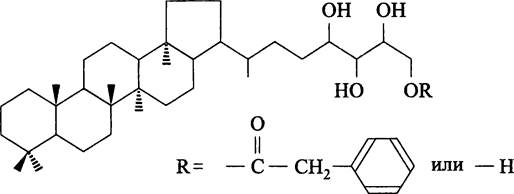
В отличие от бактероидов, находящихся в микроаэробных условиях, везикулы способны к диазотрофии при атмосферном парциальном давлении кислорода. Это происходит как inplantae (особенности анатомии хозяина, в частности широкие межклетники, создают внутри клубенька хорошо вентилируемую среду), так и ех plantae. В обоих случаях защиту нитрогеназы обеспечивает ламинарный чехол везикулы, который образован несколькими липидными слоями толщиной по 4 нм, состоящими из бактериогопантетрола и его сложного эфира с фенилуксусной кислотой (рис. 237). Оба относятся к классу гопаноидов (см. I том учебника).
Рис. 237. Бактериогопантетрол и его сложный эфир с фенилуксусной кислотой.
Зрелые везикулы с активной нитрогеназой существуют непродолжительное время, по истечении которого часть из них стареет и подвергается запрограммированной смерти (см. раздел 17.2). Другая часть, в отличие от терминально дифференцированных гетероцист, способна прорастать с образованием вегетативных гиф.
Таким образом, везикула актинобактерий конвергирует с гетероцистой как минимум по двум признакам. В обоих случаях защита нитрогеназы достигается с помо-
щью ламинарного слоя чехла. В обоих случаях симбиоз носит внеклеточный характер (исключением служит Nostoc sрр., эндоцитобионт покрытосеменного растения Gunnera sрр.). Для более детального сопоставления везикулы с гетероцистой пока еще нет оснований, поскольку, в отличие от гетероцисты, везикула слабо изучена как в физиолого-биохимическом, так и в генетическом плане.
17.5.2. Покоящиеся резистентные клетки
При попадании в стрессовые условия многие прокариоты проявляют характерную адаптивную реакцию — временно переходят в состояние покоя (англ. dormancy), которое сочетается с повышенной резистентностью к повреждающим факторам внешней среды (англ. resistance). Абсолютная и относительная степень покоя и резистентности может быть разной, вплоть до полного анабиоза в сочетании с гиперрезистентностью, что характерно для бактериальных эндоспор.
Хотя комплексное состояние физиологического покоя/резистентности может наблюдаться у вегетативных клеток, в частности при полном голодании, обезвоживании или замораживании, чаще всего оно является следствием клеточной дифференциации.
Покоящиеся резистентные клетки выполняют задачу по выживанию особи при экологическом стрессе и освоению бактериальной популяцией новых ниш и территорий. В зависимости от специфики цитологических механизмов (де)дифференциации, а также в меру глубины покоя и степени резистентности такие клетки можно разбить на две группы — цисты и эндоспоры.
17.5.2.1. Цисты
Унифицированным термином «циста» (англ. cyst; от kistis — пузырь; в данном случае — округлая клетка) мы назовем сборную группу умеренно покоящихся и слаборезистентных клеток, которые образуются непосредственно путем бинарного деления или дробления. При попадании в благоприятную экологическую обстановку цисты дедифференцируются и вновь приступают к росту и размножению.
Цисты характеризуются, по меньшей мере, пятью универсальными для них признаками:
— пониженной, по сравнению с вегетативными клетками, метаболической активностью;
— повышенной, по сравнению с вегетативными клетками, устойчивостью хотя бы к одному из повреждающих факторов внешней среды;
— образованием защитных покровов, отсутствующих у вегетативных клеток;
— накоплением запасных включений;
— способностью прорастать с образованием вегетативного потомства.
Подчеркнем, что у разных прокариотов цисты имеют разные названия («аки-
неты», «артроспоры», «галоцисты», «зооспоры», «конидии», «микроцисты», «миксоспоры», «спорангиоспоры», «споры», «экзоспоры»). Это не только дезориентирует читателя, но и приводит к искажению смысла термина. Например, спорами часто называют уникальные дифференцированные клетки бактерий — эндоспоры (см. ниже).
Цисты актинобактерий. У высших актинобактерий (см. I том учебника) цисты выполняют универсальную роль покоящихся резистентных клеток. Но одновременно с этим образование цист служит формой массового размножения и обеспечивает расселение, которое в силу мицелиального строения актинобактерий иначе было бы крайне затруднительным.
Процесс образования цист носит кооперативный характер и регулируется чувством кворума (см. раздел 18.4.2).
Обособление цист, содержащих по одной хромосоме, может происходить либо путем их поочередного отделения от конца стволовой гифы, что принято называть сегментацией (в цитологическом плане это эквивалентно почкованию), либо путем синхронного образования серии клеточных перегородок внутри стволовой гифы, что принято называть фрагментацией (в цитологическом плане это эквивалентно дроблению).
Цисты актинобактерий в общем случае называются спорами (англ. spore). Они могут образовываться на гифах субстратного мицелия или воздушного мицелия. Споры, не обладающие подвижностью, называются конидиями (англ. conidia; от греч. konia — пыль и eidos — подобный; «споры, похожие на пыльцу»), или артроспорами (англ. arthrospore; от греч. arthros — сустав; «споры как часть расчлененной структуры»). Плавающие при помощи жгутиков споры называются зооспорами (англ. zoospore).
Споры либо открыто располагаются на концах гиф, либо находятся внутри мешковидного чехла спорангия, и тогда их называют спорангиоспорами (англ. sporan- giospore). Открытые споры бывают одиночными, могут образовывать продольную пару, а также могут выстраиваться в относительно короткую (<20 клеток) или более длинную (>50 клеток) цепочку, обычно закрученную в спираль.
Наиболее изучены споры стрептомицетов (от греч. streptos — скрученный). В частности, Streptomyces griseus образует спиральные цепочки спор на концах воздушных гиф, стабилизированные общим фибриллярным чехлом. Споры сильно преломляют свет, имеют утолщенную стенку и гидрофобный скульптурированный чехол, на поверхности которого часто образуются шипики или волоски, повышающие сцепление с телом вектора-переносчика (червя, насекомого, птицы, млекопитающего и т. д.). В качестве запасного субстрата они накапливают полиглюкозиды, а в качестве осмопротектора — дисахарид трегалозу (1-О-α-D-глюкопиранозил-α-D-глюкопиранозид).
Споры обладают относительно низким уровнем эндогенного метаболизма. Они лучше вегетативных клеток переносят обезвоживание и более термоустойчивы.
Регуляция образования воздушного мицелия и спор. На первом этапе морфологической дифференциации мицелии S. griseus образует воздушные гифы. Для этого реутилизируются полимерные продукты ассимиляции органических субстратов, ранее накопленные в субстратных гифах (белки, запасные полиглюкозиды, ДНК и т. д.; см. выше). Затем на концах воздушных гиф в результате синхронной закладки септ образуется цепочка проспор — микрокомпартментов, которые содержат по одной хромосоме. Позднее каждая проспора превращается в спору.
Споры могут образовываться не только на воздушном мицелии, но и — при истощении питательных субстратов — в условиях погруженной культуры, на концах так называемых спорогенных гиф. По своим свойствам такие «водные» споры отличаются от «воздушных» спор; в частности, они имеют более тонкую стенку и, соответственно, более чувствительны к лизоциму.
В настоящее время выявлено, по меньшей мере, 15 регуляторных генов, которые отвечают за морфологическую дифференциацию S. griseus. Рост воздушного мицелия обеспечивается генами bid (сокр. англ. bald — лысый; мутанты по этим генам теряют способность к спорообразованию), а спорообразование — генами whi (сокр. англ. white — белый; мутанты по этим генам образуют непигментироаанные колонии).
При голодании по углероду или азоту, источником которого обычно служат аминокислоты, в клетках мицелия усиливается синтез (p)ppGpp — так же, как при строгом ответе в случае Е. coli (см. разделы 17.1 и 18.1).
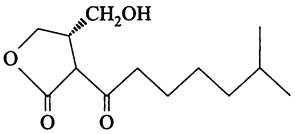
При накоплении (p)ppGpp активируется экспрессия гена синтетазы AfsA, и она начинает вырабатывать автоиндуктор — A-фактор, или 2-изокапроил-3R-гидроксиметил-y-бутиролактон (рис. 238). Он диффундирует по мицелию, секретируется в окружающую среду, а затем снова поступает в гифы, вызывая адаптивный ответ.
Рис. 238. Феромон Streptomyces griseus — 2-изокапроил-3R-гидроксиметил- y-бутиролактон (y-лактон 2-метил-7- оксо- 8(β-оксиметил-y-гидроксиэтил) - нонановой кислоты).
A-фактор запускает регуляторный каскад, с помощью которого, в конечном счете, образуется воздушный мицелий и начинается синтез вторичных метаболитов, в частности антибиотиков.
Цисты миксобактерий. По традиции данный тип цист называют миксоспора- ми (англ. myxospore) или микроцистами (англ. microcyst).
Будучи в цитоморфологическом отношении ничем не примечательными одноклеточными грамотрицательными бактериями, миксобактерии обладают уникальным для прокариотов биологическим свойством — кооперативным многоклеточным поведением. Иначе сказать, они живут в больших группах, или роях, распределенных по поверхности твердого субстрата.
Рои мигрируют в поисках питательного субстрата (часто это тела других бактерий или дрожжевых грибов). Найдя его, они секретируют гидролитические экзоферменты в концентрированном виде, что служит условием для совместного питания.
В отсутствии пищи, а также при других стрессах, миксобактерии образуют макроскопические, обычно ярко окрашенные плодовые тела, которые пассивно или с помощью биологических векторов (червей, насекомых, птиц, млекопитающих и т. д.) переносятся в другие местообитания.
При неблагоприятных условиях клетки миксобактерий тесно сближаются, или аггрегируют, скользя по поверхности твердого субстрата, а также наползая друг на друга (см. III том учебника). Результатом сосредоточения до 105клеток вокруг отдельных центров аггрегации служит образование плодового тела (англ. fruiting body), внутри которого образуются миксоспоры.
Спорообразование обычно происходит после созревания плодового тела, хотя у мутантов или при добавлении некоторых химических веществ, например, глицерола, его можно вызвать в обход данной морфогенетической стадии.
Модельным объектом при изучении спорогенеза у миксобактерий является Мухococcus xanthus, образующая плодовые тела простой сферической формы. Вторым модельным объектом является Stigmatella aurantiaca, образующая сложные плодовые тела, которые состоят из группы спорангиев, сидящих на общей ножке. Морфология, а также биологические свойства миксоспор S. aurantiaca аналогичны таковым М. xanthus.
При образовании миксоспор палочковидная или веретеновидная вегетативная клетка окружается чехлом, укорачивается и округляется. Резкое изменение формы бактерии связано с увеличением числа поперечных сшивок в муреиновом саккулусе. Чехол миксоспоры состоит из кортекса (англ. cortex), промежуточного покрова (англ. intermediate coat) и наружного покрова (англ. surface coat). В состав кортекса входит полимер, содержащий галактозамин, а покровы образованы линейным глюканом со связями α1 —> 3. Дополнительный, самый наружный слой чехла миксоспоры состоит из так назывемого «белка S».
Миксоспоры обладают низкой метаболической активностью. Они противостоят высушиванию, слабо термотолерантны и проявляют устойчивость к механическому воздействию (в том числе, к ультразвуку), ультрафиолетовому излучению и детергентам. Миксоспоры сохраняются в почве в покоящемся состоянии свыше десяти лет до момента прорастания.
Регуляция образования плодовых тел и миксоспор. Образование плодового тела, наполненного миксоспорами, вызывается голоданием по углероду, азоту (в частности, по любой из аминокислот) или фосфору. Соответствующая программа развития включает в себя индивидуальную реакцию на сигнал голодания, взаимную коммуникацию, аггрегацию клеток и собственно дифференциацию миксоспор.
Исходным внутриклеточным сигналом голодания у миксобактерий, как и у стрептомицетов, служит накопление алармона (p)ppGpp. Для взаимной коммуникации, создающей чувство кворума (см. раздел 18.4.2), голодающие клетки М. xanthus секретируют в окружающую среду «ранний» A-фактор и «поздний» С-фактор, которые играют роль автоиндукторов.
A-фактор (не путать с A-фактором S. griseus) представляет собой олигопептидный комплекс и образуется при повышении концентрации (p)ppGpp. После восприятия реципиентом он, совместно с (p)ppGpp, обеспечивает связь между альтернативным сигма-фактором σ54 и промоторными участками первой группы стрессовых генов, в частности гена fruA. Продукт экспрессии гена fruA, белок FruA, запускает трансляцию С-фактора.
С-фактор (CsgA, 17 кДа) переносится к поверхности продуцента, где он взаимодействует с рецептором на поверхности реципиента. Сигнал передается в цитоплазму и вызывает посттрансляционную активацию ДНК-связывающего белка FruA. Мишенью для активированной формы белка FruA служат два оперона второго эшелона — frzCDE (продукты которого контролируют направление скользящего движения; см. раздел 17.3.2), и оперона devTRS (сокр. англ. development — развитие), продукты которого контролируют процесс споруляции.
В качестве вспомогательного сигнала, обеспечивающего чувство кворума при образовании сложных плодовых тел S. aurantiaca, используется автоиндуктор стигмолон (англ. stigmolone). По химической структуре это 2,5,8-триметил-8-гидрокси-нонан-4-он (рис. 239). Дополнительным внешним стимулятором в данном случае служит свет — в темноте и на свету секретируется одинаковое количество феромона. Однако на свету миксобактерии сенсибилизируются к восприятию низкой концентрации феромона; иными словами, свет способствует образованию плодовых тел при относительно меньшей плотности популяции.
Рис. 239. Феромон Stigmatella aurantiaca (2,5,8-триметил-8-гидрокси- нонан-4-он).
Цисты цианобактерий. Традиционно их называют акинетами (греч. а — лишенный чего-либо и kineo — двигаюсь; в данном случае — неподвижная (?) клетка). Исторически акинеты были первыми дифференцированными клетками, известными у бактерий — английский ботаник Картер (Н. J. Carter) описал их в 1865 г., т. е. еще до того, как Фердинанд Кон и Роберт Кох в 1877 г. открыли эндоспоры.
Акинеты имеют сферическую или эллипсоидную форму; они крупнее вегетативных клеток и гранулированы, поскольку в ходе дифференциации накапливают полиглюкозидные и цианофициновые гранулы. Они окружены толстым чехлом, состоящим из внутреннего и наружного слоев, которые по составу сходны, соответственно, с гомогенным и фибриллярным слоями гетероцисты (полисахарид с глюкозо- маннозным 1 —> 3 скелетом и боковыми остатками галактозы и ксилозы). Специфическим маркером акинет является полипетид молекулярной массой 43 кДа (ген avaK), который, возможно, входит в состав чехла или является антистрессорным агентом.
Акинеты проявляют низкую фотосинтетическую активность (в частности, из- за разрушения фикобилисом), хотя, в отличие от гетероцист, электрон-транспортная цепь ФСН и кислородвыделяющий комплекс у них сохраняются. Дыхательная активность акинет, как правило, ниже, чем у вегетативных клеток.
Акинеты не обладают терморезистентностью. Тем не менее, они устойчивы к высушиванию, низкой температуре и замораживанию-оттаиванию. Благодаря этим свойствам цианобактерии получают возможность переживать зимы в высоких широтах, а также могут до 5 лет сохранять жизнеспособность в темноте в высушенном состоянии (по сравнению с 15 днями у вегетативных клеток).
Внешним стимулом к образованию акинет служат разнообразные стрессовые условия: (1) дефицит фосфора, углерода или азота; (2) слабая освещенность; (3) низкая температура; (4) понижение водной активности; (5) повышение концентрации минеральных катионов.
Регуляция образования и паттерн распределения акинет еще не изучены. Какую- то роль в этом, несомненно, играют гетероцисты, выделяющие, по крайней мере, у Cylindrospemmmsp., автоиндуктор, который по химической структуре представляет собой 1-карбокси-5-метенамин-тиофен-циклокарбамид (рис. 240). Он вызывает дифференциацию прилежащих клеток, которые превращаются в цепочки акинет, что служит отдаленным аналогом феномена эмбриональной индукции у высших организмов.
Рис. 240. Феромон Cylindro- spermum sp. (1-карбокси-5-мете- намин-тиофен-циклокарбамид).
Цисты пурпурных бактерий. По предложению российского микробиолога В. М. Горленко, который впервые описал этот уникальный тип дифференцированных клеток, их называют экзоспорами (англ. ехоsроrе).
В онтогенезе почкующейся стебельковой бактерии Rhodomicrobium vannielii, принадлежащей к физиологической группе несерных пурпурных фототрофных бактерий, реализуются клеточные циклы трех типов: (1) диморфный с вегетативной немицелиальной стадией; (2) диморфный с вегетативной мицелиальной стадией и (3) триморфный (см. рис. 221).
В двух первых случаях дифференцированная клетка (швермер) обладает жгутиками и играет роль расселительной стадии. В третьем случае на концах вегетативных гиф одна за другой отпочковуются до четырех треугольных светопреломляющих экзоспор. Благодаря окружающему их капсульному материалу они некоторое время остаются прикрепленными к материнской гифе. Экзоспоры R. vannielii одеты толстым чехлом и содержат меньше хроматофоров, чем вегетативная клетка.
Экзоспоры R. vannielii термоустойчивы и выдерживают прогрев при 100° С в течение нескольких минут, в то время как вегетативные клетки погибают при 50°С за 20 мин. Кроме того, они остаются живыми после высушивания в течение 3 дней при 30°С в отличие от вегетативных клеток, для которых такая обработка летальна.
Цисты описаны также у пурпурной бактерии Rhodospirillum centenum способной к альтернативному хемогетеротрофному росту. На среде с бутиратом в качестве единственного источника углерода подвижные спиралевидные клетки образуют пакеты эллипсоидных цист, которые стабилизированы взаимно вложенными чехлами. Цисты R. centenum накапливают до 30% полигидроксиалканоатов и в два раза более устойчивы к высушиванию по сравнению с вегетативными клетками.
Цисты Azotobacter spp. Свободноживущие диазотрофы из рода Azotobacter широко распространены в почвах и водоемах, а также заселяют ризосферу и филло- сферу. В старых культурах или при росте на бутаноле они образуют цисты, по форме и размеру близкие к вегетативным клеткам. Основу цисты составляет «центральное тело», или собственно клетка с большим количеством гранул запасных полигидроксиалканоатов. Она окружена чехлом, в котором различаются внутренняя интина и наружная экзина, примерно в равных пропорциях состоящие из альгинатов (см. I том учебника), белков и липидов.
В результате инцистирования метаболическая активность Azotobacter spp. практически затухает.
По сравнению с вегетативными клетками цисты Azotobacter sp. более устойчивы к обезвоживанию, а также токсическому воздействию химических реагентов.
Цисты метанотрофных бактерий. Разные представители облигатных метанотрофов типа-1 и типа-II (см. И том учебника) могут образовывать цисты одного из трех типов.
Штаммы Methylococcus spp. и Methylomonas spp. (тип-1) при понижении парциального давления кислорода или дефиците метана образуют цисты, сходные с цистами Azotobacter spp. Они устойчивы к высушиванию, однако не обладают термоустойчивостью.
Штаммы Methylosinus trichosporium (тип-II) отпочковуют дочерние клетки, которые превращаются в округлые цисты, содержащие хорошо развитую систему ICM и одетые толстым чехлом из внутреннего ламинарного слоя и наружного кортекса. Цисты М. trichosporium проявляют очень низкую дыхательную активность, термоустойчивы (выдерживают нагревание при 85°С в течение 15 мин), механически прочны (не разрушаются при 10-мин обработке ультразвуком) и сохраняют жизнеспособность после высушивания в течение 18 месяцев.
Штаммы Methylocystis parvus (тип-II) образуют «липидные» цисты, которые накапливают большое количество полигидроксиалканоатов и не содержат ICМ. Они термоустойчивы и переносят высушивание.
Цисты архей. Если у бактерий, равно как у протистов, образование цист служит примером часто используемой цитофизиологической стратегии, то у архей они встречаются исключительно редко.
Причина этого явления специально не выяснялась, хотя в упрощенном виде она может заключаться в следующем. Большинство актуалистических форм архей — как правило, экстремофилы, живущие в условиях, которые обычно вызывают стресс у бактерий, приводящий к инцистированию. В свою очередь, в условиях, комфортных для бактерий, архей испытывают стресс, однако их адаптационный ответ не обязательно должен быть симметричным, т. е. он может не проявляться морфологически (в изменении формы клетки, а также в образовании защитных покровов и запасных включений).
Единственным типом цист у архей являются галоцисты (англ. halocyst). Они описаны российским микробиологом В. И. Дудой на примере Halobacterium sрр.
Галоцисты представляют собой округлые клетки, собранные в группы и окруженные общим чехлом. Они образуются в гипогалинных условиях, т. е. при солености ниже оптимальной. Предполагается, что за счет дифференциации галоцист архей получают возможность переживать стресс. Оказавшись снова в гипергалинных условиях, они прорастают с образованием вегетативного потомства.
17.5.2.2. Эндоспоры
Бактериальная эндоспора, (англ. endospore; от греч. endon — внутри и spora — семя; «эндогенная спора») — это уникальное цитологическое образование. Для краткости ее обычно называют просто спорой. Однако такая, на первый взгляд, допустимая вольность приводит к размыванию концептуального смысла термина. У бактерий не бывает «просто» спор (англ. spore), а существуют принципиально различающиеся экзоспоры и эндоспоры.
Экзоспоры, или цисты, конкретные типы которых мы рассматривали в предыдущем разделе — это продукты индивидуальной дифференциации дочерней клетки.
В отличие от экзоспор, эндоспора образуется в результате взаимно скоординированной дифференциации двух дочерних клеток, одна из которых проникает в сестринский эндоплазматический компартмент (см. рис. 245). Дальнейшие цитоморфологические и физиолого-биохимические преобразования приводят к запрограммированной смерти внешней клетки, или спорангия (англ. sporangium), которую необоснованно называют материнской клеткой (англ. mother cell). В свою очередь, внутренняя клетка, или преспора (англ. forespore), дифференцируется в эндоспору, которая переходит в состояние гиперанабиоза, т. е. максимального физиологического покоя, и становится гиперрезистентной, т. е. приобретает максимальную устойчивость к повреждающим воздействиям со стороны окружающей среды.
Схема зрелой эндоспоры, окруженной специализированными покровными структурами, которые образуются внутри спорангия и сохраняются после его отмирания, представлена на рис. 241.
Рис. 241. Эндоспора в спорангии. СМ1 —цитоплазматическая мембрана эндоспоры; СМ2 — цитоплазматическая мембрана, спорангия.
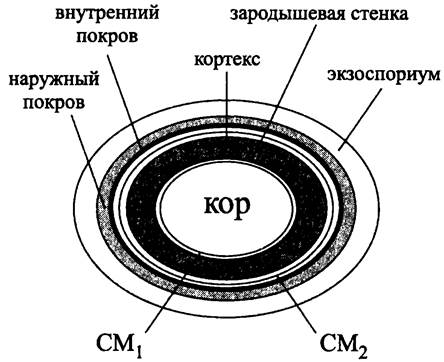
Основными структурными элементами такого комплексного цитологического образования служат:
— цитоплазматический компартмент эндоспоры, или кор (англ. core);
— комбинированная клеточная стенка, состоящая из внутренней зародышевой стенки (англ. germ cell wall) и наружной стенки, или кортекса (англ. cortex);
— цитоплазматическая мембрана эндоспоры, или внутренняя мембрана (англ, inner membrane) и цитоплазматическая мембрана спорангия, или внешняя мембрана (англ. outermembrane; не путать с ОМ грамотрицательных бактерий);
— внутренний и внешний споровые покровы (англ. spore coat);
— наружные покровы, или экзоспориум (англ. exosporium).
Совокупность кортекса, внешней мембраны и споровых покровов называется интегументом (англ. integument; от лат. integumentum — покров в широком смысле слова).
Спорогенные бактерии. Способностью к образованию эндоспор обладают относительно немногие представители филы ВХIII Firmicutes (Bacillus, Clostridium, Dendrosporobacter, Desulfosporosinus, Desulfotom aculum, Halobacillus, Heliophilum, Oscillospira, Sporobactcr, Sporobacterium, Sporohalobacter, Sporolactobacillus, Sporomusa, Sporosarcina, Sporotomaculum, Sulfobacillus, Thermoactinomyces и др. — всего около 25 родов).
Большинство спорогенных бактерий относится к грамположительному морфо- типу и характеризуется аэробным дыхательным (например, Bacillus spp.), анаэробным дыхательным (например, Desulfotomaculum spp.) или бродильным (например, Clostridium spp.) типом метаболизма.
Некоторые спорогенные бактерии, в виде исключения, относятся к грамотрицательному морфотипу. По характеру метаболизма они являются либо миксотрофными гомоацетогенами (например, Sporomusa ouata), либо факультативными фотогетеротрофами (например, Heliophilum fasciatum).
Как правило, материнская клетка образует единственную эндоспору, т. е. параллельным итогом споруляции не является размножение.
Известны только два примера, когда материнская клетка образует не одну, а несколько эндоспор.
Крупная некультивируемая бактерия Metabacterium polyspora, которая достигает длины 35 мкм и является симбионтом желудочно-кишечного тракта некоторых грызунов (в частности, морской свинки), образует до девяти эндоспор на спорангий. Споруляция протекает координированно с прохождением бактерии по пищеварительной системе. В желудке хозяина-копрофага выживают только зрелые эндоспоры; в тонкой кишке они прорастают, некоторое время бинарно делятся, а затем снова дифференцируются в слепом отростке. При споруляции происходит тройственное асимметричное деление материнской клетки, причем сестринские клетки образуются на противоположных полюсах спорангия. Обе преспоры поглощаются спорангием, а затем сразу созревают или предварительно делятся бинарно.
Второй пример связан с гигантской некультивируемой бактерией Epulopiscium sp. (до 60 x 300 мкм), которая является симбионтом тропической рыбы-единорога Naso tonganus. Спомощью аналогичного механизма она образует две эндоспоры в одном спорангии.
Интересно, что репродуктивный цикл гигантской бактерии Е. fishelsoni (см. I том учебника), близкого родственника Epulopiscium sp. и М. polyspora, связан с образованием 1-7 вегетативных клеток внутри «спорангия». Предполагается, что такой способ размножения вторично произошел на основе спорогенеза.
Основные данные о строении, свойствах и механизмах (де)дифференциации эндоспоры получены на примере представителей родов Bacillus и Clostridium, особенно В. subtilis 168.
Значение и общие свойства эндоспор. Бактерии, дифференцированные в эндоспоры, способны противостоять физико-химическим воздействиям, губительным для вегетативных клеток. Кроме того, спорогенез служит способом изоляции от стрессовых условий локальной среды — во времени, путем перехода в анабиотическое состояние, и в пространстве, благодаря перемещению с воздушными и водными потоками, а также «на плечах» мигрирующих микро- и макроорганизмов или искусственных транспортных средств.
Актуальны и практические аспекты спорогенеза. Широко применяется метод влажной стерилизации под давлением в автоклаве (фр. l’autoclave; от греч. autos — сам и clao — ломать; в данном случае — автономное дезинтегрирующее приспособление), прообразом которого был паровой котел английского изобретателя конца XVII в. Дениса Пейпина (D. Papin).
Конструкцию автоклава предложил в конце 1870-х гг. сотрудник Пастера, Шарль Шамберлан (С. Chamberland). Автоклавирование питательных сред, пищевых продуктов и медицинских материалов связано с необходимостью убить не только вегетативные клетки, но и гораздо более устойчивые эндоспоры.
Прорастание эндоспор, сохранивших жизнеспособность после стерилизации или консервирования, вызывает порчу пищевых продуктов, а в случае С. botulinum острое пищевое отравление — ботулизм.
Прорастание эндоспор В. anthracis в макрофагах вызывает легочную форму сибирской язвы.
Как уже отмечалось, эндоспора обладает двумя уникальными биологическими свойствами — гиперанабиозом (англ. dormancy — состояние покоя; спячка) и гиперрезистентностью (англ. resistance — сопротивляемость организма).
Гиперанабиоз выражается в том, что зрелая эндоспора не проявляет метаболической активности. Она почти не содержит таких важнейших медиаторов метаболизма, как АТФ и другие нуклеозидтрифосфаты, а также восстановленных пиридиннуклеотидов и ацетил-СоА. Ферменты, находящиеся в коре, не активны.
В состоянии гиперанабиоза эндоспоры характеризуются иногда феноменальным долгожительством. Неоднократно сообщалось об их реанимации из природного материала возрастом до 105 лет; а заявленными рекордсменами — хотя к таким данным нужно относиться с разумным скептицизмом — служат споры Bacillus sp., которые, по сообщениям некоторых авторов, сохранились в жизнеспособном состоянии в желудке олигоценовой пчелы, мумифицированной в образце янтаря, добытого в Доминиканской Республике, или в кристаллах поваренной соли из шахты в Нью- Мехико, США (на протяжении, соответственно, 25-40 и 250 млн. лет).
Пространственно-временных границ на пути распространения эндоспор практически не существует. Их можно обнаружить в любых нишах и географических областях на огромном удалении от места образования (например, эндоспоры термофильных видов Bacillus spp. захоронены в иле субполярных озер).
В свою очередь, гиперрезистентность выражается в том, что зрелая эндоспора устойчива к повреждающим воздействиям — высокой температуре, высушиванию, большому гидростатическому давлению, УФ- и гамма-излучению, экстремальной кислотности, окислителям и т. д.
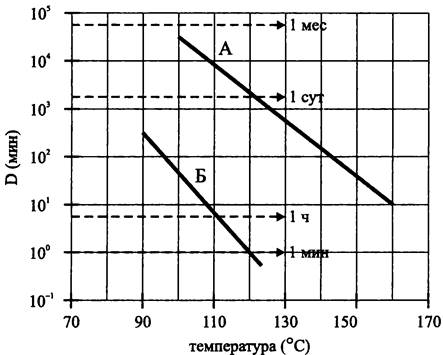
Широко известна устойчивость эндоспоры к воздействию сухого или влажного жара, т. е. к прогреванию на воздухе или в атмосфере водяного пара. В частности, время «децимации», т. е. десятикратного снижения количества прорастающих спор, составляет 20-30 мин в случае кипячения при атмосферном давлении и ~1 мин в случае автоклавирования при 120°С (для сравнения, вегетативные клетки полностью погибают в результате пастеризации, т. е. нагревания при 55-60°С в течение 30 мин). Характерно, что выживаемость эндоспор, обработанных сухим жаром, на три порядка выше, чем при использовании влажного жара (рис. 242).
Рис. 242. Выживание эндоспор В. subtilis при тепловой обработке. А — сухой жар; Б — влажный жар; D — время децимации (10- кратного уменьшения численности жизнеспособных эндоспор).
Первичная мишень для летального воздействия влажного жара еще не установлена. Скорее всего, это СМ или цитоплазматические белки, но явно не ДНК, которая защищена от потери азотистых оснований, в частности от депуринизации, специфическими SASP-белками (см. ниже). Устойчивость белковых структур эндоспоры к влажному жару связана с обезвоживанием кора и его минерализацией в результате накопления катионов Са2+, Mg2+ и Мn2+, образующих хелатный комплекс с дипиколиновой кислотой (см. ниже). В то же время она не определяется такими защитными факторами вегетативных клеток, как белки теплового шока, хотя эндоспоры термофилов более термоустойчивы, чем эндоспоры мезофилов.
В отличие от влажного жара, мишенью для воздействия сухого жара служит ДНК, повреждение которой связано, в первую очередь, с депуринизацией. В данном случае термоустойчивость эндоспор у термофилов не выше, чем у мезофилов.
Эндоспоры значительно устойчивее к холоду и высушиванию, чем вегетативные клетки. Большинство из них благополучно переносит несколько циклов лиофилизации при -80°С, а убийственное для Е. coli обезвоживание при - 200°С в условиях сверхвысокого вакуума (10-7 атм) в течение 24 ч вызывает только 50-75%-ное падение жизнеспособности эндоспор В. subtilis.
Эндоспоры на один-два порядка устойчивее вегетативных клеток к воздействию УФ-излучения в области 260 нм, что связано с «необычной» фотохимией ДНК и специфическим механизмом репарации образующихся фотопродуктов (см. ниже). Помимо высокой резистентности к воздействию УФ-излучения, эндоспоры обладают повышенной устойчивостью к гамма-излучению. Предполагается, что из-за низкого содержания воды подавляется радиоиндуцированное образование в цитоплазматическом компартменте эндоспоры (коре) опасного агента окислительного стресса — гидроксильного радикала (см. раздел 19.1.6.1).
Эндоспоры намного устойчивее вегетативных клеток к повреждающему воздействию высокого гидростатического давления (>103 атм). В то же время умеренное гидростатическое давление (до 103 атм) индуцирует их прорастание, хотя для образующихся вегетативных клеток оно является сильным стрессовым фактором.
Эндоспоры по сравнению с вегетативными клетками более резистентны к веществам, которые денатурируют или модифицируют белки (кислотам, щелочам, окислителям, альдегидам, фенолам и т. д.), а также к алкилирующим агентам, которые модифицируют ДНК. В отличие от вегетативных клеток, обладающих ферментативными системами для борьбы с токсинами, эндоспоры защищаются от токсикантов благодаря барьерам проницаемости, т. е. пассивно.
Факторы и механизмы гиперрезистентности эндоспоры. Для того, чтобы иметь возможность прорасти и принести вегетативное потомство, эндоспора должна либо в состоянии покоя избежать летальных повреждений своих жизненно важных структур (прежде всего, ДНК), либо при прорастании быстро репарировать эти структуры.
К числу факторов, определяющих гиперрезистентность эндоспор, относятся: (1) покровы; (2) барьер проницаемости вокруг кора; (3) низкое содержание воды в коре; (4) высокое содержание двухвалентных катионов в коре; (5) связывание ДНК со специфическими белками; (6) репарация повреждений при прорастании.
В большинстве случаев роль этих факторов изучена лишь на феноменологическом уровне, а молекулярные механизмы остаются неизвестными.
Покровы. Белковые покровы препятствуют проникновению к кортексу эндоспоры ферментов, разрушающих муреин (например, лизоцима), а также агрессивных химических реагентов (в частности, хлороформа).
Барьер проницаемости вокруг кора. Он создается двумя СМ, одна из которых принадлежит спорангию, а другая самой эндоспоре. Эти мембраны не пропускают в кор гидрофильные соединения молекулярной массой >300 Да.
Низкое содержание воды в коре. Известно, что при нейтральном pH вода стимулирует депуринизацию ДНК. Поэтому способность эндоспоры противостоять воздействию влажного жара объясняется низким содержанием воды в коре (28-50%). Кор остается дегидратированным даже в том случае, когда эндоспора находится в водной среде (при этом экзоспориум, покровы и кортекс имеют такую же относительную влажность, как вегетативная клетка, т. е. 75-80%). По современным представлениям, содержимое кора находится в стекловидном агрегатном состоянии.
Высокое содержание двухвалентных минеральных катионов в коре. Обезвоживание эндоспоры сопровождается накоплением катионов, прежде всего Са2+. Они в соотношении 1 :1 связываются с пиридин-2,6-дикарбоновой, или дипиколиновой кислотой (англ. dipicolinic acid, DPA; рис. 243), которая синтезируется в спорангии, а затем транспортируется в кор. Содержание этого хелатного соединения составляет 5-10% массы эндоспоры.
Рис. 243. Дипиколиновая кислота.
Связывание ДНК со специфическими белками. На третьем часу цикла споруляции в преспоре В. subtilis синтезируются уникальные низкомолекулярные кислоторастворимые белки (англ, small acid-soluble protein, SASP). Помимо двух взаимно гомологичных SASP-белков главного α//β-типа (60-75 а. о.; гены ssp), существуют несколько минорных SASP-белков.
SASP-белки содержатся в очень большом числе копий (~5% суммарного белка эндоспоры), и этого достаточно для насыщения ими ДНК. Их С-концевые домены кооперативно связываются с наружной поверхностью двойной спирали, что переводит ДНК из обычной В-конформации в более плотно скрученную А-конформацию. В комплексе с SASP-белками на фоне низкого содержания свободной воды ДНК защищена не только от депуринизации, но и от физико-химического повреждения сахарофосфатного скелета. При прорастании эндоспоры SASP-белки быстро расщепляются на аминокислоты, которые утилизируются молодой вегетативной клеткой.
Репарация повреждений при прорастании. Прежде всего, происходит репарация повреждений, нанесенных ДНК в покоящейся эндоспоре. Помимо обычных для вегетативной клетки систем эксцизионной и рекомбинационной репарации, а также системы репарации ошибок спаривания (см. раздел 16.5.1.3), в эндоспоре существует уникальная система репарации споровых фотопродуктов — SP-специфичная система репарации ДНК.
Если в вегетативной клетке главным фотопродуктом является циклобутановый димер пиримидиновых оснований, то в эндоспоре образуется тиминовый аддукт 5-тиминил-5,6-дигидротимина (англ, spore photoproduct, SP; рис. 244). Этот уникальный фотопродукт возникает как между соседними остатками тимина в одной цепи ДНК, так и в комплементарных цепях. Причина «необычной» фотохимии пиримидинов заключается в том, что ДНК в эндоспоре слабо гидратирована и стабилизирована SASP-белками α//β-типа.
Рис. 244. Циклобутановый пиримидиновый димер (А) и тиминовый аддукт 5-тиминил-5,6-дигидротимина, или споровый фотопродукт SР (Б).
SР-система репарации основана на действии SР-лиазы (SрlАВ; 79 и 342 а. о.; гены sре), которая синтезируется параллельно с дифференциацией эндоспоры, накапливается в коре, активируется в первые минуты прорастания и превращает SР в мономерные остатки тимина.
Цикл споруляции. Напомним, что цитоплазматический компартмент эндоспоры (кор), модифицированная клеточная стенка (кортекс), а также придаточные структуры (покровы и экзоспориум) образуются в результате кооперативной дифференциации двух дочерних клеток. Клетка-спорангий альтруистически отдает свои ресурсы проспоре, а затем частично лизируется.
Цикл споруляции по продолжительности гораздо дольше (~7 ч при 37°С), чем цикл образования других дифференцированных клеток, что связано с кардинальными морфофизиологическими изменениями по сложным генетическим программам, которые раздельно реализуются в спорангии и эндоспоре.
Цикл споруляции у В. subtilis состоит из семи стадий, которые французский бактериолог Антуанет Ритер (A. Ryter) обозначила в середине 1960-х гг. как стадии 0-VII (рис. 245).
Рис. 245. Цикл споруляции В. subtilis. Объяснение в тексте.
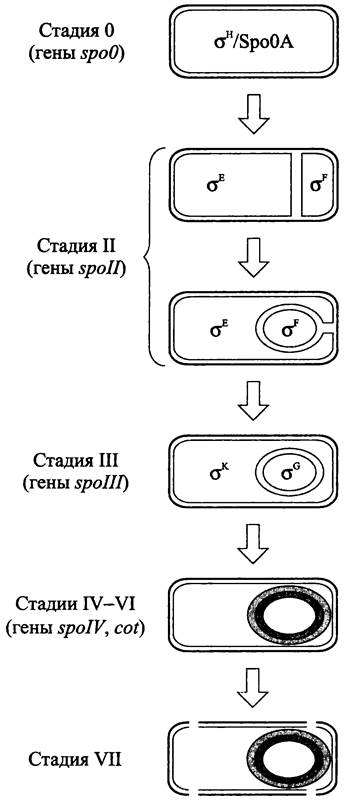
Стадия 0 соответствует вегетативной материнской клетке.
Стадию I в настоящее время не выделяют, поскольку она лишена характерных морфологических признаков, и мутанты, нарушающие ее, неизвестны.
Стадия II подразделяется на три этапа. На этапе Hi, или при септировании (англ. septation) закладывается уникальная споровая септа и происходит асимметричное бинарное деление, в результате которого образуются протопласты разного размера. На этапах Ilii-IIiii, или при поглощении (англ. engulfment) больший протопласт начинает поглощать меньший протопласт.
На стадии III поглощение завершается, и меньший протопласт, или преспора оказывается внутри эндоплазматического компартмента большей клетки, или спорангия. При этом СМ преспоры и СМ спорангия зеркально ориентированы по отношению друг к другу.
На стадии IV синтезируется кортекс, или модифицированная клеточная стенка, окружающая протопласт преспоры.
На стадии V в цитоплазме спорангия откладываются белковые покровы эндоспоры.
Морфологически не выраженная стадия VI соответствует периоду созревания (англ. maturation), когда эндоспора последовательно становится гиперрезистентной, переходит в состояние гиперанабиоза, а также приобретает способность к прорастанию.
Стадия VII соответствует запрограммированной смерти спорангия и его частичному лизису, что приводит к выходу зрелой эндоспоры (англ. release).
Цитологические основы споруляции изучены гораздо слабее, чем ее регуляторные аспекты.
Механизм расхождения сестринских хромосом при споруляции. Данный вопрос мы уже рассматривали в разделе 16.4.2.1.
Споровая септа. Уникальная споровая септа образуется в результате симметричной закладки двух Z-колец, соответственно на 1/4 и 3/4 длины продольной оси материнской клетки. Одно из них произвольно выбирается под контролем белка Spoil А, а другое демонтируется. Субполярная кольцевая инвагинация СМ вначале заполняется септовым муреином, который затем лизируется (см. ниже). В результате этого сестринские цитоплазматические компартменты оказываются разделены только двумя мембранами.
Согласно новым данным, преспоровая хромосома поступает в меньший из двух компартментов не до, а после смыкания споровой септы, т. е. когда билипидные слои СМ спорангия и СМ преспоры полностью заращиваются. Затем N-концевые домены ДНК-транслоказы FtsK/SpoIIIE образуют внутри тандема СМ два гексамерных кольцевых канала, через которые пропускаются плечи хромосмы. При этом С-концевые домены (относящиеся к суперсемейству ААА-АТФаз; см. раздел 16.6.1.3) играют роль цитоплазматического АТФазного мотора.
Поглощение. Формально этот процесс соответствует эндоцитозу, что в целом не свойственно для бактерий. Молекулярные основы поглощения слабо изучены.
В области споровой септы локализуются белки SроIID и SроIIМ, которые образуются в спорангии и гидролизуют муреин, что служит предпосылкой для смыкания двойного слоя мембран вокруг преспоры. Возможно, в поглощении участвуют Мрs-подобные белки, гомологичные ацила-
зам, которые стимулируют инвагинацию СМ при эукариотном эндоцитозе. У бактерий процесс, сходный с поглощением, наблюдается, по крайней мере, еще в двух случаях — при образовании магнитосомы (см. I том учебника), а также при инвазии хищника Daptobacter sp. в цитоплазму другой бактерии.
Образование зародышевой стенки и кортекса. Ригидный слой, который расположен в зазоре между зеркально ориентированными мембранами преспоры и спорангия, подразделяется на внутренний слой (зародышевую стенку) и наружный слой (кортекс).
Зародышевая стенка синтезируется самой проспорой. Она состоит из примордиального муреина, который имеет такое же строение, как муреин вегетативной клетки, и сохраняется при прорастании эндоспоры.
Кортекс синтезируется спорангием. Он состоит из модифицированного муреина:
— около 25% остатков мурамовой кислоты присоединяют к себе боковые тетрапептидные цепи Lana-Dnny-L, DДАII-Dала (в примордиальном муреине — свыше 50%), причем из них не более 3% образуют поперечные сшивки (в примордиальном муреине — 30%);
— около 50% остатков мурамовой кислоты образуют внутренний δ-лактам за счет амидной сзязи с собственной деацетилированной аминогруппой.
Крупнопористый муреин кортекса способен сжиматься, что способствует дегидратации протопласта преспоры. В свою очередь, δ-лактам мурамовой кислоты служит мишенью для автолизинов. При прорастании эндоспоры они разрушают кортекс, в то время как примордиальный муреин остается интактным.
Образование покровов. Белковые покровы споры, сборка которых осуществляется вокруг преспоры, синтезируются в цитоплазме спорангия. На пятом часу споруляции В. subtilisони выявляются в виде более темного гомогенного наружного покрова (англ. outer coat) толщиной 70-200 нм и более светлого ламеллярного внутреннего покрова (англ. inner coat), состоящего из 2-5 слоев толщиной по 75 нм.
Число покровных слоев варьирует у разных бактерий. Простейший однослойный покров из белка одного типа характерен для В. cereus, в то время как В. sphaericus обладает одним из самых сложно устроенных покровов.
Белки покровов богаты остатками тирозина и цистеина, за счет которых образуется большое количество поперечных сшивок. Некоторые из этих белков гликозилированы.
Набор белков в покровах В. subtilis представлен 18 типами (CotA-Z; 17-65 кДа), тогда как у других бацилл он ограничен всего несколькими типами. Локализация части из них известна; например, белки CotDHJ входят в состав внутреннего покрова, а полипептиды CotABCEG — в состав наружного покрова.
Гены cot, кодирующие белки покровов В. subtilis, занимают разное положение на хромосоме. Одни из них (например, cotABC, cotE, cotJ, cotVWX и cotYZ) образуют опероны; другие (например, cotG и cotH), расположены рядом друг с другом, но являются самостоятельными транскрипционными единицами.
Синтез и сборка покровов регулируются каскадом транскрипционных факторов σЕ, SpoIIID, σк и GerE (сигма-факторы σЕ и σк входят в голофермент РНК-полимеразы, a SpoIIID и GerE — это ДНК-связывающие белки).
Гены cot и их транскрипционные регуляторы подразделяются на четыре поочередно экспрессируемые группы (spoIIlD/cotE-P 1; sigK/cotE-P2/cotABCJ; cotD/cotF/cotH/cotS/gerE; cotG/cotVWX/cotYZ), причем первые три содержат регуляторные гены для следующей группы. Строгая последовательность биосинтеза покровных белков обеспечивает их упорядоченную сборку.
Гены cot транскрибируются голоферментами РНК-полимеразы, которые содержат сигма-факторы σЕ или σK и активны только в спорангии (рис. 245).
Предполагается, что образование покровов начинается со сборки каркаса из белка SpoIVA вокруг внешней из двух мембран, окружающих преспору. Затем на этой основе образуется наружный покров (в первую очередь, из белка CotE), а затем уже под него подслаивается внутренний покров.
Образование экзоспориума. Экзоспориум является часто встречающимся, но не обязательным структурным элементом. Он состоит из серии тонких слоев и, как правило, неплотно прилегает к внешнему споровому покрову. У некоторых видов бацилл (но не В. subtilis) экзоспориум снабжен нитевидными придатками, которые не следует путать с фимбриями вегетативных клеток (см. I том учебника). Они повышают адгезивность эндоспоры.
Экзоспориум морского штамма Bacillus sp. SG-1 окружен ореолом из оксида марганца. За образование этого минерального покрова отвечает оперон mnх, в частности ген mnxG,гомологичный генам медьсодержащих оксидаз (см. II том учебника).
Запрограммированная смерть спорангия. Детали этого процесса мало изучены; за общими сведениями мы отсылаем читателя к разделу 17.2.2.
Регуляция споруляции. Часто можно встретить утверждение, что в лаборатории или на микробиологическом производстве массовая дифференциация эндоспор начинается тогда, когда в питательной среде подходит к концу легко метаболизиру- емый источник углерода, азота или фосфора. Однако реальный экологический фон споруляции более сложен — по современным представлениям, стимулом для начала споруляции могут быть разнообразные, не всегда очевидные стрессовые факторы.
В отличие от лабораторных условий, триггеры споруляции в природной среде обитания неизвестны. Они могут оказаться совершенно иными, если принять во внимание:
— лимитированный рост бактерий в микроколониях на поверхности или внутри твердого субстрата, например, почвенной частицы;
— широкий спектр воздействующих на бактерии физико-химических факторов, в том числе экстремальных;
— развитие бактерий не в аксеничных культурах, а в составе смешанных популяций, в частности в симбиозах.
Какова природа исходных внешних индукторов, которые изменяют характер экспрессии генов? Иными словами, как происходит выбор между «вялой» вегетативной адаптацией к неблагоприятным внешним условиям и споруляцией, в результате чего сигма-фактор домашнего хозяйства σА повышает уровень глобального транскрипционного фактора — белка Spo0А?
Белок Spo0A связывается со своей мишенью («Spo0A-боксом» ДНК). Он непосредственно активирует 40 и репрессирует 80 генов, в том числе гены нескольких транскрипционных факторов, и косвенно контролирует до 400 других генов.
Ген spo0A имеет два промотора. Один из них распознается σА-формой РНК- полимеразы и используется при конститутивном синтезе белка Spo0A клетками растущей культуры. Другой промотор распознается σн-формой РНК-полимеразы и используется при споруляции. Ген белка σн (spo0H) дерепрессируется с помощью мастер-регулятора Spo0A~P, который одновременно репрессирует ген abrB.
Низкомолекулярный ДНК-связывающий белок АbгВ (сокр. англ. antibiotic resistance protein В) слабо экспрессируется в растущей популяции низкой плотности, однако накапливается с началом стационарной фазы. Этот глобальный регулятор контролирует гены «переходного состояния»; в частности, он отвечает за образование репрессора генов споруляции.
Установлено, что споруляцию определяют три типа сигналов (рис. 246). Во всех случаях центральным регуляторным звеном служит фосфорилирование глобального фактора транскрипции Spo0A, которое осуществляется с помощью автофосфорилирующихся киназ.
Рис. 246. Регуляторный путь при споруляции В. subtilis. 1, 2 и 3 — типы сигналов (объяснение в тексте); острые стрелки — активация; тупые стрелки — блокирование.
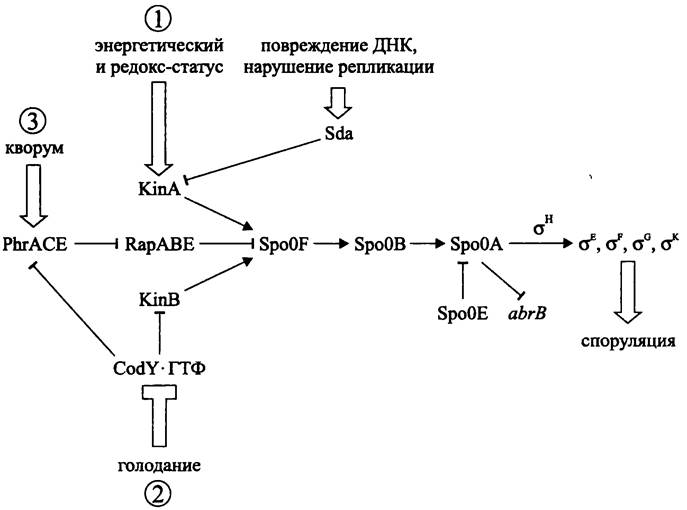
Первый тип сигнала — это так называемый старт-сигнал. Его приемником служит киназа KinА. Она содержит несколько АТФ-связывающих каталитических доменов, чувствительных к уровню редокс-потенциала; При посредстве этой ключевой киназы клетка регистрирует свой собственный редокс- и энергетический статус. Негативным старт-сигналом служит нарушение репликации или повреждение ДНК, в результате чего активируется транскрипция гена sda. Белок Sda связывается с киназой KinA и блокирует ее автофосфорилирование.
Второй тип сигнала — это дефицит питательных субстратов, в частности, источника углерода, азота или фосфора. Внутриклеточным индикатором наступившего голодания служит резкое снижение уровня гуанозинфосфатов, особенно ГДФ и ГТФ (<1 мМ), из-за уменьшения их синтеза и/или использования ГТФ для образования медиатора строгого ответа - (p)ppGpp (см. раздел 18.1.4). В отсутствии голодания ГТФ связывается с транкрипционным фактором CodY, переводя его в активную форму CodY ГТФ, которая блокирует вторую ключевую киназу споруляции — KinB.
От киназ KinA и KinB фосфорильная группа переносится по фосфореле через промежуточные белки Spo0F и Spo0B на фактор транскрипции Spo0A. В условиях, не благоприятствующих споруляции, белок Spo0A~P дефосфорилируется белком Spo0E.
Третий тип сигнала — это достижение определенного уровня плотности популяции. Индикатором кворума служат пептидные автоиндукторы Phr (продукты генов phrA, phrС и phrE), которые секретируются во внеклеточную среду. В результате их процессинга и последующего импорта образуются пентапептиды, которые вытесняют дефосфорилирующие белки RapABE из комплекса с промежуточным белком Spo0F~P. Транскрипция генов phrА и phrE репрессируется активным белком CodYГТФ.
Таким образом, экспрессия генов споруляции контролируется регуляторным каскадом, состоящим из ДНК-связывающего белка Spo0A, а также пяти сигма-факторов (σН, σЕ, σF, σG и σK), которые синтезируются в строгой последовательности и связываются со специфическими промоторами.
Экспрессия ранних генов споруляции В. subtilis определяется активированным ДНК-связывающим белком Spo0A, который запускает асимметричное деление и
транскрипцию глобальных регуляторов спорогенеза spoIIA, spoIIE и spoIIG. Клетки, содержащие белок Spo0A~P, секретируют киллер-фактор, убивающий клетки с неактивной формой белка Spo0A. В результате такого каннибализма спорогенная часть популяции использует метаболические ресурсы своих сородичей.
Переход к споруляции зависит не только от белка Spo0A, но и регулируется альтернативным сигма-фактором σH. Под его контролем находятся гены spoIIID и spoIIIM, продукты которых участвуют в образовании споровой септы.
После формирования споровой септы активность белка Spo0A продолжает возрастать в спорангии, но снижается в преспоре. В результате взаимной изоляции сестринских хромосом общая программа экспрессии генов споруляции подразделяется на две самостоятельные программы. Одна из них реализуется в преспоре, а другая в спорангии (см. рис. 245).
В преспоре активируется сигма-фактор σF, а в спорангии — сигма-фактор σЕ. До образования споровой септы сигма-фактор σF поддерживается в неактивном состоянии с помощью антисигма-фактора Spo0AB. Активация сигма-фактора σF обеспечивается анти-антисигма-фактором SpoIIAA. Последний, в свою очередь, переводится в активную дефосфорилированную форму с помощью белка SpoIIE (благодаря взаимодействию с Z-кольцом этот белок реагирует на асимметричное деление). Активация сигма-фактора σЕ в спорангии обеспечивается протеазой SpoIIGА после того, как из преспоры поступает сигнал в виде белка SpoIIR.
«Ранний» сигма-фактор σG синтезируется в преспоре и поддерживается в неактивном состоянии до завершения процесса поглощения, тогда как «поздний» сигма- фактор спорангия σК активируется протеазой SpoIVFB.
Сигма-фактор σG активирует ряд генов преспоры, в частности, гены главных ДНК-связывающих SASP-белков. В свою очередь, сигма-фактор σK совместно с ДНК-связывающим белком GerE регулирует образование споровых покровов. В результате экспрессии генов споруляции эндоспора образуется как «снаружи», с помощью аппарата трансляции спорангия, так и «изнутри», за счет аппарата трансляции самой преспоры. В частности, дипиколиновая кислота синтезируется в спорангии с помощью продуктов локуса spoVF,находящегося под контролем сигма-фактора σK, и транспортируется в кор с помощью продуктов локуса spoVA, находящегося под контролем сигма-фактора σG.
Прорастание эндоспор. Хотя зрелая эндоспора находится в анабиозе, она непрерывно регистрирует сигналы об экологической обстановке окружающей среды. В благоприятных условиях она дедифференцируется и выходит из спорангия. Данный процесс подразделяется на два основных этапа — прорастание и превращение в вегетативную клетку.
Эндоспоры прорастают (англ. germination) под воздействием индукторов прорастания (англ. germinant), которые могут быть физиологическими и нефизиологическими. В экспериментальных условиях физиологическими, или трофическими индукторами служат некоторые аминокислоты и сахара, а также пуриновые нуклеозиды. Известны и комплексные физиологические индукторы, например, для В. subtilis это смесь аспарагина, глюкозы, фруктозы и катионов К+ («AGFK»). К числу физико-химических, или нефизиологических индукторов относятся минеральные соли (в частности, КВг), экзогенный дипиколинат кальция, лизоцим и катионные детергенты (например, додециламин), сублетальный тепловой шок, а также давление в 100-600 мПа.
Прорастание начинается через считанные секунды после добавления индуктора,
а затем продолжается независимо от его присутствия. Оно состоит из пяти последовательных стадий:
— экскреции Н+ (с повышением pH кора от 6,5 до 7,7), а также катионов К+, Na+ и Zn2+;
— выхода дипиколиновой кислоты в комплексе с катионами Са2+(Ca2+-DPA);
— регидратации, или замещения (Ca2+-DPA) молекулами Н2О;
— лизиса муреина кортекса;
— дальнейшей регидратации, сопровождающейся набуханием кора и растяжением зародышевой стенки.
По завершении пятой стадии возобновляются энергетический метаболизм и биосинтез макромолекул, в результате чего происходит превращение эндоспоры в вегетативную клетку (англ, outgrowth).
Аппарат для прорастания эндоспоры состоит из: (1) рецепторов, с которыми связываются индукторы прорастания; (2) каналов для выхода минеральных катионов и Ca2+-DPA; (3) гидролитических ферментов, которые разрушают кортекс.
Рецепторы аппарата прорастания В. subtilis кодируются взаимно гомологичными трицистронными оперонами gerA, gегВ и gerК. Они ассоциированы с внутренней мембраной (в частности, амфипатический белок GerAA содержит пять трансмембранных доменов, интегральный белок GerAB десять трансмембранных доменов, а белок GerAC относится к периферическому типу). Рецепторы GerA распознают L- аланин, в то время как рецепторы GerB и GerK совместно распознают AGFK.
Для того, чтобы индукторы прорастания вступили в контакт с рецепторами внутренней мембраны, им необходимо преодолеть поверхностные структуры эндоспоры. Предполагается, что для этого используются специфические поры, в организации которых участвует белок GerP (продукт оперона gerР, который экспрессируется в спорангии с σK-зависимого промотора и негативно регулируется ДНК-связывающим белком GerE).
До сих пор неизвестно, каким образом сигнал о связывании индукторов с рецепторами передается другим компонентам аппарата прорастания; скорее всего, ключевым моментом является изменение жидкостно-кристаллического состояния мембраны.
Каналы для выхода минеральных катионов и Ca2+-DPA в покоящейся эндоспоре закрыты; они открываются только после того, как индукторы прорастания связываются со своими рецепторами.
В ходе споруляции DPA синтезируется в спорангии и поступает в преспору по мембранным каналам против градиента концентрации, что, естественно, требует энергетических затрат. Напротив, выход Ca2+-DPA при прорастании не подразумевает участия энергетического метаболизма. Предполагается, что «закачка» DPA и выход Ca2+-DPA осуществляются с помощью одних и тех же белков, продуктов оперона spoVA.
В результате регидратации кора эндоспоры В. subtilis его объем увеличивается в 2-2,5 раза. Однако механизм поступления воды в кор по мере выхода из него Ca2+-DPA до сих пор не выяснен.
Гидролитические ферменты CwlJ (с неизвестной каталитической спецификой) и SleB (трансгликозилаза), разрушающие кортекс в ходе прорастания, атакуют 6-лактам мурамовой кислоты. Они синтезируются только при споруляции, причем CwlJ образуется в спорангии, a SleB — в преспоре. Для их таргетинга и стабилизации необходимы вспомогательные белки (соответственно, GerQ и YpeB). Деградация кортекса является относительно быстрым процессом и занимает несколько минут.
На этапе превращения эндоспоры в вегетативную клетку специфическая протеаза гидролизует SАSР-белки; образующиеся аминокислоты используются в качестве субстратов для энергетического и конструктивного метаболизма. Одновременно с этим возобновляются дыхание и синтез АТФ.
Для высвобождения вегетативной клетки из спорангия частично разрушаются покровы и экзоспориум. По-видимому, ферментативное воздействие сочетается с физическим давлением, однако детали этого процесса еще не изучены.
* * *
Рассмотренные нами покоящиеся резистентные клетки являются продуктами дифференциации по эндогенным программам, которые запускаются при неблагоприятном изменении окружающей среды.
Специфические структурные и функциональные свойства, приобретенные цистами и эндоспорами, позволяют им лучше, по сравнению с вегетативными клетками, переносить стрессовые и, особенно, экстремальные условия. Умение адаптироваться, в свою очередь, определяет биологическую пригодность (англ. fitness) того или иного вида бактерий или архей.
Закончив тему онтогенеза, переходим к вопросам регуляции и адаптации.