МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 18. РЕГУЛЯЦИЯ
The range of subjects comprehended within the domain of Biology is so wide, and my own acquaintance with them so imperfect, that it is not in my power to lay before you any general outline of the recent progress of the biological sciences.
(Круг вопросов, относящихся к сфере Биологии, столь широк, а мое знание их до такой степени неполно, что передать вам общие основы современного прогресса биологических наук мне не по силам).
A.R. Wallace. TYopical Nature and other Essays (London, 1878).
Термином регуляция (лат. regulo — направлять, упорядочивать) применительно к прокариотам обозначается опосредованный внутренними или внешними стимулами эндогенный контроль над структурной организацией и процессами жизнедеятельности особи, т. е. клетки или трихома.
Регуляторная сеть. Регуляторные системы объединяются в разветвленную и многоуровневую командную структуру, или регуляторную сеть (англ. regulatory network).
Назначение регуляторной сети состоит в том, чтобы обеспечить адаптацию путем сохранения уже достигнутого уровня гомеостаза или путем перехода на новый гомеостатический уровень. Чтобы регуляция была целесообразной, в обоих случаях подразумевается петля обратной связи.
Объекты регуляции. Под управлением регуляторных систем могут находиться:
— транспортер, фермент, структурный белок или компонент сигнального пути;
— информационная, транспортная или метаболическая система;
— биогенез или функционирование клеточной органеллы;
— интегральное онтогенетическое превращение;
— индивидуальный поведенческий акт;
— групповой коммуникационный процесс.
Регуляция транскрипции и посттранскрипционная регуляция. В основе регуляции в той или иной форме лежит воздействие на информационный процесс или передачу информации. Когда речь идет об экспрессии генов, в первую очередь, различают регуляцию транскрипции и посттранскрипционную регуляцию.
Регуляция транскрипции осуществляется через ДНК-содержащие структуры, в частности гены, а посттранскрипционная регуляция — через продукт транскрипции, т. е. РНК.
Центральную роль в адаптации к изменяющимся условиям внешней или внутренней среды играют продукты экспрессии генов домашнего хозяйства. Среди них центральное место занимает аппарат трансляции.
Из небелковых компонентов аппарата трансляции на уровне транскрипции регулируются:
— содержание «стабильных» РНК (рРНК и тРНК);
— набор и содержание «нестабильных» РНК (мРНК);
— набор и содержание регуляторных РНК.
Регуляция метаболизма и регуляция поведения. Прокариоты адаптируются к окружающей среде путем изменения характера и интенсивности своего метаболизма, что непосредственно зависит от транскрипции генов домашнего хозяйства.
Паттерн и уровень транскрипции генов домашнего хозяйства регулируются в меру трофических потребностей клетки, а также в соответствии с (а)биотическими условиями окружающей среды, которые могут изменяться не только быстро, но и резко.
Классическим примером служат энтеробактерии, в частности Е. coli. До той поры, пока она остается в пищеварительном тракте хозяина, ее развитие протекает в относительно стабильных условиях на питательной среде, богатой субстратами. Выйдя наружу и очутившись в непостоянной, агрессивной и зачастую экстремальной (как правило, голодной) нише, Е. coli испытывает стресс. Для того, чтобы сохранить жизнеспособность до начала нового цикла «внутриутробного» развития, этой бактерии необходимо обладать регуляторной сетью, позволяющей быстро адаптироваться к новым условиям существования.
Помимо метаболической адаптации, выраженной в изменении паттерна и уровня транскрипции генов домашнего хозяйства, прокариоты обладают способностью к поведенческой адаптации.
Применительно к прокариотам, понятие «поведение» включает в себя как двигательный акт, так и клеточную дифференциацию. При этом особь или популяция получают возможность сменить экологическую обстановку на более благоприятную, либо пассивно переживают период, неблагоприятный для жизнедеятельности, находясь в разной степени изоляции от окружающей среды.
18.1. Регуляция транскрипции
Контроль экспрессии генов у прокариотов, изученный главным образом для Е. coli, осуществляется на четырех иерархических уровнях:
— на локальном уровне, путем регуляции транскрипции генов и оперонов;
— на региональном уровне, путем координированной регуляции транскрипции в регулоне, т. е. в группе из нескольких оперонов;
— на надрегиональном уровне, путем координированной регуляции транскрипции в стимулоне или модулоне, т. е. в группе из нескольких регулонов;
— на высшем уровне, путем регуляции общего паттерна транскрипции.
Таким образом, иерархический уровень регуляции транскрипции (рис. 247) повышаетя в ряду:
оперон —> регулон —> стимулон или модулон —> высший уровень.
Рис. 24.7. Полиморфизм транскрипционного аппарата и иерархические уровни транскрипции. 1-2 — образование полиморфных голоферментов РНК-полимеразы; 2-3 — образование полиморфных транскрипционных комплексов с участием транскрипционных факторов (ТF); 4 — выбор промоторов; 5 — опероны; 6 — регулоны; 7 — стимулоны.
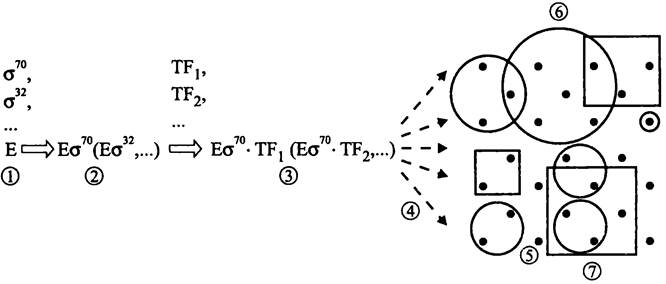
Оперон. Базовый, самый изученный уровень регуляции транскрипции соответствует оперону. Напомним, что оперон представляет собой кассету физически сцепленных генов, которые используют общий промотор и общую систему регуляторных сайтов (см. раздел 16.3.1.2). За исключением генов оперона рРНК, гены оперонов транскрибируются в мультицистронные мРНК, содержащие открытые рамки считывания.
Для конкретного регуляторного уровня характерно использование специфических внешних сигналов и функционально обусловленных внутренних механизмов ответа.
В частности, экспрессия оперона, гены которого определяют тот или иной биосинтетический путь, репрессируется конечным продуктом. В свою очередь, экспрессия генов оперона, отвечающего за катаболический процесс, как правило, активируется субстратами данного процесса.
Регуляция на уровне оперона осуществляется ДНК-связывающими белками, которые синтезируются в относительно небольшом числе копий и специфически распознают несколько сайтов-мишеней.
Регулон. Следующий иерархический уровень регуляции соответствует регулону (англ. regulon; от лат. regulo и греч. ontos — сущее; «нечто регулируемое»). Этот термин предложили в 1964 г. Маас (W. К. Maas) и Кларк (A. J. Clark) для обозначения группы оперонов, экспрессия которых координированно контролируется общим белком-регулятором под воздействием факторов окружающей среды, в частности, в ответ на тот или иной режим питания.
Опероны, входящие в состав регулона, не обязательно тесно сцеплены друг с другом, т. е. они могут быть разбросаны по генетической карте и даже могут регулироваться отдельно друг от друга. Однако все вместе они отвечают за реализацию общей физиологической функции (например, nif-регулон обеспечивает диазотро- фию; см. II том учебника).
Мастер-регулятором (англ. master regulator), т. е. общим регулятором оперонов регулона служит белок-активатор или белок-репрессор, который действует совместно с низкомолекулярным лигандом-коэффектором.
Регулоны подразделяются на глобальные и локальные. Глобальные регулоны содержат опероны и гены, имеющие отношение к нескольким клеточным системам, а локальные регулоны — только к одной системе.
Одним из примеров глобального регулона служит регулон SOS-ответа (см. ниже). Он негативно контролируется белком-репрессором LexA. В свою очередь, примером локального регулона служит arg-регулон энтеробактерий, отвечающий за биосинтез аргинина. Он состоит из восьми оперонов и регулируется белком-репрессором ArgR.
Активаторы и репрессоры распознают в оперонах унифицированную нуклеотидную последовательность. В отличие от относительно малокопийных ДНК-связывающих белков, осуществляющих регуляцию на уровне оперона (см. выше), регуляторные белки, которые контролируют регулон, синтезируются в большем числе копий и связываются с множественными сайтами ДНК.
Доказать существование регулона и выявить его функциональные компоненты можно несколькими способами.
Во-первых, анализируя с помощью двухмерного электрофореза набор меченых белков, синтез которых индуцируется внешним стимулом.
Во-вторых, вводя в оперон гибридные гены, продукты которых проявляют себя как фенотипические репортеры (зеленый флуоресцирующий белок GFP, люцифераза LuxAB и др.), или импортируя в него «селективные» гены с помощью трансформации или фаговой трансдукции (ген cat хлорамфеникол-ацетилтрансферазы, ген lacZ β-галактозидазы и др.).
Втретьих, анализируя частично или полностью секвенированный прокариотный геном на предмет наличия в нем консенсусных сайтов узнавания для того или иного белка-регулятора.
Стимулом, и модулон. Следующие уровни регуляции соответствуют стимулону (англ. stimulon; от лат. stiinulo — побуждать и греч. ontos — сущее; «нечто стимулируемое») и модулону (англ, modulon от лат. modulor — размерять и греч. ontos — сущее; «нечто модулируемое»). Эти термины были предложены в 1996 г. Нейдхардтом (F. С. Neidhardt) и Саважо (М. A. Savageau) для обозначения совокупности оперонов и регулонов, экспрессия которых координированно регулируется в ответ на стрессовые воздействия со стороны окружающей среды. Соответствующие сигналы (об изменении осмомолярности, концентрации питательных субстратов и т. д.) влияют на уровень экспресии генов и оперонов сразу в нескольких регулонах.
Стимулон — это совокупность оперонов и регулонов, уровень экспрессии которых изменяется под воздействием общего стимула при участии разных регуляторных белков. Как правило, термин «стимулон» используется, когда природа общего лиганда (или лигандов) неизвестна. В качестве примера стимулона можно привести роl-стимулон Salmonella entericaсеровар Typhimurium. Когда эта энтеробактерия заражает макрофаги, у нее повышается уровень экспрессии 285 генов (75% генов, индуцируемых полимиксином) и снижается уровень экспрессии еще 298 генов (80% генов, репрессируемых антибиотиком).
Модулон — это совокупность оперонов и регулонов, уровень экспрессии которых изменяется под воздействием лиганда, общего для разных регуляторных белков. Например, гены и опероны железного стресса образуют fur-модулон; при этом лигандом служит катион Fe2+ (см. раздел 18.3.2.5).
Регуляторные белки стимулона или модулона характеризуются более высокой копийностью, чем регуляторы регулона. Они связываются с множественными и, как правило, вырожденными сайтами ДНК.
Высший уровень. На высшем иерархическом уровне контролируется активность до 50% генов. Совокупный продукт экспрессии этих генов обеспечивает адаптацию к новым условиям существования.
В данном случае ответ клетки на разнообразные внешние сигналы носит интегративный характер, а экспрессия отдельных генов устанавливается на базовом уровне, оптимальном для сохранения жизнеспособности и развития особи в широко варьирующих и быстро изменяющихся условиях окружающей среды.
Предполагается, что высший уровень регуляции непосредственно связан с изменением суперспирализации хромосомной ДНК (см. ниже).
Регуляторный путь при транскрипции. Регуляторный путь при транскрипции состоит из нескольких этапов (рис. 248).
Рис. 248. Регуляторный путь при транскрипции.
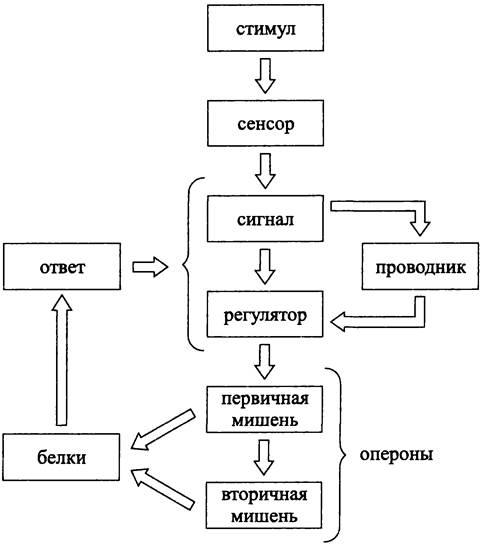
Началом, или триггером служит стимул, роль которого играют повреждение ДНК или изменение условий внешней среды, например, переход в анаэробные условия, повышение осмомолярности и т. д.
Стимул воспринимается сенсором, или рецепторным белком, который встроен в СМ или находится в цитозоле. Воздействие стимула на сенсор вызывает конформационный или химический сигнал. Этот сигнал, непосредственно или через один, или несколько передатчиков, поступает на регулятор транскрипции, или просто регулятор.
Регулятор воздействует на первичную мишень — оперон, изменяя уровень экспрессии генов. В свою очередь, первичная мишень может контролировать одну или несколько вторичных мишеней.
Белковые продукты экспрессии мишеней вызывают ответ. Он выражается в том или ином адаптационном изменении, целесообразность и эффективность которого тестируются с помощью петли обратной связи, замкнутой на уровне блока сигнал/проводник/регулятор.
18.1.1. Регуляторы транскрипции
Экспрессия генов, т. е. специфика и интенсивность их считывания, контролируется в основном на этапе инициации транскрипции — когда голофермент РНК-полимеразы связывается с промотором, и происходит переход от закрытого комплекса к открытому комплексу (см. раздел 16.7.1.1).
В свою очередь, на инициацию транскрипции оказывают воздействие:
— «сила» промоторов, которая зависит от их нуклеотидной последовательности;
— регуляторы транскрипции, имеющие белковую природу;
— регуляторы транскрипции небелковой природы.
Регуляторы транскрипции, имеющие белковую природу, влияют на распознавание промоторов и их активность. В первом случае речь идет о сигма-факторах, а во втором случае о транскрипционных факторах. Принципиальное отличие сигма- факторов от транскрипционных факторов (активаторов или репрессоров) заключается в том, что первые связываются не с UAS-последовательностью или энхансером, что характерно для активатора, и не с оператором, что характерно для репрессора, а с кор-ферментом РНК-полимеразы.
Наряду с сигма-факторами (а также антисигма-факторами и анти-антисигма- факторами; см. ниже) и транскрипционными факторами в качестве регуляторов транскрипции выступают «архитектурные» ДНК-связывающие белки и ферменты, влияющие на суперепирализацию ДНК. В отличие от сигма-факторов и транскрипционных факторов они не обладают сродством к определенным последовательностям ДНК. Тем не менее, их обычно также называют транскрипционными факторами. К числу таких регуляторов транскрипции относятся:
— «архитектурные» ДНК-связывающие белки Fis, H-NS и IHF, которые локально изгибают молекулу ДНК (см. I том учебника, а также разделы 16.4.1. 1, 16.6.1.2, 16.6.1.3 и 16.7.1.1 настоящего тома);
— ДНК-гираза, создающая отрицательные супервитки ДНК за счет использования энергии гидролиза АТФ (см. раздел 16.4.2);
— ДНК-топоизомераза Торо I, удаляющая отрицательные супервитки ДНК без затраты энергии АТФ (см. раздел 16.4.2);
— ДНК-топоизомераза Торо IV, удаляющая отрицательные супервитки ДНК без затраты энергии АТФ, а также устраняющая узлы и катенаны ДНК за счет энергии АТФ (см. раздел 16.4.2).
Напомним, что для хромосомной ДНК нормой является отрицательная супер- спирализация (см. I том учебника). Ее локальный характер зависит от глобальных физиологических факторов эндогенной природы, в частности от энергетического заряда (см. II том учебника) или экзогенной природы, например, от температуры,
осмомолярности и парциального давления кислорода. От плотности распределения супервитков по хромосоме зависит конформация спейсерных участков в промоторах, что, в свою очередь, тем или иным образом влияет на инициацию транскрипции.
В отличие от сигма-факторов и транскрипционных факторов, архитектурные белки и ферменты, определяющие суперспирализацию ДНК, не распознают специфические последовательности ДНК. Тем не менее, некоторые из них могут проявлять предпочтение к определенным участкам хромосомы, что приводит к избирательной регуляции транскрипции. Например, ДНК-связывающий белок Н-NS, который тяготеет к изгибам ДНК, подавляет транскрипцию многих генов в стационарной фазе.
Регуляторы транскрипции небелковой природы также влияют на активность промоторов или их распознавание. В качестве примеров назовем метильную группу, ковалентное связывание которой модифицирует основания ДНК (см. разделы 16.5.2 и 16.8); медиатор «строгого» ответа (р)ррGрр, нековалентно связывающийся с
РНК-полимеразой (см. раздел 18.1.4); аллостерический регулятор 3',5'-цикло- АМФ, влияющий на инициацию транскрипции (см. раздел 16.7.1.1) и ряд других.
18.1.1.1. Сигма-факторы
Напомним, что мультисубъединичный кор-фермент бактериальной РНК-полимеразы (α2ββ'ω) осуществляет элонгацию и терминацию. Однако он не может самостоятельно распознавать промоторы и эффективно инициировать транскрипцию. Для этой цели существует дополнительная субъединица σ, которая присоединяется к кор-ферменту (см. раздел 16.7.1). Конкурентная замена одного сигма-фактора другим сигма-фактором перенастраивает РНК-полимеразу на транскрипцию ранее молчавших генов.
Большинство бактерий образует несколько сг-факторов — например, у Е. coli имеется главный сигма-фактор σ70 и шесть дополнительных сигма-факторов (σS, σ32, σF, σЕ, σfecI и σ54), каждый из которых распознает разные консенсусные последовательности промоторов.
За счет конкуренции сигма-факторов за связь с кор-ферментом не только поддерживается базовый уровень транскрипции, но и регулируется уровень экспрессии генов в ответ на разнообразные внешние (экологические) или внутренние (онтогенетические) стимулы. Помимо сигма-факторов, в регуляции транскрипции участвуют антисигма-факторы, анти-антисигма-факторы, а также транскрипционные факторы, число которых в случае Е. coli достигает 350 (см. ниже).
Сигма-факторы представляют собой гетерогенное семейство белков сравнительно небольшого размера (20- 70 кДа). Они обратимо связываются с кор-ферментом Е РНК-полимеразы, в результате чего образуется голофермент Еσ (рис. 249).
Рис. 249. Участие сигма-факторов в инициации транскрипции. А — связывание голофермента с промотором (образование закрытого комплекса); Б — образование транскрипционного пузырька (открытый комплекс); В — синтез абортивных транскриптов; Г — освобождение сигма-фактора (элонгация); Д — освобождение кор-фермента РНК- полимеразы (терминация); 1 — абортивные транскрипты; 2 — первичный транскрипт.
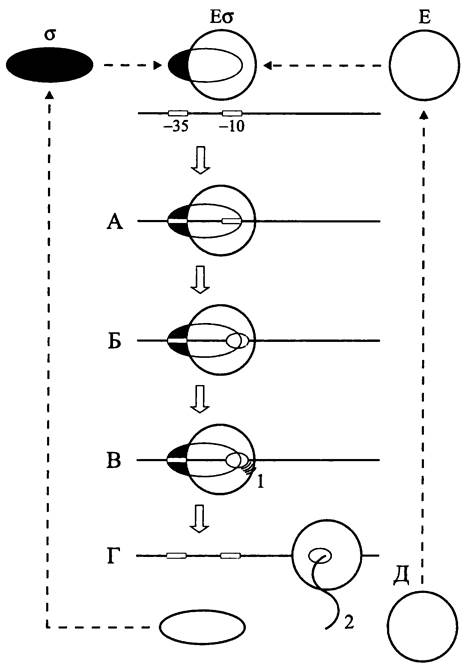
При связывании голофермента с (-35.. .-10) областью промотора первоначально возникает транскрипционно не активный, или закрытый комплекс. В результате плавления дуплекса ДНК в -10 участке связывания голофермента образуется транскрипционный пузырек открытого комплекса (см. раздел 16.7.1.1). На ранней стадии транскрипции в области промотора синтезируются абортивные транскрипты размером 2 -12 п. н. Затем сигма-фактор высвобождается, и кор-фермент РНК-полимеразы начинает двигаться вдоль матрицы, синтезируя на антисмысловой цепи первичный транскрипт — молекулу мРНК, рРНК или тРНК. По достижении терминатора транскрипция завершается, РНК-полимераза отделяется от матрицы (рис. 249), и дуплекс ДНК реконструируется.
Частота актов инициации транскрипции, или сила промотора зависит от нуклеотидной последовательности и конформации ДНК в этом специфическом участке. Сигма-фактор распознает две консервативные области промотора — консенсусные последовательности, которые обычно занимают положение с координатами, соответственно, -35 и -10.
Классификация сигма-факторов. Согласно гомологии их первичной последовательности, сигма-факторы можно разбить на два семейства — семейство σ 70 (по названию первичного сигма-фактора Е. coli; 70 кДа) и не гомологичное ему семейство σ54 (по названию сигма-фактора, контролирующего азотный метаболизм Е. coli; 54 кДа).
Номенклатура сигма-факторов довольно запутанна. Если у грамотрицательных бактерий они обычно обозначаются как Rpo (сокр. англ. RNA polymerase), то в случае грамположительных бактерий часто используется сокращение Sig (от англ. sigma) или Hrd (от англ. homologue of RpoD). В обоих случаях может вводиться надстрочный индекс, обозначающий молекулярную массу (кДа). Однако, когда известен ген сигма-фактора, надстрочным индексом становится название этого гена, например. Наконец, помимо широкого использования синонимов, один и тот же сигма-фактор у разных бактерий может иметь разные названия; в то же время случается, что обозначения разных сигма-факторов досадно совпадают (см. табл. 30).
Сигма-факторы семейства σ 70 (общие сведения). Все бактерии содержат от одного (Mycoplasma spp.) до нескольких сигма-факторов этого семейства, а в случае Streptomycescoelicolor их число превышает 60. В первичной последовательности этих белков имеются четыре консервативных участка:
— наименее консервативный N-концевой участок 1, состоящий из области 1.1 (только у первичных сигма-факторов; влияет на связывание ДНК и инициацию транскрипции) и области 1.2 (отвечает за образование открытого комплекса);
— наиболее консервативный участок 2, состоящий из областей 2.1-2.5 (отвечают за взаимодействие с кор-ферментом, за плавление дуплекса ДНК и за распознавание консенсусной последовательности в позиции -10);
— участок 3, который состоит из областей 3.1 и 3.2 (последняя отсутствует у сигма-факторов σК и σН) и отвечает за связывание с кор-ферментом;
— С-концевой участок 4, состоящий из областей 4.1 (отвечает за связь с активаторами) и 4.2 (отвечает за распознавание консенсусной последовательности в позиции -35).
Семейство σ70, в свою очередь, подразделяется на группы 1-3 (табл. 30).
Таблица 30. Сигма-факторы
Группа |
Подгруппа |
Название, синоним |
Распространение |
Консенсусные последовательности промотора |
||
-35 Спейсер -10 |
||||||
Семейство σ70 |
||||||
Первичные (1) |
Без подгруппы |
σ70(RpoD) |
Proteobacteria |
TTGACA |
16-18* |
TATAAT |
σA(SigA) |
Firmicutes |
TTGACA |
16-18 |
TATAAT |
||
MysA |
Mycobacterium spp. |
- |
- |
- |
||
HrdB |
Streptomyces spp. |
- |
- |
- |
||
Необязательные (2) |
Стационарной фазы (2.1) |
σ38 (σS, RpoS) |
Энтеробактерии, Pseudomonas spp. |
Нет |
Нет |
CTATA-CT |
Цианобактерий (2.2) |
SigB-E |
Synechococcus spp. |
- |
- |
- |
|
SigBC |
Anabaena spp., Synechocystis spp. |
- |
- |
- |
||
GС-богатых Актинобактерий (2.3) |
MysB |
Mycobacterium spp. |
- |
- |
- |
|
SigB |
Corynebacteriumspp. |
- |
- |
- |
||
HrdA,C-E |
Streptomyces spp. |
- |
- |
- |
||
Альтернативные (3) |
Флагеллогенеза (3.1) |
σ28(FHA, SigD) |
Энтеробактерии |
TAAA |
15 |
GCCGA-TAA |
σD |
B. subtilis |
TAAA |
15 |
GCCGA-TAA |
||
WhiG |
Streptomyces spp. |
TAAA |
15 |
GCCGA-TAA |
||
ЕСF (3.2) |
σE(SigE) |
E. coli, Mycobacterium spp., Streptomyces coelicolor |
GAACTT |
16-17 |
TCTRA |
|
AlgU |
P. aeruginosa |
- |
- |
- |
||
CarQ |
Myxococcus xanthus |
- |
- |
- |
||
CrnH |
Ralstonia eutropha |
- |
- |
- |
||
FecI |
E. coli |
- |
- |
- |
||
HprL |
P. syringae |
- |
- |
- |
||
PbrA |
P. fluorescens |
- |
- |
- |
||
SigV-Z |
B. subtilis |
- |
- |
- |
||
Теплового шока: σ32 и ему подобные (3.3.1) |
σ32(RpoH) |
Г рамотрицательные бактерии |
GTTGA-AA |
11-16 |
CCCAT-NT |
|
SigBC |
M. xanthus, Stigmatella aurantiaca |
GTTTAA |
12-14 |
RGAAT |
||
Теплового шока: σB и ему подобные (3.3.2) |
σB(SigF) |
В. subtilis, Mycobacterium spp., Staphylococcusspp., Streptomyces spp. |
GTTTAA |
12-14 |
GGGTAT |
|
Семейство σ70 |
||||||
Альтернативные (3) |
Спорогенеза (3.4) |
σH (SpoOH) |
Bacillus spp., Clostridium, spp. |
AGGA-WWT |
12-14 |
RGAAT |
σE (SpoIIGB) |
Bacillus spp., Clostridium spp. |
GKCAT-ATT |
13-15 |
CATAC-TA |
||
σF, (SpoIIAC) |
Bacillus spp., Clostridium spp. |
WGCA-TA |
14-15 |
GGNRA-YAMTW |
||
σF (SpoIIIG) |
Bacillus spp., Clostridium. spp. |
TGAA-TA |
17-18 |
CATAN-ANTA |
||
σK (SpoIIlC) |
Bacilhis spp., Clostridium spp. |
AC |
16-17 |
CATAN |
||
Семейство σ54 |
||||||
Сигма-54 |
Без подгруппы |
σN(RpoN, SigL) |
Aquifex aeolicus, Proteobacteria, GC-бедные Firmicutes, Planctomycetes, Chlamydiae, Spirochaetes |
TGGC-AC (-26)±1 |
5 |
TTGCW (-H)±l |
Обозначения: N — один из четырех нуклеотидов; R — А или G; W —A или T; У — С или Т; М — А или С; К — G или Т; * — п. н.; — данные отсутствуют.
Группа 1. В нее входят первичные (англ. primary), или незаменимые (англ. essential) сигма-факторы. Они отвечают за транскрипцию большинства генов домашнего хозяйства, от которых зависит жизнеспособность бактерий и которые экспрессируются при экспоненциальном росте. Конкретный вид бактерий содержит только один первичный сигма-фактор — σ70 в случае Е. coli (ген rpoD); σА в случае В. subtilis и других представителей филы Firmicutes; MysA в случае Mycobacterium spp.; HrdB в случае Streptomyces spp. и т. д. Консенсусные последовательности, узнаваемые этими сигма-факторами, очень консервативны, и уклонение от них значительно уменьшает силу промоторов. В том случае, когда консенсусная последовательность в позиции -35 вообще отсутствует, сильный промотор имеет расширенную последовательность TGNTATAAT в позиции -10.
Группа 2. В нее входят необязательные (англ. non-essential) сигма-факторы. Они обладают высокой степенью гомологии с первичными сигма-факторами и, вероятно, распознают такие же промоторные участки, однако рост и сохранение жизнеспособности бактерий от них не зависят. Данная группа, в свою очередь, подразделяется на три подгруппы.
Подгруппа 2.1. К ней относятся сигма-факторы стационарной фазы, в частности сигма-фактор σ38 (σS, RpoS) Е. coli и других энтеробактерий. Они известны преимущественно как глобальные регуляторы транскрипции при вхождении в стационарную фазу. Помимо этого, они играют ведущую роль в условиях гиперосмотического или кислотного стресса. Гены, контролируемые этими сигма-факторами, отвечают за репарацию ДНК, за барьерные свойства оболочки, морфогенез, осмо- протективные системы, термостабильность, биосинтез запасных полимеров и т. д. В экспоненциально растущих клетках сигма-факторы о38 нестабильны и разрушаются протеазой ClpXP. Отсутствие консервативной последовательности в области -35 не влияет на силу распознаваемых ими промоторов благодаря тому, что ДНК в этой области образует изгиб.
Подгруппа 2.2. Данную подгруппу составляет обособленный кластер сигма- факторов, выявленных только у нескольких штаммов одноклеточных и трихомных цианобактерий. Они контролируют экспрессию генов в ходе циркадных ритмов (см. раздел 17.1.3), а также образуются при азотном голодании, хотя не участвуют в дифференциации гетероцист (см. раздел 17.5.1.2). В случае Synechococcus spp. сигма- фактор SigE регулирует транскрипцию генов углеродного и азотного метаболизма в фазе замедленного роста, что указывает на его функциональное сходство с сигма- факторами σ38.
Подгруппа 2.3. Сигма-факторы, принадлежащие к этой подгруппе (MysB в случае Mycobacterium spp., SigB в случае Corynebacterium glutamicum и HrdA, C-E в случае Streptomycesspp.), сильнее дивергировали друг с другом, чем представители двух предыдущих групп, хотя обладают ими филогенетически родственные бактерии. Функции этих сигма-факторов в настоящее время неизвестны.
Группа 3. В нее входят альтернативные (англ. alternative) сигма-факторы. Они сильно отличаются по аминокислотной последовательности от первичных сиг-
ма-факторов и контролируют транскрипцию специфических регулонов в особых физиологических условиях или при дифференциации.
Данная группа, в свою очередь, подразделяется на четыре подгруппы.
Подгруппа 3.1. К ней относятся сигма-факторы биогенеза жгутика, или фла- геллогенеза (англ. flagellar). В частности, сигма-фактор σ28 (FliA, SigD) энтеробактерий, сигма-фактор σDВ. subtilis и сигма-фактор WhiG Streptomyces spp. контролируют гены, которые кодируют белки, участвующие в сборке нити жгутика, а также белки хемотаксиса. В случае S. coelicolor, образующего воздушный мицелий, сигма- фактор WhiG регулирует ранние гены споруляции (см. раздел 17.5.2.2).
Подгруппа 3.2. Членами этой подгруппы являются сигма-факторы ECF (сокр. англ. extracytoplasmic functions). Они контролируют разнообразные «экстравертные» ответы на внеклеточные, чаще всего неблагоприятные стимулы. В этих ответах участвуют поверхностные структуры и транспортные системы. Например, сигма-фактор σЕ(SigE) Е. coliиндуцируется при нарушении фолдинга периплазма- тических белков; сигма-факторы FecI Е. coli и PbrA Pseudomonas fluorescens контролируют импорт железа; сигма-фактор СгпН отвечает за устойчивость Ralstonia eutropha к никелю и за экскрецию кобальта у этой бактерии; сигма-фактор SigX определяет резистентность В. subtilis к тепловому шоку; сигма-фактор CarQ регулирует биосинтез фотопротекторных каротиноидов у Myxococcus xanthus, а сигма- фактор AlgU — биосинтез защитного полимера альгината у штаммов Р. aeruginosa, вызывающих цистозный фиброз легких; сигма-фактор HrpL держит под контролем транскрипцию и секрецию факторов вирулентности у фитопатогенной бактерии Р. syringae и т. д.
Подгруппа 3.3. В нее входят сигма-факторы теплового шока (англ, heat shock). Белки теплового шока синтезируются при термическом стрессе и некоторых других стрессах, например, токсическом (см. раздел 19.1.8). Они играют роль молекулярных шаперонов, обеспечивающих правильный фолдинг белков, или роль протеаз, расщепляющих неправильно уложенные белки.
Подгруппа 3.3. в свою очередь, содержит два подраздела.
К подразделу 3.3.1 относится сигма-фактор σ32(RpoH) Е. coli и подобные ему сигма-факторы ряда других грамотрицательных бактерий. При повышенной температуре синтез σ32усиливается, и стабильность этого сигма-фактора возрастает; напротив, в нормальных условиях последний образует комплекс с белком DnaK и расщепляется металлопротеазой FtsH. Большинство бактерий содержит только один Rpo-подобный сигма-фактор. Исключением служат миксобактерии Myxococcus xanthus и Stigmatella aurantiaca, у которых таких сигма-факторов два (SigBC). Они контролируют образование плодовых тел и дифференциацию миксоспор.
К подразделу 3.3.2 относится сигма-фактор σB (SigF) В. subtilis и ему подобные сигма-факторы ряда других грамположительных бактерий. Он играет роль глобального регулятора при общем стрессе, т. е. проявляет функциональное сходство с сигма-факторами σ38. Его экспрессия усиливается при вхождении в стационарную фазу, а также при повышении температуры или воздействии токсикантов. Сигма- фактор σB регулирует экспрессию >40 генов белков общего стресса, которые индуцируются в стационарной фазе, при азотном голодании и окислительном стрессе, а также при холодовом или токсическом шоке.
Подгруппа 3.4. К этой группе относятся сигма-факторы спорогенеза σH, σЕ, σF, σG и σK, наиболее изученные на примере Bacillus spp. (см. раздел 17.5.2.2).
Одни из них специфичны для материнской клетки (σH), другие — для спорангия (σЕ и σK), третьи —для преспоры (σF и σG).
Сигма-факторы семейства σ54 (общие сведения). Представители этого семейства не гомологичны представителям семейства σ70 и отличаются от последних в функциональном отношении. Эти сигма-факторы распространены широко, однако нерегулярно. В частности, они отсутствуют у грамположительных бактерий с высоким содержанием GC-nap, а также у цианобактерий.
Сигма-факторы семейства σ54 регулируют экспрессию большого числа генов с разнообразными функциями; в этом отношении они похожи на сигма-факторы семейства σ70. В частности, это ряд генов углеродного и азотного метаболизма; гены регуляторных, структурных и транспортных белков; гены дифференциации; гены хемотаксиса; гены вирулентности и т. д.
В аминокислотной последовательности сигма-факторов σ54 имеются:
— короткий консервативный N-концевой участок размером 25-50 а. о.;
— короткий вариабельный срединный участок размером 60-100 а. о.;
— длинный С-концевой участок размером 400 а.о., который, в свою очередь, подразделяется на: (1) X-линкер, связывающийся с ДНК; (2) область, или мотив «спираль-шпилька-спираль» (англ. helixturn-helix, НТН), образующую изгиб, и (3) консервативный RpoN-бокс, участвующий в распознавании промотора.
Способ инициации транскрипции голоферментом, в состав которого входят сигма-факторы семейства σ54, отличается от способа инициации транскрипции с участием сигма-факторов семействаσ70. Все известные промоторы, распознаваемые первыми, нуждаются в активаторах транскрипции (см. раздел 16.7.1), тогда как инициация транскрипции с использованием вторых в большинстве случаев обходится без активаторов.
Активаторный белок связывается с энхансером, расположенным на расстоянии >100 п. н. левее стартовой точки транскрипции (+1). При этом, как и в случае эукариотных РНК-полимераз, расходуется энергия АТФ.
К числу RpoN-активаторов, в частности, относятся: белок NtrC (контроль диазотрофии у Klebsiella pneumoniae), белок DctD (контроль транспорта дикарбоксилатов у Rhizobium spp.), белок FhlA (контроль форматного регулона Е. coli) и белок XylR (контроль деградации ароматических соединений у P. putida).
18.1.1.2. Антисигма-факторы и анти-антисигма-факторы
Антисигма-фактором называется белок, который косвенно регулирует транскрипцию путем взаимодействия с «родственным» сигма-фактором, что приводит к инактивации последнего (примерами служат пары сигма-фактор σ28/антисигма- фактор FlgM, сигма-фактор σF/антисигма-фактор SpoIIAB, сигма-фактор σЕ/антисигма-фактор RseA и др.).
Образование комплекса носит обратимый характер, и сигма-фактор инактивируется до тех пор, пока он снова не понадобится для транскрипции.
В частности, у пурпурной бактерии Rhodobacter sphaeroides альтернативный сигма-фактор σЕ из подгруппы 3.2 отвечает за адаптивную транскрипцию генов в ответ на присутствие агента окислительного стресса — синглетного кислорода 1O2 (см. раздел 19.1.6).
Без стресса этот сигма-фактор находится в неактивном состоянии в комплексе с антисигма- фактором ChrR, который относится к «цинковому» семейству антисигм (англ. zinc anti-sigmas, ZAS). В таких белках катион Zn2+координирует пару остатков Cys. Под воздействием синглетного кислорода цинк удаляется, образуется дисульфидный мостик, и конформация антисигма-фактора ChrR изменяется. В результате этого сигма-фактор σЕ освобождается из комплекса и запускает транскрипцию генов, продукты которых защищают бактерию от окислительного стресса.
В случае Salmonella entérica серовар Typhimurium антисигма-фактор FlgM регулирует активность своего собственного промотора. Пока происходит сборка базального тела и крюка жгутика, FlgM блокирует сигма-фактор σ28, в результате чего экспрессия гена флагеллина подавляется. По завершении сборки базального тела и крюка белок FlgM начинает экспортироваться по их общему внутреннему каналу, сигма-фактор σ28 освобождается из комплекса, и синтез флагеллина запускается вновь. После кэппирования нити (см. I том учебника) FlgM перестает экспортироваться и опять связывается с σ28, что в очередной раз приводит к блокированию транскрипции гена флагеллина.
В отличие от сигма-факторов, антисигма-факторы широко варьируют по первичной и вторичной структуре. Благодаря этому они могут реагировать на разнообразные стимулы и участвовать в разных регуляторных механизмах.
Антисигма-факторы, в свою очередь, регулируются анти-антисигма-факторами. В качестве примера можно привести происходящую в ходе спорогенеза регуляцию раннего сигма-фактора σF тандемом антисигма-фактор Spo0IIAB/анти-антисигма- фактор SpoIIAA (см. раздел 17.5.2.2).
18.1.1.3. Транскрипционные факторы
Транскрипционные факторы (англ, transcription factor, TF) — это ДНК-связывающие белки с регуляторной функцией. Они активируют или репрессируют взаимодействие между промоторами и сигма-факторами РНК-полимеразы. Франсуа Жакоб метко назвал их «двуглавыми» молекулами, на том основании, что они содержат два функциональных сайта:
— ДНК-связывающий сайт, обладающий сродством к специфической нуклеотидной последовательности, которая находится за пределами промотора или частично перекрывается с промотором;
— аллостерический сайт, который не ковалентно взаимодействует с субстратом- лигандом или модифицируется ферментативным путем.
В некоторых случаях под воздействием лиганда изменяются редокс-состояние и способность TF образовывать мультимерные комплексы, что также влияет на сродство TF к специфическим сайтам ДНК.
TF изменяют экспрессию генов на стадии инициации транскрипции. Большинство TF-активаторов непосредственно взаимодействует с РНК-полимеразой, что рекрутирует ее в область промотора-мишени; характерным примером являются белки CRP — рецепторы 3',5'-цикло-АМФ (см. раздел 16.7.1.1). Реже используется альтернативный механизм, когда TF-активатор влияет не на конформацию ДНК-полиме- разы, а изменяет конформацию промоторного участка, в результате чего последний лучше распознается РНК-полимеразой (примером служат TF из семейства MerR). Для TF, активирующих σ70-зависимые промоторы, область связывания с ДНК имеет координату от -30 до -80, в то время как для TF, активирующих σ54-зависимые промоторы -от -100 до -1000 или еще дальше от старта транскрипции.
Под контролем TF находятся гены, которые кодируют продукты, имеющие отношение к разным структурам и процессам. Тем не менее, взаимное влияние TF на «чужие» промоторы позволяет ко регулировать экспрессию разных оперонов. В свою очередь, согласованное изменение паттерна транскрипции обеспечивает адаптационный характер клеточного ответа.
Число разновидностей TF у конкретного вида бактерий может быть очень большим. Например, из 4,4 тыс открытых рамок считывания Е. coli около 300 (8%) представляют собой известные или предполагаемые TF. Относительно немногие их них контролируют уровень экспрессии 50% идентифицированных генов (CRP — 197 генов, IHF — 101, FNR — 111, Fis — 76, NarL — 65, АгсА — 63, Lrp — 53).
Информация о регуляторной сети, контролирующей транскрипцию Е. coli в разных физиологических условиях, в том числе информация об организации оперонов и регулонов, а также о TF содержится в базе данных RegulonDB (http://regulondb.ccg.unam.mx/).
Важнейшие стимулы, воздействующие на структуру TF, или глобальные регуляторы вызывают комплексный, или плейотпроппый фенотипический ответ (от греч. pleio — множественный и tropos — направление). Они регулируют опероны, отвечающие за разные клеточные системы и метаболические пути, за исключением незаменимых. Поскольку опероны регулона содержат одинаковый регуляторный элемент, часто называемый «боксом», использование TF позволяет контролировать совместную экспрессию многочисленных генов и оперонов.
«Эндогенные» и «экзогенные» транскрипционные факторы. TF могут отвечать на регуляторные стимулы эндогенного или экзогенного происхождения. В первом случае говорят об «эндогенных» TF, во втором случае — об «экзогенных» TF.
«Эндогенные» TF. На внутренние стимулы непосредственно реагируют примерно 25% TF. Они активируются в результате связывания лигандов, которые представляет собой эндогенные метаболиты (хотя в отдельных случаях такой метаболит импортируется из окружающей среды, а не образуется внутри клетки). Иными словами, стимулом служит малая молекула, которая синтезируется цитозольными ферментами и является индикатором физиологического состояния клетки.
Эндогенный метаболит, который образуется в ответ на внешние сигналы, может использоваться как источник энергии, а также в качестве коэнзима или индикатора метаболического стресса. Например, фруктозо-1,6-бисфосфат связывается с транскрипционным фактором FruR, который регулирует экспрессию генов, отвечающих за метаболизм углеводов.
«Экзогенные» TF. На внешние стимулы непосредственно реагируют примерно 75% TF. Внешний сигнал может поступать на TF двумя способами.
В первом случае клетка импортирует субстрат, который либо используется в качестве источника энергии и/или строительного материала, либо не метаболизируется, а только служит индикатором физико-химического состояния окружающей среды. Как правило, TF регулирует метаболический путь, в котором участвует данный субстрат; примером служит транскрипционный фактор Lac, репрессор лактозного оперона. Субстрат непосредственно связывается с TF (в отсутствии субстрата это может делать соответствующий транспортер). Например, мальтопермеаза MalY взаимодействует с транскрипционным фактором МаIТ.
Во втором случае субстрат не импортируется, а воспринимается сенсором двухкомпонентной сигнальной системы, расположенным в СМ.
Однокомпонентные и двухкомпонентные сигнальные системы. Как уже отмечалось, регуляторный путь при транскрипции начинается с сигнала, который появляется в результате взаимодействия стимула с сенсором (рис. 248). Этот сигнал передается на оперон-мишень с помощью однокомпонентной или двухкомпонентной сигнальной системы.
Однокомпонентные сигнальные системы. Более простые однокомпонентные сигнальные системы представляют собой молекулярный гибрид сенсора и регулятора. Обе функции выполняет TF; под воздействием стимула он изменяет свою конформацию и, как правило, переходит в активную гомомультимерную форму, обладающую сродством к специфическим сайтам ДНК, или «боксам».
Двухкомпонентные сигнальные системы. Более сложные по устройству двухкомпонентные сигнальные системы состоят из двух молекул — сенсора и регулятора (последним, как и в случае однокомпонентной сигнальной системы, служит TF). Их гены обычно входят в состав одного оперона.
Широко распространенные у прокариотов двухкомпонентные сигнальные системы (англ. two-component system, TCS) обеспечивают специфические адаптивные ответы на конкретный внешний стимул, чаще всего на определенное вещество — главным образом, путем изменения паттерна транскрипции. Они также встречаются у некоторых протистов, грибов и растений.
В составе >150 секвенированных к настоящему времени прокариотных геномов выявлены гены, кодирующие белки ~4 тыс двухкомпонентных сигнальных систем. У одной только Е. coli К-12 их 29; среди них наиболее известна система EnvZ/OmpR, реагирующая на изменение осмомолярности окружающей среды, а также системы NtrB/NtrC и PhoB/PhoR, реагирующие, соответственно, на дефицит источника азота и неорганического фосфора.
С увеличением размера генома растет и число закодированных в нем двухкомпонентных сигнальных систем. В частности, у свободноживущих бактерий, адаптированных к вариабельной среде, их больше, чем у обитателей гомеостатических сред, в особенности у (не)паразитических эндоцитобионтов. Некоторые облигатные паразиты, например, Mycoplasma genitalium, их вообще не имеют.
В состав двухкомпонентной сигнальной системы входят:
— сенсор (синонимы: проводник сигнала, «сенсорная» гистидинкиназа), т. е. мембраносвязанный или растворимый белок, который воспринимает стимул и преобразует его в сигнал;
— регулятор (синоним: регулятор ответа), обычно транскрипционный фактор, который получает сигнал от сенсора и индуцирует специфический ответ на уровне экспрессии генов.
Стимулом для сенсора является специфическое изменение в состоянии внешней или внутриклеточной среды. Сигналом для регулятора служит фосфорильная группа, которую он получает от сенсора.
Под воздействием стимула сенсор, обладающий АТФ-зависимой киназной активностью, автофосфорилируется по остатку His. Затем фосфорилированный сенсор трансфосфорилирует регулятор по остатку Asp. В итоге этого регулятор активируется, что позволяет ему позитивно или негативно влиять на экспрессию генов- мишеней.
Регуляторные белки могут активироваться в результате нековалентного связывания лиганда (примером служат активаторы транскрипции CRP-белки; см. раздел 16.7.1.1) или в результате ковалентной модификации, обычно путем ферментативного фосфорилирования. Катализатором этой реакции служат переносчики фосфорильной группы — протеинкиназы.
«Прокариотные» протеинкиназы, в частности играющие роль сенсоров в двухкомпонентных сигнальных системах, принадлежат к семейству гистидинкиназ. Используя АТФ, они фосфорилируют собственные остатки His с образованием фосфоамидной связи (рис. 250, А).
Рис. 250. Реакции, катализируемые прокариотными протеинкиназами. А — гистидинкиназная реакция; Б — фосфотрансферазная реакция.
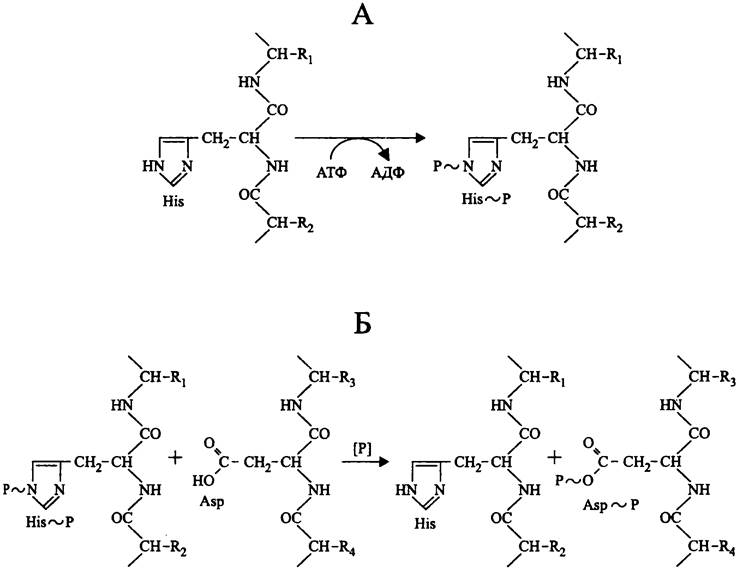
В отличие от сенсора, регулятор фосфорилируется не по остатку His, а по остатку Asp с образованием 3-ацилфосфата (рис. 250, Б). Донором фосфорильной группы в этой реакции служит сенсор.
His~P и Asp~P легко подвергаются ферментативному дефосфорилированию с помощью про- теинфосфатаз. Поскольку при этом сенсор и регулятор возвращаются в неактивную форму, сигнальный процесс замыкается петлей обратной связи.
Наряду с гистидинкиназами, у некоторых бактерий (Anabaena sp. РСС7120, Myxococcus xanthus и Streptomyces coelicolor) обнаружены «эукариотные» протеинкиназы — серин/треонинкиназы и тирозинкиназы. Их роль в прокариотных сигнальных системах пока еще не выяснена.
Белки двухкомпонентной сигнальной системы имеют доменное строение (рис. 251).
Рис. 251. Схема двухкомпонентной сигнальной системы. А — сенсор; Б — регулятор.
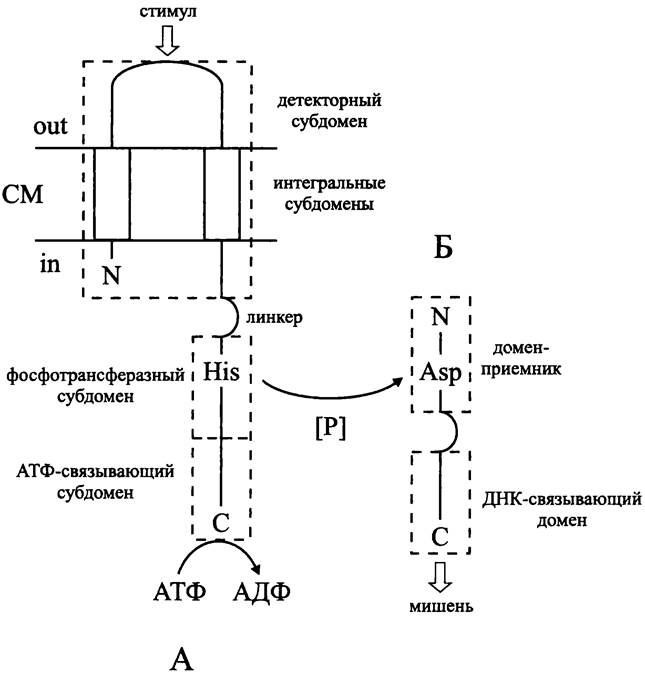
Сенсор — это чаще всего мембранный белок (рис. 251, А). Он состоит из N-концевого входного домена (англ. input domain), линкера и С-концевого автокиназного домена, или домена-передатчика (англ. transmitter domain). Входной домен включает в себя один или два интегральных субдомена и субдомен, расположенный на внешней поверхности СМ, который имеет вариабельную структуру и служит детектором специфического стимула. Домен-передатчик размером ~250 а. о. высококонсервативен и включает в себя АТФ-связывающий и фосфотрансферазный субдомены. Если фосфотрансферазных субдоменов несколько, то такая сенсорная киназа называется «гибридной». На ближайшем к линкеру конце фосфотрансферазного субдомена находится акцептор фосфорильной группы — высококонсервативный остаток His.
Мембранный сенсор обычно функционирует в форме димера. Под воздействием стимула конформация входных доменов изменяется; домены-передатчики сближаются, что активирует их протеинкиназную активность; в результате гидролиза АТФ происходит фосфорилирование остатка His.
Регулятор — это во всех случаях цитоплазматический белок (рис. 251, Б). Он состоит из N-концевого домена-приемника (англ. receiver domain) размером ~120 а. о., линкера и С-концевого выходного домена (англ. output domain), или «ДНК-связывающего» домена, который часто имеет характерную структуру типа НТН (см. выше). На N-конце домена-приемника расположен высококонсервативный остаток Asp, служащий акцептором фосфорильной группы. Выходной домен имеет вариабельную структуру и содержит сайты для связывания ДНК, а также регуляторные сайты для позитивного или негативного контроля транскрипции. В результате фосфорилирования домен-приемник перестает ингибировать выходной домен, который приобретает активную конформацию.
Существуют исключения из вышеописанной схемы. Входной домен мембранного сенсора может иметь несколько (до восьми) интегральных субдоменов. Известны случаи, когда детекторный домен расположен не на внешней, а на внутренней стороне СМ, например, у сенсора Аег (см. раздел 18.4.1.3). Наконец, сенсор может быть не только мембранным, но и цитоплазматическим белком — примером служит регуляторная система NtrB/NtrC (см. раздел 18.3.2.3).
Усложненным вариантом двухкомпонентной системы является фосфореле (англ. phosphorelay; от relay — эстафета). Как следует из названия, эта сигнальная система состоит более чем из двух компонентов. В дополнение к сенсору и регулятору имеются вторичный передатчик и вторичный приемник. Соответственно, фосфореле осуществляет несколько актов передачи фосфорильной группы по цепи His —> Asp —> His —> Asp.
Фосфореле могут состоять из одно-, двух- и мультидоменных белков, присутствующих в разных комбинациях. Канонический пример — фосфореле из одно- и двухдоменных белков, регулирующее клеточный цикл С. crescentus (см. раздел 17.1.4 и рис. 224), а также фосфореле, участвующее в контроле споруляции В. subtilis (см. раздел 17.5.2.2 и рис. 252). В свою очередь, примером фосфореле, в состав которого входит мультидоменный белок, или гибридная сенсорная киназа, является регуляторная система АrсВ/АrсА (см. раздел 18.3.1.2 и рис. 257).
Рис. 252. Фосфореле, участвующее в контроле споруляции В. subtilis.
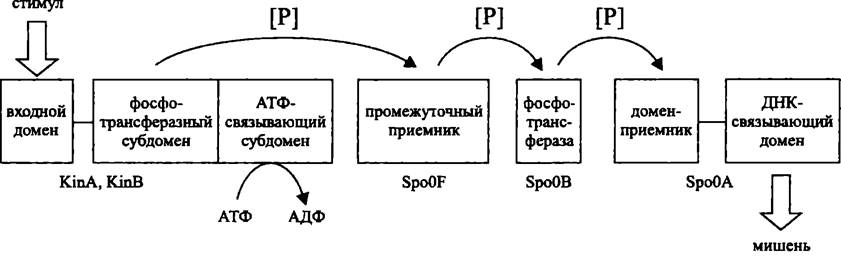
По сравнению с двухкомпонентной системой, фосфореле содержит больше звеньев для регуляции, в частности с участием протеинфосфатаз, что обеспечивает более высокую точность ответа. Поэтому у прокариотов фосфореле используются для контроля сложных онтогенетических феноменов, например, споруляции. Не удивительно также, что у ядерных организмов, с их более сложным поведением, все регуляторные системы на основе сенсора/регулятора представляют собой именно фосфореле.
Глобальные транскрипционные факторы. В соответствии с общим числом подконтрольных генов, ТF подразделяются на глобальные (~80%) и локальные (~20%). Первые могут модулировать экспрессию 10-200 генов, вторые — только 1-2 генов.
Глобальные ТF относятся к двум основным категориям: архитектурные белки и мастер-регуляторы (табл. 31). Архитектурные белки связываются с ДНК, не оказывая предпочтения специфическим сайтам, и влияют на общий паттерн транскрипции. Мастер-регуляторы распознают в ДНК специфические сайты и контролируют гены, продукты которых функционируют в определенном фенотипическом секторе.
Таблица 31. Глобальные транскрипционные факторы
Обозначение |
Фенотипический сектор для продуктов экспрессии контролируемых генов |
Распространение (среди изученных объектов) |
Архитектурные белки |
||
Fis, H-NS, IHF |
Общий паттерн транскрипции |
Е. coli |
Мастер-регуляторы |
||
Lrp |
Общий трофический статус |
Энтеробактерии |
CRP |
Энергетический статус |
Многие грамотрицательные и грамположительные бактерии |
FNR, NarL/NarP, ArcA |
(Ан)аэробный метаболизм |
Е. coli |
CepA, CodY |
Метаболизм углерода |
Firmicutes |
NtcA; NtrC |
Метаболизм азота |
Цианобактерии; энтеробактерии |
PhoB |
Фосфорное питание |
Е. coli |
Fur, DtxR |
Железный гомеостаз |
Многие грамотрицательные и грамположительные бактерии |
OxyR, SoxR |
Защита при окислительном стрессе |
Многие грамотрицательные и грамположительные бактерии |
MaR/SlyA |
Экстравертные защитные функции |
Некоторые патогенные бактерии и ряд архей |
Spo0A |
Спорогенез |
В. subtilis |
Глобальные ТF по-разному распространены в мире бактерий и представлены широким спектром типов и вариантов. Приведем важнейшие примеры (табл. 31).
Архитектурные белки Fis, H-NS и IHF. Многофункциональные ДНК-связывающие белки Fis, H-NS и IHF локально изгибают ДНК. Это конформационное изменение влияет на более высокий уровень пространственной упаковки ДНК — суперепирализацию, изменяет сродство РНК-полимеразы к промоторам и отражается на общем паттерне транскрипции.
Мастер-регулятор Lrp. С помощью однокомпонентного глобального регулятора Lrp общий трофический статус клетки воспринимается и корректируется в соответствии с концентрацией свободного лейцина, что позволяет провести комплексную метаболическую адаптацию к изменяющимся условиям питания (см. разделы 16.8 и 18.1.2).
Мастер-регулятор CRP. С помощью однокомпонентного глобального регулятора CRP энергетический статус клетки оценивается по концентрации 3'5'-цикло- АМФ, что позволяет адаптироваться к существованию в средах с разными источниками углерода (см. разделы 16.7.1.1 и 18.3.2).
Мастер-регуляторы FNR, NarL, NarP и ArcА. Однокомпонентный глобальный регулятор FNR, а также белки NarL, NarP и Arc А, которые входят в состав соответствующих двухкомпонентных сигначьных систем, определяют выбор дыхательных путей, что влияет на тип энергетики и обеспечивает адаптивный переход от существования в аэробной среде к существованию в анаэробной среде (см. раздел 18.3.1.2).
Мастер-регуляторы СерА и CodY. Однокомпонентный глобальный регулятор СсрА контролирует механизм углеродной катаболитной репрессии у Firmicutes (см. раздел 18.3.2.2). В свою очередь, у всех Firmicutes за исключением микоплазм существует однокомпонентный мастер-регулятор CodY. Он контролирует гены биосинтеза разветвленных жирных кислот, гены утилизации источников углерода, а также гены, ответственные за такие функции, как генетическая компетентность, споруляция и вирулентность.
Мастер-регуляторы NtcA и NtrC. Однокомпонентный глобальный регулятор азотного метаболизма NtcA контролирует гены цианобактерий, отвечающие за транспорт и восстановление нитрата, ассимиляцию аммония, дифференциацию гетероцист и диазотрофию (см. раздел 17.5.1.2). В случае энтеробактерий роль регулятора выполняет транскрипционный фактор NtrC, входящий в состав двухкомпонентной сигнальной системы (см. раздел 18.3.2.3).
Мастер-регулятор PhoB. Глобальный регулятор PhoB, входящий в состав двухкомпонентной сигнальной системы PhoR/PhoB, контролирует экспрессию генов, отвечающих за фосфорное питание Е. coli, в частности за транспортные системы. Аналогичную роль у грамположительных бактерий, прежде всего В. subtilis, выполняет мастер-регулятор PhoR (не путать с регулятором PhoR энтеробактерий; см. раздел 18.3.2.4).
Мастер-регуляторы Fur и DtxR. Однокомпонентные глобальные регуляторы железного гомеостаза Fur и DtxR контролируют импорт, запасание и внутриклеточную концентрацию железа, а также регулируют использование железа в метаболизме (см. раздел 18.3.2.5).
Мастер-регуляторы OxyR и SoxR. Однокомпонентный глобальный регулятор OxyR и сенсор SoxR, входящий в состав двухкомпонентной сигнальной системы SoxR/SoxS, контролируют систему защиты при окислительном стрессе (см. раздел 19.6.1.2) .
Мастер-регуляторы MarR/SlyA. Представители семейства MarR/SlyA (сокр. англ. multiple antibiotic resistance/screen for cytolysins) контролируют широкий спектр экстравертных защитных функций у патогенных вибрионов (V. cholerae), псевдомонад и родственных им бактерий (Р. aeruginosa, Erwinia chrysanthemi и др.), а также у стафилококков (S. aureus) и энтеробактерий (Е. coli, Salmonella entérica серовар Typhimurium, Yersinia enterocolitica и др.).
Белки MarR/SlyA (в настоящее время известно более 300 членов этого семейства у 45 видов бактерий и 13 видов архей) контролируют устойчивость к хозяйским иммунным системам, вирулентность, рецепцию фенольных аттрактантов и ряд других биологических функций. Гены, находящиеся под контролем транскрипционных регуляторов MarR/SlyA, кодируют мембранные, периплазматические или секретируемые белки, многие из которых служат факторами вирулентности или факторами устойчивости к антибиотикам и другим антимикробным агентам.
Мастер-регулятор Spo0A. Глобальный регулятор Spo0A, входящий в состав фосфореле, играет ключевую роль на ранних этапах споруляции (см. раздел17.5.2.2) .
Авторегуляция TF. Выступая в роли регуляторов транскрипции, TF сами регулируются на транскрипционном уровне. Это достигается с помощью механизма авторегуляции гена (англ. autoregulation). В данном случае продукт структурного гена контролирует экспрессию самого этого гена. Иными словами, авторегулируемый белок напрямую влияет на уровень собственного биосинтеза, взаимодействуя со своим регуляторным участком.
Авторегуляция принципиально отличается от непрямого транскрипционного контроля, который осуществляется с помощью белков, воздействующих на чужой регуляторный участок, в том числе, с привлечением эндогенного или экзогенного индуктора, или корепрессора.
Каноническим примером авторегуляции служит ![]() репрессор в лизогенизированных клетках Е. coli. Этот TF кодируется геном cl. За счет позитивной регуляции
репрессор в лизогенизированных клетках Е. coli. Этот TF кодируется геном cl. За счет позитивной регуляции![]() репрессор образуется в концентрации, предотвращающей индукцию профага. За счет негативной регуляции λ-репрессор образуется в недостаточном количестве, и происходит индукция профага.
репрессор образуется в концентрации, предотвращающей индукцию профага. За счет негативной регуляции λ-репрессор образуется в недостаточном количестве, и происходит индукция профага.
Ген сI транскрибируется с промотора PM- Белок сI имеет разное сродство к регуляторным сайтам oR1, oR2 и оR3 (оR1 >oR2 >oR3), расположенным в upstream-положении от оператора фага лямбда. При связывании с сайтом OR2 белок cl позитивно влияет на транскрипцию собственного гена; при связывании с сайтом оR3 влияние становится негативным. Таким образом, внутриклеточная концентрация белка cl контролируется в результате «оттитровывания» им регуляторных сайтов ДНК.
Транскрипционные факторы архей. Ранее мы уже отмечали, что транскрипция архей имеет мозаичную природу (см. раздел 16.7.3).
С одной стороны, используется фермент эукариотного типа, состоящий из не менее чем 10 субъединиц, высокогомологичных таковым у эукариотов, причем субъединицы DLNPобразуют четвертичный субкомплекс, эквивалентный субкомплексу Rpb3-Rpb10-Rpb11-Rpb12 эукариотных РНК-полимераз I и III, а субъединицы EF образуют гетеродимер, соответствующий гетеродимеру Rpb4-Rpb7.
С другой стороны, используется регуляторный механизм бактериального типа, когда промоторы распознает РНК-полимераза в комплексе со специфическими транскрипционными факторами.
Для транскрипции с археотных промоторов минимально необходимы два транскрипционных фактора, соответственно, распознающие два промоторных элемента. Это белок ТВР, который связывается с ТАТА-боксом, и белок TFB, распознающий BRE-элемент (см. раздел 16.7.3). Они гомологичны, соответственно, эукариотным транскрипционным факторам ТВР и TFIIB.
У эукариотов существуют дополнительные транскрипционные факторы (англ. transcriptional associated factor, TAF), которые совместно с ТВР и TFIIB предварительно распознают промотор, а затем рекрутируют РНК-полимеразу. Хотя у архей ТАР' отсутствуют, рекрутирование РНК- полимеразы у них происходит тем же способом, что и у эукариотов.
Поскольку у некоторых архей обнаружены множественные гомологи транскрипционных факторов ТFЗ и/или ТВР, есть предположение, что регуляция транскрипции основывается на их избирательном использовании. Иными словами, разные ТFB могут распознавать разные ВRЕ-элементы, что позволяет осуществлять выбор промоторов. Однако ограниченного числа изоформ минимально необходимого аппарата транскрипции недостаточно для того, чтобы удовлетворить все регуляторные потребности клетки.
Проблему отчасти решает то, что у архей найдены гомологи глобальных транскрипционных Lгр-факторов бактерий — Sа-Lгр и Lrs14 (см. ниже), а также транскрипционный фактор Тfх, который, в числе прочего, активирует у
Меthanobacterium thermoautotrophicum N-формил-МF-дегидрогеназу (см. II том учебника).
18.1.2. Регулоны
Поскольку количество регулонов и, соответственно, мастер-регуляторов очень велико, а подконтрольные им гены отвечают за широкий спектр не родственных функций, мы остановимся только на важнейших примерах.
Регулон ответа при общем стрессе, или регулон стационарной фазы (регулон RроS). Задержка роста, вызванная внешним лимитированием по какому- нибудь субстрату, еще не означает переход к стационарной фазе (см. раздел 21.1.1). Напротив, с помощью таких глобальных регуляторов, как CRP, Lrp, Ntr и Pho индуцируются альтернативные метаболические системы, что позволяет продолжить рост в изменившихся трофических условиях.
Иное дело — экстремальное стрессовое воздействие, в частности полное голодание по незаменимому элементу питания, что вызывает переход от фазы роста к ранней стационарной фазе. Этот процесс высокоорганизован и связан с глубокими физиологическими изменениями отдельной клетки и популяции в целом (см. главу 21).
При вхождении Е. coli или других энтеробактерий в стационарную фазу, а также при голодании по питательным субстратам индуцируется ответ при общем стрессе (англ. general stressresponse). Он осуществляется с помощью регулона RpoS, состоящего из 50-200 генов.
Мастер-регулятором в регулоне RpoS служит сигма-фактор σ38, или crs (сокр. англ. stationary или starvation). Он также известен, как ДНК-связывающий белок RpoS (от сокр. англ. RNApolymerase), или ДНК-связывающий белок KatF (от сокр. нем. Katalase); встречаются и другие обозначения.
Сигма-фактор σS принадлежит к группе 2 сигма-факторов, подгруппе 2.1 (табл. 30). Он характеризуется высокой степенью гомологии с первичным сигма- фактором σ70, однако распознает другую консенсусную последовательность в положении -10, а консенсусная последовательность в положении -35 у него дегенерирована (см. раздел 18.1.1.1).
Белок σS (RpoS) не только позитивно контролирует гены в стационарной фазе и негативно контролирует гены в фазе экспоненциального роста; он сам регулируется на транскрипционном уровне — его ген (rpoS) индуцируется в начале стационарной фазы. Наряду с дефицитом питательных субстратов и голоданием, ответ при общем стрессе провоцируется резким снижением скорости роста, экстремальным изменением температуры, высокой кислотностью, высоким осмотическим давлением среды и т. д. В силу пестроты факторов общего стресса природа первичного сигната для регуляции транскрипции гена rpoS еще не установлена.
Регуляция внутриклеточной концентрации белка RроS происходит в основном на посттранскрипционном уровне (см. раздел 18.2). Стимулятором трансляции rpoS-мРНК служит ДНК-связывающий белок НU, а ингибитором — ДНК-связывающий белок Н-Ns. Трансляции rроS-мРНК способствует белок Hfgq (см. раздел 18.2.2), который расплавляет шпильку, препятствующую взаимодействию этой мРНК с рибосомой, а также малые РНК (см. там же).
Негативный контроль концентрации белка ProS осуществляет индуцибельная протеаза СIрХР, входящая в состав протеасомы (см. I том учебника). Таргетинг RрS производит «распознающий» фактор RssВ.
Максимальное количество белка, RроS (σS) составляет не более 30% первичного сигма-фактора σ70, и он имеет меньшее сродство к РНК-полимеразе. Поэтому, чтобы обеспечить надежность рекрутирования голокомплекса ЕσS, используется антисигма-фактор Rsd, который образуется при вступлении в стационарную фазу и связывается с сигма-фактором σ70. Дополнительное конкурентное преимущество для σS создает алармон (р)ррGрр, образующийся при аминокислотном голодании (см. раздел 18.1.4). Кроме того, малая 6S РНК, которая накапливается в стационарной фазе (см. раздел 18.2.2), связывается с голокомплексом Еσ70, что блокирует его транскрипционную активность, создавая преимущество для голокомплекса ЕσS.
Как уже отмечалось, голокомплекс Ects транскрибирует множество генов, необходимых бактериям для существования не только в условиях голодании, но и при других стрессах. В частности, белок RpoS контролирует экспрессию генов устойчивости против:
— ультрафиолетового излучения (см. раздел 16.5.1.2);
— окислительного стресса (см. раздел 19.1.6);
— теплового шока (19.1.1);
— гиперосмотического стресса (19.1.3);
— кислотного стресса (см. раздел 19.1.7);
— химических повреждающих агентов, например, этанола (см. раздел 19.1.8).
В регулон RpoS также входят «морфологические» гены, в частности ген bolА (отвечает за сферическую форму Е. coli в стационарной фазе) и ген glgS (участвует в синтезе запасного полиглюкозида).
Одним из элементов ответа при общем стрессе является увеличение скорости спонтанного мутирования (см. раздел 16.6.1.1). После того, как ДНК-полимераза III покинула блокированную репликационную вилку, ее работу продолжает «склонная к ошибкам» ДНК-полимераза Pol IV (через 10 ч после вхождения Е. coli в стационарную фазу ее количество возрастает почти втрое). Поскольку ДНК-полимераза Pol IV нестабильна, требуется непрерывная транскрипция ее гена (dinB) под контролем белка RpoS.
Наряду с активацией гена dinB, белок RpoS негативно регулирует белки MutS и MutH, ответственные за репарацию ошибок спаривания (см. раздел 16.5.1.3).
Важно отметить, что с помощью регулона ответа при общем стрессе приобретается устойчивость при «частных» стрессах, что связано с индукцией специфических регулонов и стимулонов. Например, клетки Е. coli в стационарной фазе становятся устойчивыми к коротковолновому ультрафиолетовому излучению (300-400 нм), тепловому шоку (> 50°С), пероксиду водорода, а также Nad в высокой концентрации (> 2,5М).
Устойчивость к ультрафиолетовому излучению связана с активацией системы эксцизионной репарации, в которой участвует экзонуклеаза III (экспрессия ее гена xthA контролируется белком RpoS).
Терморезистентность в данном случае не связана с образованием альтернативного сигма-фактора σ32 (ген гроН) и синтезом белков теплового шока, а зависит от накопления трегалозы (О-α-D-глюкозил(1-1)-α-D-глюкозида), стабилизирующей мембраны за счет связывания с полярными группами липидов. Гены otsAB, отвечающие за синтез этого дисахарида, находятся под контролем мастер-регулятора Rpo. В свою очередь, защита от окислительного стресса в стационарной фазе связана с таким компонентом Rpo-регулона, как ген katE (который кодирует цитоплазматическую каталазу НРН). Интересно, что ген katG, кодирующий периплазматическую каталазу HPI, принадлежит к другому регулону — oxyR,который индуцируется при окислительном стрессе. Наконец, защита от осмотического стресса, как и терморезистентность, связана с накоплением трегалозы; последняя в данном случае выступает в качестве осмопротектора.
Важно подчеркнуть, что при общем стрессе защита от «частных» стрессов не индуцируется конкретной стрессовой ситуацией, а косвенно приобретается в условиях субстратного голодания. Это логично, поскольку в случае потребности в соответствующих системах их синтез в голодных условиях оказался бы невозможным. Таким образом, генерализованный ответ при общем стрессе не только имеет комбинированную природу, но и носит превентивный характер.
Регулон ответа на лейцин (регулон Lrp). Этот регулон представляет собой группу генов, которая находится под контролем глобального транскрипционного фактора Lrp (сокр. англ. leucine-responsive regulatory protein).
В качестве «двуглавого» белка (ДНК-связывающего и L-лейцин-связывающего) транскрипционный фактор Lrp интегрирует транскрипцию, прежде всего, с лейцин- зависимых промоторов. Хотя в общем случае лейцин или его производные выполняют роль аллостерического эффектора, часть промоторов Lrp-регулона контролируется свободным белком Lrp.
Lrp представляет собой катионный гомодимерный белок (2 x 18,8 кДа). Он высококонсервативен — его гомология у разных энтеробактерий составляет не менее 90% (гомология между геном lrp у Е. coli и его ортологом bkdR у Pseudomonas spp. также достаточно высока и составляет 36%). Это свидетельствует о важной роли белка Lrp в управлении метаболизмом, в первую очередь, путем контроля генов, экспрессия которых регулируется лейцином. В то же время высокое содержание этого белка (3-103 молекул на клетку), а также его способность изгибать ДНК указывают на то, что он дополнительно служит одним из структурных организаторов бактериальной хромосомы.
Как и другие TF, белок Lrp авторегулируется.
Физиологическая логика лейциновой «зависимости» белка Lrp становится понятной, если рассмотреть паттерн его регуляторного действия. В качестве глобального TF он служит активатором до 20 оперонов и репрессором до 10 оперонов Е. coli. К ним, в частности, относятся:
— «биосинтетические» опероны gcvTHP (биосинтез С1-блока N-метилен- Н4фолата), gltBDF (биосинтез глутамата), glyA (биосинтез глицина), ilvIH (биосинтез изолейцина и валина), leuABCD (биосинтез лейцина), lysU (лизил-тРНК- синтетаза), pntAB (НАДФН/НАД-трансгидрогеназа) и serA (биосинтез серина);
— «катаболитные» опероны kbl-tdh (расщепление треонина), lacZ (Дгалактозидаза), и sdaA (дезаминаза L-серина);
— «транспортные» опероны HvJ и livKHMGF (транспорт лейцина); malEFG, malK-lamB-malM и malT (транспорт мальтозы); oppA-D (транспорт олигопептидов) и ompC/ompF (порины);
— «фимбриевые» опероны daaA-E, fae, fanABC, firnB, рарАВ и sfaA\
— «осмосенсорный» оперон osmY.
Таким образом, мастер-регулятор Lrp перенастраивает генеральный метаболизм при обратимом переходе от благоприятного трофического состояния к голоданию (англ. feast-or-famine).
Регулон SOS-ответа (регулон SOS). В отличие от регулона Lrp, в состав которого входят гены домашнего хозяйства, регулон SOS в первую очередь включает в себя информационные гены. Он индуцируется повреждением ДНК, путем репарации предотвращает летальные последствия этого повреждения и сводит к минимуму его мутагенные последствия (см. также раздел 16.5.1.4 и табл. 23). Тем не менее, специфика индуцируемых при SOS-ответе репарационных систем такова, что в данном случае неизбежно происходит мутагенез, в том числе имеющий адаптивное значение (см. разделы 16.5.1.4 и 16.6.1.1).
В качестве агентов, повреждающих ДНК, выступают такие гетерогенные факторы, как ультрафиолетовое излучение, ионизирующая радиация, высокое гидростатическое давление, антибиотики (в частности, налидиксовая кислота — ингибитор ДНК-гиразы) и т. д. В то же время SOS-ответ не обязательно вызывается экзогенными агентами, повреждающими ДНК. Его стимулом могут быть и эндогенные метаболиты, а также нерепарированные ошибки репликации, сегрегации сестринских хромосом или рекомбинации. Наконец, причиной SOS-ответа может стать уменьшение концентрации репрессора транскрипции — белка LexA (см. ниже), вызванное неблагоприятными условиями роста.
Повреждение ДНК блокирует репликацию, что при неэффективной репарации представляет смертельную угрозу. Чтобы избежать ее (отсюда и происходит образное название — «SOS-ответ») многие прокариоты, в частности Е. coli, используют координированную систему экспрессии генов, отвечающих, в первую очередь, за репарацию ДНК, а также за репликацию хромосомы и клеточное деление.
Индукторами SOS-регулона Е. coli являются два белка — многофункциональный ДНК-связывающий белок RecA (см. раздел 16.6.1.2) и репрессор транскрипции LexA.
Важно отметить, что сигналом, индуцирующим SOS-ответ в клетках с одно- или двухцепочечным повреждением ДНК, является не повреждение как таковое, а связанное с ним нарушение нормальной репликации. Дело в том, что при репликации «поверх повреждения» или вследствие распада репликационной вилки, наталкивающейся на повреждение, образуются одноцепочечные участки ДНК (ssДНК; см. раздел 16.5.1.4). Свободный белок RecA распознает их, активируется за счет энергии АТФ (RecA —> RecA*) и образует нуклеопротеиновый комплекс. Свободный белок LexA, в свою очередь, распознает спиральную борозду в филаменте ssДНК/RесА*, в результате чего образуется тройственный комплекс ssДНК/RесА*/LехА. Белок RecA* играет в нем роль аллостерического кофактора и стимулирует процессинг белка LexA, который в данном случае выступает в роли сериновой протеазы (остатки Ser-119 и Lys-156 в активном центре). В ходе автопротеолиза белка LexA (22 кДа) расщепляется пептидная связь между остатками Аlа-84 и Gly-85 в петлевом домене, который расположен между N-концевым доменом, ответственным за связывание с ДНК, и С-концевым доменом, отвечающим за образование функционально активных олигомеров. В результате этого содержание репрессора Lex, способного распознавать промоторные/операторные участки подконтрольных ему оперонов, снижается, что активирует транскрипцию.
При взаимодействии с белком RecA* происходит автопротеолиз еще одного белка — UmuD с образованием его активной формы (UmuD)' (рис. 253), которая в составе комплекса «склонной к ошибкам» ДНК-полимеразы Pol V участвует в «мутагенной» репарации (см. разделы 16.5.1.4 и 16.6.1.1).
Рис. 253. Участие белков RecА и LехА в индукции Sos-ответа. Острые стрелки — активация; тупые стрелки — блокирование.
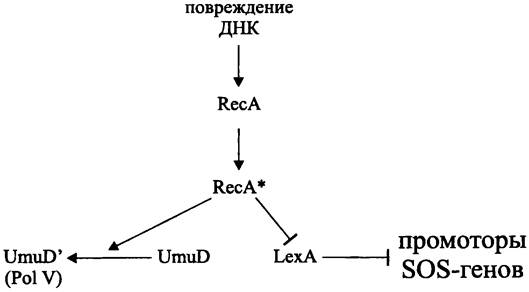
Таким образом, стимулом для регулона SOS-ответа служат агенты, повреждающие ДНК, сенсором-ДНК, сигналом — однонитевые участки ДНК. Белок RecA является проводником сигнала, а белок LexA — мастер-регулятором.
Благодаря инактивации репрессора LexA дерепрессируются гены SOS-регулона, многие из которых кодируют ферменты, отвечающие за репарацию, рекомбинацию и репликацию, в том числе за репликацию «поверх повреждения».
Глобальная система SOS-ответа существует не только у Е. coli, хотя она наиболее изучена именно у этой бактерии.
У многих грамотрицательных и грамположительных бактерий, а также у архей имеются гомологи белка RecA. Примечательно, что они также найдены у эукариотов — от дрожжей до Н. sapiens. Например, у S. cerevisiae это белки Rad51p, Rad55p, Rad57p и Dmc1p (первый из них способствует устранению двухцепочечных разрывов ДНК, а также участвует в митотической и мейотической рекомбинации).
LexA-подобные белки обнаружены у представителей 20 родов грамотрицательных и грамположительных бактерий, в частности, это белок DinR В. sub filis (23 кДа).
В случае Е. coli в состав регулона SOS входят до 30 несцепленных генов, в том числе гены гесА и lexА. Половина из них обозначается как гены din (сокр. англ. damage inducible), причем их конкретная функция часто неизвестна.
Большинство SOS-зависимых генов имеет прямое отношение к репарации ДНК:
— гены uvrAB (кодируют субъединицы эксцизионной эндонуклеазы; см. раздел 16.5.1.2);
— ген uvrD (кодирует ДНК-геликазу II, участвующую в эксцизионной репарации и репарации ошибок спаривания; см. разделы 16.5.1.2 и 16.5.1.3);
— гены ruvAB (кодируют компоненты резольвасомы, осуществляющей гомологическую рекомбинацию, в частности при рекомбинационной репарации; см. разделы 16.5.1.4 и 16.6.1.2);
— ген recN (кодирует белок RecN, участвующий в рекомбинационной репарации; см. раздел 16.5.1.4);
— гены umuDC (кодируют субъединицы «склонной к ошибкам» ДНК-полимеразы Pol V; см. раздел 16.4.1.1);
— ген dinA/polB (кодирует ДНК-полимеразу Pol II, возможно, участвующую в репарации; см. раздел 16.4.1.1);
— ген ssb (кодирует белок SSB, связывающийся с однонитевой ДНК при репликации, рекомбинационной репарации и гомологической рекомбинации; см. разделы 16.4.1.1, 16. 5. 1. 4 и 16.6.1.2);
— ген sulA (кодирует белок SulA, предотвращающий деление, пока не завершится репликация; см. разделы 16.5.1.4 и 17.4.1).
Как уже отмечалось, мастер-регулятором регулона SOS является белок LexА, который связывается с консенсусной последовательностью 5'-TACTG(TA)5 CAGTA-3' (SOS-боксом). Хотя активный репрессор LexА перекрывает блоки -35 и -10 σ70-зависимых промоторов генов lexА, rесА и uvrB, его связь с операторами слаба, и поэтому базовый уровень транскрипции этих генов достаточно высок.
По мере того, как идет репарация повреждений с помощью белков SOS-системы, одноцепочечные участки ДНК исчезают, а с ними пропадает и сигнал для индукции этой системы. В результате SOS-ответ выключается, и гены SOS снова начинают репрессироваться белком LexА.
SOS-ответ может взаимодействовать с ответами при других стрессах (см. главу 19). Характер этого взаимодействия зависит от природы организма и типа стресса.
Например, в случае Е. coli голодание по фосфору, а также холодовой шок могут индуцировать гены, контролируемые белком LexA. Особо интересна связь элементов SOS-ответа и элементов ответа при тепловом шоке. В частности, белки теплового шока GroEL и GroES (см. ниже) участвуют в мутагенной репарации, обеспечивая фолдинг белка UmuC — компонента комплекса (UmuD)′2UmuC.
Регулон ответа при тепловом шоке (регулон Hsp). Под воздействием повышенной температуры в любом организме, от прокариотов до Н. sapiens, активируется на транскрипционном уровне синтез белков теплового шока (англ. heat shock protein, HSP). Они имеют высококонсервативную структуру и выполняют сходные функции у организмов самого разного происхождения.
Как следует из их названия, главным стимулом для активации транскрипции генов HSP служит повышение температуры. Например, в клетках Е. coli при температурном переходе 37° —> 45°С скорость синтеза белка теплового шока GroEL возрастает на порядок.
Однако синтез HSP может стимулироваться и при оптимальной температуре, в частности при токсическом стрессе — под воздействием денатурирующих реагентов (например, этанола); антибиотиков, влияющих на терминацию трансляции (например, пуромицина); аналогов аминокислот, вызывающих образование дефектных полипептидов (например, канаванина) и т. д. Кроме того, индукция регулона теплового шока может вызываться повреждением ДНК, окислительным стрессом, фаговой инфекцией, а также голоданием по источнику углерода или азота. Иными словами, индукция регулона теплового шока является ответом при общем стрессе.
Наконец, HSP образуются и в отсутствии стресса — правда, в меньшем количестве, и тогда они участвуют в физиологических процессах неповрежденной клетки.
Использование HSP лежит в основе защитно-адаптационного механизма, позволяющего избежать цитоплазматического стресса, т. е. вредных последствий накопления белков, правильная укладка которых не произошла в ходе трансляции или была нарушена из-за денатурации. Точнее сказать, HSP придают ненативным белкам правильную конфигурацию, т. е. участвуют в пострансляционном фолдинге при любой температуре, не обязательно стрессовой. Если же белок не поддается фолдингу или необратимо поврежден, HSP вызывают его деградацию. Соответственно, большинство HSP является либо шаперонами, либо АТФ-зависимыми протеазами (см. I том учебника).
HSP-шапероны. Шапероны обеспечивают фолдинг ненативных белков, т. е. придают им правильную трехмерную структуру. Они подразделяются на две группы.
К первой группе относятся шаперон GroES (10 кДа) и шаперон GroEL (57 кДа). Они кодируются опероном groESL и образуют шаперонинный комплекс, состоящий из 7 субъединиц шаперона GroES и 14 субъединиц шаперона GroEL (Gro — сокр. англ. growth; этот белок необходим для репликации фагов типа лямбда; Е — означает, что мутации gro- супрессируются мутацией по гену Е головки фага; L и S —сокр. англ. large и small, т. е. это большая и малая субъединицы комплекса (GroEL)14(GroES)7).
Ко второй группе относятся шапероны DnaK и DnaJ, которые кодируются дицистронным опероном dnaKJ, а также шаперон GrpE (сокр. англ. growth of phage; обозначение гена grpEпроисходит от мутации дтрЕ280, блокирующей репродукцию фага лямбда при любой температуре), который кодируется моноцистронным опероном grpE.
Шаперон DnaJ связывается с ненативным белком и передает его комплексу АТФ с шапероном DnaK (аналог эукариотного белка теплового шока Hsp70). В результате стимулирования АТФазной активности шаперона DnaK шапероном DnaJ образуется прочный тройственный комплекс DnaJ/DnaK-АДФ/ненативный белок. Шаперон GrpE вызывает диссоциацию этого комплекса, в результате чего ненативный белок либо самостоятельно приобретает правильную укладку, либо передается шаперонину (GroEL)14 (GroES)7 (см. I том учебника).
HSP-протеазы. Если ненативный белок не поддается фолдингу, то он в развернутой форме поступает от комплекса шаперонов DnaJ/DnaK/GrpE к другим функционально специализированным HSP — протеазам. Для работы этих протеаз необходима энергия гидролиза АТФ, и поэтому их называют «АТФ-зависимыми» протеазами.
Наиболее изучена АТФ-зависимая протеаза Lon, которая расщепляет ненативные белки, а также нестабильные белки как чужеродного, так и собственного происхождения. В частности, она вызывает протеолиз антитерминатора N фага лямбда (отсюда ее обозначение; см. раздел 17.2.2) или протеолиз ингибитора клеточного деления SulA (см. раздел 17.4.1). В деградации ненативных белков также участвует протеаза СIрА (сокр. англ. caseinolytic protease), состоящая из каталитической субъединицы СIрР, АТФазной субъединицы СIрА и регуляторной субъединицы ClpB (см. I том учебника).
Большинство генов белков теплового шока Е. coli (~30) входит в главный регу- лон теплового шока этой бактерии, или регулон Hsp. Он позитивно контролируется альтернативным сигма-фактором σ32/RpoH (ген rроН).
Белок RpoH используется для распознавания специфических промоторов, и его содержание критично для транскрипции генов теплового шока. Концентрация белка RpoH регулируется на уровне транскрипции гена rроН, на уровне трансляции мРНК, а также на уровне готового белка, т. е. на уровне обеспечения его стабильности.
При (суб)оптимальной температуре <30°С концентрация белка RpoH поддерживается на крайне низком уровне — не более 30 молекул на клетку. Поэтому незаменимые гены groES, groEL и grрЕ, необходимые для фолдинга при любых условиях, должны иметь дополнительные промоторы для голокомплекса Еσ70.
Низкое базовое содержание RpoH связано со слабой интенсивностью трансляции rроH-мРНК, а также с очень быстрой деградацией этого белка. Причиной нестабильности RpoH служит белок-белковое взаимодействие с шаперонами DnaJ/DnaK, которые «выдают» его АТФ-зависимым протеазам.
При температурном переходе 30° —> 42°С концентрация белка RpoH временно увеличивается почти на порядок, достигая концентрации главного сигма-фактора σ70 (~500 молекул на клетку), в результате чего они начинают взаимно конкурировать за кор-фермент РНК-полимеразы. Успех конкуренции обеспечивается силой промоторов генов, кодирующих HSP. После первоначального повышения скорости транскрипции гена rроН она снижается до нового базового уровня, примерно вдвое выше исходной.
Помимо активации транскрипции гена rроН, дополнительный вклад в увеличение концентрации белка RpoH вносит усиление трансляции его мРНК с помощью еще не расшифрованного механизма, а также повышение его стабильности за счет нарушения взаимодействия с шаперонами DnaJ/DnaK/GrpE, которые негативно регулируют его синтез.
Общая схема контроля регулона Hsp выглядит следующим образом. При повышении температуры увеличивается концентрация ненативных белков, которые «оттитровывают» шапероны DnaJ/DnaK/GrpE. В результате этого появляется пул свободных молекул белка RpoH, устойчивого к протеолизу. Они начинают успешно конкурировать с сигма-фактором σ-32 за кор-фермент РНК-полимеразы; содержание голофермента Еσ32 возрастает, в результате чего повышается экспрессия генов всех HSP. Шапероны DnaJ/DnaK/GrpEпостепенно освобождаются от гнета ненативных белков, связываются с белком RpoH, его стабильность уменьшается, и т. д. В конечном счете, устанавливается новый уровень HSP, соответствующий росту организма при более высокой температуре.
Таким образом, стимулом для регулона Hsp служит теплота, сенсором — конформационное состояние белка, сигналом — ненативные белки, проводником сигнала — шапероны DnaJ/DnaK/GrpE, а мастер-регулятором — белок RpoH.
Система ответа при тепловом шоке, используемая Е. coli, не универсальна для прокариотов. Например, она отсутствует у грамположительных бактерий, в частности В. suhtilis. В данном случае гены, кодирующие HSP, образуют не регулон, а стимулон.
18.1.3. Стимулоны
В качестве примера рассмотрим стимулон теплового шока В. subtilis. Он содержит два регулона, один из которых находится под негативным контролем репрессора, а другой негативно контролируется антисигма-фактором.
Напомним, что стимулон отличается от регулона тем, что он состоит не из одного, а из нескольких регулонов, уровень экспрессии которых изменяется с помощью индивидуальных мастер-регуляторов, но под общим стимулом.
Регулон CIRCE. В этот регулон входят два оперона. Первый оперон (dnaK) образован генами hrc-grpE-dnaK-dnaJ-orf35- orf28-orf50 (за геном dnaJ идут три открытые рамки считывания; цифры обозначают молекулярные массы предполагаемых белковых продуктов). Второй оперон (grоЕ) образован генами groES-groEL. Они транскрибируются без участия альтернативных сигма-факторов, при помощи главной РНК-полимеразы В. subtilis — ЕσА (Еσ43; см. раздел 16.7.1). Левее этих оперонов находится палиндром CIRCE (сокр. англ. controlling inverted repeat of chaperone expression); его консенсусная последовательность у нескольких десятков видов грамположительных бактерий имеет структуру TTAGCACTC(N)g GAGTGCTAA.
С регуляторным элементом CIRCE, играющим роль оператора, связывается белок-репрессор НrсА (сокр. англ. heat shock response control), который негативно регулирует свой собственный ген.
Белок НrсА приобретает активную конформацию с помощью шаперонов GroES и GroEL (но не шаперона DnaK). Если «праздных» шаперонов слишком много, гены белков HSPрепрессируются. Наоборот, когда в результате теплового или токсического стресса в клетке накапливаются ненативные белки, они «оттитровывают» шапероны GroES и GroEL, в результате чего происходит индукция HSR Стимулом для регулона CIRCE служат теплота или пуромицин.
Регулон общего стресса GSP. В случае В. subtilis основная часть генов, кодирующих HSP (>40), индуцируется не только при тепловом стрессе, но и под воздействием денатурирующих реагентов, например, этанола; при осмотическом шоке; при углеродном или фосфорном голодании; при гипоксии и т. д. Иными словами, индукция этого регулона является ответом при общем стрессе, что и объясняет его название (англ. general stress proteins, GSP).
Гены регулона GSP транскрибируются голоферментом РНК-полимеразы, в состав которого входит альтернативный сигма-фактор σB (σ30). Его ген, sigB входит в состав октацистронного оперона rsbR-rsbS-rsbT-rsbU-rsbV-rsbW-sigB-rsbX, который транскрибируется с промотора Рв, расположенного между генами rsbU и rsbV. Промотор Рв распознается голоферментом ЕσB, т. е. экспрессия оперона GSP авторегулируется с помощью сигма-фактора σB.
Активность сигма-фактора σB, в свой черед, негативно контролируется антисигма-фактором RsbW и позитивно контролируется анти-антисигма-фактором RsbV. Активность последнего зависит от величины энергетического заряда (ЕС; см. II том учебника). При повышенном содержании АТФ (т. е. при высоком ЕС) антисигма- фактор RsbW образует комплекс с сигма-фактором σB, и регулон GSР репрессируется. При пониженном содержании АТФ (т. е. при низком ЕС), что, например, наблюдается в условиях голодания или при вхождении в стационарную фазу, антисигма-фактор RsbW связывается с анти-антисигма-фактором RsbV, и регулон GSР активируется.
18.1.4. Модулоны
В качестве примера рассмотрим модулон строгого ответа (англ. stringent response). В его состав входят гены и опероны, уровень экспрессии которых изменяется при трофическом стрессе, что влияет на общий паттерн метаболизма.
Голодание по источнику азота или углерода почти мгновенно вызывает плейотропный ответ, затрагивающий ~30% генов. Транскрипционное репрограммирование на уровне нескольких сотен генов домашнего хозяйства носит глобальный характер, и стратегия роста уступает место стратегии биосинтеза аминокислот. В результате этого не только обеспечивается выживание, но и оптимизируются процессы развития.
Бактерии обычно адаптируются к лимиту питательных субстратов, негативно регулируя биосинтез нуклеиновых кислот и белков и одновременно с этим — позитивно регулируя протеолиз и биосинтез аминокислот.
Медиаторами клеточного ответа, выраженного в изменении паттерна и интенсивности генерального метаболизма, в обоих случаях служат сигналы тревоги — алармоны (p)ppGpp. Об их роли в регуляторных процессах мы уже упоминали в разделе 16.7.1 (полиморфизм РНК-полимераз), разделе 17.2.1 (механизмы выживания клетки после прекращения роста), а также в разделах 17.5.2.1 и 17.5.2.2 (соответственно, дифференциация цист и эндоспор).
По современным данным, (p)ppGpp участвуют и в глобальных генетических процессах — репликации, рекомбинации и репарации. В частности, при репликации у В. subtilis алармоны ингибируют элонгацию на уровне действия праймазы.
Кроме того, показано участие алармонов в индукции факторов вирулентности у ряда патогенов, в частности Legionella pneumophila, а также в индукции биосинтеза антибиотиков у Streptomyces antibioticus и S. coelicolor.
В 1952 г. Сэндс (М. К. Sands) и Робертс (R. В. Roberts) установили, что у штамма Е. coli, мутантного по гену relA, первой реакцией на аминокислотное голодание становится прекращение образования «стабильных» РНК, т. е. рРНК и тРНК. В 1969 г. Кэшель (М. Cashel) и Гэллент (J. Gallant) идентифицировали связующее звено между трофическим стрессом и адаптивным ответом. Специфическими лигандами, участвующими в этом регуляторном процессе, оказались необычные нуклеотиды — гуанозин-3'-дифосфат,5'-трифосфат ((p)ppGpp) и гуанозин-3',5'- биспирофосфат (ppGpp) (рис. 254), сообща фигурирующие под некорректным названием «гуанозинтетрафосфат». Они синтезируются путем переноса пирофосфатной группы от АТФ, соответственно, на ГТФ и ГДФ. Данная реакция катализируется 3'-киназой RelA (синтазой 1) и 3'-гидролазой/синтазой SpoT (синтазой II).
Рис. 254. Гуанозин-3'-дифосфат,5'-трифосфат ((p)ppGpp) и гуанозин-3',5'-биспирофосфат (ppGpp).
В благоприятных условиях низкий базовый уровень обоих алармонов поддерживается за счет гидролазной активности SpoT: (p)ppGpp —> pGpp. Напротив, при стрессе содержание (p)ppGpp резко возрастает и достигает концентрации в несколько мМ.
Алармоны (р)ppGpp контролируют экспрессию генов непосредственно на уровне транскрипции. В свою очередь, биосинтез самих алармонов регулируется соотношением между количествами аминоацил-тРНК и тРНК. Дело в том, что в условиях аминокислотного голодания вместо аминоацил-тРНК накапливаются молекулы «незаряженной» тРНК. Их появление в A-сайте рибосомы (см. I том учебника) блокирует трансляцию. Такое «праздное» состояние (англ. idling reaction) активирует ассоциированную с рибосомой синтазу RelA, что и приводит к накоплению (p)ppGpp. Хотя число молекул синтазы RelA относительно невелико (~1 на 200 рибосом), образование (р)ppGpp приводит к диссоциации этого фермента от праздной рибосомы и ассоциации с другой праздной рибосомой.
В отличие от синтазы RelA, синтаза SpoT в клетках Е. coli не связана с рибосомой. Кроме того, она образует (p)ppGpp не в ответ на аминокислотное голодание, а при дефиците источника углерода или макро- и микроэлементов минерального питания — железа, фосфора и т. д. В частности, при голодании по жирным кислотам «незаряженный» ацилпереносящий белок ACP (см. II том учебника) связывается с синтазой SpoT и смещает баланс ее активностей в сторону синтеза, что приводит к накоплению (p)ppGpp.
В отличие от грамотрицательных бактерий, грамположительные бактерии часто бывают лишены гидролазы/синтазы SpoT, но зато содержат бифункциональный гомолог синтазы RelA.
Функции синтаз RelA/SpoT консервативны почти для всех грамотрицательных и грамположительных бактерий, что свидетельствует о глобальном адаптивном значении строгого ответа.
При накоплении (p)ppGpp эти нуклеотиды связываются с РНК-полимеразой в сайте, образованном ββ'σ-субъединицами, и вызывают конформационное изменение РНК-полимеразы, что влияет на выбор промоторов. В состав модулированной транскрипционной системы наряду с РНК-полимеразой, (p)ppGpp и промоторами входит белковый кофактор DksA (сокр. англ. discovery of supressor of dnaK; белок DnaK — шаперон, аналог эукариотного белка Hsp70, способствующий протеолизу сигма-фактора теплового шока σ32; см. разделы 18.1.2 и 19.1.1).
При связывании трио РНК-полимераза/(р)ррGрр/DksА с «чувствительными» промоторами транскрипция блокируется либо на стадии закрытого комплекса, либо из-за образования нестабильного открытого комплекса (см. раздел 16.7.1.1).
Большинство промоторов, попадающих под негативный строгий контроль, содержит GC-богатый регуляторный мотив, или дискриминатор (англ. discriminator), расположенный между положением -10 и стартовой точкой транскрипции (см. раздел 16.7.1.1). При строгом ответе, в частности, уменьшается синтез стабильной РНК из-за понижения сродства РНК-полимеразы к сильному промотору rrn-оперона Р1 (см. раздел 18.2.1), что незамедлительно приводит к падению скорости роста.
Часть генов, напротив, попадает под позитивный строгий контроль. В данном случае либо стимулируется образование открытого комплекса, либо промоторы образуют стабильные открытые комплексы. Общей чертой таких генов является АТ- богатый дискриминатор, расположенный между положением -10 и стартовой точкой транскрипции. Характерными примерами служат гены транспорта и биосинтеза аминокислот, в частности ген hisG, а также ген rpoS альтернативного сигма-фактора σS (σ38), входящий в регулон общего стресса Rpo (см. раздел 18.1.2).
Наконец, (p)ppGpp косвенно активирует экспрессию стрессовых генов, освобождая РНК-полимеразу от σ70-специфичных промоторов, что в ответ способствует использованию альтернативных сигма-факторов, например, σ38 (см. раздел 17.2.1 и рис. 225).