МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 20. СИНЭКОЛОГИЯ
20.3. Эндоцитобиоз
Первоначально для обозначения симбиотической ассоциации, в которой младший партнер, в частности прокариот, поселяется в цитоплазме, фагоцитарной вакуоли или ядре хозяина, использовался термин эндосимбиоз (англ. endosyrnbiosis; от греч. endon — внутри и symbiosis — совместная жизнь; «внутреннее (?) сосуществование»). В настоящее время такая ассоциация перименована в эндоцитобиоз (англ. endocytobiosis; от греч. endon — внутри, kitos — сосуд, в данном случае — клетка и bios — жизнь; «существование одной клетки внутри другой»).
Физиологической основой важнейших эндоцитобиозов служит «автотрофный» метаболизм младшего партнера - фотосинтез, хемосинтез или диазотрофия, а также его способность обеспечивать хозяина отдельными органическими соединениями, которые тот не способен создать сам по себе.
20.3.1. Эндоцитобиоз на основе фотосинтеза
В случае фотосинтетического эндоцитобиоза мы сталкиваемся с противоречивой и отчасти парадоксальной ситуацией. С одной стороны, эукариотная клетка получает огромное селективное преимущество, вступая в эндоцитобиотическую ассоциацию с фотосинтезирующим партнером, что видно на примере пластид, произошедших от бактерий (см. раздел 20.4.1). С другой стороны, известно мало примеров, когда фотосинтезирующий эндоцитобионт является именно бактерией, а не продуктом эволюционного превращения бактерии в полу автономную органеллу-ксеносому.
Яркий пример эндоцитобиоза с участием оксигенной фотосинтезирующей бактерии — это ассоциация цианобактерии «Nostoc punctiforme» и покрытосеменных растений рода Gunnera(см. раздел 20.3.3). Поскольку сам хозяин способен к фотосинтезу, он получает от младшего партнера не связанный углерод, а связанный азот.
В свою очередь, пример эндоцитобиоза с участием аноксигенного фототрофа — это ассоциация неидентифицированной пурпурной бактерии и морской ресничной инфузории Strombidmm purpureum. Помимо 200-300 анаэробных митохондрий, хозяин содержит в цитоплазме 200-700 бактериальных клеток. На свету, в анаэробных условиях они осуществляют фотолито- или фотогетеротрофию, используя побочные продукты брожения хозяина (ацетат, водород, лактат и др.). Этот синтрофический процесс позволяет хозяину получать энергию в термодинамически выгодных условиях. В темноте, при наличии кислорода бактерия катаболизирует эти же субстраты и уподобляется аэробной митохондрии.
В чем причина отсутствия «бактериальных» эндо цитобиозов, основанных на фотосинтезе? Скорее всего, в ходе эволюции они не выдержали конкуренции с эффективными химерными ассоциациями между протоэукариотными клетками и потомками пурпурных бактерий (митохондриями) совместно с потомками цианобактерий (пластидами).
20.3.2. Эндоцитобиоз на основе хемосинтеза
Хемосинтезирующие эндоцитобионты — тионовые или метанотрофные бактерии — имеются у многих моллюсков и погонофоров. Эти бактерии получают энергию за счет окисления восстановленных неорганических субстратов (соответственно, и СН4) и ассимилируют СО2 в цикле Кельвина-Бенсона-Бэссема. Младший партнер обеспечивает хозяина органическими веществами, делая его полностью независимым от фотосинтетической ассимиляции углерода, что невозможно у других животных.
Эндоцитобионты моллюсков. Большинство эндоцитобиозов на основе «серного» хемосинтеза встречается у двустворчатых моллюсков сем. Lucinidae, Mytilidae, Thyasiridae и Vesicomidae (подкласс Lamellibranchia), а также сем. Solemydae (подкласс Protobranchia).
В данном случае тионовые бактерии из класса «Gammaproteobacteria» скапливаются в жабрах внутри специализированных клеток, или бактериоцитов (англ. bactériocyte), где они лежат поодиночке в перибактериальных вакуолях (англ. peribacterial vacuole). Хозяева живут в морях и океанах на разных глубинах от литорали до абиссали (~6 км) в температурном интервале 2°- 30°С. Их ниши весьма разнообразны — гидротермальные клапаны (англ. vent), «холодные» газовые просачивания (англ. seep), заросли водорослей, коралловые пески, мангровы, а также участки с высокой концентрацией органического углерода, например, сточные сбросы. В этих местах всегда одновременно присутствуют сульфид и кислород, что служит условием «серной» хемолитотрофии (см. II том учебника).
Наиболее широко распространена эндоцитобиотическая ассоциация тионовых бактерий с пластинчатожаберными моллюсками Calyptogena spp. и Bathymodiolus thermophilus (рис. 278). В данном случае у животного сохраняется рудиментарная пищеварительная система, однако она не функционирует, поскольку хозяин полностью зависит от автотрофного партнера, который передается от поколения к поколению трансовариальным путем (через ооциты). Реже встречается другой тип эндоцитобиотической ассоциации — между моллюсками сем. Myttlidae, процветающими в местах «холодных» газовых просачиваний, и метанотрофными бактериями.
Рис. 278. Схема хемосинтетического эндоцитобиоза. ВС — бактериоцит; ВА — бактероид; РМ — перибактериальная мембрана; СВВ — цикл Кельвина-Бенсона-Бэссема; NR — нитратредуктаза.; [СН2О] и [NН2] — продукты ассимиляции углерода и азота, передаваемые от младшего партнера хозяину.
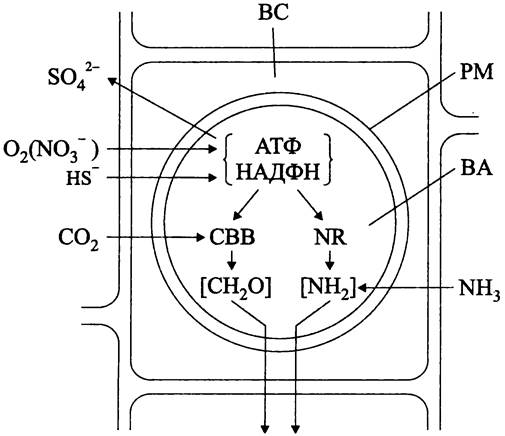
Эндоцитобионты погонофоров. Погонофоры, или не имеющие пищеварительной системы червеобразные животные с хитиновым чехлом, подразделяются на мелких представителей класса Perviata, которые живут в рыхлых илах, и гигантских вестиментифер класса Obturata, которые прикреплены к твердому субстрату вокруг глубоководных гидротермальных клапанов (300 м — 3 км; в отдельных случаях до 9 км) или вокруг «холодных» газовых просачиваний. В целом, по аналогии с двустворчатыми моллюсками, погонофоры приурочены к разнообразным нишам, где создаются условия для «серной» хемолитотрофии их эндоцитобионтов.
Эндоцитобионты вестиментиферы Riftia pachyptila, тионовые бактерии из класса «Gammaproteobacteria», живут внутри бактериоцитов, образующих губчатую трофосому (англ. trophosome) — орган эктодермального происхождения, рудимент пищеварительной полости. Трофосома имеет относительно большой размер (до 50% тела животного) и сильно развитую сосудистую систему (до 25% общего объема крови), доставляющую эндоцитобионту сульфид и кислород, общим перенос-
чиком которых служит растворенный гемоглобин. Проходя по щупальцам наружного «плюмажа», он насыщается кислородом, а затем отдает его бактериям в задней части тела. Одновременно с кислородом, но уже в другом сайте гемоглобин переносит сульфид в форме HS- (рис. 278). В гипоксичных местах обитания кислород частично заменяется нитратом, который восстанавливается до NO2- или до N2. Наряду с системой доставки субстратов для хемолитотрофии хозяин обладает системой доставки СО2 (того же типа, как у С4-растений; в «плюмаже» образуются малат и сукцинат, которые затем декарбоксилируются в трофосоме).
Хозяин приобретает эндоцитобионтов не трансовариальным путем, как у моллюсков, а из окружающей среды, т. е. в результате реинфекции. Внутри трофосомы бактерии превращаются в бактериоциты, т. е. в не размножающиеся, но метаболически активные клетки; по завершении своего жизненного цикла они лизируются.
Интересно, что по цитоархитектуре эндоцитобиотической ассоциации, а также по способу снабжения бактероидов кислородом эндоцитобиоз на основе хемосинтеза конвергирует с эндоцитобиозом на основе диазотрофил (см. ниже).
20.3.3. Эндоцитобиоз на основе диазотрофии
Младшими партнерами в диазотрофных эндоцитобиозах становятся либо цианобактерии, либо клубеньковые бактерии (ризобии); при этом хозяином является либо протист, либо высшее растение. В качестве третьего примера обычно приводят симбиоз между актинобактерией Frankia spp. и ольхой Ainus spp. (сем. Betulaceae), что неверно, поскольку в действительности это не эндоцитобиоз, а квази-эндоцитобиоз (см. разделы 17.5.1.2 и 20.2).
Эндоцитобиоз цианобактерий с диатомовыми водорослями и низшими грибами. Клетки морских диатомовых водорослей Rhizosolenia spp. (пор. Bacillariophyceae) содержат нитчатых эндоцитобионтов, которые образуют концевые гетероцисты и похожи на цианобактерий Calothrix spp. В свою очередь, эндоцитобионтами пресноводных диатомей Rhophalodia gibba и R. gibberula являются некультивируемые одноклеточные цианобактерии. В обоих случаях эндоцитобионт обладает нитрогеназной активностью, что важно для питания фитопланктона.
Факультативным эндоцитобионтом фикомицета Geosiphon pyrifomie является диазотрофная цианобактерия рода Nostoc.
Эндоцитобиоз Nostoc-Gunnera. Диазотроф «Nostoc puntciforme» и Gunnera spp. вступают в факультативный эндоцитобиоз — единственный случай, когда цианобактерии поселяются внутри клеток покрытосеменного растения.
Род Gunnera (сем. Haloragaceae) был назван Карлом Линнеем в честь норвежского епископа и ботаника Гуннера (J. Е. Gunnerus). Его представители (65 видов) распространены главным образом в Южном полушарии и приурочены к переувлажненным нишам, прежде всего к местам с обильными дождями; они также растут на болотах, по берегам рек, рядом с водопадами, колодцами и т. д. Среди них есть как мелкие, так и гигантские, до 6 м высотой, растения с листьями, как у ревеня, выращиваемые в декоративных целях в оранжереях или в открытом грунте (например, на Британских островах).
В основании черешков листьев Gunnera spp. еще до инфицирования образуются слизистые железки, которые затем заселяются цианобактериями. Предполагается, что они выделяют органические вещества, которые выступают в роли хемоаттрактантов. По достижении контакта со слизистой поверхностью железки большинство цианобактерий дифференцируется в короткие подвижные трихомы, лишенные гетероцист. Через каналы в эпидермисе железки они проникают в меристемагическую зону, стимулируют целлюлазную активность, растворяют тонкие стенки клеток и внедряются в них посредством эндоцитоза. В эндоцитобиотическом состоянии цианобактерии растут и размножаются, заполняя основную часть интерьера хозяйской клетки. При этом они образуют большое количество гетероцист (до 80% общего числа клеток), что обеспечивает высокий уровень нитрогеназной активности.
Несмотря на низкую освещенность внутри железки, эндоцитобиотическая цианобактерия, или цианобионт частично сохраняет активность фотосинтетического аппарата, хотя большинство органики обеспечивает хозяин, который взамен получает продукт диазотрофии — аммоний.
Эндоцитобиоз ризобиев с бобовыми растениями. В отличие от редких и не имеющих глобального экологического значения диазотрофных эндоцитобиозов с участием цианобактерий, диазотрофный эндоцитобиоз, где младшим партнером являются клубеньковые бактерии, или ризобии (от греч. rhiza — корень и греч. bios — жизнь; «живущее в корне») служит примером широко встречающейся и исключительно важной симбиотической ситуации.
Ризобии — это тривиальное название сборной группы бактерий из класса «Аlphaproteobacteria» (рода Allorhizobium, Azorhizobium, Bradyrhizobium, Mesorhizobium, Rhizobium и Sinorhizobium), которые вступают в факультативную эндоцитобиотическую ассоциацию с представителями сем. Leguminosae (бобовых). Младший партнер индуцирует у хозяина образование специализированных органов — корневых или стеблевых клубеньков. Колонизируя клетки сердцевины клубенька, вегетативные ризобии превращаются в терминально дифференцированные диазотрофные бактероиды, которые секретируют аммоний, используемый хозяином. Хозяин, в свою очередь, обеспечивает нитрогеназу ризобия энергией и восстановительными эквивалентами, снабжая его органическими субстратами и доставляя ему молекулярный кислород.
Клубеньки на корнях бобовых растений впервые изобразил в 1542 г. в своем ботаническом атласе немецкий естествоиспытатель Леонард Фукс (L. Fuchsius). Приоритетное описание клубеньков у бобов и фасоли, как морфологического явления нодуляции (от лат. nodulus — узелок) дал в 1675 г. итальянский анатом Марчелло Мальпиги (М. Malpighi). В 1866 г. русский ботаник М. С. Воронин обнаружил, что корневые клубеньки люпина заполнены бактериями. Наконец, доказательство того, что бактерии индуцируют образование клубеньков и обеспечивают растение азотом, привели в конце 1880-х гг. немцы Гельригель (H. Hellriegel) и Вильфарт (H. Wilfarth) совместно с голландцем Бейеринком (М. W. Beyerinck).
Эндоцитобиотическая диазотрофия имеет громадное значение для полей и пастбищ. Ее продуктивность достигает 300 кг биологически связанного азота на гектар в год (что в глобальном масштабе составляет 7 • 107 т).
Индуктором нодуляции являются специфические сигнальные молекулы ризобиев — Nod-факторы (сокр. англ. nodulation). Это семейство структурно сходных липоолигосахаридов, которые у отдельных видов ризобиев содержат разное число гликозильных остатков и разные боковые заместители, а также имеют разную степень насыщенности и разную длину липидного «хвоста» (рис. 279, А).
Рис. 279. Nod-фактор NodRm-IV Sinorhizobium meliloti (А) и хозяйский флавоноид апигенин (Б).
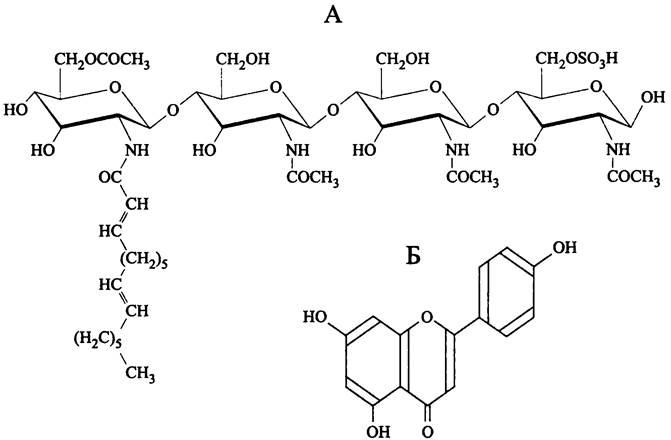
Триггером симбиотического взаимодействия являются сигнальные флавоноиды, которые секретируются корнями хозяина, в частности, апигенин (рис. 279, Б). Они служат стимулами-лигандами для мембранного белка NodD, играющего у ризобиев роль сенсора и одновременно с этим — роль однокомпонентного транскрипционного фактора из семейства LysR. Он связывается с высококонсервативными последовательностями ДНК длиной 49 п. н. (nod-боксами) и активирует промоторы downstream-генов nod. Продукты экспрессии большинства этих генов участвуют в биосинтезе Nod-факторов.
Nod-фактор, секретируемый ризобием, обладает митогенной активностью и стимулирует деление клеток внутреннего кортекса корня у хозяина с образованием примордия и меристемы клубенька, индуцирует хозяйские «симбиотические» гены- нодулины, а также вызывает осцилляцию катионов Са2+ и характерное закручивание корневого волоска.
К числу ризобиальных экзопродуктов, контролирующих развитие клубенька, также относятся внеклеточные полисахариды (англ, extracellular polysaccharide, EPS). В качестве примера назовем сукциногликан R. meliloti, состоящий из октасахаридного блока (цепь из трех остатков глюкозы и остатка галактозы, соединенная с боковой цепью из четырех глюкозильных остатков; заместителями служат ацетил, пирувил и сукцинил). Кроме того, в регуляции инфекционного процесса участвуют внеклеточные белки ризобия, которые экспортируются с помощью секреторной системы III типа (см. I том учебника).
Инфекционный процесс (рис. 280) начинается с прикрепления свободных ризобиев к поверхности эпидермальной клетки корневого волоска. Под стимулирующим воздействием нодулинов корневой волосок закручивается, и микроколония ризобиев фиксируется между встречно ориентированными клеточными стенками. Установлено, что изменение характера роста и, как следствие, изменение формы клетки связаны с реорганизацией цитоскелета за счет деполимеризации актиновых микрофиламентов.
Рис. 280. Инфицирование клубеньковыми бактериями клеток корня бобового растения. I — прикрепление бактерий к корневому волоску; II — закручивание корневого волоска и фиксация микроколонии ризобиев; III — образование и распространение инфекционной нити; IV — переход ризобиев в перибактероидные вакуоли.
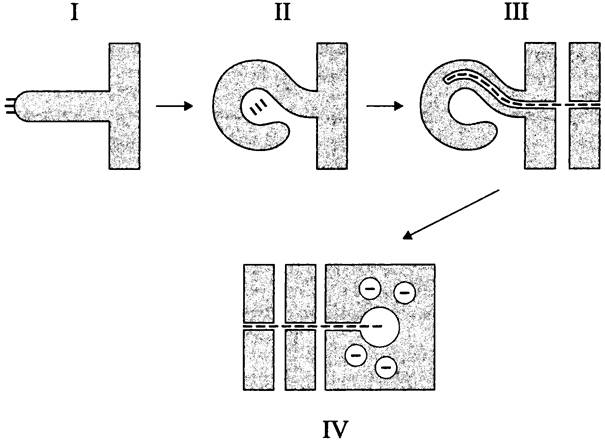
Непосредственно в месте прикрепления ризобиев клеточная стенка инвагинирует, образуя зачаток инфекционной нити (англ. infection thread). Он удлиняется, прободает клетку корневого волоска и сливается с дистальной стенкой, в результате чего ризобии высвобождаются в межклетник между эпидермальной клеткой и верхней клеткой субэпидермального слоя. Стенка последней, в свою очередь, инвагинирует, образуя следующий сегмент инфекционной нити и т. д. Таким образом, до встречи с внешним кортексом инфекционная нить — это не сплошное образование, а симбиотическая структура в виде цепочки коридоров, пронизывающих клетки субэпидермиса и заполненная ризобиями. Внутри инфекционной нити бактерии погружены в экзополисахаридный матрикс и интенсивно размножаются, образуя 2-3 колонны продольно ориентированных клеток. Механизм их распространения по инфекционной нити неизвестен, хотя предполагается, что он основан на недавно открытом способе коллективной подвижности — выдвижении (англ. sliding).
Инфекционная нить, заполненная колоннами ризобиев, распространяется по направлению к внешнему кортексу, клетки которого соединяются цитоплазматическими мостиками, образуя преинфекционную нить (англ. preinfection thread, PIT). По этому каналу инфекционная нить достигает разрастающейся меристемы клубенька. Встретившись с последней, она начинает ветвиться, клеточная стенка на концах ветвлений разрушается, ризобии путем эндоцитоза внедряются в меристематические клетки клубенька и попадают в перибактероидную вакуоль — эквивалент фагосомы.
Внутри перибактероидной вакуоли вегетативные ризобии размножаются, а затем дифференцируются в бактероиды. Свойства бактероидов как одного из типов дифференцированных клеток у прокариотов, а также детали их метаболических взаимоотношений с хозяином мы уже рассматривали в разделе 17.5.1.2.
20.3.4. Эндоцитобиоз на основе хемогетеротрофии
Многие некультивируемые хемогетеротрофные бактерии (см. I том учебника) находятся в состоянии эндоцитобиоза с протистами или беспозвоночными.
В первом случае младший партнер оккупирует разные компартменты клетки хозяина — фагоцитарные вакуоли, цитоплазму или ядро. При этом выгода, получаемая партнерами, далеко не очевидна (см. раздел 20.3.4.1).
Во втором случае младшие партнеры, как правило, находятся внутри бактериоцитов и «вертикально» передаются потомству. Инфицирование происходит трансовариально по материнской линии. Взаимоотношения между партнерами носят мутуалистический характер и часто принимают форму облигатного симбиоза (при этом размер генома бактерии уменьшается до 450-800 т. п.н.). Младший партнер позволяет хозяину выжить на неполноценной диете, снабжая его такими пищевыми добавками, как аминокислоты и витамины. Элиминация эндосимбионта приводит к стерильности, дистрофии и укорачиванию жизни хозяина.
20.3.4.1. Эндоцитобиоз у протистов
Среди хемогетеротрофных протистов хозяевами хемогетеротрофных эндоцитобионтов являются амебы или инфузории.
Эндоцитобионты амеб. Этот тип симбиотической ассоциации встречается у ~25% изолятов патогенных амеб Acanthemoeba spp., которые являются возбудителями грануломатозного энцефалита, а также изъязвлений роговицы при использовании контактных линз. Цитоплазматические эндоцитобионты вызывают у хозяина комплекс морфологических, физиологических и биохимических изменений. В частности, они отвечают за «киллерный» фенотип, когда один штамм хозяина образует токсичный белковый агент, вызывающий летальный эффект у другого штамма.
Взаимная выгода от симбиоза не очевидна; предполагается, что младшие партнеры, которые не культивируются вне хозяина, находят физическую защиту и питательные субстраты, а хозяева, будучи паразитами, дополнительно получают конкурентные преимущества благодаря образованию киллер-факторов.
Эндоцитобионты инфузорий. Многие инфузории содержат эндоцитобиотические бактерии. Некоторые из них токсичны для других штаммов инфузорий. В частности, бактерии из рода Caedibacter (от лат. caedes — убийство) образуют R-тела (сокр. англ. refractile — преломляющие свет; в данном случае — при наблюдении в фазово-контрастном микроскопе). Это белковый рулон, который после попадания в фагосому чувствительного штамма разворачивается в ленту длиной 20-30 мкм и каким-то образом оказывает на него токсическое воздействие.
Бактерий, живущих в макронуклеусе, микронуклеусе или цитоплазме ресничных инфузорий, первым обнаружил в 1856 г. немецкий физиолог Иоганнес Мюллер (J. Müller). Однако вплотную ими стали заниматься только век спустя, когда выяснилось, что они определяют киллерный фенотип хозяина, и что этот наследуемый признак связан с цитоплазматическими каппа-частицами (от греч. буквы kappa, созвучной с первой буквой англ. слова killer — убийца). В 1938 г. Зоннеборн (T. М. Sonneborn) установил, что каппа-частицы Paramecium aurelia представляют собой грамотрицательные бактерии, получившие название Caedibacter taeniospirales.
Наиболее изучены эндоцитобионты Р. aurelia, P. caudatum и Euplotes spp., а также эндоцитобионты анаэробных морских или пресноводных инфузорий. В ряде слу-
чаев геном младших партнеров уменьшается в размере; поэтому они не покидают хозяина и передаются «по вертикали».
Эндоцитобионты Р. aurena относятся к роду Holospora (класс «Alphaproteobacteria»). Отдельные виды обладают хозяйской и ядерной специфичностью, размножаясь в ядре только одного типа (микро- или макронуклеусе). Они придают хозяину способность синтезировать токсины, играющие роль киллер-факторов для чувствительных штаммов парамеций того же вида или других видов. Эти токсины действуют либо после секреции в окружающую среду, либо контактным путем при образовании половых пар. Жизненный цикл Holospora sрр. включает в себя две морфологически различающиеся формы — эндоцитобиотическую репродуктивную и инфекционную. После проникновения в фагосому бактерия инфекционной фазы сложным путем достигает места своей репродуции.
Polynucleobacter necessarius, облигатные эндоцитобионты Euplotes sрр, которые раньше обозначались как омикрон-частицы, а также родственные им эпсилон-частицы и эта-частицы обычно размножаются в хозяйских фагосомах и могут образовывать киллер-факторы.
Феномен киллерства способствует доминированию популяций инфузорий, содержащих эндоцитобиотические бактерии, что выгодно, прежде всего, бактериям. Таким образом, данный тип симбиотической ассоциации можно рассматривать как умеренный паразитизм.
20.3.4.2. Эндоцитобиоз у беспозвоночных
В данном случае симбиоз на основе хемогетеротрофии принимает форму либо мутуализма, либо репродуктивного паразитизма.
Мутуализм. Все известные представители тлей, важнейшей группы насекомых-вредителей растений (порядок Homoptera, суперсемейство Aphidoidea) образуют эндоцитобиотические ассоциации с бактерий Buchnera aphidicola, принадлежащей к филогенетическому классу «Gammaproteobacteria».
В целомической полости афидид находится мицетома (англ. mycetome), или бактериом (англ. bacteriome). Это двухлопастной агрегат из 60-90 бактериоцитов, заполненных симбиосомами (англ. symbiosome) — фагоцитартными вакуолями, вмещающими по одной клетке В. aphidicola.
Сок флоэмы, которым питаются тли, является неполноценной диетой, поскольку он богат углеводами, но содержит очень мало азота; кроме того, афидиды нуждаются в незаменимых аминокислотах, прежде всего в триптофане и лейцине. Большинство из них хозяин получает в готовом виде от младшего партнера. Тот, в свою очередь, извлекает выгоду, находясь в гомеостатичной и богатой субстратами нише.
Гены trpEG, кодирующие ключевой фермент пути биосинтеза триптофана — антранилатсинтазу, находятся в мультикопийной плазмиде В. aphidicola, что делает бактерию сверхпродуцентом этой незаменимой аминокислоты, которая в большом количестве становится доступной для хозяина. Триптофан экспортируется как составной компонент шаперонина GroEL, содержание которого достигает 10% растворимого белка В. aphidicola; поступая в гемолимфу афидид, он пополняет пул незаменимых аминокислот.
Репродуктивный паразитизм. Бактерии рода Wolbachia (класс «Alphaproteobacteria») инфицируют разные виды нематод и членистоногих — насекомых (класс Insecta),паукообразных (класс Arachnida) и ракообразных (класс Crustacea).
Бактерии рода Wolbachia, названного в честь американского микробиолога Вольбаха (S. В. Wol- bach), с единственным видом W. pipientis были впервые описаны в 1924 г. в качестве подобного риккетсиям эндоцитобионта в яичнике комара Culex pipiens. Они размножаются бинарным делениям в цитоплазматических вакуолях хозяйских гонад, хотя также встречаются в нервной ткани и гемоцитах.
Вольбахии являются одними из наиболее успешных эндоцитобионтов. Они инфицируют ~20% видов насекомых, многих пауков, клещей, наземных ракообразных и большинство видов нитевидных нематод.
Широкое распространение W. pipiens связано со способностью вмешиваться в репродуктивные процессы беспозвоночных. Конкретнее, эндоцитобиотические бактерии способствуют собственной вертикальной трансовариальной передаче, обеспечивая преимущественное размножение зараженных самок.
Репродуктивные «манипуляции» эндоцитобионта включают в себя: (1) индукцию партеногенеза у инфицированного хозяина; (2) изменение хромосомной детерминации пола, приводящее к феминизации, когда инфицированные генетические самцы превращаются в функциональных самок; (3) эмбриональную летальность из-за цитоплазматической несовместимости (англ, cytoplasmic incompatibility; CI) после спаривания неинфицированных самок с инфицированными самцами. Все эти эффекты, в конечном счете, приводят к расселению эндоцитобионта.
Бактериям репродуктивный паразитизм выгоден, однако у беспозвоночных он не только нарушает нормальное размножение и изменяет соотношение полов, но и приводит к гибели части особей (эмбрионов самцов). Молекулярные механизмы, лежащие в основе репродуктивного паразитизма, практически неизвестны.
20.3.5. Внутриклеточный паразитизм зоопатогенных бактерий
Живую клетку можно рассматривать как экстремальную нишу, в которой процветают только сравнительно немногие виды адаптированных бактерий (см. I том учебника). Что касается клетки-хозяина, то ее отношение к младшему партнеру отнюдь не инертно — особенно если тот избирает стратегию внутриклеточного паразитизма. Она ограничивает его проникновение, стремится его уничтожить и, если это не удается, вступает с ним в метаболическую конкуренцию. Поэтому стратегическая задача эндоцитобионта — не только выжить в стрессовых условиях, но и подчинить чужие ресурсы нуждам собственного метаболизма.
Внутриклеточное инфицирование животных осуществляется путем фагоцитоза, после чего захваченная бактерия делает решающий выбор — либо остается в фагоцитарной факуоли (фагосоме), либо спасается из нее и транзитом проникает в цитоплазму.
Фагоцитозом называется поглощение эукариотной клеткой микроскопических частиц, в том числе бактерий. Его осуществляют либо профессиональные антигенпрезентирующие клетки — профессиональные фагоциты (макрофаги, дендритные клетки и В-лимфоциты), либо непрофессиональные антигенпрезентирующие клетки — непрофессиональные фагоциты (эпителиальные клетки, фибробласты, астроциты, клетки эндотелия и гранулоциты). Механизмы профессионального и непрофессионального фагоцитоза существенно различаются. Непрофессиональный фагоцитоз основан либо на использовании бактерией поверхностных белков инвазинов, которые взаимодействуют с хозяйскими рецепторами, либо на доставке в цитоплазму хозяина белков, которые индуцируют складчатость его плазматической мембраны и, как следствие, макропиноцитоз.
На бактерию, попавшую внутрь первичной фагосомы профессионального фагоцита, обрушивается каскад деструктивных процессов: (1) накапливаются токсичные соединения кислорода и азота (ROS и RNS; см. раздел 19.1.6.1); (2) фагосома сливается с лизосомами, содержащими кислые гидролазы; (3) интерьер фагосомы закисляется при помощи Н+-транслоцирующей V-АТФазы (см. II том учебника); (4) в фагосому поступают катионные антибактериальные белки и пептиды, в частности дефензины. Кроме того, после фагосомного процессинга бактериальных белков на поверхность фагоцита выводятся пептидные антигены, презентация которых Т-лимфоцитам вызывает разнообразные формы гуморального иммунного ответа, направленного против специфического паразита.
Эндоцитобионт, в частности внутриклеточный паразит, использует механизмы, позволяющие ему не только избежать уничтожения защитным арсеналом фагосомы, но и адаптироваться в этой нише с целью дальнейшего размножения. Альтернативной и более радикальной стратегией является разрушение мембраны фагосомы с выходом в более комфортабельный компартмент — цитоплазму.
Эндоцитобионт в фагосоме. Ряд важнейших эндоцитобионтов-патогенов человека и животных размножается или сохраняется (персистирует) в латентном состоянии в фагосоме хозяина.
Brucella spp. Бактерии рода Brucella являются этиологическим агентом бруцеллеза — широко распространенного заболевания в форме инфекционного аборта (у животных, которые служат природным резервуаром для данной бактерии, относящейся к патогенам третьей, наиболее опасной группы) или мальтийской лихорадки (у человека). Brucella spp. выживает в макрофагах или в эпителиальных клетках слизистых оболочек, предотвращая слияние мембраны фагосомы с лизосомами. Она размножается в модифицированной фагосоме — вакуоли BCV (сокр. англ. Brucella- containing vacuole). С помощью секреторной системы IV типа VirB паразит доставляет в хозяйскую клетку белки, контролирующие созревание BCV и размножение бактерий внутри этого репликативного компартмента с привлечением шероховатого эндоплазматического ретикулума.
Legionella pneumophila. Возбудитель легионеллеза — острой инфекционной пневмонии, или болезни легионеров служит этиологическим агентом 1-15% зарегистрированных случаев пневмонии (7-25% летальных исходов) и только в США ежегодно поражает до 100 тыс человек. В свободном состоянии легионелла вяло размножается в планктоне или биопленках рек и озер, однако она активно репродуцируется в двух хозяевах — амебах (Acanthamocba castellana, Hartmanelia sp., Naeglaria sp. и др.) и альвеолярных макрофагах человека, куда попадает аэрозольным путем. Через несколько минут после проникновения в клетку-хозяина бактерия блокирует слияние фагосомы с лизосомами. Решающую роль в этом играют секреторная система IV типа Dot/Icm (сокр. англ. Defective for organelle trafficking/Intracellular multiplication) и секреторная система II типа Isp (сокр. англ. Legionella secretion of pilin). Кроме того, эти системы транслоцируют в клетку-хозяина белковые факторы, обеспечивающие функционирование модифицированной фагосомы — вакуоли LCV (сокр. англ. Legionella-containing vacuole) в качестве ниши для размножения паразита.
Mycobacterium tuberculosis. Микобактерия М. tuberculosis является одним из опаснейших патогенов человека — ежегодно она инфицирует до 8 млн. человек (2 млн. летальных исходов). Ее высокая вирулентность объясняется способностью выживать в макрофагах. Если при фагоцитозе в результате активации макрофага фагосома обычно сливается с лизосомами, то в данном случае макрофаг не активируется, и фаголизосома не образуется. Это связано с использованием особых поверхностных рецепторов хозяина (CR3), а также с уникальной природой липидов микобактерий. Некоторые из них (например, димиколат трегалозы; см. I том учебника) являются иммуномодуляторами; другие (в частности, липоарабиноманнаны) предотвращают созревание фагосомы. Ингибирующий эффект липоарабиноманнанов связан с тем, что они блокируют накопление в макрофагах катионов Са2+ — активаторов фосфатидилинозитолкиназы (фактора слияния мембран). После фагоцитоза и внутриклеточного размножения патогенных микобактерий макрофаги мигрируют в органы-мишени. Там из них и Т-лимфоцитов образуется туберкулезный бугорок (гранулома) — зачаток инкапсулированной каверны, состоящей из некротических тканей и мертвых микобактерий. Не уничтоженные микобактерии впадают в латентное состояние (неизвестно, вне клеток хозяина или в макрофагах); при их реактивации инфекционный процесс переходит в острую стадию.
Salmonella entérica. Вид S. entérica объединяет ~2 тыс сероваров, обладающих разной хозяйской специфичностью и вызывающих разные заболевания. В частности, серовар Typhi является возбудителем тифоидной лихорадки и ежегодно поражает более 20 млн. человек; а серовар Typhimurium вызывает гастроэнтерит у людей или системное тифоидное заболевание у мышей. Вирулентность S. enterica связана со способностью проникать в клетки кишечного эпителия и размножаться в модифицированной фагосоме — вакуоли SCV (сокр. англ. Salmonella-containing vacuole). За проникновение, выживание и размножение паразита отвечают хромосомные гены вирулентности, объединенные в островки патогенности SPI-1 и SPI-2 (см. раздел 16.6.1.3). В частности, они кодируют секреторные системы III типа T3SS1 и T3SS2, которые доставляют в хозяйскую клетку белки, обеспечивающие инвазию, выживание в фагосоме и ее превращение в SCV, которая не сливается с лизосомами.
Хламидии. Вышеописанные бактерии способны самостоятельно размножаться вне клетки- хозяина. В отличие от них, хламидии (рода Chlamydia и Chlamydophila) — это облигатные внутриклеточные паразиты человека и животных. Виды С. tracomatis и С. pneumoniae патогенны для человека и вызывают, соответственно, хронические генитально/глазные инфекции и бронхофа- рингиты/пневмонию. В свою очередь, C. psittaci возбуждает пситтакоз у птиц, хотя может передаваться человеку, вызывая острую пневмонию. У хламидий сложный инфекционный процесс. Он начинается с прикрепления метаболически неактивной цисты хламидии, или элементарного тела (англ. elementary body, ЕВ) диаметром ~0,3 мкм к поверхности эпителиальной клетки. Затем младший партнер экспортирует в хозяйскую клетку эффекторный белок Таrр, который локально активирует эукариотную ГТФазу Racl. Это приводит к изменению характера сборки актиновых микрофиламентов хозяйского цитоскелета и поглощению (интернализации) элементарного тела. Внутри фагосомы элементарное тело дедифференцируется в метаболически активное ретикулярное тело (англ. reticulate body) диаметром ~1 мкм. Фагосома, содержащая ретикулярное тело, уклоняется от созревания в фаголизосому и превращается в репродукционную вакуоль — раннее включение (англ. early inclusion). В результате последовательной активации альтернативными сигма-факторами σ28 и σ54 «ранних» (1-8 ч), «средних» (8-16 ч) и «поздних» (16-24 ч) хламидийных генов происходит размножение ретикулярных тел и их дифференциация в элементарные тела. Хотя в редуцированном геноме хламидий (1 млн. п. н.) содержатся детерминанты энергетического и конструктивного метаболизма, в частности гены гликолиза и биосинтеза муреина, эти бактерии являются не только «конструктивными», но и «энергетическими» паразитами. Иными словами, они получают от хозяина и энергию (в форме АТФ), и строительный материал, в том числе мембранные липиды. Когда расплодившиеся включения практически полностью заполняют хозяйскую клетку, она разрушается в результате активации цистеиновых протеаз, а также механическим путем под воздействием собственного цитоскелета.
Эндоцитобионт в цитоплазме. Некоторые патогенные факультативные или облигатные эндоцитобионты (Actinobacillus actinomycetemcomitans, Е. coli, Listeria spp., Rickettsia spp., Shigella spp. и др.) непосредственно после своего захвата покидают первичную фагосому и выходят в цитоплазму клетки-хозяина, где и размножаются.
Listeria monocytogenes. Возбудитель листериоза, психротолерантная бактерия L. monocytogenes передается с пищевыми продуктами и вызывает системные заболевания у детей, а также у иммунодепрессивных и пожилых людей. В связи с использованием неглубокого холода при хранении мяса, рыбы, овощей и фруктов распространение листериоза стало глобальной угрозой. «Продырявливание» мембраны первичной фагосомы осуществляется с помощью цитолизина листериолизина О (англ. listeriolysin О; LLO). Ген hly, кодирующий этот протеолитический фермент, входит в состав островка патогенности (см. раздел 16.6.1.3), который позитивно регулируется транскрипционным фактором PrfA. Дальнейшее «распечатывание» фагосомы осуществляется фосфолипазами С-типа, специфичными в отношении фосфатидилинозитола (PI-PLC) и фосфатидилхолина (PC-PLC). Гены plcA и plcB,кодирующие эти ферменты, входят в состав вышеуказанного геномного островка.
L. monocytogenes с одинаковым успехом размножается в цитоплазме профессиональных и непрофессиональных фагоцитов. Кроме того, она расселяется из первично зараженной клетки в ее соседей за счет способности полимеризовать на одном из своих полюсов хозяйский актин с помощью белка Act А (см. I том учебника).
Shigella flexneri. Этот эндоцитобионт-патоген вызывает водянистую диарею или кровавую бациллярную дизентерию человека и животных. С помощью секретируемых белков он индуцирует макропиноцитоз у непрофессональных и профессиональных фагоцитов — эпителиальных клеток толстой кишки и М-клеток тонкой кишки. S. flexneri образует гемолизины IpaB и IpaC, которые «продырявливают» мембрану первичной фагосомы. Участвуют ли в «распечатывании» фагосомы специфические фосфолипазы, еще неизвестно. По аналогии с L. monocytogenes шигелла распространяется в соседние клетки, полимеризуя хозяйский актин с помощью белка IscA.
Yersinia enterocolitica и Y. pseudotuberculosis. Данные бактерии вызывают разнообразные локальные и системные синдромы, в том числе мезентерический лимфоаденит, реактивный артрит, септицемию и энтерит. Инфекционный процесс начинается с проникновения патогена в М- клетки при помощи инвазина. После колонизации пейеровых бляшек бактерии либо переходят во внеклеточную среду, либо вторично попадают в фагоциты (а из них в клетки эндотелия) и затем распространяются с кровотоком.
Риккетсии. В отличие от вышеописанных факультативных эндоцитобионтов, риккетсии являются облигатными внутриклеточными паразитами. Они вызывают у человека риккетсиозный тиф (Rickettsia prowazekii, R. typhi) и сифилис (R. akari), a также сыпную лихорадку (R. rickettsii, R. conorii). Природным резервуаром риккетсий служат клещи; они же переносят их от грызунов к человеку. После фагоцитирования риккетсия быстро покидает фагосому. Механизм перехода в цитоплазму хозяйской клетки неизвестен; в случае R. prowazekii он может быть связан с использованием фосфолипазы А. Риккетсии репродуцируются не только в цитоплазме, но и в ядре; численность инфекционного потомства составляет от 100 до 1 тыс на клетку хозяина. Их диаметр ~0,3 мкм, и они имеют небольшой геном (в случае R. rickettsii, этиологического агента сыпной лихорадки Скалистых гор, его размер составляет ~1 млн. п. н.), вследствие чего эти патогены находятся в облигатной метаболической зависимости от хозяина. Часть энергии риккетсии получают, окисляя глутамат через цикл Кребса, но в основном они прибегают к «энергетическому» паразитизму, обменивая АДФ на АТФ хозяина. Ферменты гликолиза и глюконеогенеза у них отсутствуют; с помощью уникального механизма они импортируют НАДН и УДФ-глюкозу. Кроме того, они получают от хозяина аминокислоты, в частности глицин и серин.
Патогенность эндоцитобионтов-паразитов является прямым результатом их размножения. Она связана либо с апоптозом клетки-хозяина, либо с накоплением бактериальных токсинов, адресно или системно поражающих ткани и органы макроорганизма.
Наконец, все паразитические эндоцитобионты обладают общим приспособительным свойством — до завершения собственной репродукции они разными путями блокируют механизмы апоптоза у клетки-хозяина.