МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 20. СИНЭКОЛОГИЯ
20.4. Ксеносомы
В предыдущем разделе мы обозначили физиологические стратегии эндоцитобио- за; выяснили его экологическое значение; привели примеры облигатно эндоцитобиотических бактерий; отметили, что обитание в такой нише, как живая клетка, часто приводит к уменьшению размера генома.
Теперь рассмотрим роль эндоцитобиоза в возникновении современных ядерных клеток. Как известно, по данному сценарию произошли химеры прокариотов с эукариотами. Такие клеточные ассоциации не вписываются в глобальное древо, а принадлежат сразу к двум доменам — Bacteria и Еucarya, объединяя «под одной крышей» два глобальных морфотипа — прокариотный и эукариотный (см. I том учебника).
Около 1,5 млрд, лет назад в архаичную эукариотную клетку поочередно проникли представители двух фил домена Bacteria (BXII Proteobacteria и ВХ Cyanobacteria). В результате кардинальных генетических изменений эти бактерии потеряли способность к автономному существованию и, пройдя стадию облигатных эндоцитобионтов, трансформировались в полуавтономные цитоплазматические органеллы — ксеносомы (англ. xenosome; от греч. xenos — чужой и soma — тело; «чужеродное тело»).
Ксеносомы функционально специализированы для ассимиляции энергии (митохондрии и пластиды) или ассимиляции энергии в сочетании с ассимиляцией неорганического углерода (только пластиды).
Митохондрии — это хемотрофные ксеносомы. У них нет пигментных систем фотосинтетического аппарата, и они ассимилируют энергию в процессе аэробного, реже анаэробного митодыхания (англ. mitorespiration), которое сопровождается мембранным фосфорилированием АДФ. Они неспособны и к автотрофной ассимиляции углерода.
Пластиды — это фотосинтетические ксеносомы. Они обладают фотосинтетическим аппаратом оксигенного типа, в состав которого входят реакционные центры ФСI и ФСII, светособирающие комплексы, а также электрон-транспортная цепь и АТФ-синтаза, или фактор «сопряжения» (англ. coupling factor). Пластиды обладают набором ферментов, позволяющих ассимилировать неорганический углерод (цикл Кельвина-Бенсона-Бэссема; см. II том учебника). У особого типа пластид, примерами которых являются дифференцированные хлоропласты и специализированные пластиды, пигментный аппарат в той или иной степени редуцирован. Некоторые типы пластид, помимо фототрофии, способны к хлородыханию (см. ниже).
Доказательства того, что митохондрии и пластиды происходят от бактериальной клетки, следующие:
— они окружены оболочкой из двух мембран, содержат кольцевую хромосому и 70S-рибосомы, причем пластидные гены рРНК гомологичны генам рРНК представителей архаичного кластера филы ВХ Cyanobacteria, а гены митохондриальной рРНК гомологичны генам рРНК представителей класса «Alphaproteobacteria» филы ВХII Proteobacteria;
— по размерам и форме они не только сходны с бактериями, но и обладают усложненным бактериальным морфотипом, т. е. имеют три мембраны (СМ, ОМ и ICM; см. I том учебника);
— их ICM сходны с бактериальными ICM по строению и выполняемой функции (см. I том учебника);
— они бинарно размножаются с помощью кольца деления, которое во многих случаях состоит из белка, гомологичного бактериальному белку FtsZ (см. раздел 17.4);
— их информационные гены, которые кодируют аппарат репликации/транскрипции/трансляции, гомологичны соответствующим бактериальным генам;
— их гены домашнего хозяйства, которые кодируют генераторы Pmf, субъединицы АТФ-синтазы, регуляторные белки, шапероны, транспортные белки и ферменты конструктивного метаболизма, гомологичны соответствующим бактериальным генам.
Приобретение митохондрий, а следом за ними простых пластид стало одним из крупнейших ароморфозов в эволюции органической жизни. Благодаря этому мир протохимер разделился на многочисленные царства одноклеточных ядерных организмов (сборная группа Protista), а также на царства растений (Plantae), грибов (Fungi) и животных (Animalia).
Если все митохондрии ведут начало от протеобактерий, то пластиды произошли разными путями. Наряду с простыми пластидами, потомками цианобактерий, существуют сложные пластиды — потомки редуцированных одноклеточных водорослей. В состав сложной пластиды, помимо центральной части (кора), которая соответствует простой пластиде, входят рудиментарные СМ и 80S-рибосомы эукариотной клетки, а иногда даже нуклеоморф — гомолог ядра.
20.4.1. Фототрофные ксеносомы
Существует несколько типов фототрофных ксеносом, которые обозначаются общим термином «пластиды» (англ. plastid; от греч. plasma — восковая фигурка и eidos — вид; «нечто оформленное»). Они различаются по происхождению, онтогенезу, функциональным особенностям и физиологической специализации.
Пластиды, за исключением дифференцированных хлоропластов и специализированных пластид (см. ниже), ассимилируют световую энергию в форме АТФ и образуют восстановитель — НАДФН. Восполняемый пул этих субстратов расходуется самой ксеносомой для поддержания метаболических, транспортных, регуляторных и репродуктивных процессов, а также на общие нужды химерной ассоциации. Пластиды осуществляют фотосинтез — комплексный процесс ассимиляции световой энергии и неорганического углерода.
В некоторых случаях пластиды ведут себя как амбивалентные ксеносомы, т. е. наряду со своей основной функцией выполняют побочную, «митохондриальную» функцию. Иными словами, вместо восстановления НАДФ они окисляют его с помощью молекулярного кислорода. Такой процесс называют аэробным хлородыханием, или просто хлородыханием (англ. chlororespiration).
Феномен хлородыхания открыл в начале 1980-х гг. французский биохимик Поль Беннун (Р. Bennoun) на примере лишенного ФСI мутанта F14 Chlamydomonas reinhardtii. Помимо С. reinhardtii способность к хлородыханию выявлена у водорослей Chlorella pyrenoidosa (класс Chlorophyceae) и Mantoniella squamata (класс Prasinophyceae). В хлоропластных геномах широкого круга высших растений — от мхов до однодольных и двудольных покрытосеменных (Marchantía polymorpha, Oryza sativa, Beta vulgaris, Vicia faba и др.) — обнаружены ndh-гены, гомологичные генам субъединиц митохондриальной НАДН-дегидрогеназы. Охарактеризован и продукт экспрессии этих генов: НАД(Ф)Н-дегидрогеназный комплекс, входящий в состав мембраны тилакоида. Молекулярная природа остальных переносчиков в хлородыхательной цепи была неизвестна до тех пор, пока в тилакоидах Arabidopsis thaliana не обнаружили гомолога митохондриальной альтернативной оксидазы (ген immutans).
Хлородыхание обладает всеми признаками биоэнергетического процесса. Во-первых, при нем энергизируется мембрана тилакоида. Во-вторых, как и у большинства аэробных дыхательных систем, в нем участвует терминальная кислородредуктаза. Поэтому его не следует отождествлять с фотодыханием, которое представляет собой поглощение кислорода в оксигеназной реакции, катализируемой RuBisCO. Хлородыхание не имеет ничего общего и с реакцией Мелера (см. раздел 19.1.6.1), связанной со спонтанным восстановлением кислорода в акцепторном участке ФСI.
В чем заключается физиологический смысл хлородыхания? Можно ли считать его рудиментарным биоэнергетическим процессом, поскольку бактериальные предки пластид, скорее всего, обладали бифункциональной электрон-транспортной цепью с цитохром 6/с-комплексом и хинонным пулом, которая альтернативно обеспечивала фотосинтетический и дыхательный транспорт электронов? Если да, то дышащие пластиды и современные цианобактерии унаследовали свою физиологическую амбивалентность от общего предка. Однако, в отличие от темнового дыхания цианобактерий, пластидное хлородыхание протекает без участия цитохром b6/f-комплекса и цитохромоксидазы аа3. Кроме того, скорость хлородыхания составляет ≤10% скорости митохондриального дыхания, т. е. его биоэнергетическое значение ничтожно.
Трудно допустить, что бесполезный биохимический механизм смог бы сохраниться на протяжении миллионов лет эволюции пластид. Скорее всего, реликтовое хлородыхание приобрело вторичный физиологический смысл — в соответствии, с общебиологическим принципом смены функций. Не исключено, что оно определяет эффективность таких глобальных регуляторов энергетического метаболизма, как величина Pmf и редокс-состояние хинонного пула.
Пластиды подразделяются на цианеллы и собственно пластиды.
20.4.1.1. Цианеллы
Цианеллами (англ. cyanelle; от греч. kianeos — синий и лат. уменьшит, оконч. -ella; «маленький живой объект синего цвета») называются фототрофные ксеносомы одноклеточных водорослей класса Glaucocystophyceae. В соответствии с особенностями первичной структуры рРНК они относятся к филе ВХ Cyanobacteria.
Поскольку цианеллы обладают рудиментарными бактериальными признаками, их вначале считали промежуточной стадией эволюции от эндоцитобиотических цианобактерий к простым пластидам — иными словами, «уже» не цианобактериями, но «еще» не пластидами. Позднее победила иная точка зрения, и в настоящее время цианеллы рассматриваются в качестве примитивной ветви простых пластид. Чтобы точнее указать место цианелл среди пластид, Хайнфрид Шенк (Н. Schenk) предложил переименовать их в цианопласты (англ. cyanoplast; от греч. kianeos — синий и англ. plastid — пластида; «синяя пластида»).
Хотя обычно утверждают, что синезеленые цитоплазматические органеллы амебы Paulinella chromatophora в конце XIX в. открыл Лаутерборн (R. Lauterborn), их до него описывали у одноклеточных водорослей Glaucocystis nostochinearum и Gloeochaete ivittrockiana. В 1930-е гг. Пашер (А. Pascher) предложил для них термин «цианелла»; в свою очередь, эндоцитобиотическую ассоциацию с участием цианелл он назвал цианомом (англ. суanomе; от греч. kianeos — синий и лат. оконч. -от для обозначения множества; «совокупность живых объектов синего цвета»).
Протисты, содержащие цианеллы, образуют девять родов класса Glaucocystophyceae. К ним принадлежат подвижные или неподвижные формы; сейчас в коллекциях поддерживаютсячетыре вида (Cyanophora paradoxa, Glaucocystis nostochinearum, Glaucosphaera vacuolata и Gloeochaete wittrockiana).
Признаки, позволяющие рассматривать цианеллы в качестве примитивных пластид, следующие: (1) фикобилисомы вместо антенных комплексов со вспомогательными хлорофиллами (см. II том учебника); (2) периферические ряды обособленных тилакоидов (см. раздел 20.4.1.2); (3) карбоксисомы (см. I том учебника); (4) муреиновый ригидный слой клеточной стенки (см. I том учебника).
Цианеллы имеют сферическую (С. paradoxa; G. unttrockiana) или эллипсоидную (G. nostochinearum; P. chromatophora) форму. На наружной поверхности тилакоидов находятся фикобилисомы. Цианелла окружена оболочкой из двух мембран, которые гомологичны бактериальным СМ и ОМ. Между ними (исключением служит G. vacuolata) расположен муреиновый саккулус. Его толщина (7 нм в случае С. paradoxa) такая же, как у Е. coli, но меньше, чем у цианобактерий. Муреин цианеллы, в отличие от бактериального муреина, не заякорен в ОМ с помощью липопротеина Брауна (см. I том учебника).
Цианеллы, подобно пластидам, являются облигатными эндоцитобионтами, т.е они не размножаются вне хозяина.
Геном цианелл двух исследованных штаммов С. paradoxa имеет размер 130 и 140 т. п.н., что на порядок меньше, чем у цианобактерий, но близко к размеру хлоропластного генома. В геноме цианеллы С. paradoxa присутствуют гены апопротеинов ФСI и ФСII (psaA-C, psal-K, psbA, psbC-F), a также гены апопротеинов фикобилисомы (срсАВ, арсА, apcBDE). Гены субъединиц цитохром b/f-комплекса и АТФ-синтазы высоко гомологичны соответствующим генам хлоропластов. Субъединицы RuBisCO кодируются геномом цианеллы и котранскрибируются так же, как у цианобактерий (у высших растений, Chlorophyceae и Euglenozoa ген малой субъединицы rbcS входит в состав ядерного генома).
Тилакоиды цианелл в темноте преобразуются в сеть тубулярных мембран, или тилакоид-организующий центр (англ. thylakoid-organizing centre). Эта структура эквивалентна проламеллярному телу (англ. prolamellar body) высших растений, при освещении из нее развиваются протилакоиды (см. раздел 20.4.1.2). На свету в цианеллах, как у высших растений, но в отличие от цианобактерий, протохлорофиллид а восстанавливается в хлорофиллид а.
Согласно результатам анализа ядерных генов, кодирующих рРНК цитоплазматических рибосом, хозяева цианелл имеют монофилетичное происхождение и лока-
лизуются в кроне эволюционного древа Еuсагуа. Цианеллы также монофилетичны, хотя их величина, форма и ультраструктурные детали (в частности, морфология карбоксисом) сильно варьируют.
G. vacuolata обладает рядом морфологических особенностей, отличающих ее от других Glau- cocystophyceae, что дает основание пересмотреть таксономический статус этого микроорганизма и поместить его в класс Rhodophyceae (красные водоросли), тем более что в данном случае ксеносома расположена на эволюционном древе Cyanobacteria по соседству с родопластами — простыми пластидами красных водорослей.
Таким образом, цианеллы — это примитивная, относительно слабо дивергировавшая внутри себя ветвь пластид и единственный пример энергетических ксеносом, которые в ходе эволюции сохранили бактериальную клеточную стенку.
20.4.1.2. Собственно пластиды
Собственно, пластиды подразделяются на простые пластиды, сложные пластиды и специализированные пластиды.
Простые пластиды (англ. simple plastid). Простые пластиды монофилетичны и произошли от цианобактерий. Сложные пластиды, напротив, полифилетичны и возникли в результате серии однотипных вторичных эндоцитобиозов между двумя ядерными клетками — митохондриальным протестом, по типу питания фаготрофом, который стал хозяином, и одноклеточной водорослью с простыми пластидами, которая стала ксеносомой.
Таким образом, если простые пластиды являются гомологами бактериальной клетки, то сложные пластиды — это в разной степени редуцированные ядерные эндоцитобионты. Они окружены оболочкой из трех или четырех мембран, часть которых имеет бактериальное, а часть — эукариотное происхождение.
Хотя первичный эндоцитобиоз, приведший к образованию простых пластид, состоялся около 1,5 млрд, лет назад, древнейшие ископаемые останки микроорганизмов со сложными пластидами (класс Dinozoa) имеют возраст не более 250 млн. лет. Почему же тогда вторичный эндоцитобиоз на протяжении 1,25 млрд. лет не приводил к появлению сложных пластид? Скорее всего, периодически возникавшие вторичные эндоцитобиотические ассоциации элиминировались, поскольку не обладали преимуществами перед первичными эндоцитобиотическими ассоциациями.
Появление микроорганизмов со сложными пластидами было связано со снижением концентрации атмосферного СО2 к концу палеозоя. Известно, что в пермском периоде она была втрое меньше современной, в результате чего уровень растворенного неорганического углерода (англ. dissolved inorganic carbon, DIC) стал лимитировать фотосинтез в древнем Океане.
DIC представлен четырьмя взаимно превращающимися формами (Н2О + СО2 <-> Н2СО3 <-> Н+ + НСО-3 <-> 2Н+ + СО3-). Реальное соотношение их концентраций зависит от кислотности среды. При слабокислом pH преобладает СО2, а при слабощелочном (характерном для морской воды) DIC представлен главным образом НСО-3.
Субстратом реакции карбоксилирования, катализируемой RuBisCO, служит СО2 (см. II том учебника). Поскольку сложные пластиды находились в фагоцитарной вакуоли, где DIC из-за закисления был представлен только СО2, они обладали преимуществом перед простыми пластидами, расположенными непосредственно в цитоплазме. Видимо, это и позволило вторичным симбиозам приобрести устойчивый характер, а затем закрепиться в процессе эволюции.
Еще раз подчеркнем, что простые пластиды являются потомками облигатно эндоцитобиотических бактерий и принадлежат к филе ВХ Cyanobacteria. О монофиле- тичности этих органелл свидетельствует гомология пластидных генов rrs (кодируют 16S рРНК), генов psbA (кодируют апопротеин ядра реакционного центра ФСII), генов tufА (кодируют фактор элонгации EF-Tu), а также генов dtpВ (кодируют fl- субъединицу интегрального домена АТФ-синтазы) у разных растений.
По мере преобразования цианобактерии в простую пластиду ее геном уменьшился почти на порядок. Часть генов была необратимо утрачена, другие путем горизонтального переноса вошли в состав ядерного генома. У большинства простых пластид геном имеет размер 120-150 т. п. н. (120 и более открытых рамок считывания). Протеом простых пластид состоит из 2-5 тыс белков, большинство из которых кодируется ядерным геномом, транслируется в цитоплазме клетки-хозяина и импортируется в пластиду.
Мембранный аппарат простых пластид обнаруживает удивительное сходство с мембранным аппаратом цианобактерий. В него входят: двойная мембранная оболочка и внутренняя система уплощенных мембранных цистерн, которые называются тилакоидами (англ. thylakoid; от греч. thylakoeides — мешковидный). Систему тилакоидов также называют ламеллярной системой. В нефотосинтезирующих простых пластидах — пропластидах и этиопластах — ламеллярная система практически отсутствует (см. ниже).
Внутренняя мембрана оболочки простой пластиды гомологична СМ цианобактерий. В ней обнаружены ксантофиллы в комплексе с белком. Компоненты транслоказного комплекса (Tic20, Tic22 и Tic55) и большинство шаперонов, контролирующих импорт белка в пластиду, также принадлежат к цианобактериальному типу. Что касается внешней мембраны, то ее происхождение дискуссионно. Это либо производное фагосомной мембраны хозяина, либо производное ОМ эндоцитобионта. В пользу первого свидетельствуют анастомозы внешней мембраны с мембранами эндоплазматического ретикулума, а также с другими элементами эндомембранной системы хозяина. На вторую возможность указывают «бактериальные» липиды внешней мембраны (фосфатидилглицерол и моногалактозилдиглицерид: см. I том учебника). То, что в наружном полумембранном листке внешней мембраны отсутствуют липополисахариды, а во внутренний полумембранный листок входит типичный для эукариотов фосфатидилхолин, можно объяснить упрощением липидного состава ОМ эндоцитобионта, а также заменой ее компонентов. Во внешней мембране присутствуют порины (см. 1 том учебника), состоящие из нескольких интегральных β-цепей и сходные с бактериальными поринам; среди них выявлены как неспецифические, так и селективные порины (ОЕР16, ОЕР21 и ОЕР24). Во внешней мембране содержатся транспортные белки, которые могут иметь бактериальное (Тос75), эукариотное (Тос159) или химерное (Тос34) происхождение.
Предполагается, что общий предок простых пластид синтезировал хлорофиллы а/b наряду с фикобилипротеинами. В ходе эволюции одна ветвь его потомства лишилась антенн с хлорофиллами а/b, но сохранила фикобилииротеиновые антенны. У другой ветви, наоборот, сохранились антенны с хлорофиллами а/b, но исчезли фикобилипротеиновые антенны. Результатом альтернативной редукции антенн стали два типа простых пластид — родопласты и хлоропласты. Они имеют разную морфологию ламелл, компоненты фотосинтетического аппарата по-разному распределены в плоскости тилакоида, а светособирающая антенна по-разному возбуждает две фотосистемы.
Родопласты (англ. rhodoplast; от греч. rodon — роза и англ. plastid — пластида; красная пластида). Простые пластиды этого типа имеются у представителей двух классов водорослей — Rhodophyceae и Glaucocystophyceae.
Родопласты содержат хлорофилл а и фикобилипротеины, образующие периферическую антенну-фикобилисому (см. II том учебника). ФСI и ФСII равномерно распределены в плоскости мембраны тилакоида, причем фикобилисома избирательно взаимодействует с ФСII. Тилакоиды родопластов не «слипаются» друг с другом.
Хлоропласты (англ. chloroplast; от греч. chloros — зеленый и англ. plastid — пластида; зеленая пластида). Простые пластиды этого типа характерны для двух классов водорослей: Chlorophyceae (зеленых водорослей) и Prasino- phyceae, а также для высших растений.
Хлоропласты содержат хлорофиллы а/b; единственное исключение — это хлоропласты празинофитов, которые содержат хлорофиллы a/b/с.
Хлоропластный геном (cpDNA, сокр. англ. chloroplastic) имеет размер 150 т. п. н., что недостаточно для самостоятельного биогенеза фотосинтетического аппарата. Поэтому за исключением генов, кодирующих рРНК, мРНК, а также генов ~100 наиболее консервативных полипептидов генетические детерминанты пластид находятся в ядре хозяина, куда они переселились по мере эволюции эндоцитобиотической ассоциации.
Как уже отмечалось, фотосинтезирующие хлоропласты содержат тилакоиды.
В отдельных участках ламеллярной системы тилакоиды за счет взаимной адгезии объединяются в пачки, или граны (лат. granum — зерно). Тилакоиды, не объединенные в граны, называются тилакоидами стромы (греч. stroma — ложе). Тилакоиды, образующие грану, соединяются с 2-12 тилакоидами стромы при помощи трубчатых анастомозов.
Фотосистемы распределены в плоскости тилакоида неравномерно. Примерно 80% ФСII и светособирающей антенны (содержащей хлорофиллы а/b) сосредоточены в гранальных участках. В свою очередь, до 90% ФСI и вся АТФ-синтаза связаны с ламеллами стромы. Цитохром b/f-комплекс, напротив, равномерно распределен между гранальными и стромальными участками.
Размер хлоропластов высших растений варьирует в зависимости от хозяина, а гранальные участки различаются по величине и пространственной ориентации. Растения, вегетирующие при высокой освещенности, содержат «светолюбивые» (англ. sun-type) хлоропласты с гранами уменьшенного размера, и число дисков в гране может сокращаться до двух. В отличие от этого «теневыносливые» (англ. shade-type) хлоропласты растений, растущих при низкой освещенности, обладают хорошо развитой гранальной системой с крупными гранами.
Ультраструктура мембран хлоропластов отклоняется от гранального типа в клетках ситовидных трубок, в обкладке С4-растений, образующих в качестве первичного продукта ассимиляции СО2 органические кислоты, а также в паренхиме CAM-растений (сокр. англ. crassulacean acid metabolism), которые в условиях резких суточных колебаний температуры временно запасают ассимилированный углерод в форме органических кислот.
Характерные изменения в хлоропластах происходят при избыточном накоплении запасных продуктов, в частности белков и липидов. Белки в хлоропластах многих представителей Chlorophyceae и некоторых видов Anthocerotae хранятся в пиреноиде (англ. pyrenoid; от греч. руrеn — зерно и eidos — подобие). Пиреноид встречается и в пластидах других типов, например, в сложных хромопластах водорослей из класса Cryptophyceae. Это электроноплотное включение, не окруженное мембраной и состоящее в основном из RuBisCO (см. I том учебника). Таким образом, роль пиреноида не ограничивается запасанием белка; он участвует и в ферментативных процессах. В некоторых случаях, например, в пластидах Cryptophyceae, Rhodophyceae и Bacillariophyceae, тилакоиды по одному или по два пронизывают тело пиреноида.
Альтернативный способ запасания белка использует дифференцированная форма хлоропласта — протеинопласт (англ. proteinoplast; от protein — белок и plastid — пластида; белковая пластида) многих покрытосеменных растений. Белковый материал скапливаются в аморфном, иногда кристаллическом теле, окруженном мембраной.
Вместо белков дифференцированные хлоропласты некоторых высших растений накапливают липиды, образующие осмиофильные гранулы. В этом случае их называют элайопластами (англ. elaioplast; от греч. elaion — масло и англ. plastid — пластида; липидная пластида); такие пластиды, в частности, содержатся в клетках выделительных железок цветковых растений.
У высших растений существует онтогенетическое семейство пластид, к которому помимо хлоропластов относятся пропластиды, этиопласты, простые хромопласты и амилопласты (рис. 281).
Рис. 281. Онтогенетическое семейство пластид высших растений. Объяснение в тексте.
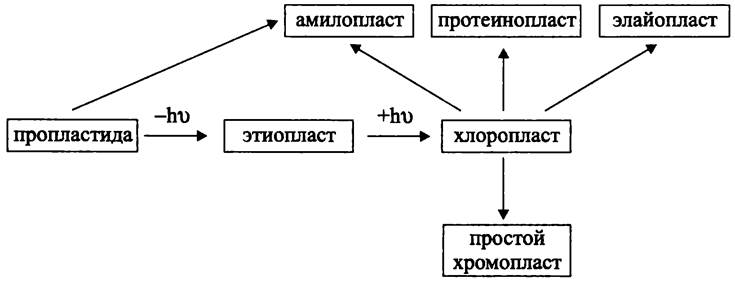
Пропластидами (англ. proplastid; от греч. pro — до и англ. plastid — пластида; предшественник пластиды) называются пластиды меристематической, или находящейся в состоянии роста ткани высших растений. Они содержат слабо развитую систему тилакоидов, которые соединяются с внутренней мембраной оболочки.
В результате дифференциации пропластид образуются хлоропласты, а также:
— этиопласты (бесцветны; содержат комплекс тубулярных мембран, или проламеллярное тело; образуются из пропластид; на свету превращаются в хлоропласты);
— простив хромопласты (ярко окрашены вследствие накопления каротиноидов; образуются из хлоропластов);
— амилопласты (бесцветны; накапливают крахмал; образуются из пропластид или хлоропластов).
Пластиды, образующиеся из пропластид или хлоропластов, а также нефотосинтезирующие хлоропласты паразитических высших растений сохраняют хромосому, хотя во втором случае в ней делетированы многие гены.
Помимо клеток меристемы высших растений, пропластиды содержатся в меристематических клетках представителей классов Chlorophyceae, Phaeophyceae (бурые водоросли) и Rhodophyceae. Дифференциация пропластид связана со стадией онтогенеза растения-хозяина. Как правило, в пропластидах присутствуют элементы эндомембранной системы. У пропластид Rhodophyceae имеется периферический тилакоид, у Phaeophyceae — опоясывающая ламелла (англ. girdle lamella), тогда как в пропластидах сифональных Chlorophyceaeнемногочисленные тилакоиды образуют полимембранное терминальное тело (англ. terminal body). В любом случае в пропластидах присутствует примордиальная система мембран, из которых развиваются тилакоиды.
Этиопласты (англ. etioplast; от etiolate — отбеливать и plastid — пластида; бесцветная пластида) развиваются из пропластид у растений, выращенных в темноте. У них заблокирован биосинтез хлорофиллов а/b, однако накапливается их предшественник — протохлорофиллид (см. II том учебника), а также образуется немного каротиноидов. За исключением зачаточных гранальных участков, содержащих сдвоенные тилакоиды, в этиопластах не развита ламеллярная система. Этиопласты содержат АТФ-синтазу, цитохромы и растворимые переносчики электронов, в частности ферредоксин и пластоцианин, однако у них отсутствуют реакционные центры ФСI и ФСII, а также светособирающая антенна.
Характерным морфологическим признаком этиопластов служит проламеллярное тело (англ. prolamellar body, PLB). Это паракристаллическая решетка с гексагональным, квадратным или скошенным профилем, состоящая из тетрамеров белковых субъединиц. От ее периферии в строму расходятся зачатки протилакоидов (англ. prothylakoid, РТ), однако биогенез собственно тилакоидов заблокирован.
Проламеллярное тело обогащено галактолипидами и каротиноидами, а также содержит протохлорофиллид, который с помощью НАДФН-зависимой редуктазы превращается на свету в хлорофиллы а/b. Примерно за сутки происходит позеленение (англ. greening) этиопласта, и он последовательно дифференцируется в этиохлоропласт и хлоропласт. Позеленение сопровождается образованием ламеллярной системы с полным набором компонентов оксигенного фотосинтетического аппарата.
Простые хромопласты (англ. chromoplast; от греч. chroma — цвет и англ. plastid — пластида; окрашенная пластида) обогащены желтыми, оранжевыми и красными каротиноидами, что служит причиной пестрой окраски стареющих листьев. Яркая пигментация цветков, плодов и корней также часто связана с образованием хромопластов, избирательно накапливающих каротиноиды.
Простые хромопласты имеют причудливую, например, амебоидную форму. Способов накопления каротиноидов у них четыре: (1) каротиноиды совместно с другими липидами образуют в строме осмиофильные включения, или пластоглобулы (англ. plastoglobule; от англ. plasticl — пластида и лат. globula — шарик); (2) каротиноиды образуют кристаллические включения, состоящие из β-каротина/ликопина и расположенные внутри тилакоидов или рядом с ними; при увеличении в размере они даже деформируют хромопласт; (3) каротиноиды накапливаются в тубулярных эндомембранах, на образование которых идет липидный материал пластоглобул; (4) каротиноиды накапливаются в ламеллярных эндомембранах, которые образуются не из ламелл стромы или гран, а за счет инвагинации внутренней мембраны оболочки хромопласта.
Амилопласты (англ. amyloplast; от греч. amilon — крахмал и англ. plastid — пластида; крахмальная пластида) запасают крахмал. Совместно с протеинопластами и элайопластами их раньше называли лейкопластами (англ. leucoplast; от греч. leikos — белый и англ. plastid — пластида; белая пластида), хотя отсутствие или низкое содержание пигментов служит общим признаком пластид с разным запасным материалом и неодинаковой онтогенетической историей.
Способность временно накапливать крахмал характерна для Chlorophyceae и высших наземных растений, у которых он выполняет функцию пула углерода и расходуется при снижении фотосинтетической активности. На перманентной основе крахмал накапливается в специализированных амилопластах органов и тканей высших растений. Прежде всего, это запасающие ткани, хотя амилопласты также содержатся в клетках меристемы и корневого чехлика.
Амилопласты имеют преимущественно сферическую форму и запасают крахмал, который откладывается в строме в виде мелких гранул или одной крупной гранулы.
Сложные пластиды (англ. complex plastid). Сложные пластиды произошли путем вторичного эндоцитобиоза, т. е. не от эндоцитобиотических бактерий, а от эндосимбиотических фототрофных протистов, уже содержавших простые пластиды. В соответствии с происхождением и пигментным составом они подразделяются на две группы.
К первой группе относятся сложные хлоропластом. Они содержат хлорофиллы а/b и характерны для водорослей, относящихся к классу Chlorarachniophyceae, а также для протистов из класса Euglenozoa. Согласно результатам секвенирования 18S рРНК, они произошли от эндоцитобиотических Chlorophyceae (зеленых водорослей). Сложные хлоропласты сходны с простыми хлоропластами по составу пигментов светособирающей антенны и строению ламеллярной системы; в функциональном отношении между ними также нет принципиальных различий.
Ко второй группе относятся сложные хромопласты. Они произошли от эндоцитобиотических Rhodophyceae, содержат хлорофиллы а/с (иногда совместно с фикобилипротеинами) и характерны для водорослей, относящихся к сборной группе «Chromista» (классы Bacillariophyceae, Chrysophyceae, Cryptophyceae, Eustigmato- phyceae, Haptophyceae, Phaeophyceae, Raphidophyceae и Xanthophyceae), а также для протистов из класса Dinozoa.
Сложные хлоропласты. Сложные пластиды Chlorarachniophyceae окружены четырьмя мембранами (рис. 282). Две внутренние мембраны принадлежат простой пластиде. Третья, промежуточная мембрана представляет собой рудиментарную СМ эукариотного эндоцитобионта. Четвертая, внешняя мембрана, или мембрана хлоропластного эндоплазматического ретикулума (англ. chloroplast endoplasmic reticulum, CR) происходит от мембраны фагосомы хозяина.
Между наружным и внутренним дублетами мембран находится перипластидное пространство (англ. periplastid space), которое соответствует рудиментарному цитоплазматическому компартменту эукариотного эндоцитобионта. В нем находится рудиментарное ядро, или нуклеоморф (англ. nucleomorph; от лат. nucleus — ядро и греч. morphe — образ).
Рис. 282. Схема клетки со сложной пластидой. NU — ядро; NC — ядрышко; MI — митохондрия; ER — эндоплазматический ретикулум; ВС — бактериальная хромосома; ЕС — эукариотная хромосома; 70S и 80S — рибосомы; СР — сложная пластида; CR — хлоропластный эндоплазматический ретикулум; NM — нуклеоморф; PS — перипластидное пространство; SP — простая пластида.
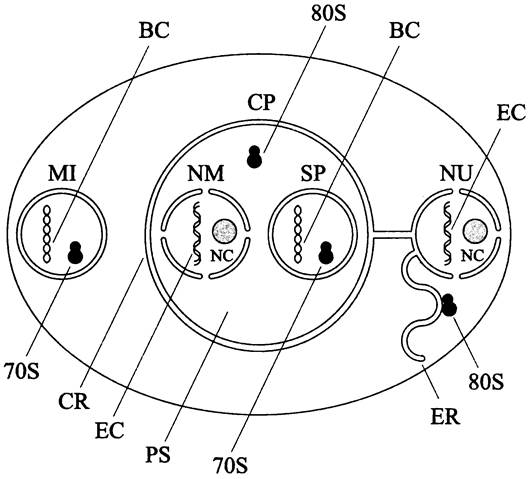
Нуклеоморф имеет двойную мембранную оболочку с порами. Его деление происходит без конденсации хроматина и образования митотического веретена. Геном нуклеоморфа размером 400- 600 т.п.н. содержит 200-300 генов. К ним относятся информационные гены, гены домашнего хозяйства, а также гены белков, которые экспортируются во внутреннюю часть (кор) ксеносомы. В частности, это ген тубулин-подобного белка FtsZ, из которого формируется кольцо деления простой пластиды.
По аналогии с геномом цианелл, который входит в число самых малых прокариотных геномов (~150 т. п. н.), геном нуклеоморфа является минимальным эукариотным геномом. Изучение таких бонсай-геномов (англ. bonsai genome; от японского названия карликового декоративного растения) важно для понимания эволюции генных структур у низших эукариотов.
Помимо нуклеоморфа в перипластидном пространстве находятся 80S-рибосомы. Таким образом, в сложных пластидах сосуществуют две популяции рибосом (рис. 282). Бактериальные 703- рибосомы локализованы в коре ксеносомы, их 16S рРНК кодируется геномом простой пластиды. Эукариотные 80S-рибосомы расположены в перипластидном пространстве, их 18S рРНК закодирована в геноме нуклеоморфа.
Протисты из класса Euglenozoa примыкают к водорослям из класса Chlorarach- niophyceae благодаря общему происхождению путем вторичного эндоцитобиоза между фаготрофными протестами и одноклеточными зелеными водорослями. В пользу этого свидетельствует сходство морфологии ламеллярной системы, одина-
ковый набор хлорофиллов, гомология антенных апопротеинов, а также гомология гена rbcS, кодирующего малую субъединицу RuBisCO.
Хлоропласты Euglenozoa окружены не четырьмя, а тремя мембранами, что объясняется редукцией промежуточной мембраны — рудиментарной СМ эукариотного эндоцитобионта. Нуклеоморф также был утрачен в ходе внутриклеточной эволюции эндоцитобионта, однако часть его генов успела переселиться в ядро хозяина. Пластиды ~30% видов эвгленоидов вторично редуцированы; многие из таких бесцветных форм способны к фаготрофии.
Сложные хромопласты (англ. complex chromoplast). У представителей сборной группы «Chromista» (за исключением Cryptophyceae, сложные хромопласты которых имеют одинаковую структуру со сложными хлоропластами, в частности, содержат нуклеоморф) эти органеллы обладают рядом общих структурных признаков. Прежде всего, они окружены четырьмя мембранами. Периферическая мембрана, или мембрана хлоропластного эндоплазматического ретикулума покрыта рибосомами и переходит во внешнюю мембрану ядерной оболочки хозяина. В отличие от сложных пластид Chlorarachniophyceae и Cryptophyceae внутренний и наружный дублеты мембран тесно примыкают друг к другу.
Сложные хромопласты «Chromista», за исключением Cryptophyceae и Eustigmatophyceae, содержат периферическую антенну, в которую входят хлорофиллы а/с. У сложных хромопластов Cryptophyceae светособирающая антенна двух типов — интегральная (содержит хлорофиллы а/с) и периферическая (содержит фикобилипротеины, но, в отличие от фикобилисомы, расположена на внутренней, а не на внешней поверхности тилакоида). Сложные хромопласты Eustigmatophyceae обладают интегральной антенной с вторично упрощенным пигментным составом (только один хлорофилл — а).
У сложных хромопластов Chromista фотосистемы равномерно распределены в плоскости тилакоида. Интегральные и периферические антенны одновременно взаимодействуют с ФСI и ФСII. В отличие от тилакоидов сложных хлоропластов, тилакоиды сложных хромопластов не образуют граны.
Протистов из класса Dinozoa рассматривают как сестринскую группу сборной группы «Chromista». У большинства фотосинтезирующих видов Dinozoa хромопласт окружен тремя мембранами. До половины видов динофлагеллят вторично потеряли пластиды и перешли на фаготрофное питание.
Специализированные пластиды. Специализированными пластидами (англ. specialized plastid) называются такие ксеносомы, которые содержат реакционные центры и светособирающие антенны, а также обладают слаборазвитой ламеллярной системой, но практически бесцветны из-за низкого содержания хлорофилла и каротиноидов. Они слабо ассимилируют световую энергию, что не позволяет провести функциональную параллель между ними и квази-фототрофными бактериями (см. II том учебника).
Известны два примера специализированных пластид — апикопласты Apicomplexa и тилакосомы амебоидных жгутиконосцев.
Апикопласты. Внутриклеточные паразитические протисты из группы Apicomplexa (Eimeria tenella, Plasm.odium falciparum. Sarcocystis muris, Toxoplasma gondii и др.) содержат два генома с материнским типом наследования. Один из них соответствует митохондриальному геному размером ~7 т. п. н. Другой, размером ~35 т. п. н., представляет собой кольцевую группу сцепления, содержащую хлоропластные гены rроВС (кодируют субъединицы РНК-полимеразы), tufA (кодирует фактор элонгации Tu) и clpC (кодирует субъединицу протеазы).
С помощью гибридизации in situ показано, что ген 16S рРНК входит в состав более крупного генома Т. gondii и экспрессируется в цитоплазматических органеллах, которые раньше описывались под названиями сферическое тело (англ. spherical body), полимембранная вакуоль (франц. vacuole plurimembranaire) и полый цилиндр (нем. Hohlzylinder). В настоящее время их называют апикопластами (англ, api- coplast). По строению они сходны со сложными пластидами: окружены четырьмя мембранами, размножаются бинарным делением и заполнены частицами диаметром ~18 нм, очень похожими на 70S-рибосомы.
Сходство апикопластов со сложными пластидами подтверждается результатами филогенетического анализа. В частности, ген фактора элонгации (tufА) у этих ксеносом гомологичен гену фактора элонгации у сложных пластид Dinozoa.
Апикопласты во многом вспоминают сложные пластиды, но неспособны к фотосинтезу, хотя при помощи высокочувствительной жидкостной хроматографии, а также низкотемпературной флуоресцентной спектроскопии в них обнаружены следы протохлорофиллида а и хлорофилла а. Кроме того, в геномах ксеносом Т. gondii и S. mûris с помощью PCR-реакции и саузерн-блот гибридизации выявлен ген psbA, кодирующий «каркасный» полипетид D1 реакционного центра ФСII.
Любопытно, что паразитические Apicomplexa, в частности малярийный плазмодий, чувствительны к триазиновым гербицидам и DCMU, которые действуют на уровне акцепторного участка ФСII (иными словами, малярию можно лечить ингибиторами фотосинтеза!).
Тилакосомы. Специализированные пластиды этого типа характерны для амебоидных жгутиконосцев, первый представитель которых, Psalteriomonas lanterna, был выделен в начале 1990-х гг. в окрестностях Наймегена (Нидерланды). Этот свободноживущий микроаэроб не содержит пластид, митохондрий, микротелец и диктиосом; в нем слабо развит эндоплазматический ретикулум. На обеих стадиях развития, амебоидной и жгутиковой, в клетках обнаруживаются гидрогеносомы (см. раздел 20.4.2), а также 10-20 цитоплазматических органелл с ламеллами, напоминающими тилакоиды. Из-за внешнего сходства с пластидами такие ксеносомы были названы тилакосомами (англ. thylakosome). В начале своего онтогенеза они похожи на этиолированные (т. е. имеющие неразвитую пигментную систему) хлоропласты или на хромопласты, позже — на цианобактерии, в зрелом состоянии — на пластиды Apicomplexa.
Тилакосомы содержат ДНК, что доказывается окрашиванием флуорохромами бромистым этидием и диамидинофенилиндолом. В геноме этой органеллы содержатся гены рРНК с инвертированными повторами, что характерно для пластид. Строма тилакосомы характерно гранулирована, что говорит о присутствии рибосом; кроме того, иммуномикроскопическим методом в ней выявлена RuBisCO.
С помощью высокочувствительной жидкостной хроматографии и масс-спектроскопии у P. lanterna обнаружены следы хлорофилла а и каротиноидов. Тилакосомы содержат гены psaA и psbB, об экспрессии которых косвенно свидетельствует выделение кислорода на свету и поглощение кислорода по типу реакции Мелера.
В то же время тилакосома содержит цитохромоксидазу аа3-типа и обладает слабой темновой дыхательной активностью.
Таким образом, апикопласты Apicomplexa проявляют способность к рудиментарному фотосинтезу, а тилакосомы амебоидных жгутиконосцев — к рудиментарному фотосинтезу и рудиментарному аэробному дыханию. Каково же физиологическое значение специализированных пластид для микроорганизмов, ведущих паразитиче-
ское или гетеротрофное существование в слабо освещенных микроаэробных нишах? Ответа на этот вопрос пока нет, но — судя по тому, что эти ксеносомы сохранились на протяжении сотен миллионов лет эволюции — они выполняют какую-то важную метаболическую или регуляторную функцию.
20.4.2. Хемотрофные ксеносомы
В отличие от фототрофных ксеносом, хемотрофные ксеносомы обладают только катаболической системой, с помощью которой энергия ассимилируется в форме АТФ.
Хемотрофные ксеносомы подразделяются на митохондрии, гидрогеносомы и митосомы.
Митохондрии. Классический термин «митохондрия» (англ. mitochondrion; от греч. mitos — нить и chondros — зерно; «похожая на гирлянду») указывает не на функциональную специализацию этих органелл, а лишь подчеркивает их форму, причем весьма специфическую — в кардиомиоцитах млекопитающих.
Согласно результатам анализа первичной структуры 16S рРНК, митохондрии растений, грибов и протистов занимают взаимно обособленное положение на дендрограмме класса «Alphaproteobacteria». Точнее сказать, они произошли от разных пурпурных бактерий, что подтверждается разным размером мДНК, а также различиями в структуре и экспрессии митохондриальных генов. В ходе эндоцитобиотической эволюции эти бактерии потеряли пигментный аппарат и перешли на хемотрофию.
Мыслится следующий сценарий происхождения митохондрий. Путем эндоцитоза в цитоплазму протоэукариотного хозяина проникла пурпурная бактерия. Система ассимиляции энергии у нее была амбивалентной, т. е. позволяла использовать и энергию света, и энергию химических субстратов (напомним, что в первом случае цитохром bс-комплекс заполняет электронную вакансию в первичном доноре реакционного центра, а во втором случае — восстанавливает цитохромоксидазу; см. II том учебника). По мере превращения эндоцитобионта в органеллу у него исчезла пигментная система, но сохранилась электрон-транспортная цепь, используемая при дыхании.
Энергетическая специализация митохондрий и их метаболическая интеграция в эндоцитобиотическую систему основаны на экспорте АТФ в цитоплазму хозяина с помощью АДФ: АТФ-транслоказы. В матриксе митохондрии происходит окислительное декарбоксилирование пирувата. Катализатором этой реакции служит СоА- зависимая пируватдегидрогеназа; образующийся ацетил-СоА поступаеит в цикл Кребса (см. II том учебника). Кофакторы дегидрогеназ, участвующих в этом цикле (НАД(Ф)Н и ФАДН2), передают электроны дыхательной цепи, и при этом создается Pmf.
«Классический» вариант митохондрий — это аэробные митохондрии гепатоцитов человека, содержащие терминальную оксидазу цитохром aа3-типа. Роль акцептора электронов выполняет молекулярный кислород. Иногда при низком парциальном давлении кислорода митохондрии переходят на анаэробное дыхание (примером служит нитратное дыхание гриба Fusarium oxysporum и некоторых ресничных инфузорий, а также фумаратное дыхание трипаносомид и плоских червей). В онтогенезе нематоды Ascaris suum аэробное дыхание сменяется фумаратным дыханием. Наконец, в митохондриях анаэробной инфузории Nyctotherus sp. происходит субстратзависимое фосфорилирование АДФ, что позволяет рассматривать эти органеллы как переходную форму от собственно митохондрий к другим хемотрофным органеллам — гидрогеносомам (см. ниже).
По степени генетической автономии митохондрии уступают пластидам; в данном случае эндоцитобионт максимально зависим от хозяина. Так, в геноме митохондрии ретортомонады Reclinamonas americanus всего 97 гена, в то время как в пластидный геном красной водоросли Porphyra purpurea входят 253 гена.
В мДНК закодированы только тРНК и несколько белков; остальные митохондриальные гены переселились в ядро. Митохондрии имеют такой же морфотип, как и грамотрицательные бактерии; правда, в отличие от цианелл, они не сохранили ригидный слой клеточной стенки. За единственным исключением (у хромофитных водорослей), деление митохондрий осуществляется перетяжкой, хотя и без участия «бактериального» белка деления FtsZ (см. раздел 17.4.5).
По аналогии с хлopoпластами, которые проходят онтогенетическую стадию пропластиды, митохондрии проходят стадию промитохондрии. Но если в зрелых митохондриях имеются кристы — гомологи бактериальных ICM (которые содержат дыхательную цепь и развиваются соразмерно энергетическим потребностям хозяина), в промитохондриях они отсутствуют.
Кристы соединяются с внутренней мембраной оболочки митохондрии при помощи стебелька- перемычки. Вопреки своему названию, кристы (лат. crista — гребень) не только имеют разную форму у разных организмов, но и изменяют ее в зависимости от метаболического статуса органеллы.
Кристы митохондрий у растений, грибов и животных преимущественно ламеллярные, хотя в последнем случае встречаются тубулярные и призматические варианты. У протистов в митохондриях встречаются кристы тубулярной, тубуло-везикулярной, везикулярной, дискоидной, ламеллярной, а также нерегулярной формы. Геометрия крист учитывается в систематике протистов, а ее разнообразие служит дополнительным свидетельством полифилетического происхождения митохондрий.
Биогенез митохондрий в большей степени, чем биогнез пластид, зависит от хозяина.
Как уже отмечалось, ядерно-цитоплазматические системы кодируют и синтезируют 95-98% митохондриальных белков, а сами митохондрии — лишь несколько гидрофобных полипептидов. К ним, в частности, относятся: апоцитохром b6, три субъединицы цитохромоксидазы aa3 и OSCP- субъединица протон-транслоцирующей АТФ-синтазы (сокр. англ. oligomycin sensitivity conferring protein).
Остальные митохондриальные белки синтезируются в цитоплазме хозяина в виде препротеинов, содержащих N-концевые транзитные пептиды. В ходе многоэтапного процесса, при котором используется энергия гидролиза АТФ, препротеины распознаются рецепторами, расположенными на поверхности митохондрии, и приобретают развернутую конформацию. Затем они проникают в матрикс через зоны адгезии между двумя мембранами оболочки митохондрии.
Дальнейший таргетинг белков осуществляется с помощью шаперона Hsp60 — гомолога бактериального шаперона GroEL (см. раздел 18.1.2). Часть белков реэкспортируется в пространство между мембранами оболочки митохондрии; примечательно, что секреция осуществляется с помощью Sec- системы бактериального типа (см. I том учебника).
Митохондрии филогенетически древнее пластид. На пути внутриклеточной эволюции (фагоцитированная бактерия —> облигатный эндоцитобионт —> ксеносома —> митохондрия) произошли глубокие генетические изменения, которые обеспечили физиологическую специализацию митохондрии: (1) делеция генов, кодирующих апопротеины фотосинтетического реакционного центра, а также апопро- теины светособирающей антенны; (2) делеция генов, кодирующих дегидрогеназы, специфичные по отношению к неорганическим субстратам; (3) делеция генов, отвечающих за углеродную автотрофию; (4) селекция терминального участка электрон-транспортной цепи по признаку повышения сродства к молекулярному кислороду.
Точная датировка процессов, связанных с приобретением митохондрий эукари- отной клеткой, отсутствует. В свое время кандидатом на роль «первично амитохондриальных» протистов считали сборную группу Amitozoa, которая находится в основании ствола родословного древа Еuсаrуа и в которую входят микроспоридии Giardia, Entamoeba и Trichomonas. Сейчас Amitozoa рассматриваются в качестве «вторично амитохондриальных» протистов (см. I том учебника). Иными словами, у их предков вначале были митохондрии, а потом они их потеряли. В доказательство приводится тот факт, что в ядерном геноме Е. histolytica сохранились гены митохондриального типа. Вероятно, исчезновение митохондрий в филогенезе протистов было таким же закономерным явлением, как и исчезновение пластид.
Гидрогеносомы. Термином «гидрогеносома» (англ. hydrogenosome; от лат. hydrogenium — водород и греч. soma — тело; «частица, выделяющая водород») обозначается сборная группа хемотрофных ксеносом, побочным продуктом метаболизма которых служит молекулярный водород. Некоторые варианты гидрогеносом филогенетически близки митохондриям.
Гидрогеносомы встречаются у трихомонад, ресничных инфузорий (Metopus соnsortus, Plagiopyla frontata) и амебоидных жгутиконосцев (Psalteriomonas lantema), а также у хитридиомицетов. В качестве побочных продуктов метаболизма они выделяют молекулярный водород и ацетат.
Подобно митохондриям, гидрогеносомы имеют оболочку из двух мембран. Иногда они содержат мембранные структуры, напоминающие кристы. Деление этих органелл осуществляется с помощью бактериального механизма, перетяжкой (хотя, как у митохондрий, белок деления FtsZ у них отсутствует). По аналогии с митохондриями, гидрогеносомы импортируют хозяйские белки, препротеины которых содержат концевые транзитные пептиды. Среди них выявлены гомологи митохондриальных шаперонов — белки Hsp10, Hsp60 и Hsp70. Белок, переносящий АТФ из гидрогеносомы в цитоплазму хозяина (АДФ: АТФ-транслоказа), также гомологичен митохондриальному.
Гидрогеносомы и митохондрии различаются по механизму окислительного декарбоксилирования пирувата.
Митохондрии окисляют пируват с помощью НАД-зависимой пируватдегидрогеназы:
СН3- СО-СОО- + CoASH + НАД —> СН3-СО ~ SCoA + СO2 + НАДН.
Ловушкой для электронов служит дыхательная цепь, переносящая их от НАДН к терминальному акцептору — молекулярному кислороду.
В то же время гидрогеносомы окисляют пируват при помощи ферредоксинзависимой пиру- ват: ферредоксин-оксидоредуктазы:
СН3-СО-СОО- + CoASH + 2ФДоХ —> СН3-СО ~ SCoA + СO2 + 2Фдred.
В данном случае роль ловушки для электронов выполняют протоны, а катализатором служит гидрогеназа:
Фдred + 2Н+ —> ФДred + Н2,
где Фдred и Фдох — соответственно, восстановленный и окисленный ферредоксин.
CoASH регенерируется из ацетил-СоА не с помощью цитрат-синтазы, как в митохондриальном цикле Кребса, а с помощью сукцинат: ацетат СоА-трансферазы и сукцинат-тиокиназы (сукцинил- СоА-синтазы).
Сукцинат: ацетат СоА-трансфераза катализирует трансацетилазную реакцию:
СН3-СО ~ SCoA + сукцинат —> сукцинил-СоА + СН3-СООН.
В свою очередь, сукцинат-тиокиназа катализирует реакцию субстратзависимого фосфорилирования АДФ:
сукцинил-СоА + АДФ + Ф —> сукцинат + CoASH + АТФ.
Установлено, что в большинстве случаев гидрогеносомы не имеют генома. Тем не менее, у протиста Nyctotherus ovalis, представителя подкласса Heterotrichia, амплифицирован ядерный ген, гомологичный митохондриальному гену 16S рРНК. Это позволяег считать гидрогеносомы (по крайней мере, некоторые варианты) видоизмененными митохондриями. Согласно альтернативной гипотезе, митохондрии и гидрогеносомы ведут начало от общего предка, факультативно анаэробного представителя класса «Alphaproteobacteria».
Митосомы. В конце 1990-х гг. у Enthamoeba histolytica были открыты ксеносомы нового типа, названные «митосомами» (англ. mitosome), или «криптонами» (англ. crypton; от греч. kryptos — скрытый).
Митосома представляет собой рудиментарную митохондрию, полностью потерявшую способность к хемотрофной ассимиляции энергии. По аналогии со специализированными пластидами ее можно рассматривать как продукт эволюционного преобразования хемотрофной ксеносомы в органеллу с вторичной, еще не выясненной функцией.