Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Гидрофобное ядро
Как правило, гидрофобное ядро состоит исключительно из гидрофобных боковых цепей, лишь изредка в него оказывается погруженным гидрофильный, тем более заряженный аминокислотный остаток. Принято считать, что такие исключения обусловлены какими-то функциональными требованиями.
В гидрофобное ядро, которое, как уже отмечалось, вовсе не обязательно приближается к сферической конфигурации, но более или менее компактно, обычно входит 20-30% общего числа аминокислотных остатков. В нем особенно представлены объемистые остатки лейцина, изолейцина, фенилаланина, валина. Так, ДНКаза I, полипептидная цепь которой состоит из 259 аминокислотных остатков, при формировании структуры образует три гидрофобных ядра, в которых содержится 70% имеющихся в этом белке гидрофобных остатков. Тенденцию к погружению гидрофобных боковых цепей (прежде всего аланина, валина, изолейцина, лейцина, фенилаланина и метионина) внутрь глобулы этого фермента, типичную и для других белков, иллюстрирует табл. 6.1.
Таблица 6.1 Доступность для воды боковых цепей аминокислотных остатков ДНКазы I
|
Аминокислота |
Всего остатков |
Недоступны для воды |
Частично и полностью доступны |
Процент доступных |
|
Ala |
22 |
13 |
9 |
41 |
|
Val |
25 |
17 |
8 |
32 |
|
Ile |
12 |
12 |
0 |
0 |
|
Leu |
23 |
11 |
12 |
52 |
|
Phe |
11 |
8 |
з |
27 |
|
Met |
4 |
3 |
1 |
25 |
|
Pro |
9 |
2 |
7 |
78 |
|
Trp |
3 |
0 |
3 |
100 |
|
Gly |
3 |
o J |
6 |
67 |
|
Cys |
4 |
1 |
3 |
75 |
|
Ser |
31 |
4 |
27 |
87 |
|
Thr |
14 |
3 |
11 |
79 |
|
Tyr |
15 |
3 |
12 |
80 |
|
Asn |
12 |
2 |
10 |
83 |
|
Gin |
9 |
1 |
8 |
89 |
|
Asp |
20 |
3 |
17 |
85 |
|
Glu |
10 |
2 |
8 |
80 |
|
His |
6 |
0 |
6 |
100 |
|
Lys |
9 |
0 |
9 |
100 |
|
Arg |
12 |
1 |
11 |
92 |
Таблица 6.2 Доля аминокислотных остатков, которые после свертывания белка оказываются скрытыми, практически недоступными растворителю
|
Аминокислота |
Процент скрытых остатков |
|
|
от общего числа остатков данного типа |
от суммы скрытых остатков |
|
|
Не |
65 |
2 |
|
Val |
56 |
15 |
|
Met |
50 |
2 |
|
Cys |
50 |
2 |
|
Phe |
48 |
5 |
|
CySH |
47 |
3 |
|
Leu |
41 |
10 |
|
Ala |
38 |
12 |
|
Gly |
37 |
10 |
|
Thr |
25 |
5,5 |
|
Ser |
24 |
8 |
|
Pro |
24 |
3 |
|
Trp |
23 |
1,5 |
|
Glu |
20 |
2 |
|
His |
19 |
1 |
|
Asp |
14,5 |
3 |
|
Tyr |
13 |
2 |
|
Asn |
10 |
2 |
|
Gin |
6,3 |
2 |
|
Lys |
4 |
од |
|
Arg |
0 |
0 |
Общность тенденции к погружению гидрофобных боковых цепей внутрь глобулы подтверждает анализ пространственных структур 9 белков, которые содержат в общей сложности 2000 аминокислотных остатков, в том числе 587 (29%) скрытых, т.е. образующих гидрофобные ядра (табл. 6.2).
Упаковка боковых цепей аминокислот в гидрофобном ядре, как правило, близка к плотной (рис. 6.2), что делает эффективными ван-дер-ваальсовы взаимодействия между углеводородными структурами — дополнительный фактор стабилизации пространственной структуры. У эволюционно родственных белков с однотипной третичной структурой объем гидрофобного ядра обычно меняется мало — появление более крупных боковых групп компенсируется мутациями, которые приводят к уменьшению объема находящихся с ними в контакте боковых радикалов. Все же было бы неправильным сводить стабилизирующее действие гидрофобного ядра только к его объему — структурная организация имеет немалое значение.
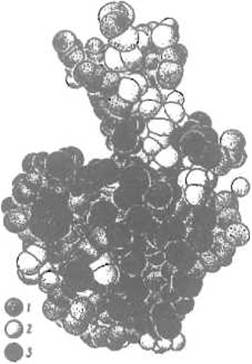
Рис. 6.2. Поперечное сечение (скол) модели лизоцима куриного яйца.
1 — отчетливо полярные группы; 2 — умеренно полярные; 3 — гидрофобные. Видно, что последние сконцентрированы внутри глобулы, но могут выходить на поверхность, в частности во впадине активного центра (слева вверху). Полярные остатки формируют оболочку, изредка (например, слева внизу) проникая внутрь глобулы
Примером может служить весьма тонкая зависимость стабильности белка гена V бактериофага f1 его мутантов от природы аминокислот, образующих гидрофобное ядро. Так, замена изолейцина-47 на валин устраняет одну метальную группу из гидрофобного ядра, замена валина-35 на изолейцин, напротив, вводит дополнительную метальную группу. Следовательно, в двойном мутанте Ilе-47 → Val; Val-35 → Ile объем гидрофобного ядра остается таким же, как и в белке дикого типа, хотя упаковка гидрофобных групп во внутреннем ядре белка, естественно, должна несколько измениться. Оба мутанта, содержащие одиночные замены Ilе-47 → Val и Val-35 → Ile, как и двойной мутант, о котором говорилось выше, похожи на исходный белок по строению и функции, однако значительно менее стабильны.
Гидрофобное ядро окружено наружной оболочкой, имеющей контакт с водой. В ней содержатся гидрофильные аминокислотные остатки, но наряду с ними немало и боковых цепей гидрофобных аминокислот — до половины их общего содержания. Нередко образуются своего рода гидрофобные пятна, «лоскуты», которые придают поверхности белка мозаичный характер, чередуясь со строго гидрофильными участками. Такие гидрофобные выходы могут иметь функциональное значение — они формируют гидрофобные участки зон связывания субстратов и других лигандов, участвуют в белок-белковых взаимодействиях, в частности в стабилизации четвертичной структуры.
Разумеется, границы между гидрофобным ядром и поверхностным слоем белка не так уж резки, более того, нередко обнаруживаются включенные в пространственную структуру молекулы воды, участвующие в поддержании системы внутримолекулярных водородных связей путем образования мостиков между функциональными группами боковых цепей аминокислот.