Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Аминокислоты
Методы синтеза а-аминокислот
1.3.1. Химический синтез
Методы химического синтеза аминокислот весьма разнообразны. Многие из них нашли применение в промышленном производстве аминокислот, используемых в качестве добавок к кормам для сельскохозяйственных животных, а также в медицине. Рассмотрим лишь главнейшие, не останавливаясь на тех методах, которые позволяют получать лишь одну аминокислоту.
Простейшие аминокислоты можно получать аминолизом а-галоидкарбоновых кислот, например аланин — обработкой хлор-пропионовой кислоты очень большим избытком аммиака, чтобы подавить побочную реакцию образования иминодикарбоновой кислоты:
![]()
Синтез, предложенный еще в прошлом веке А. Штреккером, основан на реакции альдегида R—СНО с цианидом калия и солями аммония, причем последние можно заменить мочевиной. Получающийся в последнем случае замещенный гидантоин (циклическое производное соответствующей аминокислоты) далее гидролизуют щелочью, получая D,L-аминокислоту. Таким способом в промышленности синтезируют D,L-метионин (аминокислоту, применяемую в медицине и в животноводстве); исходя из ß-метил-тиопропионового альдегида, в свою очередь образующегося по реакции акролеина и метилмеркаптана:
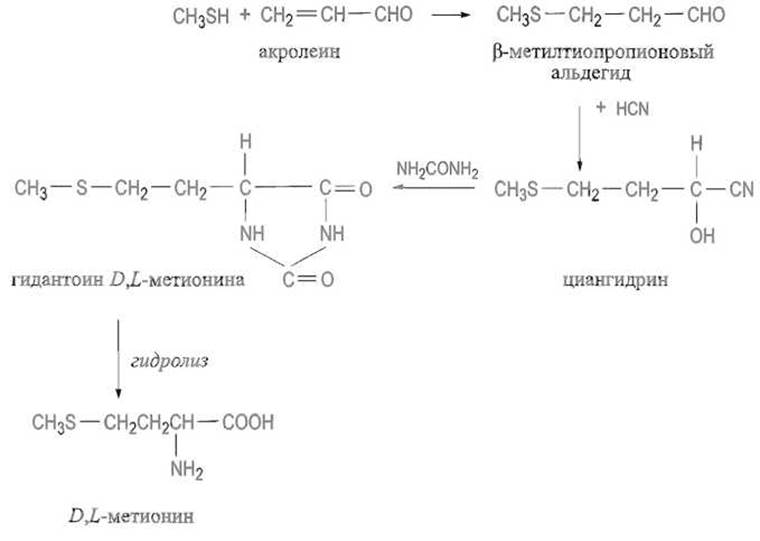
Альдегиды можно вводить в реакцию с заранее полученным гидантоином. Последующее гидрирование двойной связи и гидролиз приводят к получению рацемата соответствующей аминокислоты:
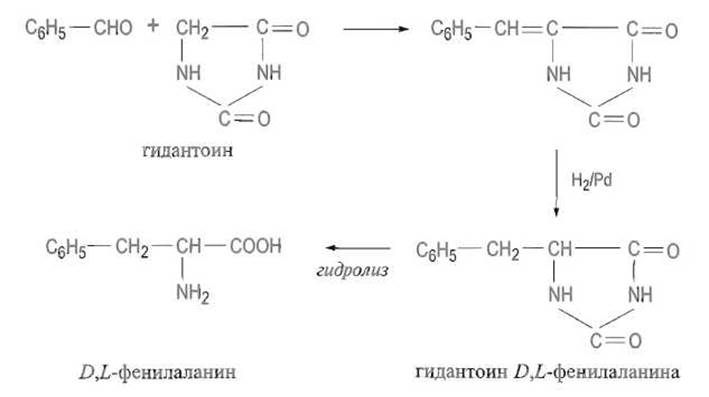
1.3.2. Разделение рацемических аминокислот
Как бы ни протекал химический синтез, он приводит к образованию смеси строго одинаковых количеств L- и D-изомеров аминокислоты — к ее рацемату. Практический интерес имеют, как правило, природные L-изомеры, поэтому важны способы разделения рацематов, позволяющие выделить Z-изомеры. Химические методы разделения основаны на взаимодействии рацемических аминокислот или их производных с асимметрическими соединениями.
Так, прибегают к получению солей эфиров аминокислот с заранее полуденным стереоизомером аминокислоты, например с Z-глутаминовой кислотой, ацилированной Z-аминокислотой или какой-то другой асимметрической кислотой, в частности D-винной. Образующиеся диастереомерные соли обладают, как правило, разной растворимостью. Соль эфира Z-изомера разделяемой аминокислоты с D-винной кислотой по растворимости отличается от соли, построенной из эфира D-аминокислоты и D-винной кислоты. Это открывает возможность выделения изомеров дробной кристаллизацией. Сложность этого пути очевидна, поэтому к нему прибегают лишь в тех случаях, когда иные подходы не дают результата.
Наибольшее распространение получил ферментативный способ разделения рацематов аминокислот. Чаще всего используют способность фермента ацилазы L-аминокислот, содержащейся в почках животных или продуцируемой некоторыми микроскопическими грибами, избирательно гидролизовать N-ацил-L-аминокислоты, не затрагивая D-изомеров. После исчерпывающего гидролиза ацилированной (чаще ацетилированной) аминокислоты в присутствии ацилазы образуется смесь свободной D-аминокислоты и ацетила-аминокислоты, которые легко разделяются кристаллизацией или ионным обменом:
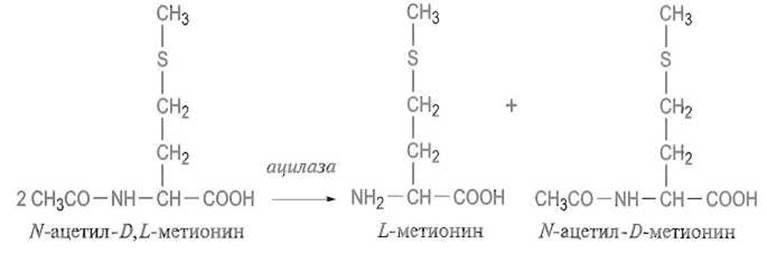
Как правило, после разделения проводят рацемизацию ацетила-аминокислоты, а образовавшийся рацемат вновь гидролизуют ацилазой, достигая в конечном счете практически полного превращения ацетил-D,D-аминокислоты в D-аминокислоту.
Интересно превращение рацемического лактама D,L-лизина (получаемого из доступного исходного соединения — капролактама) в D-лизин за счет совместного действия двух ферментов. Один из них — L-лизинлактамаза — гидролизует с образованием D-лизина только D-изомер лактама, другой же — рацемаза — превращает нерасщепленный лактам D-изомера в рацемический лактам D,D-лизина. D-Изомер вновь гидролизуется лактамазой. Итогом является полное превращение лактама D,D-лизина в D-лизин, применяемый в качестве кормовой добавки
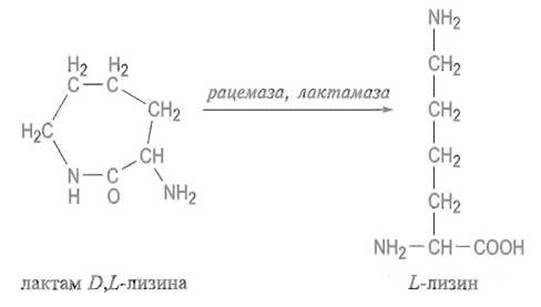
1.3.3. Ферментативный синтез аминокислот
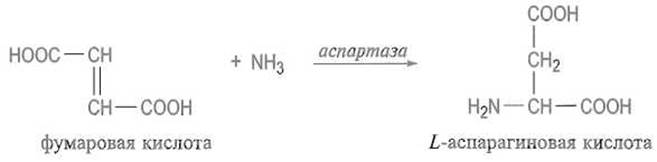
Практически удобны способы получения аминокислот путем катализируемого специфическими ферментами превращения соединений-предшественников. При этом фермент обеспечивает стерео-избирательностъ реакции, образование только одного, как правило, L-изомера. Широко распространен синтез L-аспарагиновой кислоты путем присоединения аммиака к фумаровой кислоте, который катализируется аспартазой или микробными клетками, содержащими этот фермент:
Для получения L-фенилаланина применяют реакцию коричной кислоты и аммиака, катализируемую фенилаланинаммиаклиазой:

1.3.4. Микробиологический синтез аминокислот
Способ основан на образовании свободных аминокислот некоторыми микроорганизмами из простого сырья — отходов сахарной промышленности, крахмала, ацетата и т.п. Используют мутанты микроорганизмов, утратившие некоторые ферменты разветвленного пути биосинтеза аминокислот, что приводит к усиленному образованию других аминокислот. Например, блокирование гомосериндегидрогеназы, ответственной за превращение полуальдегида аспарагиновой кислоты в гомосерин и далее в треонин, метионин, направляет практически весь полуальдегид аспарагиновой кислоты на синтез лизина. Дополнительно вводят мутации, снимающие торможение активности ферментов конечным продуктом цепи реакций, например лизином; иногда прибегают к умножению числа генов, кодирующих ключевые ферменты биосинтеза данной аминокислоты.
Сочетание этих приемов позволило получить мутанты, способные, например, синтезировать до 100 г L-лизина на 1 л культуральной жидкости при высокой степени конверсии исходных веществ в аминокислоту. Микробиологические, химические и отчасти ферментативные методы синтеза аминокислот положены в основу их промышленного производства, достигающего сотен и десятков тысяч тонн в год (лизин, глутаминовая кислота, фенилаланин, аспарагиновая кислота, метионин). Эти аминокислоты применяют как добавки к кормам, вкусовые добавки, лекарственные препараты, исходные вещества для получения физиологически активных пептидов.