Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Лактатдегидрогеназа
Описанный механизм не является единственным для дегидрогеназ. Известны ферменты, которые способны катализировать сходную реакцию, не прибегая к использованию иона цинка или другого металла. Таковы, например, лактат- и малатдегидрогеназы. Каталитический центр лактатдегидрогеназы описан достаточно хорошо, что подтверждается успехом направленного изменения субстратной специфичности лактатдегидрогеназы термофильной бактерии Bacillus stearothermophilus.
Связывание пирувата в активном центре лактатдегидрогеназы определяется в первую очередь электростатическим взаимодействием между карбоксилатной группой субстрата и гуанидогруппой остатка Arg-171 (рис. 10.11). Другие функциональные группы фермента, участвующие в связывании пирувата, одновременно выполняют и собственно каталитическую функцию — частый случай для небольших субстратов. Существенно, что образование ионной пары индуцирует характерное, изменение конформации в активном центре — петля, включающая остатки 98-110, смещается, прикрывая каталитический центр и связанный в нем субстрат. Этим достигается перенос реакции из воды в благоприятную для процесса среду, приближение к центру реакции — карбонильной группе субстрата — сразу нескольких, функциональных групп фермента.
Еще одним следствием такого переноса является значительное усиление взаимодействия между карбоксильной группой субстрата и гуанидином Arg-171, а также образование достаточно плотного окружения пирувата, что способствует повышению субстратной специфичности лактатдегидрогеназы. Этот фермент на три порядка активнее в отношении пирувата, чем оксалоацетата — субстрата малатдегидрогеназы, хотя оба фермента родственны, используют в качестве кофермента НАД, имеют сходную пространственную структуру и действуют по однотипному механизму.
В связанном пирувате карбонильная группа поляризуется под влиянием катионной гуанидогруппы Arg-109, принадлежащей подвижной петле. Это приводит к возрастанию частичного отрицательного заряда на кислородном атоме и положительного — на атоме углерода группы С = О субстрата. Последнее облегчает перенос гидрид-иона от дигидропиридиновой формы никотинамидного фрагмента НАДН на углерод карбонильной группы, в то время как протон пространственно сближенного с субстратом имидазола His-193 переносится на отрицательно заряженный кислород, чем и завершается восстановление карбонильной группы и превращение пирувата в лактат.
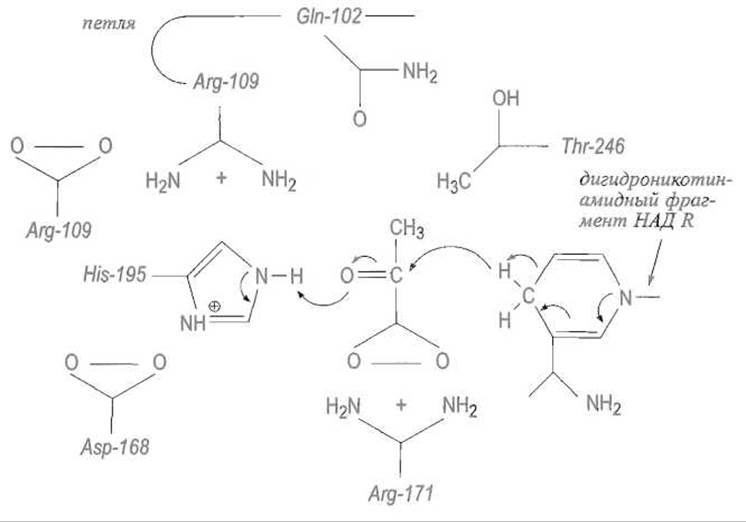
Рис. 10.11. Каталитический центр лактатдегидрогеназы.
При связывании пирувата в активном центре образуется ионная пара между карбоксилат-анионом субстрата и гуанидиниевой группой Arg-171. Взаимодействие протонированной имидазольной группы остатка His-193 с С=0-группировкой субстрата усиливает поляризацию последней, а образующийся дефицит электронов у углерода кетогруппы компенсируется переносом гидрид-иона H- от сближенного с субстратом никотинамидного кольца кофермента. Замена Gin-102 аргинином и введение мутаций, несколько увеличивающих впадину зоны связывания, дает ферменту возможность связать оксалоацетат, и он становится малатдегидрогеназой.
Заметим, что роль имидазольного кольца His-193 как донора протона облегчается тем, что эта группа находится под влиянием карбоксила Asp-168, который отдает свой протон имидазолу, компенсируя переход протона от другого атома азота имидазола на карбонильный кислород субстрата. Таким образом, здесь реализуется нечто вроде «эстафеты заряда», впервые обнаруженной для ансамбля Asp—His в сериновых протеиназах.
Как уже отмечалось, фермент обладает весьма высокой субстратной специфичностью. Он на три порядка хуже катализирует близкую по характеру реакцию восстановления оксалоацетата. Видимо, связывание субстрата, отличающегося от пирувата присутствием еще одной карбоксильной группы, было бы сопряжено с переносом этого карбоксилат-аниона из воды в зону связывания субстрата, а энергетические затраты на его дегидратацию не были бы ничем скомпенсированы. Замена остатка Gln-102 в подвижной петле фермента на аргинин позволяет ввести в зону связывания субстрата модифицированного фермента катионную гуанидиновую группу, способную в отсутствие воды установить электростатическое взаимодействие со вторым карбоксилат-ионом оксалоацетата. Этого достаточно для превращения лактатдегидрогеназы в высокоэффективную малатдегидрогеназу: фермент катализирует реакцию с оксалоацетатом в 8400 раз эффективнее, чем с пируватом, и обнаруживает даже несколько лучшую активность, чем природная малатдегидрогеназа.