Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Имунноглобулины
Молекулярная организация иммуноглобулина G
Иммуноглобулины — белки, синтезируемые в организме позвоночных и способные распознавать и специфически связывать чужеродные молекулы — антигены, а также включать механизм их элиминирования (удаления), выполняя тем самым защитную функцию антител. Заметим, что белки, обладающие свойством избирательно связывать другие молекулы, не редки. Более того, хорошо известны случаи образования белками чрезвычайно прочных комплексов с различными соединениями — лигандами. К ним относятся, например, комплексы авидина или его микробного аналога стрептавидина с биотином, комплексы ферментов и их природных ингибиторов и т.п. Таким образом, само по себе связывание макромолекул или других лигандов не представляет собой уникального свойства иммуноглобулинов.
Необычна способность этого семейства белков, обладающих целым рядом общих, постоянных для него структурных черт, создавать огромное многообразие центров связывания, комплементарных множеству антигенов, совершенно различных химически. Сразу же заметим, что речь не идет о создании той или иной особью антитела, комплементарного данному антигену. Возникновение такой структуры есть результат более или менее длительного эволюционного процесса, на уровне организма происходит лишь отбор клеток, несущих предсуществующую генетическую информацию о ней, и, возможно, некоторая ее модификация. Важно, что такая структура практически всегда может быть найдена. Следовательно, при описании семейства иммуноглобулинов необходимо в первую очередь выяснить структурные предпосылки. которые обеспечивают решение этой функциональной задачи.
Среди известных типов иммуноглобулинов иммуноглобулин G обладает наиболее простой структурой и особенно хорошо изучен. Его молекула имеет четвертичную структуру и образована двумя тяжелыми (Н) и двумя легкими (L) цепями (субъединицами), что отражает формула H2L2. Целостность четвертичной структуры поддерживается как нековэлентными взаимодействиями, так и межсубъединичными дисульфидными связями (рис. 13.1)
В пространственной структуре и легкой, и тяжелой цепей иммуноглобулинов четко прослеживаются домены, отвечающие отрезкам последовательности, которые содержат примерно 110 аминокислотных остатков. Домены сходны по способу укладки полипептидной цепи и могут быть отнесены к типичным ß-структурным белкам. Так, в СL-домене четыре антипараллельных отрезка пептидной цепи образуют один ß-складчатый слой, еще три отрезка — другой, примерно параллельный первому. Между этими слоями, в формировании которых участвует примерно 60% аминокислотных остатков, расположено гидрофобное ядро, в которое включена и дисульфидная связь, соединяющая эти два ß-слоя, будучи примерно перпендикулярна им.
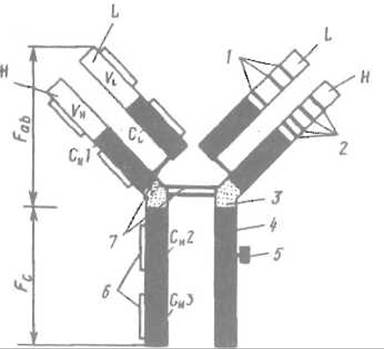
Рис. 13.1. Строение молекулы иммуноглобулина G.
Н — тяжелая цепь; L — легкая цепь; CL и СH — константные, области; VLи VH — вариабельные области; 1 — гипервариабельные участки легкой цепи; 2 — гипервариабельные участки тяжелой цепи; 3 — шарнирная область; 4 — участок связывания комплемента; 5 — углевод; 6 — внутрицепьевые дисульфидные связи; 7 — межцепьевые дисульфидные связи; Fab — фрагмент, связывающий антиген; Fc — кристаллизующийся фрагмент
Третичная структура других доменов аналогична и отличается лишь деталями. В целом же сходство их строения настолько значительно, что домены иммуноглобулинов принято рассматривать как потомки небольшого прародительского белка, который в ходе эволюции был включен в качестве нескольких повторов в гораздо более протяженные и функционально специализированные структуры. Легкие цепи иммуноглобулина G состоят из двух таких доменов, тяжелые — из четырех (рис. 13.2).
Если сравнивать первичные структуры полилептидных цепей целого ряда индивидуальных иммуноглобулинов (моноклональных антител), то оказывается, что в аминоконцевых доменах как легких, так и тяжелых цепей наблюдается очень высокий процент аминокислотных замен. Соответствующие фрагменты полипептидной цепи получили название вариабельных и обозначаются VL (вариабельный домен легкой цепи) и VH (вариабельный домен тяжелой цепи).
Остальные домены, в которых аминокислотные замены встречаются редко, называют константными и обозначают CL — константный район легкой цепи, СH1, СH2, СH3 — константные домены тяжелой цепи, номера которых возрастают к карбоксильному концу полипептида.
Четко выраженная доменная организация молекулы иммуноглобулина делает возможным самостоятельное существование, а в ряде случаев и функционирование отдельных ее частей при условии, что в них сохраняются более или менее сложные ансамбли доменов. Так, давно известны аномальные белки Бенс-Джонса, которые представляют собой димеры L-цепей.
Домены иммуноглобулинов, соответственно расположенные в разных цепях, взаимодействуют между собой, как правило, за счет нековалентных связей, что приводит к промежуточным подуровням структурной организации. Например, вариабельные домены VL и VH взаимодействуют весьма тесно, образуя единый центр связывания антигена. Такой «сдвоенный» домен (иногда называемый Fv -модулем) обладает определенной подвижностью как целое относительно следующего модуля — сдвоенного домена CL + СH1. Более того, два таких сдвоенных домена (модуля) — VL + VH и СL + СH - объединяются в общую структуру: Fab'-фрагмент (от англ. Fragment antibody-binding — антигенсвязывающий фрагмент).
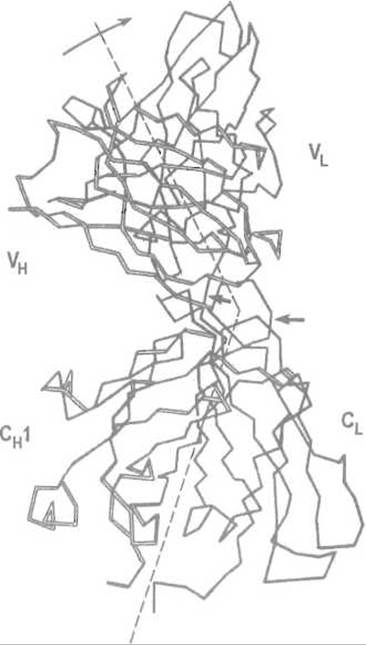
Рис. 13.2 Домены в Fab-фрагменте иммуноглобулина G Вариабельные домены легкой (VL) и тяжелой (VH) цепей объединяются в домен, непосредственно взаимодействующий с антигеном. Константные участки (СH1 и CL) этих цепей также образуют домен. Стрелками показаны участки цепей, протеолиз которых приводит к разделению доменов
Этот фрагмент может быть отщеплен при помощи ограниченного протеолиза от остальной части молекулы — Fc-фрагмента (от англ. crystallizable — кристаллизующийся), в который входят две С-концевые половины тяжелых цепей, образованные доменами СH2 и СH3. Fc-фрагмент не участвует непосредственно в связывании антигена, однако ответствен за взаимодействие со специфическими рецепторами иммуноглобулинов на поверхности клеток и необходим для инициирования целого каскада реакций, направленных на элиминирование связанного антителом антигена.
Существенно, что Fab'-фрагмент не только устойчиво удерживает свою пространственную структуру и может существовать как независимая молекула, но достаточно автономен и функционален, в полной мере сохраняя способность связывать молекулу антигена. Fab’-фрагменты в составе целой молекулы иммуноглобулина G способны двигаться как целое относительно Fc-фрагмента, что придает иммуноглобулину так называемую сегментную гибкость. Это позволяет каждому из двух центров связывания, локализованных в аминоконцевой части Fab'-фрагмеытов, реагировать с соседними антигенными участками в протяженной структуре, например в бактериальной стенке. Угол между осями Fab'-фрагментов в целых молекулах иммуноглобулина может существенно меняться, приближаясь даже к 180°. Гибкость обеспечивается и специфическими особенностями первичной структуры расположенного на стыке доменов СН1 и СH2 шарнирного участка, богатого остатками пролина (на примере иммуноглобулина y-GI Daw):
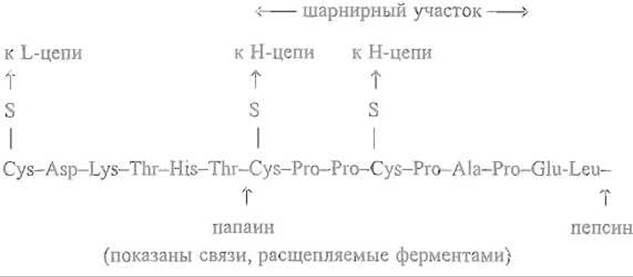
Ограниченный протеолиз в этом случае легко осуществим, так как доменная структура продуктов расщепления достаточно устойчива и способна противостоять глубокому гидролизу протеиназой. В результате действие последней ограничивается междоменным шарнирным участком пептидной цепи. При этом в зависимости от условий, в частности от специфичности протеолитического фермента, гидролиз проходит то «слева», то «справа» от межсубъединичных дисульфидных связей, что приводит в первом случае к Fab'-фрагментам, во втором — к их димерам — (Fab)'2 -фрагментам. К получению Fab'- и (Fab)2-фрагментов прибегают при производстве антитоксических сывороток. Интересно, что специфический протеолиз шарнирного участка используется патогенными микроорганизмами для инактивации иммуноглобулина А, содержащегося в секрете слизистых оболочек.
Итак, существование в иммуноглобулине нескольких подуровней структурной организации за счет взаимодействия доменов, расположенных в разных цепях этого белка, является необходимой предпосылкой его функционирования. Эта особенность строения иммуноглобулина не объясняет, однако, возможности образования в рамках семейства структурно весьма близких белков огромного множества антител, способных специфически связывать различные антигены.