Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Фибриллярные белки
Коллаген
Фибриллярные белки выполняют по преимуществу структурные функции, однако их роль ничуть не менее значительна, чем роль глобулярных белков, велико и число фибриллярных белков, особенно возросшее с открытием белков цитоскелета и межклеточного матрикса. Далее будут рассмотрены лишь некоторые, наиболее изученные фибриллярные белки.
Коллаген («образующий клей») является, видимо, наиболее распространенным белком многоклеточных. Так, у млекопитающих он составляет по массе около 1/4 суммарного белка. Коллаген — важнейший компонент соединительной ткани, он входит в структуру кожи, костей, сухожилий, кровеносных сосудов, хрящей, зубов. Его главная функция — образование нерастворимых фибрилл высокой прочности.
Существует не менее десяти структурных генов, которые кодируют различные молекулярные формы коллагена, отличающиеся первичной структурой, а иногда и пространственным строением. Кодируемые ими коллагены по-разному распределены в органах и тканях. Коллаген типа I, наиболее распространенный в организме и содержащийся в коже, сухожилиях, костях, роговице глаза, построен из двух полипептидных цепей: а1 и отличающейся первичной структурой цепи а2; коллагены других типов образованы тремя одинаковыми и характерными для данного типа полипептидными цепями. Каждая из полипептидных цепей коллагена образована примерно 1000 аминокислотных остатков. Для коллагена характерна интенсивная посттрансляционная модификация, глубина которой зависит от органа или ткани и изменяется с возрастом животного.
В первичной структуре полипептидных цепей, образующих фибриллы коллагенов I—IV, четко выражен повторяющийся на протяжении всей цепи структурный мотив: Gly—Хаа—Yaa (где Хаа и Yaa — различные аминокислоты), причем часто встречается структура Gly—Pro—Hyp. Этому соответствует высокое содержание глицина и пролина, а также оксипролина (Нур).
Оксипролин, встречающийся только в коллагене и эластине, образуется как результат котрансляционной модификации пролина, которая происходит еще до завершения синтеза полипептидной цепи. Пролин, включенный в пептидную цепь, гидроксилируется содержащим двухвалентное железо ферментом пролилгидроксилазой.
Фермент катализирует реакцию кислорода с пролином, при которой происходит гидроксилирование 4-го атома пролина, второй же атом молекулы кислорода реагирует с кетоглутаратом, превращая его в сукцинат и СО2. Двухвалентное состояние железа сохраняется в этих условиях благодаря восстановительному действию аскорбиновой кислоты:
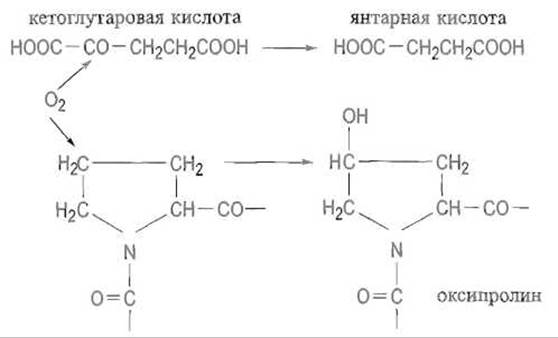
Гидроксилированию по С-4 подвергаются только те остатки пролина, которые предшествуют остаткам глицина в последовательности Pro—Gly—Хаа—Yaa. Аналогичным образом (котрансляционно) лизингидроксилаза гидроксилирует по δ-углеродным атомам остатки лизина, предшествующие глицину. Гидроксильные группы оксилизина служат точкой гликозилирования.
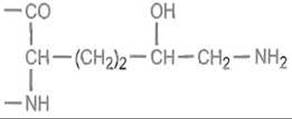
К ним последовательно присоединяются галактоза и глюкоза. Отмеченные модификации происходят в фибробластах и открывают собой целую последовательность дальнейших превращений коллагена. Не претерпевший более глубоких модификаций «незрелый» коллаген называется тропоколлагеном и может быть выделен из кожи молодых животных.
Тропоколлаген имеет форму стержня длиной 3000 А и диаметром 15 Å и представляет собой три идущие в одном направлении
полипептидные цепи, скрученные в спирали (рис, 14.1). Каждая из них аналогична спирали хорошо изученного модельного полипептида— поли-L-пролина. Последняя отличается от а-спирали уже тем, что в ней невозможна стабилизация водородными связями вдоль спирали, поскольку отсутствуют донорные группы NH. Вследствие этого конформация поли-L-пролина диктуется практически только пространственными ограничениями со стороны пирролидиновых колец остатков пролина. На один оборот спирали приходится точно три аминокислотных остатка. Далее три параллельно направленные спирали типа поли-L-пролина в коллагене закручиваются в пучок, образуя суперспираль.
Три спирали связаны между собой поперечными водородными связями. Роль глицина, обязательно занимающего каждое третье положение в пептидной цепи, состоит в том, что он позволяет трем цепям коллагена сблизиться, так как не создает стерических. помех в центре спирали, не имея боковой группы. Объемистые пирролидиновые кольца пролина и оксипролина направлены наружу (рис. 14.2).
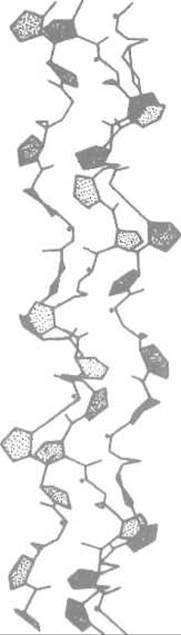
Рис. 14.1. Тройная спираль коллагена. Точками отмечены NH-гpyппы остатков глицина, занимающих каждое третье положение
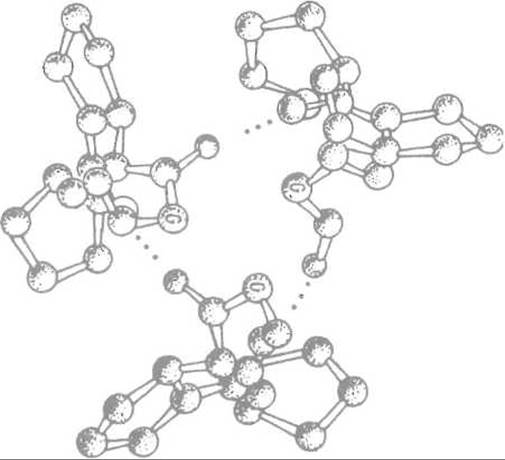
Рис. 14.2. Взаимодействие полипептидных цепей коллагена за счет образования водородных связей между остатками глицина (G).
Необходимое для этого сближение цепей обеспечивается регулярно расположенными остатками глицина, не имеющими боковых цепей
Стабильность тройной спирали определяется кооперативными взаимодействиями, ее денатурация — переход в желатину — обычно происходит скачком в небольшом температурном интервале, середину которого принято называть температурой плавления коллагена. Интересно, что температура плавления коррелирует с содержанием суммы остатков пролина и оксипролина и как-то связана с температурой тела животного, превышая ее на несколько градусов.
|
Сумма остатков пролина и оксипролина |
Температура плавления коллагена, °С |
Температура тела животного, °С |
|
|
Кожа теленка |
232 |
39 |
37 |
|
Кожа акулы |
191 |
29 |
24-28 |
|
Кожа трески |
155 |
16 |
10-14 |
Такая «подогнанность» температуры плавления к температуре тела, видимо, обусловлена необходимостью обеспечить эластичность коллагеновых волокон. Гидроксилирование пролина повышает стабильность и температуру плавления коллагена, поэтому нарушение гидроксилирования, например при цинге за счет недостатка витамина С, приводит к поражению кожи, сосудов, выпадению зубов и т.п.
Образование тройной спирали коллагена может происходить спонтанно, однако это медленный процесс In vivo такой скорости было бы недостаточно. Поэтому коллаген синтезируется в виде предшественника — проколлагена, который имеет молекулярную массу 140 кДа, в то время как молекулярная масса собственно a-цепи равна 95 кДа. В предшественнике N- и С-концевые участки трех полипептидных цепей, первичная структура которых лишена характерного «коллагенового» мотива, формируют глобулярные структуры, которые затем объединяются, взаимодействуя между собой, причем контакт между С-концевыми глобулами дополнительно стабилизируется межцепьевыми дисульфидными связями.
В результате молекула проколлагена приобретает форму своеобразной гантели, в которой будущие коллагеновые пептидные цепи сближены и направлены параллельно, что резко упрощает и ускоряет свертывание тройной спирали. Таким образом, концевые глобулы выполняют функцию «монтажных устройств», облегчая правильную сборку молекулы проколлагена.
Проколлаген синтезируется и секретируется в межклеточное пространство фибробластами. Затем специфические проколлаген пептидазы отщепляют выполнившие свою роль глобулярные домены, оставляя тройную спираль, образованную полипептидными цепями, в каждой из которых структурный мотив Gly—Хаа—Yaa повторяется 338 раз (рис. 14.3).
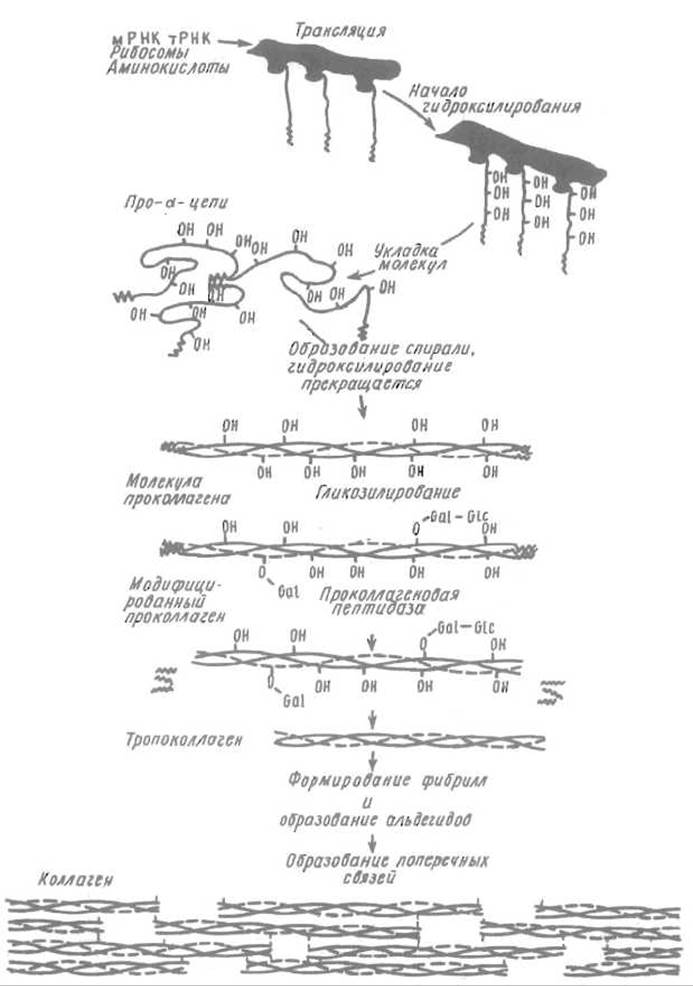
Рис. 14.3. Схема биосинтеза, сборки тройной спирати, формирования волокна и посттрансляционной модификации коллагена (остальные пояснения см. в тексте)
Молекулы тропоколлагена упаковываются в коллагеновые волокна, располагаясь в них параллельно, однако со сдвигом по отношению друг к другу примерно на 1/4 длины молекулы. Между концом одной молекулы и началом другой образуется просвет в 400 Å, который служит в костной ткани центром образования гидроксил-апатита.
Далее коллагеновое волокно стабилизируется целой системой поперечных сшивок. Среди процессов посттрансляционной модификации, определяющих созревание коллагена, особенно важно образование аль-лизина (альдегидопроизводного лизина) под действием лизиноксидазы:
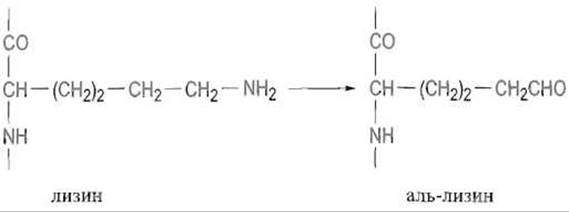
Аналогичное превращение в альдегид претерпевает и оксилизин. Лизиноксидаза — медьсодержащий фермент, в котором в качестве кофактора выступает пиридоксаль. Далее спонтанно, без участия ферментов, образуется шиффово основание с пространственно сближенной аминогруппой остатка лизина, находящегося в другой полипептидной цепи:
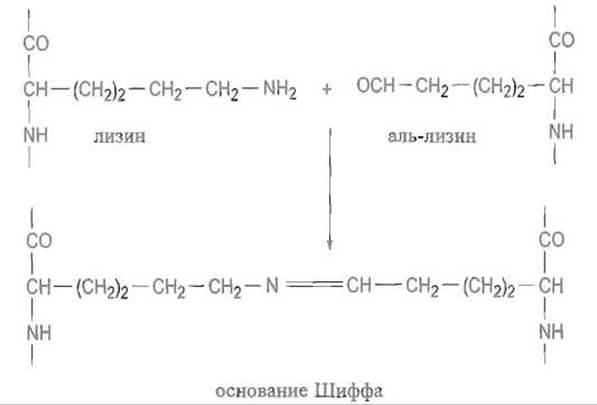
Связь —N=CH—, сама по себе малоустойчивая, восстанавливаясь до — NH—СН2—, превращается в весьма прочную поперечную сшивку, так называемый лизинонорлейцин:
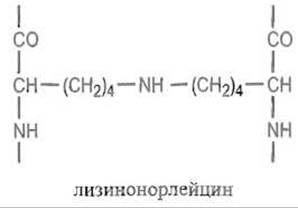
Альдегидные группировки аль-лизина, будучи весьма реакционноспособными, легко вступают в реакции альдольной, а затем и кротоновой конденсации. Далее возможно присоединение к активированной двойной связи имидазольной группы гистидина и еще более сложные превращения:
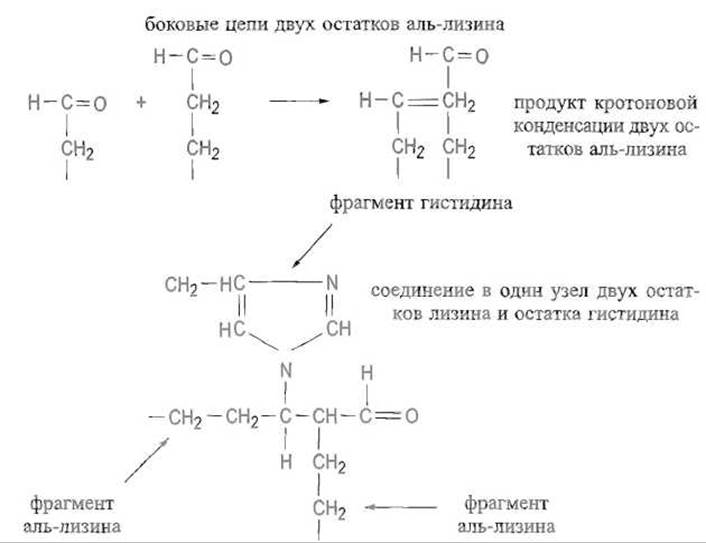
Количество и характер возникающих при этом поперечных, связей позволяют регулировать эластичность волокна.
Таким образом, биосинтез коллагена включает целую цепь посттрансляционных модификаций. В фибробластах синтезируется и собирается проколлаген, в котором уже проходит образование остатков оксипролина, оксилизина и гликозилирование последних. После секреции проколлаген подвергается ограниченному протеолизу, который приводит к отщеплению концевых глобулярных структур и образованию тропоколлагена. Далее происходит созревание этого, еще сохраняющего водорастворимость, белка и возникает более или менее разветвленная система поперечных межцепьевых «сшивок». Интенсивность последнего процесса зависит от возраста животного и природы ткани, в которой локализован коллаген, что позволяет регулировать физические свойства включающих его структур.
Биологическая значимость этой последовательности превращений подчеркивается тем, что нарушение хотя бы одного из ее звеньев приводит к серьезным нарушениям в формировании соединительной ткани. Например, блокирование лизиноксидазы биогенным амином — латирином NH2CH2CH2CN (ß-аминопропионитрил), попадающим в организм животного при поедании им определенного вида горошка, делает невозможным образование аль-лизина и тем самым прерывает дальнейшее формирование поперечных сшивок, стабилизирующих коллагеновые волокна, что приводит к глубоким поражениям кожи. Образование поперечных связей тормозится и при дефиците ионов меди, входящих в активный центр лизиноксидазы.
Интересно, что в стенках клеток растений содержатся богатые оксипролином гликопротеины, играющие роль структурообразующих белков. Друтой структурный компонент стенок растительных клеток — белок, богатый глицином, найденный в бобовых. В его аминокислотной последовательности на долю глицина приходится 60%. Предполагают, что этот белок образует ß-структуру.