Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Фибриллярные белки
Кератины
Кератин — структурообразующий фибриллярный белок, синтезируемый эпителиальными клетками и образующий в них так называемые промежуточные филаменты — тяжи, участвующие в построении дитоскелета. В цитоскелет клеток других типов входят белки, родственные кератину. Из кератина же построены роговые образования — волосы, ногти, когти, клювы, перья, шипы, панцирь, сухой наружный слой кожи.
По мере перемещения эпителиальных клеток к поверхности синтез кератинов становится все более интенсивным, и в конечном счете волокна кератина заполняют всю клетку, поверхностные структуры которой оттесняются на периферию волокна, образуя его оболочку — кутикулу.
В эпителиальных клетках не менее 20 структурных генов кодируют синтез кератинов, принадлежащих к одному из двух типов I или II; кератины типа III синтезируются в качестве белков цитоскелета в неэпителиальных клетках. Все кератины, являясь эволюционно родственными белками, построены по одному плану. Так, эпидермальный кератин II человека содержит в одной полипептидной цепи 562 аминокислотных остатка, причем его N- и С-концевые фрагменты (своего рода домены), по-видимому, не имеют какой-либо доминирующей регулярной вторичной структуры, тогда как последовательность центральной части полипептид- ыой цепи, которая соответствует четырем экзонам, состоит из состыкованных четырех спиральных доменов В каждом из них многократно повторяется одинаковый структурный мотив из семи аминокислотных остатков, среди которых первый и четвертый, как правило, гидрофобны. Например, с 386-го остатка начинается фрагмент (гидрофобные остатки выделены полужирным шрифтом): Ile—Gin—Arg—Leu—Arg—Ser—Glu—Ile—Asp—His—Val— Lys—Lys—Gm—Cys—Ala—Asn—Leu и т.д.
Регулярное появление гидрофобных боковых цепей через каждые три или два аминокислотных остатка в а-спиральных участках кератина приводит к образованию своеобразных гидрофобных «гребней», взаимодействие между которыми стабилизирует суперепирань, так называемую протофибриллу, образующуюся при закручивании двух (рис. 14.4) одинаково направленных цепей кератина друг относительно друга. По-видимому, концевые неспиральные участки в полипептидных цепях кератина, как и в коллагене, выполняют «монтажную» функцию, способствуя их правильной укладке и ускоряя образование суперспирали. Одиннадцать протофибрилл, соединяясь в пучок, образуют микрофибриллу, микрофибриллы собираются в фибриллы.
При образовании роговых структур — волос, шерсти, панциря и т.п. — большую роль играет белок матрикса, в который погружены фибриллы кератина. Этот неспиральный белок, в отличие от собственно кератина, очень богат остатками цистеина, которые, окисляясь, образуют многочисленные дисульфидные мостики, упрочняющие структуру фибрилл кератина и делающие их практически нерастворимыми. Так, богатые цистеином белки волос человека и шерсти овцы, очень похожие по первичной структуре, содержат в полипептидиой цепи 168 аминокислотных остатков, из которых 36% приходятся на цистеин, превращающийся при окислении в цистин. Характерна N-концевая последовательность богатого серой белка волос человека, в которой остатки цистеина занимают каждое третье или четвертое место:
Met—Gly—Cys—Ser—Gly—Cys—Ser—Gly—Gly—Cys—Gly—Ser—Ser— Cys—Cly—Gly—Cys—Gly—Ser—Arg—Cys—Gly— Gly—Cys—Ser— Ser— Ser—Cys—Cys—
Содержание остатков цистеина в кератиновых роговых образованиях сильно зависит от вида животного, пищевого рациона, природы эпидермальных тканей. Так, у овцы содержание цистеина в шерсти значительно выше, чем в рогах. В панцире черепахи оно достигает 20%.
Растягивание кератиновых волокон при одновременном их увлажнении приводит к глубокой реорганизации вторичной структуры: а-спиральные цепи, вытягиваясь, переходят в ß-структуру с одновременным установлением системы межцепьевых водородных связей, чему способствует и увлажнение. Такой переход и обусловленное им растяжение кератиновых волокон, например волос, обратимы: при снятии нагрузки и понижении влажности происходит переход в а-спиральную структуру и сокращение длины. Это свойство используют при устройстве психрометров — приборов, регистрирующих влажность воздуха.
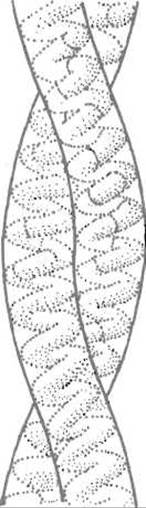
Рис. 14.4. Двойная спираль кератина
Восстановление дисульфидных связей, проводимое обычно действием избытка меркаптосоединения (тиогликолевой кислоты или меркаптоэтанола), снимает поперечные сшивки в богатом цистеином белке матрикса и делает волокна кератина весьма гибкими, поддающимися формованию. Последующее окисление вызывает образование уже иного набора дисульфидных связей и фиксирует новую форму волокна. Такую обработку применяют при «химической» завивке волос, а также для придания шерстяным тканям, построенным из кератина, несминаемых складок.