ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 19. Вакцинация
■ Неспецифическая иммунизация, например путем введения цитокинов, может применяться, когда целесообразно стимулировать общую иммунореактивность.
■ Адъюванты - вещества, усиливающие образование антител, - обычно необходимы при иммунизации убитыми вакцинами.
■ Технология рекомбинантных ДНК, по всей вероятности, станет основой для разработки вакцин следующего поколения.
■ Вакцинация основана на способности организма формировать приобретенный иммунитет и иммунологическую память в отношении возбудителя.
■ В качестве вакцин применяют самые разнообразные антигенные препараты, от целых микробов до просто пептидов и полисахаридов.
■ Живые вакцины существенно отличаются от убитых и, как правило, эффективнее их.
■ Вакцинация представляет собой форму активной иммунизации.
■ Пассивная иммунизация путем непосредственного введения готовых антител еще сохраняет свое значение как средство противоинфекционной защиты в определенных обстоятельствах, например при столбняке, когда токсин уже проник в кровоток.
Вакцинация, несомненно, самое известное и наиболее успешное применение иммунологических принципов в медицине. Первая вакцина была названа так по болезни крупного рогатого скота—vaccinia (коровья оспа), вызываемой, как выяснилось впоследствии, вирусом. Два столетия назад ее применил пионер исследований в этой области английский врач Джемпер. Это стало первой научно продуманной попыткой предотвратить инфекционное заболевание человека (натуральную оспу), причем автор метода ничего не знал о вирусах (или о любых других микробах) и об иммунитете.
Лишь столетие спустя уже Пастером был сформулирован фундаментальный принцип вакцинации: для создания напряженного иммунитета против высоковирулентных микроорганизмов можно применять препараты из тех же микробов, но с ослабленной путем определенного воздействия вирулентностью. Используя в соответствии с этим высушенный спинной мозг кролика, зараженного вирусом бешенства, и прогретые культуры бацилл сибирской язвы, Пастер создал по сути дела прототипы современных вакцин. В то же время созданная Дженнером вакцина животного происхождения, содержащая вирус коровьей оспы (гетерологичная), не получила впоследствии как метод какого-либо продолжения.
Даже и сам Пастер не знал ничего о функции лимфоцитов или сущности иммунологической памяти; их открытие заставило себя ждать еще полстолетия. Тогда, наконец, с появлением клонально-селекционной теории Бернета (1957) и данных о Т/В-дифференциации лимфоцитов (1965) стал понятен ключевой механизм вакцинации: содержащийся в вакцине антиген должен вызвать клональную экспансию специфических Т- и/или В-клеток, оставив после себя популяцию клеток иммунологической памяти. При следующей встрече с тем же антигеном именно они способны дать вторичный ответ, который обычно быстрее и эффективнее первичного. Часто первичный ответ слишком слаб, чтобы сдержать развитие опасной инфекции (см. рис. 1.19).
Таким образом, вакцинация приводит к формированию приобретенного иммунитета, а искусство создания вакцин заключается в разработке таких антигенных препаратов, которые
✵ безвредны для организма,
✵ вызывают нужную форму иммунного ответа и, кроме того,
✵ доступны по стоимости для населения. Благодаря вакцинации достигнуты успехи в предупреждении многих инфекционных заболеваний, но существуют и болезни, для защиты от которых вакцин еще не создано. Причины такого противоречия и составляют в основном предмет рассмотрения в данной главе.
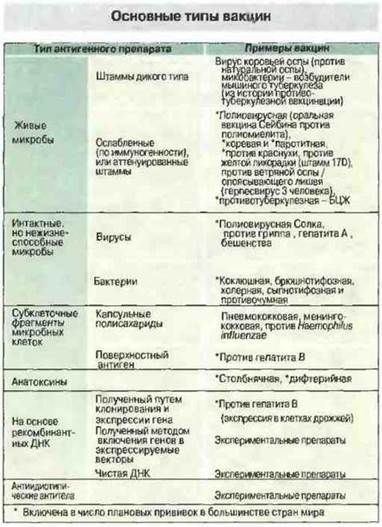
Рис. 19.1. Вакцинами могут служит разнообразные препараты микробных, антигенов.
АНТИГЕННЫЕ ПРЕПАРАТЫ, ИСПОЛЬЗУЕМЫЕ КАК ВАКЦИНЫ
Выбор типа антигенного препарата для применения в качестве вакцины зависит от многих факторов. В общем, чем больше антигенов данного микроба останется в вакцине, тем лучше, и живые микроорганизмы, как правило, эффективнее убитых (см. ниже). Исключение составляют болезни, патогенез которых определяется действием токсина. В этом случае основой вакцины может служить сам токсин. Еще одно исключение — это вакцины, в которых нужные микробные антигены экспрессируются клетками других микробов, используемых в качестве вектора.
На рис. 19.1 перечислены основные антигенные препараты, используемые в настоящее время в качестве вакцин.
Для приготовления живых вакцин могут использоваться как штаммы дикого типа, так и аттенуированные, или ослабленные, штаммы микробов
Живые микроорганизмы штаммов дикого типа редко используются для вакцин. За исключением вируса коровьей оспы, ни один полностью нативный (циркулирующий в природе) микроорганизм не служил когда-либо для приготовления используемых на практике вакцин. Однако известны испытания бычьего и обезьяньего ротавирусов в качестве вакцин для детей. Одно время внимание исследователей привлекала иммунизация микобактериями — возбудителями мышиного туберкулеза, как средство противотуберкулезной защиты. На Ближнем и Среднем Востоке, а также в России для создания иммунитета к кожному лейшманиозу делают прививки живой культуры Leishmania tropica major, выделенной от больного с легким течением болезни. Вполне вероятно, что в будущем будет получена еще одна хорошая гетерологичная (как у Дженнера) вакцина, но при этом возможны серьезные проблемы, связанные с требованием безвредности.
Наиболее эффективны живые ослабленные вакцины. При разработке вакцин самой плодотворной оказалась стратегия ослабления (аттенуации) вирулентности возбудителей, вызывающих болезни у человека, при сохранении нужных антигенов. Первый успех на этом пути был достигнут Кальметтом и Гереном с одним из штаммов туберкулезных бактерий бычьего типа (Mycobacteriun bovis complex), который за 13 лет (1908—1921) пересевов превратился в намного менее вирулентную форму, известную теперь как BCG (bacille Calmette—Guérin) и в некоторой степени эффективную в качестве противотуберкулезной вакцины. По-настоящему удачными оказались работы по аттенуации вирусов. Началом их стало получение путем пассирования в мышах и куриных эмбрионах ослабленного штамма 17D вируса желтой лихорадки (1937). В дальнейшем принципиально сходный подход позволил создать вакцины против полиомиелита, кори, эпидемического паротита и краснухи (рис. 19.2). Об эффективности этих вакцин свидетельствует резкое снижение заболеваемости соответствующими инфекциями на протяжении последних двух- трех десятилетий (рис. 19.3).
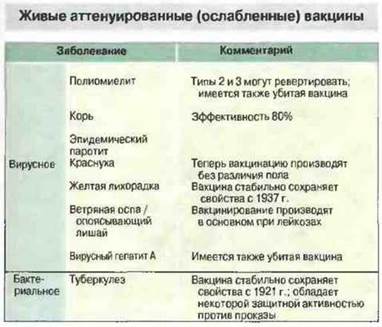
Рис. 19.2. Аттенуированные вакцины получены против многих, но не всех, инфекционных болезней. Как правило, легче аттенуировать вирусы, чем бактерии.
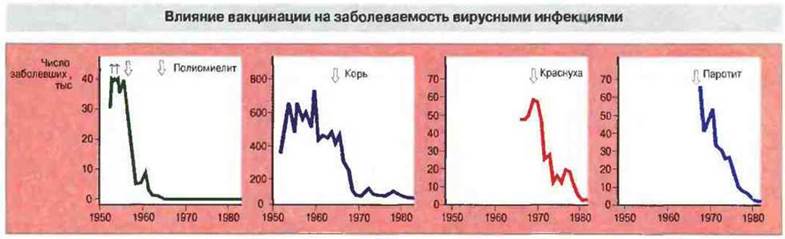
Рис. 19.3. В США эффект вакцинации проявился резким снижением заболеваемости рядом вирусных болезней после применения соответствующих вакцин (указано стрелками).
Аттенуация может быть результатом мутаций. В чем суть изменений, приводящих к аттенуации? Впервые ослабленные микробы были получены в результате серии случайных мутаций, индуцированных неблагоприятными условиями роста; их удалось выделить благодаря постоянной перепроверке и отбору по признаку утраты вирулентности при сохранении исходного антигенного состава. Эта длительная кропотливая работа была остроумно названа генетической рулеткой. Когда стало возможным секвенирование вирусных геномов, оказалось, что результаты традиционного способа аттенуации весьма неоднозначны. Один из примеров этого — различия между вирусами полиомиелита трех типов, входящих r состав живой полиомиелитной вакцины Сейбина. Геном вируса первого типа содержит 57 мутаций и почти никогда не ревертирует к дикому (вирулентному) типу, в то время как с вакцинными штаммами полиовирусов 2 и 3 типов это происходит часто, поскольку их безвредность зависит всего от двух ключевых мутаций. В некоторых случаях реверсии приводят к вспышкам поствакцинального паразитического полиомиелита. Одна из них, произошедшая в Швеции, стала достаточно убедительным аргументом для службы здравоохранения этой страны, чтобы прекратить применение живой вакцины, заменив ее убитой вакциной Солка (см. ниже). Однако в пользу живой вакцины свидетельствует тот факт, что во многих районах США она в настоящее время вытеснила вирус полиомиелита дикого типа в источниках водоснабжения и несомненно обеспечивает иммунную защиту части никогда не вакцинированного населения — яркий пример «коллективного иммунитета». С появлением современной технологам получения рекомбинантных ДНК стало очевидным, что как вирусные, так и бактериальные аттенуированные вакцины должны создаваться на основе направленно точечных, а не случайных мутаций.
Убитые вакцины - это сохранившие нативность антигенов, но нежизнеспособные микроорганизмы
Эти вакцины создают по принципу упомянутых выше убитых вакцин Пастера. Некоторые из убитых вакцин высокоэффективны (антирабическая вакцина и полиомиелитная вакцина Солка), эффективность же других невысока (брюшнотифозная, холерная и гриппозная вакцины) или спорна (чумная вакцина и вакцина против эндемического сыпного тифа). Применение некоторых вакцин встречает возражения из-за их токсичности (цельноклеточная коклюшная вакцина). Перечень большей части применяемых в настоящее время убитых вакцин приведен на рис. 19.4. Можно надеяться, что некоторые из них будут заменены, как более эффективными, вакцинами на основе ослабленных возбудителей, и уже видна определенная перспектива появления такой антирабической вакцины, а также полученных методом генной инженерии брюшнотифозной и холерной вакцин.
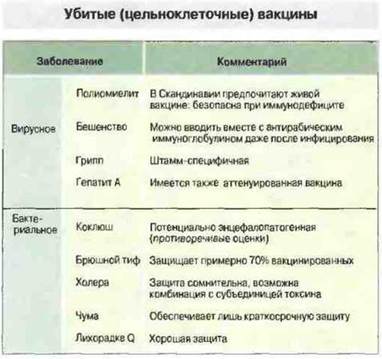
Рис. 19.4. Основные цельноклеточные убитые вакцины.
Инактивированные токсины и анатоксины - наиболее удачные из бактериальных вакцин
Самыми эффективными среди всех бактериальных вакцин считаются столбнячная и дифтерийная вакцины (рис. 19.5), приготовленные из инактивированных экзотоксинов (рис. 19.6). Тот же принцип может, как оказалось, быть использован для приготовления вакцин и против ряда других инфекционных болезней.
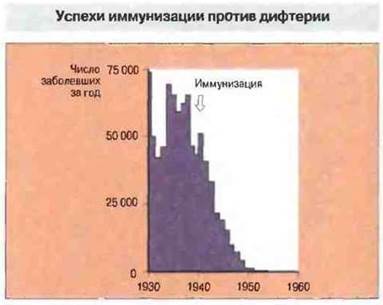
Рис. 19.5. Данные ежегодного учета случаев дифтерии демонстрируют поразительный успех применения вакцины из инактивированного токсина: число заболевших резко упало после введения в 1940 г. обязательной вакцинации. (С любезного разрешения по J.R. Pattison In Brostoff J. et al., eds. Clinical Immunology (Ch. 26). London: Mosby, 1991.)
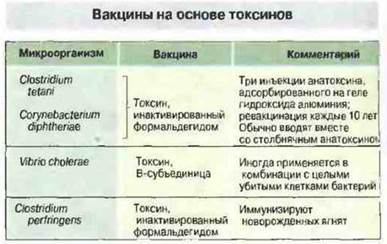
Рис. 19.6. Вакцины, приготовленные на основе токсинов. В список не включены препараты против многочисленных экзотоксинов стафилококков и стрептококков, а также против бактериальных эндотоксинов, подобных липополисахариду.
Столбнячный анатоксин может служить «носителем» в составе других вакцин. Столбнячный анатоксин, кроме применения в качестве вакцины против столбняка, используется еще и как «носитель» в вакцинах, состоящих из коротких пептидов, которые иначе лишены иммуногенности. Такой способ эффективен благодаря тому, что население в большинстве вакцинировано против столбняка и обладает Т-клетками иммунологической памяти, распознающими токсин. Однако целесообразно использовать в качестве носителя белок того же микроба, против которого направлена конструируемая вакцина (в частности, пневмококковая, малярийная и т. д.).
Безвредными и эффективными вакцинами служат поверхностные антигены и фрагменты микробных клеток
Иммунная система (главным образом В-клетки и антитела) распознает прежде всего поверхностные антигены большинства микроорганизмов и отвечает на них. Они и служат безвредной и эффективной вакциной в тех случаях, когда вторичное образование антител способно сдерживать инфекцию (рис. 19.7). Наиболее удачными оказались вакцины против инкапсулированных бактерий, капсульные полисахариды которых удается получить в препаративных количествах, и против вируса гепатита В, обладающего необычным свойством сверхсинтеза поверхностного антигена (HBs).

Рис. 19.7. Основные вакцины, состоящие из фрагментов микробных клеток.
Низкомолекулярные антигены можно получать путем химического синтеза или молекулярного клонирования
Если установлено, что защиту обеспечивает небольшой пептид (не частый случай), удобнее, возможно, получать его путем синтеза или клонирования в подходящем векторе экспрессии. Пример успешной реализации этого подхода - получение HBs-антигена, клонированного в клетках дрожжей. Изготовленная таким способом вакцина вытеснила теперь HBs-вакцину первого поколения, которую приходилось готовить трудоемким методом выделения HBs-антигена из крови носителей вируса и последующей очистки; при новом способе снизилась и стоимость вакцины.
Привлекательность молекулярного клонирования заключается и в том, что в продукт можно ввести дополнительные последовательности, например необходимые В- и Т-клеточные эпитопы, скомбинированные различным образом для оптимизации иммунного ответа. Т-клетки распознают линейные аминокислотные последовательности, тогда как В-клетки отвечают на трехмерную конфигурацию эпитопов антигена (см. гл. 9). Поэтому пептиды хорошо функционируют в качестве Т-клеточных эпитопов, но не способны имитировать структурированные В-клеточные эпитопы. Даже в том случае, если В-клеточная детерминанта имеет линейную конфигурацию, антитела, полученные к свободному гибкому пептиду, не связываются с ним так же оптимально, как с идентичной последовательностью в составе нативного белка, где она имеет более жесткую структуру.
Вакцины будущего - это микробные гены в комбинации с векторами для экспрессии антигена in situ
Дальнейшее развитие подхода с применением клонирования генов предполагает введение нужного гена в такой вектор, который способен после инъекции в организм обеспечивать репликацию и экспрессию с образованием большого количества антигена in situ (рис. 19.8). Ранее на роль вектора выдвигали вирус коровьей оспы (несмотря на изредка проявляемую им токсичность), однако его использованию препятствует то, что многие люди уже привиты против оспы и у них этот вирус будет слишком быстро выводиться из организма. В качестве альтернативы предлагались почти все из имеющихся аттенуированных вирусных вакцин.
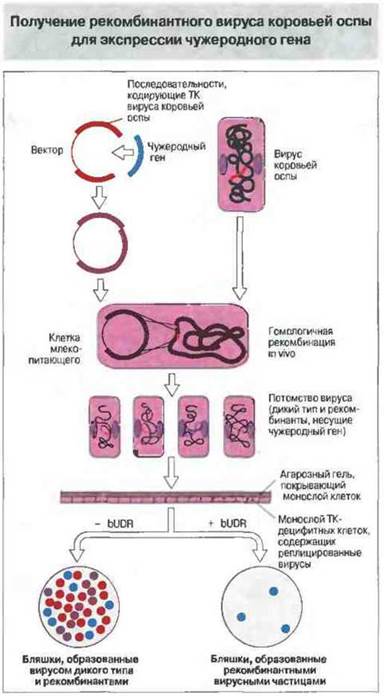
Рис. 19.8. Рекомбинантный вирус коровьей оспы может служить вектором для экспрессии чужеродного гена. Чужеродный ген встроен в ген тимидинкиназы (ТК) этого вируса, чтобы по условиям образования бляшек рекомбинантный вирус отличался от вируса дикого типа. ТК необходима вирусу для включения тимидина из питательной среды или внутриклеточного пула при синтезе ДНК. Рекомбинантный вирус не образует ТК, поскольку этот ген прерван вставкой, и вынужден использовать особый путь для синтеза тимидина de novo. В присутствии аналога тимидина - бромдезоксиуридина (bUDR), включение которого в ДНК блокирует ее синтез, репликации вируса дикого типа не происходит, тогда как рекомбинантный вирус продолжает реплицироваться за счет синтеза тимидина de novo. Клетки, образующие монослой, должны быть ТК-дефицитными, чтобы рекомбинантный вирус не мог использовать клеточную ТК для включения bURD. (С любезного разрешения д-ра D.J, Rowlands, по Brostoff J. etal., Clinical Immunology (Ch. 26). London: Mosby, 1991.)
Другой подход к созданию вакцины заключается в использовании в роли векторов аттенуированных бактерий, и естественным кандидатом на нее представляется вакцина БЦЖ (от франц. BCG - bacille Calmette-Guérin), поскольку геном микобактерий по расчетам достаточно велик для включения генов любых других микробов, из которых необходимо создать вакцину. Имеется также ряд мутантных штаммов сальмонелл, способных при пероральном введении проиммунизировать лимфоидную ткань кишечника, прежде чем будут элиминированы. Эти бактерии идеально подходят как векторная вакцина для индукции местного иммунитета в кишечнике — очень важная задача, если учесть, что диарейные заболевания составляют главную причину детской смертности на земном шаре. Еще одно преимущество аттенуированных микроорганизмов как векторов заключается в том, что их могут поглощать макрофаги, вызывая в результате системный иммунный ответ вследствие миграции в другие части тела.
Самым новым направлением в этой области стала разработка метода вакцинирования чистой ДНК, в последовательность оснований которой включен подходящий промотор. Поразительным образом такая вакцина создает превосходный иммунитет, как гуморальный, так и клеточный, не вызывая при этом толерантности, которую можно было бы ожидать в случае потенциально неограниченного источника чужеродного антигена. Это направление, привлекающее огромный интерес, быстро развивается, и уже вскоре можно ожидать результатов испытаний «ДНКовой» гриппозной вакцины.
Когда нативный антиген непригоден для иммунизации, можно использовать антиидиотипические вакцины
Это единственный тип вакцин, созданный исключительно на основе теоретических представлений. Идея состоит в получении большого количества антиидиотипических моноклональных антител (анти-Id) против V-области (идиотипа) иммуноглобулина, заведомо обладающего защитной активностью. Отобранные соответствующим образом антитела анти-Id будут по пространственной конфигурации подобны эпитопам исходного иммунизирующего антигена и пригодны для использования с целью активной иммунизации вместо него (рис. 19.9). Такая стратегия, хотя и воспринимается нередко скептически, как плод «умозрительной иммунологии», все же может оказаться действительно эффективной в тех случаях, когда сам по себе нативный антиген непригоден, т. е. не обладает иммуногенностью, как, например, некоторые бактериальные полисахариды или липид А из бактериального эндотоксина (липополисахарвда, ЛПС). При этом моноклональные антитела имеют то преимущество, что они как белки должны индуцировать иммунологическую память, которой полисахариды и липиды обычно не вызывают.
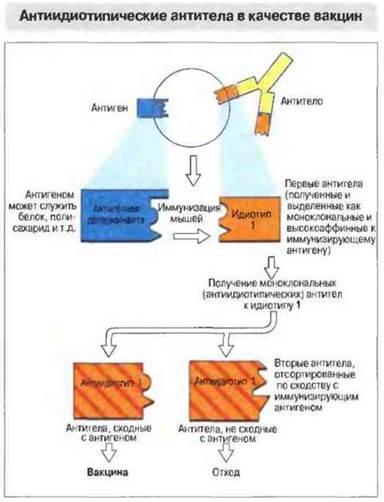
Рис. 19.9. Разработка метода получения моноклональных антител и открытие «идиотипической сети» (см. гл. 13) сделали возможным использование иммуноглобулинов в качестве заменителей антигенов. Такая технология позволяет получить белковую копию углеводного или липидного антигена, обладающую возможным преимуществом в качестве вакцины.