ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 20. Иммунология опухолей
ИММУНОТЕРАПИЯ
В настоящее время значение иммунотерапии невелико
Иммунотерапия имеет долгую историю, однако лишь в редких случаях этот метод применим как основной. Иммунолечение может быть активным или пассивным, специфическим или неспецифическим и даже комбинированным. На рис. 20.18 суммированы некоторые иммунотерапевтические способы лечения.
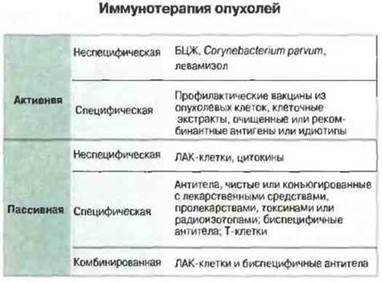
Рис. 20.18. Неспецифические агенты активируют специфические и неспецифические механизмы иммунитета, вероятно вызывая выделение цитокинов. Возможно и применение цитокинов или эффекторных клеток (например, лимфокин-активированных киллерных клеток), отдельно или совместно с биспецифичными антителами, «наводящими» эти клетки на опухоль.
Активная иммунотерапия остается пока большей частью на стадии экспериментальной разработки
Специфическая активная иммунизация. В экспериментах на животных оказался до некоторой степени успешным подход, основанный на применении инактивированных опухолевых клеток для иммунизации до прививки опухоли. Намного менее удачными оказались попытки вызвать регрессию развившихся опухолей. Большие усилия были направлены на то, чтобы найти способ повышения иммуногенности опухолевых клеток (рис. 20.19), однако пока это не дало практического выхода. Новые данные — о презентации Т-клеточных эпитопов молекулами МНС и о зависимости иммунного ответа на стадии индукции от костимулирующих факторов - позволили начать разработку более рациональных подходов.
Так, в опытах на животных установлено, что трансфекция генов В7 или цитокинов, например ИЛ-2, ИЛ-4, ИФγ или ГМ-КСФ, в опухолевые клетки существенно увеличивает иммуно генность этих клеток. Кроме того, путем иммунизации определенными пептидными эпитопами с применением новых адъювантов удаюсь индуцировать образование цитотоксических Т-лимфоцитов, способных вызывать отторжение экспериментальных опухолей. Для непосредственной иммунизации животных могут быть также использованы полученные методом генетической инженерии фрагменты ДНК, кодирующие опухолевые антигены и костимуляторные молекулы; это позволяет устранить генетические ограничения, мешающие при использовании самих опухолевых клеток для иммунизации. У животных все указанные методы могут обеспечивать защиту при последующей пересадке опухоли, но значительно менее эффективны при лечении развившихся опухолей. Таким образом, лишь немногие данные указывают на то, что специфическая активная иммунизация применима для противоопухолевой терапии у человека.
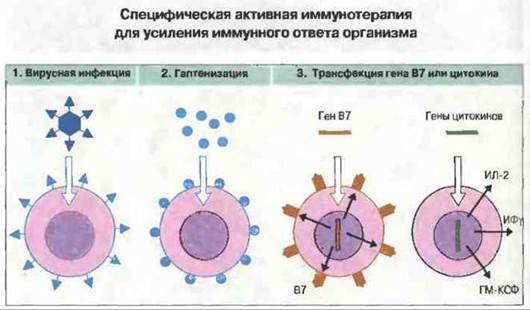
Рис. 20.19. 1 и 2. Возможность противоопухолевой вакцинации, основанной на повышении иммуногенности клеток опухолей, изучается уже в течение многих лет. 3. Новым подходом к решению этой задачи стало встраивание генов важных костимулирующих молекул (например, В7 или цитокинов), необходимых для индукции иммунного ответа, в опухолевые клетки путем трансфекции. Продукция такими клетками костимулирующих молекул обеспечивает активацию примированных Т-лимфоцитов, которые в результате атакуют родительские опухолевые клетки.
Неспецифическая стимуляция иммунного ответа. Для этой цели используют различные агенты (рис. 20.20). У человека большинство попыток системной терапии не дает успеха, однако локальное применение противотуберкулезной вакцины БЦЖ — может быть эффективным: введение БЦЖ в очаг поражения способно вызвать регрессию меланомы. И, кроме того, неспецифическая локальная иммунизация БЦЖ эффективна при опухолях мочевого пузыря.
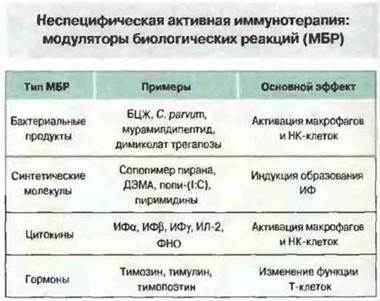
Рис. 20.20. Модуляторы биологических реакций (МБР), используемые для усиления иммунного ответа на опухоли, подразделяются на четыре группы. В общем случае, бактериальные продукты обладают адъювантными функциями по отношению к макрофагам (см. гл. 17 и 19); различные синтетические полимеры, нуклеотиды и полинуклеотиды индуцируют образование и выделение ИФ; введенные цитокины непосредственно действуют на макрофаги и НК-клетки; разнообразные гормоны, в том числе тимуса, могут усиливать активность Т-клеток. (ДЭМА - дивиниловый эфир малеинового ангидрида; ФНО - фактор некроза опухолей; поли-(I:С) - полиинозиновая и полицитидиловая кислоты).
Иммунизации против онкогенных вирусов. Поскольку все больше данных указывает на роль вирусов в развитии некоторых онкологических заболеваний у человека, наиболее перспективным направлением иммунизации может быть предотвращение инфекций, вызываемых потенциально онкогенными возбудителями. Массовая иммунизация против гепатита В несомненно уменьшит частоту возникновения первичного рака печени. Возможна вакцинация людей определенной группы риска против вирусов папилломы, вируса Т-клеточного лейкоза человека (HTLV-1) и вируса Эпштейна-Барр.
Пассивная иммунотерапия моноклональными антителами имеет некоторые перспективы, но с ограничениями
На раннем этапе исследований был сделан ряд попыток применить пассивную иммунотерапию поликлональной антисывороткой, но они остались без продолжения из-за трудности получения специфичных антител в высоких титрах. Возможно, эти проблемы поможет решить гибриломная технология получения моноклональных антител. Хотя специфические опухолевые антигены пока не обнаружены (за исключением В- и Т-клеточных идиотипов на лимфомах), все же выявлена повышенная экспрессия определенных антигенов на клетках некоторых опухолей, что открывает путь для терапии с помощью мАт, поскольку повреждение нормальных клеток организма, несущих те же антигены, может быть при этом незначительным или отсутствовать. Моноклональные антитела могут использоваться как в виде чистых препаратов, гак и в конъюгированной форме — с лекарственными средствами, пролекарствами, токсинами, цитокинами или изотопами (рис. 20.21). Однако имеется целый ряд ограничений для применения антител с терапевтической целью.
✵ Как правило, антитела слабо проникают в массивные опухоли. Теоретически это возможно преодолеть, применяя молекулы меньших размеров, но сохраняющие способность специфического связывания антигена, например Fab'-фрагменты, или специально сконструированные однодоменные антитела. Другой подход состоит в том, чтобы направлять терапевтическое воздействие на эндотелий кровеносных сосудов, снабжающих опухоль.
✵ Антитела связываются другими клетками, в том числе нормальными клетками, экспрессирующими антиген-мишень. Возможно и неспецифическое связывание антител клетками, имеющими Fc-рецепторы или рецепторы для углеводных компонентов иммуноглобулинов. Частично эти проблемы можно решить путем химической модификации антител или их изменения метолом генетической инженерии. Предотвратить связывание антител нормальными клетками можно было бы и путем применения биспецифичных антител, т. е. направленных сразу к двум различным антигенам, одновременно экспрессируемым на опухолевых клетках, при том что только один из них присутствует на нормальных клетках.
✵ Антитела обладают иммуногенностью и могут быть «атакованы» иммунной системой. Поэтому химерные, или гибридные, антитела, т. е. содержащие участки иммуноглобулинов человека, способны индуцировать антиидио-типический иммунный ответ. Эту проблему возможно устранить путем проведения последовательных курсов лечения различными мАт.
Несмотря на перечисленные трудности, уже получены некоторые обнадеживающие результаты. В исследовании, проведенном по методу случайной выборки, мАт были использованы для лечения рака толстой кишки после хирургического удаления первичной опухоли. Мишенью терапии были микрометастазы, что исключало проблемы, связанные со слабым проникновением мАт в массу опухоли. Такое лечение существенно продлевало жизнь больных. Определенные перспективы обнаруживает и применение радиоактивно меченных антител к В-клеткам в случае лимфом, устойчивых к традиционным методам лечения.
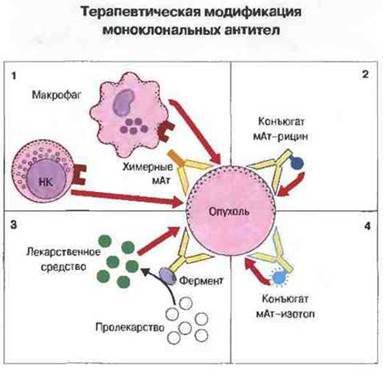
Рис. 20.21. 1. Получение методом генетической инженерии химерных антител, содержащих Fc-фрагмент антител человека, связанный с F(аb)'2-фрагментом антител мыши, позволяет снизить вероятность иммунного ответа на мАт со стороны организма-хозяина. Кроме того, Fc-фрагмент антител человека обеспечивает мобилизацию эффекторных механизмов хозяина. Другой путь оптимизации терапевтического действия мАт - связывание с ними различных молекул для «нацеливания» на опухолевые клетки. К таким молекулам относятся, например, токсины (2), цитотоксические лекарственные препараты, ферменты, способные активировать пролекарства (3) или радиоактивно меченные изотопы (4). (мАт - моноклональные антитела.)
Антитела могут быть также использованы in vitro — либо для очистки костного мозга от опухолевых клеток с его последующей аутотрансплантацией (рис. 20.22), либо для удаления Т-клеток с целью предотвращения реакции «трансплантат против хозяина» при аллотрансплантации.
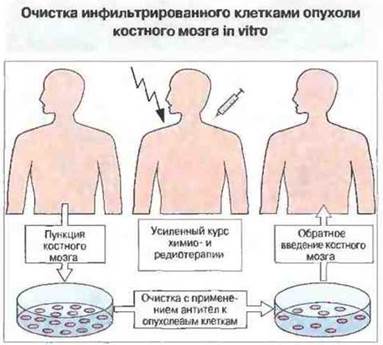
Рис. 20.22. Костный мозг, содержащий опухолевые клетки, может быть очищен с помощью мАт и комплемента, конъюгатов токсин-антитела или с применением антител, адсорбированных на магнитных гранулах. Очищенный костный мозг вводят больному после прохождения им усиленного курса химиотерапии и радиотерапии. Такой способ лечения дает обнадеживающие результаты при некоторых лейкозах и лимфомах, когда не эффективны традиционные методы лечения.
В последние годы сконструированы библиотеки генов вариабельной области Ig человека, встроенных в рекомбинантные бактериофаги нитевидной формы, которые экспонируют Ig на своей поверхности. Благодаря этому можно отбирать высокоаффинные антитела к любому данному антигену и уже получены антитела ко многим антигенам клеточной поверхности, так что описанная технология, вполне вероятно, обеспечит получение терапевтически эффективных антител второго поколения, направленных к опухолеассоциированным молекулам.
Результаты пассивной иммунотерапии с помощью лимфоцитов неоднозначны
Культивируемые in vitro мононуклеарные клетки периферической крови человека в присутствии ИЛ-2 приобретают высокую цитотоксическую активность к широкому спектру опухолевых мишеней, большая часть которых устойчива к свежевыделенным НК-клеткам. Начальные эксперименты на животных и человеке, в которых такие лимфокин-активированные киллерные клетки (ЛАК) реинфузировали больным, дачи хорошие результаты, особенно при одновременном введении ИЛ-2. Однако в клинических испытаниях результаты менее обнадеживающие, причем применение в высоких дозах ИЛ-2 вызывает существенный токсический эффект. По-видимому, лишь небольшое количество ЛАК локализуется в опухолях, и это может служить одной из причин слабого эффекта подобного лечения. Для повышения его эффективности применяют биспецифичные моноклональные антитела. Один антигенсвязываюший участок таких антител специфичен к опухолевой молекуле, а другой - к поверхностным маркерам эффекторных клеток, например CD3 на Tц-клетках или CD16 на ИК- клетках. Теоретически данные антитела должны способствовать локализации ЛАК на поверхности опухоли. Описанные подходы дают эффект in vitro, однако in vivo их эффективность менее очевидна.
Для реинфузии используют также культуры Т-клеток, экстрагированных из участков опухолей и выращиваемых в присутствии ИЛ-2. В некоторых случаях такие культивируемые Т-клетки обнаруживают относительную специфичность к опухоли, из которой они были выделены. В экспериментах на животных четко установлено, что опухолеспецифичные цитотоксические Т-клетки способны вызывать быструю регрессию опухоли. Токсичность инфильтрирующих опухоль лимфоцитов может быть повышена путем трансфекции в них генов, кодирующих тот или иной цитокин. Однако реальную эффективность подобных стратегий в применении к человеку еще только предстоит выяснять. В то же время с терапевтической целью уже применяют ВЭБ-специфичные Тц-клетки, культивируемые в присутствии ИЛ-2; их вводят больным, у которых образовались лимфомы после трансплантации костного мозга. В результате такой терапии происходит ремиссия опухолей. Мишенями при этом служат сильные антигены ВЭБ. Предполагается исследовать эффективность такого подхода в отношении распространенных эпителиальных злокачественных новообразований.
Регрессию опухолей может вызывать пассивная иммунотерапия с применением цитокинов
Для терапии опухолей используются многие цитокины, препараты которых получены на основе клонированных генов. Данные о наиболее хорошо исследованных к настоящему времени цитокинах приведены на рис. 20.23. Успехи в этой области пока ограниченные, тем не менее установлено, что ИФγ способен обеспечивать длительную ремиссию волосатоклеточного лейкоза, а ИЛ-2 эффективен при некоторых типах меланом и раке почки. Имеются также перспективные результаты терапии перитонеальных опухолей яичников с помощью ИФγ и ФНОα. Возможно, однако, что цитокины пока используются несоответствующим образом. Обычно их применяют по аналогии с цитотоксическими препаратами, т. е. в предельно допустимых дозах. Вместе с тем последние данные по лечению злокачественных опухолей головы и шеи позволяют предполагать, что не менее, если не более эффективными могут быть меньшие дозы, R которых цитокины будут давать значительно меньше побочных эффектов.
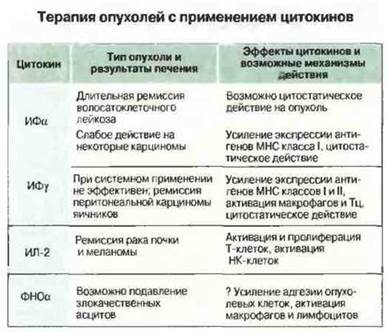
Рис. 20.23. Как правило, цитокины назначают для системного применения в высоких дозах, В большинстве случаев механизм их противоопухолевого действия неизвестен. In vitro интерфероны и ФНОα оказывают цитостатическое действие на некоторые опухолевые клетки, однако in vivo их эффекты могут быть опосредованными, поскольку многие цитокины индуцируют образование других цитокинов (цитокиновый каскад) Иногда после применения ИЛ-2 у больных отмечается транзиторный аутоиммунный тиреоидит, что свидетельствует о действительном усилении иммунореактивности в результате лечения цитокинами.
Некоторые цитокины обнаруживают полезные эффекты для поддерживающей терапии. Например, колониестимулирующие факторы способны уменьшать период аплазии после трансплантации костного мозга или цитотоксической терапии, а эритропоэтин ослабляет анемию.
Вопросы для размышления
■ По имеющимся данным, у многих больных формируется иммунный ответ на опухолеассоциированные антигены Тем не менее в отсутствие лечения злокачественные опухоли растут, что приводит к летальному исходу. Как можно объяснить этот парадокс?
■ Иммунологию опухолей часто рассматривают как отдельную проблему. Существуют ли явные особенности иммунного ответа на опухоли, отличающие его от других?
■ Поиски способов иммунотерапии злокачественных опухолей продолжаются уже более 100 лет. Почему успешные результаты пока столь ограниченны и с чем связаны основные надежды?
■ Профилактическая иммунизация против инфекционных заболеваний дает высокий эффект. Будет ли этот метод наибольшим вкладом иммунологии в онкологию?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Boon Т., Cerrotini J.-C., Van de Eynde В. et al. 1994. Tumor antigens recognised by T lymphocytes. Annu. Rev. Immunol. 12: 337-66.
Franks L.M., Teich N. 1991. Introduction to the Cellular and Molecular Biology of Cancer. Oxford: Oxford University Press.
De Kruif J., van der Vuurst deVries A.-R., Ciienti L. etal. 1996. New on recombinant human antibodies. Immunol. Today 17: 453-55.
Kedar E., Klein E. 1992. Cancer immunotherapy: are the results discouraging? Can they be improved? Adv. Cancer Res. 59: 245-94.
Pardoll D.M. 1993. New strategies for enhancing the immunogenicity of tumors. Curr. Opin. Immunol. 5: 719-25.
Riethmuller G.. Schneider-GKdicke E., Schlimok G. et al. 1994. German Cancer Aid 17-1A Study Group. Randomised trial of monoclonal antibody for adjuvant therapy of resected Dukes C colorectal carcinoma. Lancet 343: 1177-83.
Sheil A.G.R. 1992. Development of malignancy following renal transpantation in Australia and New Zealand. Transplant Proc. 24: 275-79.
Soussi T. 1996. The humoural response to the tumor-suppressor gene-product p53 in human cancer: implications for diagnosis and therapy. Immunol. Today 17: 353-56.
Sulitzeanu D. 1993. Immunosuppressive factors in human cancer. Adv. Cancer Res. 60: 247-62.
Vlasveld L.T., Rankin E.M. 1994. Recombinant interleukin-2: basic and clinical aspects. Cancer Treat. Rev. 20: 275-311.
Zier K., Gransbacher B., Salvadori S. 1996. Preventing abnormalities in signal transduction of T cells in cancer: the promise of cytokine gene therapy. Immunol. Today 17: 39-45.