ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 27. Трансплантация и отторжение
РОЛЬ Т-ЛИМФОЦИТОВ В ОТТОРЖЕНИИ ТРАНСПЛАНТАТА
Т-клеткам принадлежит ведущая роль в отторжении трансплантата
Грызуны с врожденным отсутствием тимуса (бестимусные, или «голые», животные) не имеют зрелых Т-клеток и не отторгают трансплантаты. То же самое имеет место и у нормальных мышей и крыс, тимэктомированных в неонатальный период, до заселения периферических лимфоидных органов зрелыми Т-клетками. Аналогичный эффект можно получить путем тимэктомии взрослых мышей и крыс (она позволяет устранить продукцию зрелых клеток) с последующим облучением (для элиминации имеющихся зрелых Т-клеток) и пересадкой костного мозга (с целью восстановления гемопоэза). Таким способом получают реципиентов АТх.ВМ (от англ. adult thymectomy и bone marrow), которые лишены Т-клеток и не могут отторгать трансплантаты.
У всех перечисленных животных (бестимусных, неонатально тимэктомированных или АТх.ВМ) способность разрушать трансплантированные ткани удается восстановить путем введения Т-клеток нормальных животных той же линии. Таким образом, для отторжения трансплантата необходимы Т-клетки. Это не означает, что антитела, В-лимфоциты или клетки других типов не принимают участия в отторжении. В частности, антитела вызывают повреждение трансплантированной ткани, а макрофаги способствуют развитию в ней воспалительных реакций.
Молекулярная основа реакции отторжения - это взаимодействие ТкР-МНС
С помощью своих Т-клеточных рецепторов (ТкР) участвующие в реакции отторжения Т-лимфоциты распознают пептиды донора, экспрессированные на клетках трансплантата в ассоциации с антигенами МНС. Как известно (см. гл. 7), Т-клеточный рецептор построен таким образом, что Т-клетки могут «видеть» только те антигенные пептиды, которые ассоциированы с молекулами МНС. Подобная МНС-рестрикция возникает в результате положительной селекции в тимусе (см. гл. 12 и 14 и рис. 27.8). Таким образом, чтобы оценить ту роль, которую выполняют Т-клетки в реакции отторжения, необходимо определить различия между молекулами МНС донора и реципиента и установить, какое значение имеют эти различия для презентации широкого спектра антигенов рецепторам Т-лимфоцитов реципиента.
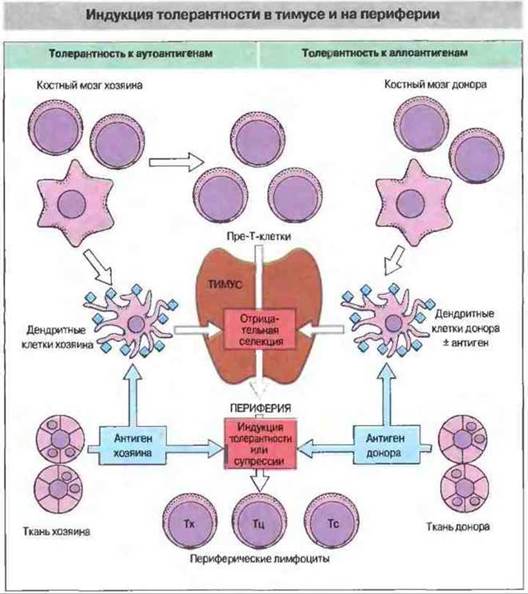
Рис. 27.8. В нормальных физиологических условиях пре-Т-клетки костномозгового происхождения попадают в тимус, где подвергаются положительной и отрицательной селекции. Положительная селекция происходит при взаимодействии тимоцитов с собственными молекулами МНС на эпителиальных клетках корковой зоны. В результате этого процесса пре-Т-клетки избегают запрограммированной клеточной гибели. Отрицательная селекция (делеция аутореактивных клонов) осуществляется при контакте тимоцитов с дендритными клетками в области кортико-медуллярного соединения. Вновь образующиеся аутореактивные клетки могут быть инактивированы (но не обязательно элиминированы) и вне тимуса, на периферии, под влиянием антигена. В другом случае они могут стать активированными клетками-супрессорами. У животных, толерантных к аллогенным клеткам, чужеродный антиген может присутствовать в мозговой зоне тимуса (его несут дендритные клетки донорского происхождения, т. е. клетки-«пассажиры», или же он презентирован дендритными клетками реципиента). Этот аллоантиген способен действовать как собственный и вызывать развитие толерантности в результате отрицательной селекции реагирующих с ним Т-клеток (клональная делеция). В периферических лимфоидных органах чужеродный антиген способен вызвать клональную анергию (т. е. индуцировать толерантность - ареактивность) или у животных, толерантных к аллоантигенам, симулировать активную супрессию.
Различные молекулы МНС в целом сходны по структуре, однако различаются по строению пептидсвязывающей полости. По структуре различные молекулы МНС почти идентичны. Каждая молекула имеет две α-спирали, расположенные на β-складчатом слое поверх двух иммуноглобулин-подобных доменов, «сидящих» на клеточной мембране (см. гл. 7). Между α-спиралями имеется глубокая полость, в которой происходит связывание пептидов. Часть молекулы МНС, ответственная за Т-клеточное распознавание, представлена обращенной вверх стороной α-спиралей, относительно консервативной у различных молекул МНС.
Аминокислотные остатки, определяющие важные различия между молекулами МНС — например, между аллельными вариантами А2 и Aw68 антигена HLA-A. находятся большей частью внутри полости, образованной α-спиралями, а не на их верхних сторонах, контактирующих с ТкР (см. гл. 7). Поэтому для Т-клеточного распознавания основное значение имеют различия в форме и заряде поверхности пептидсвязывающей полости (см. гл. 7), которые определяют, какие пептиды могут связываться и в какой ориентации они будут представлены для распознавания Т-клеточным рецептором (см. гл. 9).
Молекулы МНС трансплантата и реципиента презентируют различные пептиды. В обычных физиологических условиях в полости молекул МНС находятся пептиды, представляющие собой фрагменты нормальных клеточных компонентов, образующиеся вследствие внутриклеточной деградации белков. Состояние иммунологической толерантности, индуцированной в тимусе (клональная деления аутореактивных клеток, см. гл. 14), препятствует возникновению аутоиммунных реакций, которые могли бы развиться в результате распознавания Т-клетками комплексов «свой пептид своя молекула МНС». Но если клетки инфицированы (например, вирусом), собственные пептиды в полости молекул МНС «профессиональных» АПК могут быть замешены чужеродными. В этом случае Т-клетки будут реагировать на чужеродные пептиды, ассоциированные со «своими» молекулами МНС.
Однако при трансплантации генетически чужеродной ткани возникает третий вариант. Здесь на поверхности клеток трансплантата презентирован иной набор пептидов, что определяется отличиями в форме и заряде поверхности пептид- связывающей полости молекул МНС трансплантата. Кроме того, трансплантат может содержать аллельные варианты нормальных клеточных компонентов, отличные от вариантов этих молекул реципиента (детерминированных локусами минорных генов гистосовместимости). Это существенно сказывается на характеристиках пептидов, презентируемых клетками трансплантата. Различия между донором трансплантируемой ткани и реципиентом по антигенам МНС (неодинаковые формы и заряд поверхности пептид- связывающей полости) или по минорным антигенам гистосовместимости (различающиеся антигенные пептиды) служат причиной того, что трансплантат экспрессирует чрезвычайно большое число новых чужеродных антигенов, которые могут распознаваться Т-клетками реципиента. Поэтому до 10 % Т-клеток в организме способны реагировать на эти антигены аллогенного трансплантата.
В реакции отторжения участвуют хелперные Т-клетки (Тх-клетки) и лимфокины
Роль Тх-клеток в отторжении. Введение Т-клеток CD4+(Тх) бестимусным мышам или реципиентам АТх.ВМ вызывает реакцию острого отторжения кожного трансплантата. Непримированные Т-лимфоциты CD8+(Тц-клетки) неспособны давать такую реакцию, однако если вводить их вместе с очень небольшим числом Т-клеток CD4+или использовать Т-клетки CD8+, предварительно сенсибилизированные антигенами трансплантата (например, полученные от животных, у которых уже произошло отторжение трансплантата), то наблюдается быстрое разрушение трансплантата. Значение Тх-клеток в реакции отторжения подтверждают результаты опытов с введением реципиентам моноклональных антител анти-СD4+ (рис. 27.9).
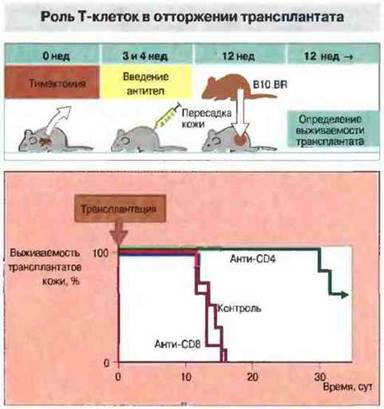
Рис. 27.9. Тимэктомированным мышам линии СВА были введены цитотоксические моноклональные антитела анти-СD4 или анти-СD8 для избирательного истощения популяций Тх- и Тц-клеток соответственно. Затем животным трансплантировали кожу мышей линии B10.BR, несовместимых с реципиентами по минорным локусам гистосовместимости. Регистрировали приживление трансплантатов. У животных, обработанных антителами анти-СD4, выживаемость трансплантата была гораздо выше, чем у необработанных реципиентов или у мышей, получивших антитела анти-СD8. Эти результаты свидетельствуют о значении популяции Т-клеток CD4+ (Тх) в отторжении трансплантата. (По данным проф. Н. Watdman и д-ра S. Cobbold).
Тх-клетки активируются АПК костномозгового происхождения, несущими молекулы МНС класса II. Стимулирующие отторжение АПК могут принадлежать как донору, так и реципиенту. АПК донора присутствуют в трансплантате в качестве лейкоцитов-пассажиров (интерстициальные дендритные клетки) и могут обусловить «прямую» активацию Тх-клеток реципиента. АПК, принадлежащие реципиенту и локализованные в дренирующих лимфоидных тканях, приобретают антиген, высвобождаемый трансплантатом, и презентируют его Тх-клеткам реципиента, вызывая их «непрямую» активацию. Прямая активация дает более мощный стимул к отторжению трансплантированной ткани по сравнению с непрямым путем. Таким образом, лейкоциты-пассажиры могут оказывать сильное влияние на приживаемость трансплантата (рис. 27.10).
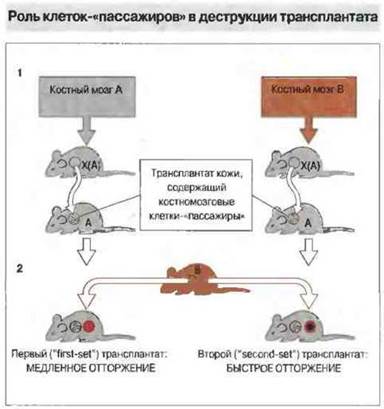
Рис. 27.10. Мышам линии А, подвергнутым Х-облучению [Х(А)], вводили клетки костного мозга мышей линии А или В Кожный трансплантат этих животных приживлялся при пересадке мышам-реципиентам линии А (1). Затем реципиентам трансплантировали кожу мышей линии В. Мыши с первым трансплантатом, донором которого были животные Х(А), получившие клетки костного мозга А, отторгали кожу мышей линии В медленнее, чем те животные, которым первый трансплантат пересаживали от доноров Х(А), получивших клетки В (2). Это свидетельствует, что костномозговые клетки мышей линии В, содержавшиеся в первом трансплантате в качестве клеток-«пассажиров», примировали реципиента к аллоантигенам В.
Роль лимфокинов в отторжении. Помимо Тх-клеток CD4+в отторжении участвуют и другие иммунологические факторы, включая лимфокины (рис. 27.11).
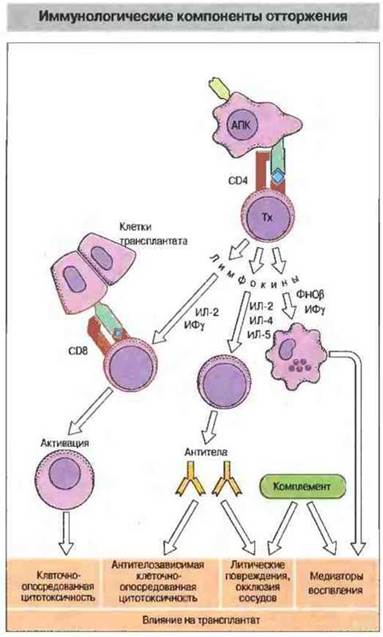
Рис. 27.11. Активированные АПК Тх-клетки выделяют цитокины, из которых ИЛ-2 и ИФγ необходимы для активации Тц-клеток, ИЛ-2, ИЛ-4 и ИЛ-5 - В-клеток, а ФНОβ (лимфотоксин) в сочетании с ИФγ действует как фактор активации макрофагов (ФАМ). Эти клетки вызывают специфические клеточно- и антителоопосредованные реакции или неспецифические воспалительные процессы, которые вызывают отторжение трансплантата.
Наиболее важную роль в разрушении трансплантированных клеток играют иитерлейкин-2 (ИЛ-2) — он необходим для активации Тц-клеток, и ИФγ - он индуцирует экспрессию МНС, повышает активность АПК, стимулирует большие гранулярные лимфоциты и совместно с ФНОβ (лимфотоксином) активирует макрофаги. [Примечание: ранее смесь ИФγ и ФНОβ была известна под названием фактора, активирующего макрофаги (ФАМ)].
Лимфокины (ИЛ-4, ИЛ-5 и ИЛ-6) требуются также для активации В-клеток, продуцирующих антитела против трансплантата. Эти антитела связывают комплемент и вызывают повреждение сосудистого эндотелия, что ведет к возникновению геморрагий, агрегации тромбоцитов внутри сосудов трансплантата и их тромбозу; антитела обусловливают также литическое повреждение клеток трансплантата и высвобождение провоспалительных компонентов комплемента, С3а и С5а.
Для отторжения трансплантата не обязательно, чтобы иммунные факторы подействовали на все его структуры. Главными объектами их воздействия (мишенями) служат эндотелий микрососудистого русла трансплантата и специализированные паренхиматозные клетки данного органа - почечные канальцы, островки Лангерганса поджелудочной железы или миоциты сердечной мышцы.
Лимфокин ИФγ способен индуцировать высокий уровень экспрессии молекул МНС класса II клетками эндотелия сосудов, а также появление молекул классов I и II на паренхиматозных клетках, которые в обычных условиях не экспрессируют антигены МНС или экспрессируют их в небольшом количестве. Такое повышение экспрессии антигенов МНС клетками трансплантата увеличивает число молекул-мишеней для действия антител и активированных клеток, что ведет к усилению реакции отторжения.
Под влиянием ФНОβ и ИФγ возрастает также экспрессия молекул адгезии на сосудистом эндотелии. Эти молекулы необходимы для прилипания циркулирующих в крови лейкоцитов к стенке сосудов, перед тем как они проходят через эндотелий в ткани.