ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 27. Трансплантация и отторжение
ПРЕДОТВРАЩЕНИЕ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
Реакцию отторжения трансплантата можно ослабить правильным подбором пары донор-реципиент
Идеальная пара для пересадки — это изогенные донор и реципиент, например однояйцевые близнецы. Однако возможность подобрать такую пару встречается редко, и в большинстве случаев существуют различия между донором и реципиентом по МНС и/или минорным локусам гистосовместимости. На практике достаточно подобрать пару, совместимую по главным антигенам (МНС, у человека HLA). Проверить совместимость можно при помощи серологического типирования (рис. 27.19), постановка которого требует всего лишь нескольких часов и поэтому может быть осуществлена в течение срока хранения донорского органа во льду. Недавно был разработан новый, чувствительный и точный метол типирования с использованием полимеразной цепной реакции (ПЦР; см. гл. 29), позволяющий идентифицировать гены HLA донора и реципиента.
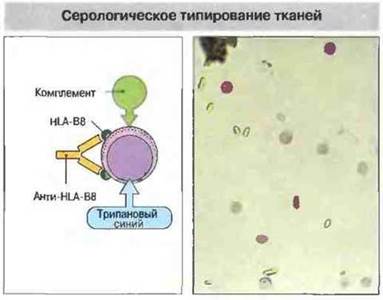
Рис. 27.19. Серологическое типирование тканей производят при помощи микролимфоцитотоксического теста. К испытуемым клеткам добавляют типирующие сыворотки (например, анти-HLA-В8), комплемент и краситель трипановый синий. Гибель клеток, определяемая по их окрашиванию, говорит о том, что тест-клетки несут определяемый антиген (в данном случае HLA-B8). На микрофотографии справа видны окрашенные трипа- новым синим (темные) погибшие клетки.
Обеспечить совместимость по всем известным антигенам HLA практически невозможно, однако хорошие результаты удается получить в тех случаях, когда донор и реципиент имеют одни и те же МНС-антигены класса II, особенно если это антигены HLA-DR (рис. 27.20) — они непосредственно активируют Тх-клетки реципиента.
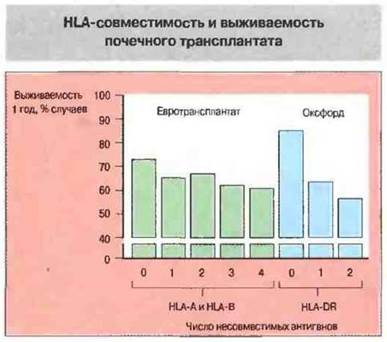
Рис. 27.20. На рисунке представлены результаты двух разных исследований, в которых определяли выживаемость трансплантированных трупных почек через 1 год после пересадки. В первой работе (Евротрансплантат) доноров типировали по антигенам HLA-A и HLA-B (класс I). Во втором исследовании (Оксфорд) производили типирование доноров по антигенам HLA-DR (класс II).
Число известных к настоящему времени HLA-антигенов класса I (HLA-A, HLA-B и HLA-C) и класса II (HLA-DP, HLA-DQ и HLA-DR) достаточно велико (рис. 27.21), так что полная совместимость двух выбранных случайным образом индивидов крайне маловероятна.
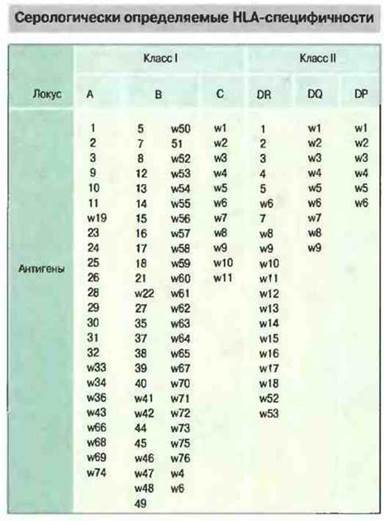
Рис. 27.21. У человека идентифицировано примерно 80 различных молекул класса I (HLA-A, HLA-B и HLA-C) и свыше 35 разных молекул класса II (HLA-DP, HLA-DQ и НLA-DR). При помощи молекулярно-генетических методов удается обнаружить гораздо больше вариантов. Однако не все из этих новых вариантов можно различить серологически.
Для определения реактивности лимфоцитов реципиента в отношении антигенов, экспрессируемых клетками донора, можно использовать также реакцию смешанной культуры лимфоцитов (СКЛ) (рис. 27.22). Слабая реакция в смеси клеток донора и реципиента ассоциируется с отличной выживаемостью трансплантата. Однако постановка реакции СКЛ занимает 4-5 сут, что служит серьезным препятствием для ее использования в клинике — органы, полученные от трупа или больного, смерть которого зарегистрирована по прекращению функционирования головного мозга, не могут сохраняться более 24-48 ч. Тест СКЛ можно применять в тех случаях, когда орган взят от живого донора (например, родственника). Результаты этой реакции особенно важны при трансплантации костного мозга, так как они позволяют установить, способны ли клетки костного мозга донора реагировать на антигены реципиента и вызывать РТПХ.
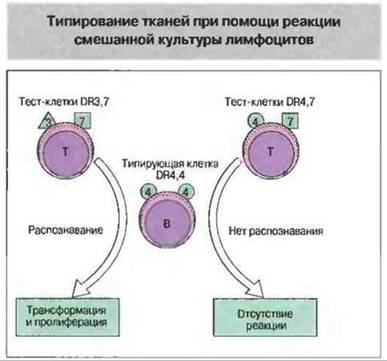
Рис. 27.22. В реакции смешанной культуры лимфоцитов тест-клетки инкубируют с «типирующими» клетками известной HLA-специфичности (в данном случае DR4,4). Клетки DR3,7 распознают типирующие клетки как чужеродные; это можно определить по трансформации и пролиферации типируемых клеток (типирующие клетки заранее обрабатывают таким образом, что сами они не могут делиться при взаимодействии с тест-клетками). В отличие от этого клетки DR4,7, имеющие такую же специфичность, как типирующие клетки (DR4), не распознают типирующие клетки и не реагируют на них.
Реакцию отторжения трансплантата можно предотвратить неспецифической иммуносупрессией
Существуют две формы иммуносулрессивной обработки — антиген-неспецифическая и антиген-специфическая. Путем неспецифической иммуносупрессии можно подавить или ослабить активность иммунной системы по отношению ко всем антигенам, однако при этом повышается чувствительность реципиента трансплантата к инфекциям. Так, Х-облучение в высокой дозе предотвращает отторжение, но одновременно вызывает ряд неблагоприятных эффектов, включая угнетение противомикробного иммунитета. Большинство неспецифических иммуносупрессивных агентов, применяемых в настоящее время, — это препараты, оказывающие избирательное воздействие на иммунную систему или действующие в той или иной степени избирательно благодаря использованию их по определенной схеме. В будущем такой подход будет усовершенствован, чтобы можно было элиминировать только те клоны лимфоцитов, которые специфичны к антигенам донора, оставляя другие клоны интактными. Это позволит сохранять защиту от инфекций и избегать других побочных эффектов. Такая высокоспецифическая иммуносупрессия пока остается для трансплантационной иммунобиологии своего рода чашей Грааля (см. ниже).
В клинической практике сейчас наиболее широко применяются неспецифические иммуносупрессивные агенты трех типов — стероиды, циклоспорин иазатиоприн (рис. 27.23).
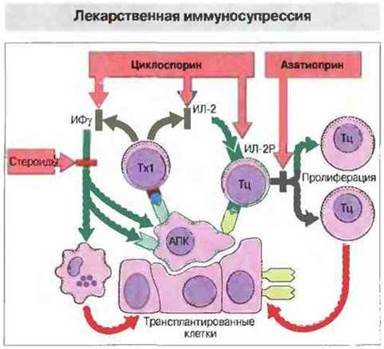
Рис. 27.23. Широко используемые в клинике агенты - стероиды, циклоспорин и азатиоприн - подавляют реакцию отторжения разными путями. Стероиды обладают противовоспалительными свойствами - угнетают функции макрофагов и АПК, снижая также экспрессию антигенов МНС. Циклоспорин блокирует продукцию цитокинов; азатиоприн подавляет пролиферацию активированных клеток.
Стероиды обладают противовоспалительными свойствами, супрессируют активированные макрофаги, угнетают функции АПК и снижают экспрессию антигенов МНС. Такое действие стероидов обусловлено тем, что они могут отменять многие эффекты ИФγ в отношении макрофагов и трансплантированных тканей.
Циклоспорин — это циклический полипептидный антибиотик, продуцентами которого служат почвенные грибы. Он обладает высокой иммуносупрессивной активностью. Основное в действии циклоспорина — это подавление синтеза лимфокинов (в результате влияния на активацию генов лимфокинов) и прямое или опосредованное снижение экспрессии рецепторов ИЛ-2 лимфоцитами, получившими сигнал активации. Другие продуцируемые грибами циклические полипептидные антибиотики, например FK506 (такролимус) и рапамицин, также обладают иммуносупрессивными свойствами. Антибиотик FK506 подавляет продукцию лимфокинов Тх-клетками, обладая сходным с циклоспорином механизмом действия. Рапамицин блокирует пути внутриклеточной передачи сигнала с рецептора ИЛ-2 и тем самым угнетает ИЛ-2-зависимую активацию лимфоцитов. Структура циклоспорина, FK506 и рапамицина показана на рис. 27.24.
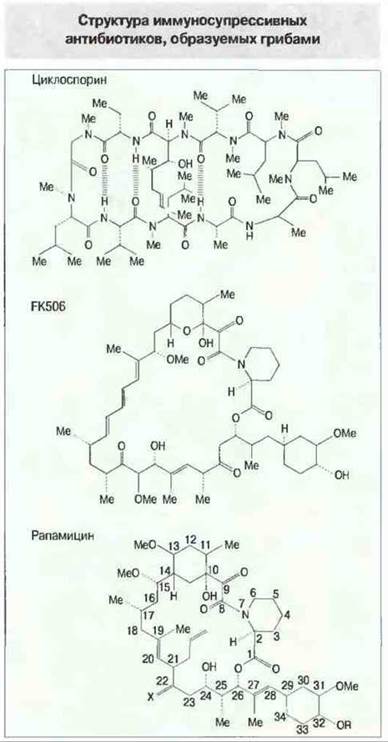
Рис. 27.24. Иммупосупрессивные циклические полипептидные антибиотики, продуцируемые грибами, различны по структуре и различным образом действуют на лимфоциты: циклоспорин и FK506 угнетают образование лимфокинов, а рапамицин блокирует передачу сигнала, осуществляемую при участии рецептора к ИЛ-2 (ИЛ-2Р).
Реакция отторжения трансплантата связана с быстрым делением и дифференцировкой — пролиферацией — лимфоцитов. Воздействовать на нее можно с помощью антипролиферативного агента азатиоприна. Продукт его метаболизирования включае тся в ДНК делящихся клеток, препятствуя их дальнейшей пролиферации. Сейчас изучаются новые антипролиферативные препараты, в частности производные микофеноловой кислоты.
Все эти иммупосупрессивные агенты могут быть эффективны как монотерапевтические средства, однако для получения желаемого результата требуется их введение в высоких дозах, из-за чего возрастает вероятность возникновения побочных токсических эффектов. При использовании в сочетаниях иммунодепрессанты дают синергичный эффект, так как влияют на разные стадии одного и того же иммунного процесса. Поэтому дозы отдельных компонентов комбинации можно уменьшать, сводя тем самым к минимуму побочные реакции. Применение циклоспорина существенно улучшило результаты трансплантации в клинике (выживаемость трансплантатов почек, сердца и печени достигает 1 года в 85—90 % случаев). Однако время полужизни трансплантированных почек по-прежнему составляет 7—8 лет, поскольку использование циклоспорина не решило проблемы хронического отторжения, а длительное применение этого препарата все же сопряжено с побочными эффектами. Дальнейших успехов следует ожидать от введения в клиническую практику новых лекарственных препаратов.
Сейчас проводится изучение новых агентов, также обладающих неспецифическими иммуносупрессивными свойствами, но действующих более избирательно (рис. 27.25). Для элиминации клеток или блокирования их функции могут быть использованы моноклональные антитела к антигенам клеточной поверхности, в частности к CD3, CD4, CD8 и рецептору ИЛ-2. С целью повышения эффективности этих антител их можно конъюгировать с цитотоксическими агентами. Другой, подобный этому подход заключается в соединении токсина с ИЛ-2: экспрессирующие рецептор ИЛ-2 клетки, активация которых происходит при ответе на антигены трансплантата, связывают конъюгат ИЛ-2-токсин и избирательно инактивируются токсином.
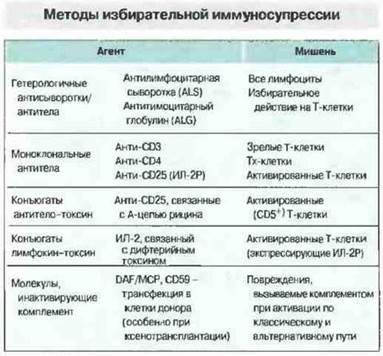
Рис. 27.25. Антитела и лимфокины могут направленно действовать на определенные клетки иммунной системы. В отличие от этого лекарственные средства способны оказывать нежелательное влияние на нелимфоидные ткани, например обладать нефро- и гепатотоксичностью. Эффективность биологических агентов повышается при соединении их с химическими агентами или токсинами. (DAF - фактор, ускоряющий диссоциацию, от англ. decay accelerating tactor; МСР - мембранный кофакторный белок, от англ. membrane cofactor protein.)
Специфическая иммуносупрессия ослабляет иммунный ответ на трансплантат, не вызывая повышения чувствительности к инфекциям
Регуляция интенсивности, типа и специфичности иммунологических реакций происходит различными путями по механизму обратной связи (см. гл. 13). В эксперименте можно предотвратить отторжение трансплантата, воздействуя на эти пути регуляции с помощью трех классических приемов: индукции толерантности в неонатальный период, активного усиления и пассивного усиления толерантности.
Введение антигенов донора новорожденным животным может индуцировать у них ареактивность к трансплантату. У грызунов, в противоположность человеку, зрелые Т-клетки начинают покидать тимус уже в неонатальный период (соответствующая стадия развития у человека приходится на 16—20 нед внутриутробного развития). Если новорожденным мышам ввести постоянный источник антигена (например, живые клетки, способные к росту) или вводить антиген многократно, развитие зрелых Т-клеток, которые реагируют с данным антигеном, подавляется. В классической постановке опыт производят следующим образом. Клетки костного мозга мышей (А х В)F1 вводят новорожденным мышам лиши В. (Использование клеток гибридов F1 исключает РТПХ анти-В, которая возникает, если вместо клеток (А х B)F1 мышам линии В ввести клетки мышей линии А.) Трансплантированный костный мозг служит постоянным источником донорских антигенов. Когда мыши линии В достигают' взрослого состояния, они оказываются ареактивными к антигенам А, воздействию которых подверглись в постнатальный период. Эти животные характеризуются толерантностью к антигенам А кожного трансплантата и других тканей доноров линии А или (А х B)F1. Механизм неонатальной индукции толерантности представлен на рис. 27.8 и детально описан в гл. 12.
Антиген может избирательно активировать некоторые субпопуляции лимфоцитов. Согласно современным представлениям, Тх-клетки делятся на две основные популяции — Тх1 и Тх2 (см. гл. II). Мыши с неонатально индуцированной толерантностью могул иметь дефицит донор-специфических Tx1- и повышенное число донор-специфических Тх2-лимфоцитов. Как показано на рис. 27.23, Tx1-клетки продуцируют ИФγ и ИЛ-2 и участвуют в отторжении трансплантата. В противоположность этому Тх2-клетки образуют другие лимфокины, включая ИЛ-10 и фактор, подавляющий синтез лимфокинов клетками Tx1. Наличие немногочисленных Tx1-клеток и боль- шогочислаТх2-клетокдонораутаких мышей означает изменение баланса между процессами отторжения и приживления трансплантата, которое ведет к развитию толерантности. Строго говоря, эта форма толерантности представляет собой не ареактивность per se, а скорее иммунное отклонение. Интересно, что циклоспорин может действовать преимущественно на Tx1-клетки, оставляя интактными Тх2.
И, наконец, антиген может активировать супрессорные Т-клетки (Тс-клетки). Их природа все еще остается неясной. Единственное наблюдение, свидетельствующее об активности Тс-клеток, состоит в том, что перенос Т-лимфоцитов, полученных от донора, толерантного к кожному трансплантату А, предотвращает у реципиента отторжение трансплантата, несущего антигены А. Это означает адоптивный перенос супрессии, и ответственными за эффект клетками могут быть Тх- или Тс-лимфоциты. Экспериментальные данные с определенностью указывают, что Т-клетки, выполняющие супрессивную функцию, существуют, однако мнения о природе Тс-клеток и механизмах их действия весьма противоречивы. Эти клетки резистентны к циклоспорину и могут способствовать его эффектам, опосредуя толерантность благодаря активной иммуносупрессии.
Специфическая иммуносупрессия у человека. Состояние, эквивалентное неонатально индуцированной толерантности животных, у человека получить невозможно. Однако сходная до некоторой степени ситуация возникает при использовании специальных методов воздействия на иммунную систему человека. Общее облучение лимфоидной ткани (ООЛ) ведет к ее резкому истощению, а применяемое при этом экранирование (защита) костного мозга сохраняет гемопоэз неповрежденным. В результате у человека возникает состояние, напоминающее неонатально индуцированную толерантность у грызунов. Действительно, ООЛ с последующим введением антигена вызывает развитие глубокой толерантности Однако использовать ООЛ в повседневной клинической практике довольно опасно. При пересадке сердца широко применяют антилимфоцитарную сыворотку, получаемую от животных, иммунизированных лимфоцитами человека. Эффект такой сыворотки состоит в элиминации циркулирующих Т-клеток реципиента. Более безопасно, но столь же эффективно позволяют элиминировать Т-клетки моноклональные антитела к антигенам зрелых Т-лимфоцитов, и в клинике нашли применение антитела анти-СD3.
У человека ареактивность к трансплантату можно индуцировать при помощи гемотрансфузий. В некоторых случаях выживаемость трансплантата удается продлить, иногда на неопределенно долгое время, предварительным введением антигенов донора (рис. 27.26). Это противоположно тому, чего можно было бы ожидать от иммунизации реципиента антигенами донора — ускоренного или сверхострого отторжения трансплантата. Данный феномен получил название активного усиления выживаемости трансплантата. Большое значение имеет путь введения антигена, что обусловлено, по-видимому, вовлечением в реакцию разных отделов лимфоидной ткани. Так, в опытах с трансплантацией почек у крыс было установлено, что внутривенное введение крови донора реципиенту за неделю до трансплантации обеспечивает долговременную выживаемость трансплантированного органа, тогда как при подкожной инъекции то же количество донорской крови вызывает ускоренное отторжение. Эффект иммунологически специфичен, поэтому донор крови и донор почки должны иметь по крайней мере некоторые общие антигены.
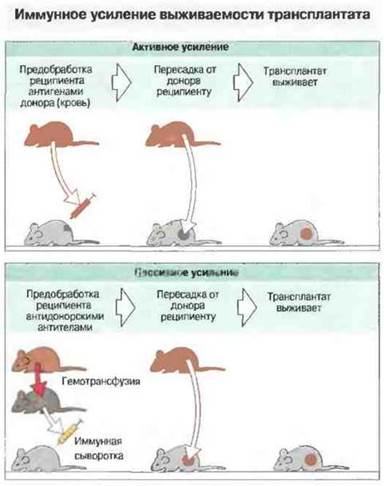
Рис. 27.26. Предварительное внутривенное введение реципиентам антигенов донора может повысить выживаемость пересаженного вслед за этим аллотрансплантата. Этот феномен носит название активного иммунного усиления толерантности, так как обусловлен активным иммунным ответом реципиента. (Следует отметить, что при другом пути введения крови того же донора может произойти быстрое отторжение трансплантата.) В отличие от этого введение реципиенту антидонорских антител во время трансплантации способно вызвать пассивное усиление толерантности. Как активное, так и пассивное усиление иммунологически специфичны, поскольку подавляется реакция лишь на антигены данного донора; продления выживаемости (усиления) трансплантата «третьего порядка», т. е. взятого у постороннего, неродственного донора, при этом не происходит.
В клинике нашел применение метод активного усиления толерантности — путем предварительной трансфузии донор-специфичной крови (ТДК). Например, перед трансплантацией почки одного из родителей ребенку трансфузируют кровь этого родителя. К сожалению, примерно у 20 % больных, которым производят ТДК, образуются антидонорские антитела и запланированную пересадку почки невозможно осуществить вследствие риска развития реакции сверхострого отторжения. Однако у остальных 80 % больных трансплантация оказывается успешной в 95-100 % случаев.
Благоприятный эффект переливания крови до трансплантации (гемотрансфузионный эффект) отмечен также у реципиентов, получивших кровь не подобранного специально донора (т. е. когда донор крови не является донором трансплантируемого органа). По-видимому, этот эффект обусловлен случайной общностью антигенов доноров крови и трансплантата (рис. 27.27). В пользу такого объяснения говорят данные о том, что гемотрансфузионный эффект возрастает с увеличением числа переливаний крови, взятой у разных допоров. В свое время в большинстве центров трансплантации была принята стратегия предварительной трансфузии крови любых доноров будущим реципиентам. Однако при этом всегда существовал риск сенсибилизации пациентов и передачи СПИДа: ставшее доступным применение иммунодепрессивных агентов сделало эту процедуру в большинстве случаев излишней.
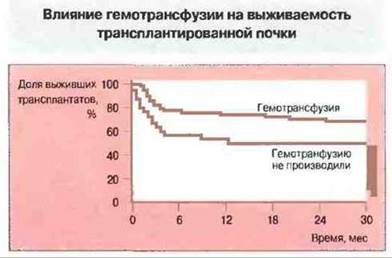
Рис. 27.27. Выживаемость трансплантированной почки у больных (102 человека), которым до трансплантации трансфузировали донорскую кровь, более продолжительна, чем у больных (71 человек), не получавших гемотрансфузии.
Для активного усиления необходимо, чтобы у больного возникла активная иммунная реакция па введенные антигены донора. Возможные механизмы этою — индукция анергии, избирательная активация Тх2-клеток или активация Тс-клеток под влиянием антигенов крови, которые имеют место при неонатально индуцированной толерантности. В других случаях возможно образование «усиливающих антител», которые, блокируя распознавание специфических антигенов донора, подавляют процесс отторжения трансплантата или разрушают высокоиммуногенные лейкоциты-«пассажиры». содержащиеся в трансплантате. Может происходить и образование таких усиливающих антител, которые взаимодействуют с антигенными рецепторами клеток, реактивных по отношению к антигенам донора; эти клетки элиминируются или же изменяется презентация антигенов таким образом, что после трансплантации избирательно активируются определенные субпопуляции, например Тх2- и Тс-лимфоциты.
В организме реципиента трансплантата антитела могут осуществлять регуляцию по механизму обратной связи. Введение антидонорских антител (пассивное усиление) крысам при трансплантации почки может обеспечить долговременную выживаемость пересаженного органа (рис. 27.26).
Вопросы для размышления
■ Чем отличаются реакции, индуцированные в результате прямой активации Т-клеток реципиента комплексом антигенный пептид донора - молекула МНС донора, от реакций, развивающихсяпри непрямой активации комплексом пептид донора - молекула МНС реципиента?
■ Гемотрансфузия, произведенная до трансплантации, может продлить выживаемость трансплантата благодаря возникновению иммунологической ареактивности. Однако у некоторых больныхобразуются антитела к чужеродным клеткам крови донора, в связи с чем трудно рассчитывать на успех последующей трансплантации органа. Каким образом можно предотвратить продукцию антидонорских антител?
■ Эффекторные механизмы хронического и острого отторжения различаются. Какие изменения нужно внести в схему лечения, чтобы избежать хронического отторжения?
■ Первый барьер при ксенотрансплантации создают ранее образованные у реципиента антитела против антигенов донора. Предположим, что можно избежать развития сверхострого отторжения, например при трансплантации человеку органов свиньи. Однако существует вероятность возникновения клеточной реакции. Чем будут отличаться процессы распознавания чужеродных антигенов при ксено-и аллотрансплантации?
■ В чем состоят механизмы, способствующие отторжению трансплантата при прямом и непрямом способах иммунизации?
■ Какая комбинация лекарственных препаратов, антител и антигенов оказалась бы, по вашему мнению, наиболее эффективной при пересадке гистонесовместимого трансплантата?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Alexander G.P.J., Latime D., Gianello P. et al. 1991. Preformed cytotoxic antibodies and ABO-incompatible grafts. Clin. Transplant. 5: 583.
Bach F.H. 1991. Xenotransplantation: problems for consideration. Clin. Transplant. 5: 595.
Bjorkman P.J., Saper M.A., Samaouri B. et al. 1987. The foreign antigen binding site and T cell recognition regions of class I histocompatibility antigens. Nature 329: 512.
Burdick J.F. 1991. Chronic rejection Clin. Transplant. 5: 489.
Concar D. 1994. The organ factory of the future? New Scientist 1930: 24-29.
Dallman M.J., Clark G.J. 1991. Cytokines and their receptors in transplantation. Curr. Opin. Immunol. 3. 729.
Graff R.J., Bailey D.W. 1973. The non-H-2 histocompatibility loci and their antigens. Transplant. Rev. 15: 26-49.
Hall B.M., Dorsch S., Roser B. 1978. The cellular basis of allograft rejection in vivo. I. The cellular requirements for first set rejection of heart grafts. J. Exp. Med. 148: 878.
Halloran P.F. Broski A.P., Batiuk T.D. et al. 1993. The molecular immunology of acute rejection: an overview. Transplant. Immunol. 1: 3-27.
Hunt S., Billingham М. 1991. Long-term results of cardiac transplantation. Ann. Rev. Med. 42: 437.
Hutchinson I.V. 1991. Cellular mechanisms of allograft rejection. Cure Opin. Immunol. 3: 722.
Lechler R.I., Lombardi G., Batchelor J.R. et al. 1990. The molecular basis of alloreactivity. Immunol. Today 11:83.
Mason D.W., Morris P.J. 1986. Effector mechanisms in allograft rejection. Annu. Rev. Immunol. 4: 119.
Masoor S., Schroeder T.J., Michler R.E. et al. 1986. Monoclonal antibodies in organ transplantation: an overview. Transplant. Immunol. 4: 176-89.
Opelz G. 1989. Effect of HLA matching in heart transplantation. Transplant. Proc. 21: 794.
Piatt J.L., Bach F.H. 1991. The barrier to xenotransplantation. Transplantation 52: 937.
Sablinski T., Hancock W.W., Tilney N.L. et al. 1991. CD4 monoclonal antibodies in organ transplantation. A review of progress. Transplantation 52: 579.
Sachs D.H., Bach F.H. 1990. Immunology of xenograft rejection. Human Immunol. 28: 245.
Stemmuller D. 1985. Which T cells mediate allograft rejection? Transplantion 40: 229.
Thomson A.W. 1994. Immunosuppressive drugs and the induction of transplantation tolerance. Transplant. Immunol. 2: 263-70.
Waldman H., Cobbold S. 1993. The use of monoclonal antibodies to achieve immunological tolerance. Immunol. Today 14: 247-51.
Waldmann H. 1989. Manipulation of T-cell responses with monoclonal antibodies. Annu. Rev. Immunol. 7: 407.
Wood K.J. 1991. Transplantation tolerance. Curr. Opin. Immunol. 3: 710.