ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 4. Комплемент
АКТИВАЦИЯ КОМПЛЕМЕНТА
Существует три пути (механизма) активации комплемента: классический, лектиновый и альтернативный. Все они ведут к образованию конвертазы, расщепляющей С3 на С3а и С3b, — центральный момент любого из каскадов комплемента (рис. 4.2).
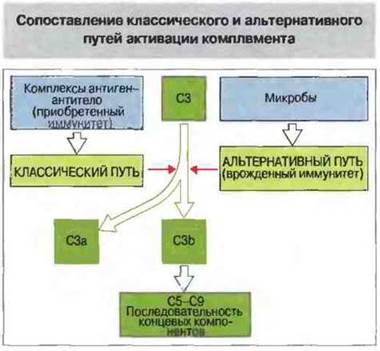
Рис. 4.2. Активация комплемента как по классическому, так и по альтернативному пути приводит к появлению С3-конвертазы, которая превращает С3 в С3b, и эта конверсия - центральное событие всего каскада. В свою очередь, С3b активирует цепочку концевых компонентов комплемента (С5-С9), образующих литический комплекс. При активации по классическому пути сначала антиген связывается со специфическими антителами и только затем происходит фиксация С3. В альтернативной активации антитела не участвуют. Она начинается ковалентным связыванием С3b с гидроксильными группами на цитоплазматической мембране микробной клетки. Активация по альтернативному пути служит механизмом неспецифического врожденного иммунитета, тогда как классический путь представляет собой связующее звено между врожденным и приобретенным иммунитетом, появившееся в филогенезе сравнительно недавно.
Конвертаза классического и лектинового путей представляет собой комбинацию фрагментов С4 и ![]() тогда как конвертаза альтернативного пути — это комплекс С3 с
тогда как конвертаза альтернативного пути — это комплекс С3 с ![]() Фрагмент С3b, который отщепляют от С3 обе конвертазы, связывается с мембраной мишени и становится фокусом дополнительного образования С3b — эта ступень каскада получила название петля усиления.
Фрагмент С3b, который отщепляют от С3 обе конвертазы, связывается с мембраной мишени и становится фокусом дополнительного образования С3b — эта ступень каскада получила название петля усиления.
Присоединяя дополнительно молекулу С3b, обе С3-конвертазы могут превращаться в конвертазу С5, которая функционирует как катализатор на первой ступени каскада, ведущего к образованию лизирующего мембрану комплекса.
Классический путь активации комплемента чаще всего запускается иммунными комплексами
Зависимая от антител активация комплемента развертывается в основном по классическому пути (рис. 4.3); роль первого ферментного комплекса в нем выполняет белок С1.
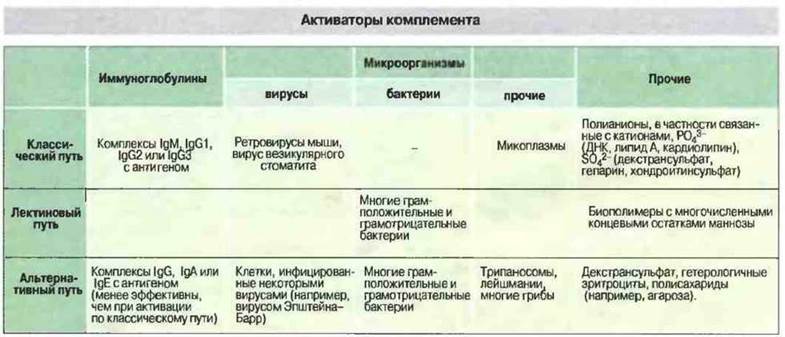
Рис. 4.3. В таблице перечислены основные активаторы комплемента по классическому, лещиновому и альтернативному механизмам.
Активацию инициирует связывание С1 с антителами в составе иммунных комплексов. Ферментный комплекс С1 состоит из 5 молекул — одной C1q, двух С1r и двух C1s; их соединение зависит от Ca2+ (рис. 4.4). Первая ступень каскада активации по классическому пути — это связывание антитела не менее чем с двумя из шести сферических доменов молекулы C1q. В этом высокоавидном связывании участвуют Сн2-домены (части Fc-областей) агрегированных молекул IgG в составе комплекса с антигеном. Молекулы C1q могут также связываться Сн3-доменами неагрегированной молекулы IgM, конформация которой изменилась с «плоской» на «сложенную» в результате образования комплекса с антигеном.
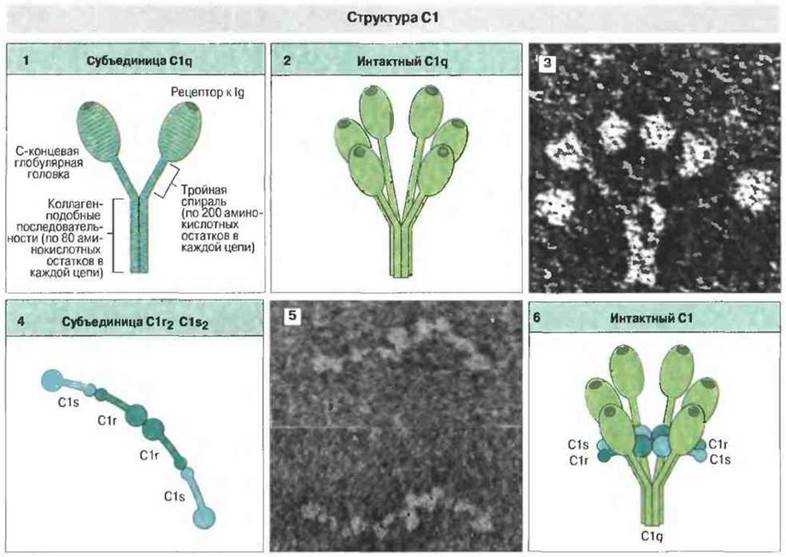
Рис. 4.4. Каждая субъединица C1q имеет Y-образную форму, при этом обе ветви Y оканчиваются сферическими головками (1). Молекула C1q образована тремя такими субъединицами, соединенными вместе (2, 3). Субъединица состоит из шести, а целая молекула C1q из 18 полипептидных цепей. Сферические головки субъединиц служат рецепторами для Fc-области IgG и образуют кольцо по периметру молекулы C1q. Пары молекул С1r и C1s. объединенные в одну структурную единицу (4, 5), располагаются поперек молекулы C1q (6). Каталитические участки С1r и C1s находятся рядом в центре кольца. Взаимное сцепление всех единиц комплекса С1 зависит от Са2+. [3 и 5 по Ross G.D. (см. дополнит, лит.); фото любезно предоставлены д-ром N. Hughes-Jones.]
Предполагается, что многоточечное связывание сферических доменов C1q с входящими в иммунные комплексы молекулами IgG или IgM ведет к изменению конформации всего комплекса С1, вызывая автокаталитическую самоактивацию сначала одной, а затем и другой молекул С1r с превращением их в две молекулы активного фермента ![]() которые расщепляют обе молекулы C1s с образованием соответственно двух молекул
которые расщепляют обе молекулы C1s с образованием соответственно двух молекул ![]() обладающих активностью сериновой эстеразы.
обладающих активностью сериновой эстеразы.
Лектиновый путь активации комплемента почти идентичен классическому, но запускается независимо от антител. Белок C1q относится к семейству кальций-зависимых лектинов, названных коллсктинами (коллагеновые лектины). В это же семейство белков входят маннан-связывающий лектин (МСЛ), называемый иначе маннан-связывающим белком (МСБ), конглютинин и легочные поверхностно-активные балки А и D. Сывороточный МСЛ может связываться с концевыми маннановыми группами на поверхности клеток бактерий, приобретая за счет этого способность к взаимодействию с двумя маннан-связывающими лектин-ассоциированными сериновыми протсиназами, МАСП1 и МАСП2, гомологичными по структуре С1r и С1s. Это взаимодействие подобно взаимодействию C1q с С1r и С1s и приводит к независимой от антител активации комплемента по классическому пути.
Кроме тою, C1q связывается непосредственно, т. е. без участия антител, с некоторыми микробами, в частности с микоплазмами и рядом ретровирусов (но не ВИЧ).
Под действием С1 происходит расщепление С4 с образованием активированного С4b. Белок С4 комплемента содержит внутреннюю гиоэфирную связь, участок расположения которой высокогомологичен тиоэфир-содержашему участку С3 (см. ниже). При растеплении С4 под действием ![]() возникает два фрагмента: С4а, обладающий слабой анафилатоксической активностью, и более крупный (нестабильный, промежуточный), С4b*. (Звездочка указывает на нестабильное состояние молекулы, в которой активирован участок связывания.) В течение нескольких миллисекунд С4b* подвергается атаке расположенных в непосредственной близости нуклеофильных групп. Большинство молекул С4b* гидролизуется с образованием инактивированного iC4b. Однако С4b* может образовывать ковалентные связи с амино- или гидроксигруппами молекул клеточной мембраны, превращаясь в связанный на поверхности С4b.
возникает два фрагмента: С4а, обладающий слабой анафилатоксической активностью, и более крупный (нестабильный, промежуточный), С4b*. (Звездочка указывает на нестабильное состояние молекулы, в которой активирован участок связывания.) В течение нескольких миллисекунд С4b* подвергается атаке расположенных в непосредственной близости нуклеофильных групп. Большинство молекул С4b* гидролизуется с образованием инактивированного iC4b. Однако С4b* может образовывать ковалентные связи с амино- или гидроксигруппами молекул клеточной мембраны, превращаясь в связанный на поверхности С4b.
Известны два изотипа С4 — С4А и С4В. Их кодируют расположенные тандемно гены главного комплекса гистосовместимости. Активированный С4А взаимодействует преимущественно с аминогруппами, а С4В — с гидроксируппами, образуя соответственно амидные и эфирные связи. Таким образом, С4А связывается в основном с белками, а С4В с углеводами.
В результате присоединения С2 к связанному на клеточной поверхности С4b образуется С3-конвертаза классического пути. Связанный на клеточной поверхности С4b становится, в свою очередь, участком связывания для профермента С2. Связанный С2 служит субстратом для C1s, который расщепляет его с освобождением С2b. при этом более крупный фрагмент, С2а, остается присоединенным к С4b. в результате чего образуется С4b2а — ферментный комплекс, называемый С3-конвертазой классического пути.
Образующийся под действием С3-конвертазы белок С3b может ковалентно связываться с молекулами клеточной поверхности. Полипептид С3 относится к белкам с необычными посттрансляционными изменениями структуры. Расположенные на близком расстоянии остатки цистеина и глутамина образуют за счет элиминации аммиака метастабильную внутреннюю тиоэфирную связь. Электрофильная (акцептирующая электроны) карбонильная группа (—С+=0) этого тиоэфира чувствительна к атаке нуклеофильных групп (доноры электронов), в том числе амино- и гидроксигрупп приближающихся белковых и углеводных молекул. Таким образом, С3 способен ковалентно связываться с этими молекулами (рис. 4.5).
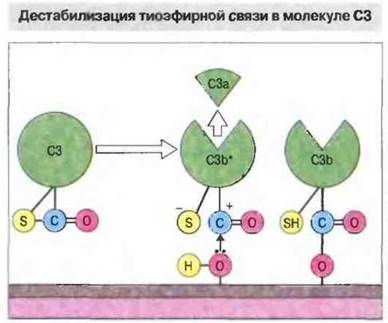
Рис. 4.5. α-Цепь молекулы С3 содержит тиоэфирную связь, образованную остатками цистеина и глутамина. В результате расщепления С3 на С3а и С3b* эта связь становится нестабильной и чувствительной к нуклеофильной атаке —ОН- и —NH2-гpyпп (доноров электронов), что позволяет С3b ковалентно связываться с белками и углеводами.
Протеолитическое отщепление С3а от N- конца α-цепи С3 под действием С3-конвертазы приводит к конформационному изменению оставшейся части молекулы (т. е. С3b*), делающему внутреннюю тиоэфирную связь весьма нестабильной. Она становится новым участком связывания внутри С3b*, способным очень активно взаимодействовать с находящимися вблизи нуклеофильными группами. Как и в случае С4b*, большая часть молекул С3b* подвергается гидролизу, однако некоторые молекулы связываются с белками и углеводами, находящимися в непосредственной близости от места активации. Поскольку С3-конвертаза обычно образуется на чужеродной поверхности или на иммунных комплексах, С3b накапливается в основном там же. Затем связанный С3b становится фокусом дальнейшей активации комплемента по так называемой петле усиления альтернативного пути (см. ниже) (рис. 4.6).
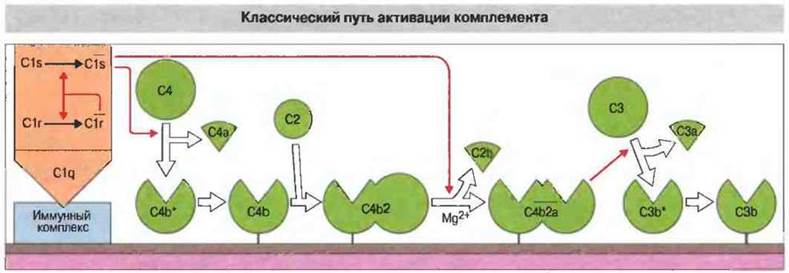
Рис. 4.6. В результате связывания C1q с иммунными комплексами происходит каталитическая самоактивация С1r и активация C1s. Затем ![]() расщепляет С4 с освобождением С4а; фрагмент С4b* остается при этом на месте и немедленно связывается с расположенными вблизи белками или углеводами. Связавшийся таким образом с клеточной поверхностью С4b в свою очередь связывает С2 (в присутствии Мg2+). Затем C1s отщепляет от образовавшегося комплекса С2b, при этом С2а остается связанным. (Напомним, что вопреки общему принципу обозначения фрагментов, С2а - это больший фрагмент. Внесены предложения об изменении номенклатуры и принятии более четкой системы обозначений, однако в этой книге еще использованы данные ранее обозначения.) Комплекс
расщепляет С4 с освобождением С4а; фрагмент С4b* остается при этом на месте и немедленно связывается с расположенными вблизи белками или углеводами. Связавшийся таким образом с клеточной поверхностью С4b в свою очередь связывает С2 (в присутствии Мg2+). Затем C1s отщепляет от образовавшегося комплекса С2b, при этом С2а остается связанным. (Напомним, что вопреки общему принципу обозначения фрагментов, С2а - это больший фрагмент. Внесены предложения об изменении номенклатуры и принятии более четкой системы обозначений, однако в этой книге еще использованы данные ранее обозначения.) Комплекс ![]() - это С3-конвертаза классического механизма. Здесь и в последующих диаграммах в этой главе все ферментативные реакции обозначены красными стрелками.
- это С3-конвертаза классического механизма. Здесь и в последующих диаграммах в этой главе все ферментативные реакции обозначены красными стрелками.
Активация комплемента по классическому пути тонко регулируется. Существует два механизма регуляции классического пути активации комплемента в жидкой фазе. Первый - это действие СI-ингибитора, т. е. ингибитора сериновых протеиназ (серпина), связывающего и инактивирующего ![]() и
и ![]()
Второй механизм состоит в подавлении образования С3-конвертазы классического пути, ![]() В жидкой фазе так действуют фактор I и С4-связываюший белок (С4-bр), вместе расщепляющие С4b. Кроме того, С4-bр вызывает диссоциацию
В жидкой фазе так действуют фактор I и С4-связываюший белок (С4-bр), вместе расщепляющие С4b. Кроме того, С4-bр вызывает диссоциацию ![]() на С2а и С4b.
на С2а и С4b.
Активация по классическому пути регулируется также путем подавления взаимодействия комплемента с поверхностью клеток хозяина. Ингибирование осуществляют регуляторные белки комплемента: фактор, ускоряющий диссоциацию С3-конвсртазы (ФУД, CD55), рецепторы комплемента 1 типа (CR1, CD35) и мембранный кофакторный белок (МКБ, CD46). Эти белки действуют следующим образом (рис. 4.7):
✵ подавляют связывание С2 с С4b (ФУД или CR1);
✵ вызывают и ускоряют диссоциацию С4b2а на С2а и С4b (ФУД и CR1);
✵ действуют как кофакторы, стимулируя катаболизм С4b под действием фактора I (МКБ или CR1).
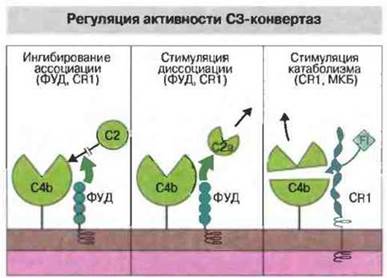
Рис. 4.7. Фактор, ускоряющий диссоциацию С3-конвертазы (ФУД), и CR1 ингибируют связывание С2 с С4b и вызывают распад уже образовавшегося комплекса ![]() Белок CR1 и мембранный кофакторный белок (МКБ) индуцируют расщепление С4b под действием фактора I (FI). Эти молекулы регулируют также взаимодействие С3b с фактором В.
Белок CR1 и мембранный кофакторный белок (МКБ) индуцируют расщепление С4b под действием фактора I (FI). Эти молекулы регулируют также взаимодействие С3b с фактором В.
Существует самопроизвольная активация комплемента по альтернативному пути
«Холостая» альтернативная активация комплемента постоянно поддерживает в плазме крови небольшую концентрацию С3b*. Внутренняя тиоэфирная связь в нативной молекуле С3 чувствительна к спонтанному гидролизу с превращением в активированную форму - C3i. (Эта постоянная, происходящая на низком уровне, самопроизвольная активация СЗ в плазме крови называется «холостой».) Образующийся C3i связывает фактор В с образованием C3iB (рис. 4.8). [Аналогичным образом, С2 связывается с С4b (рис. 4.9).] Связанный фактор В расщепляется фактором D с высвобождением Ва. Оставшийся комплекс ![]() представляет собой жидкофазную С3-конвертазу альтернативного пути (рис. 4.8), расщепляющую С3 на С3а и С3b. Запуск петли усиления альтернативного пути связанным на поверхности аутологичных клеток С3b предотвращают регуляторные белки комплемента.
представляет собой жидкофазную С3-конвертазу альтернативного пути (рис. 4.8), расщепляющую С3 на С3а и С3b. Запуск петли усиления альтернативного пути связанным на поверхности аутологичных клеток С3b предотвращают регуляторные белки комплемента.
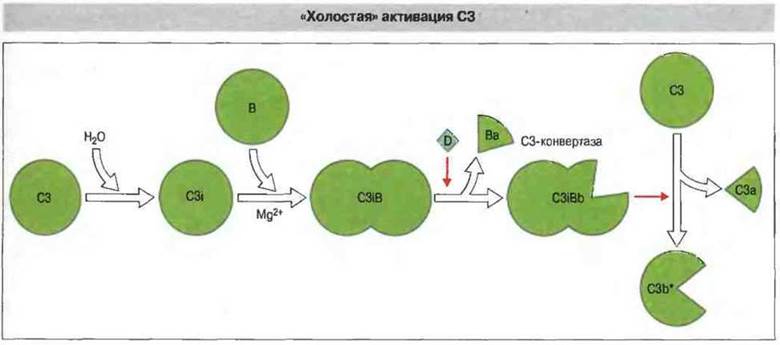
Рис. 4.8. В результате гидролиза тиоэфирной связи в молекуле нативного С3 этот компонент превращается в C3i [С3(Н2O)], который в присутствии Мg2+ связывается с фактором В. Возникший комплекс в результате расщепления фактора В фактором D превращается в жидкофазную С3-конвертазу, которая может уже непосредственно расщеплять нативный С3 на С3а и С3b.
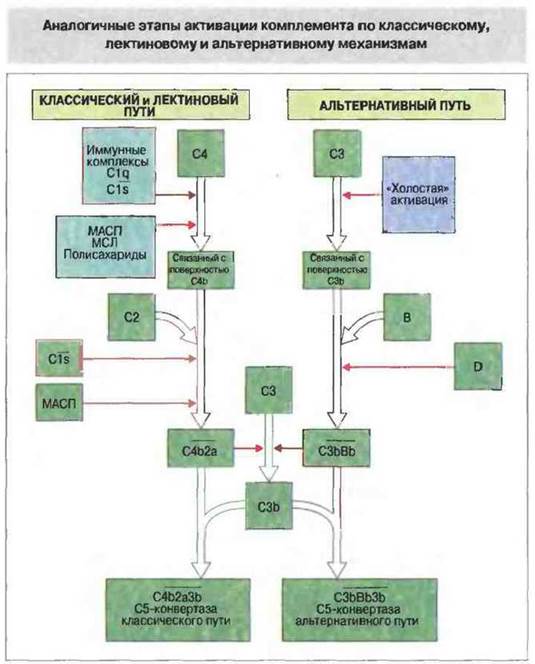
Рис. 4.9. Как классический, так и альтернативный путь активации комплемента приводит к появлению С3-конвертазы: ![]() и
и ![]() соответственно. Классический путь начинается с активации C1s комплексом антиген-антитело и последующего расщепления активированным С1s компонентов С4 и С2. фрагменты меньшего размера, С4а и С2b, высвобождаются, а более крупные образуют
соответственно. Классический путь начинается с активации C1s комплексом антиген-антитело и последующего расщепления активированным С1s компонентов С4 и С2. фрагменты меньшего размера, С4а и С2b, высвобождаются, а более крупные образуют ![]() . Компоненты С4 и С2 могут быть активированы также МАСП (маннан-связывающей лектин-ассоциированной сериновой протеиназой) - белком лектинового пути, аналогичным C1s, и МСЛ (сывороточным маннан-связывающим лектином). На первых этапах альтернативного пути возникший в результате «холостой» активации и связавшийся с поверхностью белок С3b соединяется с фактором В, от которого фактор D отщепляет меньший фрагмент - Ва. Больший фрагмент В, т. е. Вb, остается связанным с С3b, образуя
. Компоненты С4 и С2 могут быть активированы также МАСП (маннан-связывающей лектин-ассоциированной сериновой протеиназой) - белком лектинового пути, аналогичным C1s, и МСЛ (сывороточным маннан-связывающим лектином). На первых этапах альтернативного пути возникший в результате «холостой» активации и связавшийся с поверхностью белок С3b соединяется с фактором В, от которого фактор D отщепляет меньший фрагмент - Ва. Больший фрагмент В, т. е. Вb, остается связанным с С3b, образуя ![]() - С3-конвертазу, которая расщепляет дополнительное количество молекул С3 (механизм положительной обратной связи) Поверхность, активирующая комплемент (например, микроорганизмов), стабилизирует С3b, обеспечивая его связывание с фактором В. Это способствует дальнейшей альтернативной активации комплемента. С3-конвертазы классического и альтернативного путей могут дополнительно присоединять С3b, образуя ферментные комплексы, называемые С5-конвертазами (
- С3-конвертазу, которая расщепляет дополнительное количество молекул С3 (механизм положительной обратной связи) Поверхность, активирующая комплемент (например, микроорганизмов), стабилизирует С3b, обеспечивая его связывание с фактором В. Это способствует дальнейшей альтернативной активации комплемента. С3-конвертазы классического и альтернативного путей могут дополнительно присоединять С3b, образуя ферментные комплексы, называемые С5-конвертазами (![]() и
и ![]() соответственно), которые активируют следующий компонент системы комплемента - С5.
соответственно), которые активируют следующий компонент системы комплемента - С5.
Поскольку С3-конвертаза альтернативного пути действует в жидкой фазе, большая часть образовавшегося в результате ее активности С3b* гидролизуется и инактивируется водой. Однако в случае контакта с чужеродной поверхностью, в частности с мембраной бактериальной клетки, С3b* ковалентно связывается и инициирует действие петли усиления альтернативного пути. Общая схема взаимодействия компонентов комплемента при активации по классическому, лектиновому и альтернативному механизмам представлена на рис. 4.9.
На поверхности микробной клетки С3b защищен от протеолиза. Поверхности, интенсивно активирующие комплемент, названы защитными (рис. 4.12), поскольку связанный с ними С3b защищен от протеолиза. Чужеродная поверхность, подобная мембране бактериальной клетки, «защищает» С3, поскольку, связавшись с ней, он проявляет более высокую аффинность к фактору В, чем к фактору Н, и образует, вероятно, более стабильную конвертазу. Кроме того, на чужеродной поверхности отсутствуют регуляторные белки организма-хозяина, ингибирующие активацию комплемента.
Хотя не совсем ясно, каковы конкретные структурные характеристики, необходимые для того, чтобы поверхность была защитной, особое значение имеет, по-видимому, ее углеводный состав. Например, присутствие кислых сахаров, в частности сиаловой кислоты, способствует, по-видимому, защите мембраны собственных клеток организма от повышенного отложения С3b.
За первоначальным прикреплением одной молекулы С3b к «защитной» поверхности следует стадия амплификации, в результате которой в том же месте фиксируется много дополнительных молекул С3b. Ключевым моментом для быстрого накопления С3b служит образование мембраносвязанной С3-конвертазы.
Петля усиления - это механизм положительной обратной связи в активации комплемента по альтернативному пути. Связанный с поверхностью С3b присоединяет фактор В. Образовавшийся С3bВ становится субстратом для фактора D — сериновой эстеразы, отщепляющей от фактора В небольшой фрагмент, Ва. Остающийся на поверхности комплекс ![]() весьма быстро диссоциирует, если не будет стабилизирован в результате связывания пропердина (Р) с образованием комплекса
весьма быстро диссоциирует, если не будет стабилизирован в результате связывания пропердина (Р) с образованием комплекса ![]() , представляющего собой связанную с поверхностью С3-конвертазу альтернативного пути.
, представляющего собой связанную с поверхностью С3-конвертазу альтернативного пути.
Комплекс ![]() расщепляет много все новых молекул С3. Поскольку конвертаза локализована на «защитной» поверхности, образующиеся молекулы С3b* будут связываться именно там, а не в каком-либо ином месте (рис. 4.10).
расщепляет много все новых молекул С3. Поскольку конвертаза локализована на «защитной» поверхности, образующиеся молекулы С3b* будут связываться именно там, а не в каком-либо ином месте (рис. 4.10).
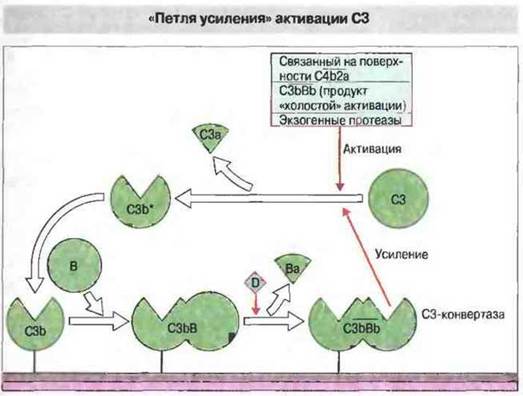
Рис. 4.10. Фрагмент С3b может образовываться по действием С3-конвертазы классического (![]() ) или альтернативного (
) или альтернативного (![]() ) пути. Образовавшийся С3b связывается с фактором В в Мg2+-зависимый комплекс (С3bВ), на который воздействует фактор D. Последний отщепляет от фактора В фрагмент Ва, и комплекс превращается в С3-конвертазу альтернативного пути (
) пути. Образовавшийся С3b связывается с фактором В в Мg2+-зависимый комплекс (С3bВ), на который воздействует фактор D. Последний отщепляет от фактора В фрагмент Ва, и комплекс превращается в С3-конвертазу альтернативного пути (![]() ), которая в свою очередь, действуя на все новые молекулы С3, может дать добавочное количество С3b. Так функционирует механизм положительной обратной связи («петля»), усиливая первоначальную активацию комплемента.
), которая в свою очередь, действуя на все новые молекулы С3, может дать добавочное количество С3b. Так функционирует механизм положительной обратной связи («петля»), усиливая первоначальную активацию комплемента.
Отметим, что петля усиления функционирует и в том случае, когда С3b фиксируется на поверхности в результате классической (зависимой от антител) активации комплемента.
Активацию комплемента по альтернативному пути, включая петлю усиления, контролируют регуляторные белки. Альтернативная активация в жидкой фазе, когда С3b не связан с поверхностью, жестко регулируется белками, подобными или идентичными тем, которые «сдерживают» классическую активацию комплемента. Гомологичный С4-связывающсму белку фактор Н, ген которого входит в кнастер RCA, вызывает диссоциацию ВЬ из его комплексов с C3i или С3b, а также действует в качестве кофактора при катаболизировании C3i и С3b с участием фактора I (рис. 4.11).
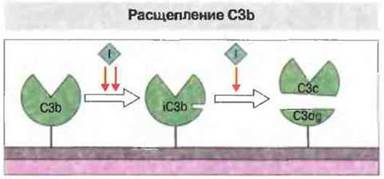
Рис. 4.11. Фактор I расщепляет С3b в трех участках, высвобождая С3с и оставляя связанным с поверхностью C4dg - фрагмент α-цепи С1. Два первых расщепления, дающие промежуточный продукт, iC3b, стимулирует фактор Н, МКБ или CR1. Расщепление в третьем участке стимулируется CR1.
Регуляция механизма усиления чрезвычайно важна для организма. Если она не функционирует, усиление (как циклический процесс, протекающий по принципу положительной обратной связи) идет до полного расщепления всех молекул С3. (Впервые это наблюдали у больного с наследственным дефицитом регуляторного фермента — фактора I. В отсутствие фактора I петля усиления действует вплоть до превращения всех молекул С3 сыворотки больного в С3b.)
На мембранах собственных клеток организма как ФУД, так и CR1 ускоряют диссоциацию комплекса СЗЬВЬ с высвобождением С3b. И CR1, и МКБ действуют как кофакторы расщепления С3bфактором I (см. рис. 4.7). Полностью аналогичным образом ФУД, МКБ и CR1 регулируют активность ![]() (С3-конвертазы классического пути), когда она связана с клеточными мембранами.
(С3-конвертазы классического пути), когда она связана с клеточными мембранами.
Таким образом, судьба связанного на поверхности С3b — это наиболее важный этап в том неспецифическом механизме, с помощью которого система комплемента отличает «свое» от «нe-своего». Для связанного С3b существуют две возможности.
✵ Усиление: С3b связывает фактор В с образованием конвертазы, которая вызывает фиксацию все новых молекул С3b на той же самой поверхности.
✵ Подавление: С3b расщепляется фактором I при участии одного из трех кофакторов: фактора Н (из плазмы), CR1 или МКБ (связанного на поверхности).
Какая из этих возможностей реализуется, зависит от природы поверхности, связавшей С3b (рис. 4.12). Присутствие на аутологичной (в частности, клеточной) поверхности собственных молекул, таких как ФУД, CR1 и МКБ, эффективно ограничивает образование С3-конвсртаз. Напротив, чужеродная поверхность, например мембрана бактериальной клетки, обеспечивает «защиту» для С3b, так как именно на ней фактор В имеет большую аффинность к С3b, чем фактор Н. В результате фиксация всего нескольких молекул С3b приводит к образованию относительно стабильной С3-конвсртазы альтернативного пути — ![]() ферментного комплекса, который вызывает связывание все новых молекул С3b в том же участке.
ферментного комплекса, который вызывает связывание все новых молекул С3b в том же участке.
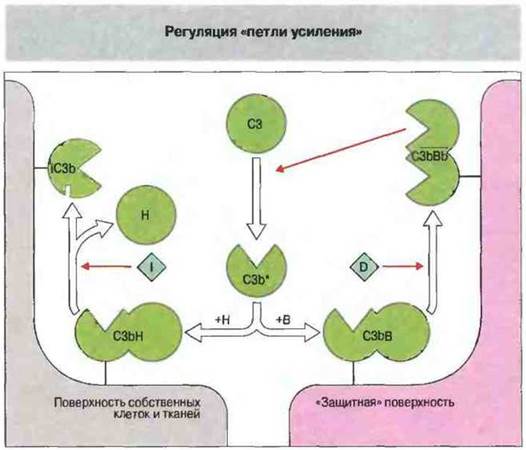
Рис. 4.12. Активация комплемента по альтернативному пути зависит от наличия «защитных» поверхностей, т. е. поверхностей, способных защитить связанный с ними С3b от протеолиза. С фиксированным на такой комллемент активирующей поверхности СЗЬ связывается фактор В; образующаяся в результате С3-конвертаза альтернативного пути ![]() инициирует действие петли усиления. В отличие от этого на поверхности собственных клеток и тканей организма С3b предпочтительно связывает фактор Н и инактивируется фактором I. Следовательно, от связывания фактора В или Н зависит развитие реакций альтернативного пути. Кроме того, на мембране собственных клеток присутствует несколько регуляторных белков, подавляющих активацию комплемента (см. рис. 4.7 и 4.14).
инициирует действие петли усиления. В отличие от этого на поверхности собственных клеток и тканей организма С3b предпочтительно связывает фактор Н и инактивируется фактором I. Следовательно, от связывания фактора В или Н зависит развитие реакций альтернативного пути. Кроме того, на мембране собственных клеток присутствует несколько регуляторных белков, подавляющих активацию комплемента (см. рис. 4.7 и 4.14).
Конечная фаза активации комплемента - это образование лизирующего мембрану комплекса
Каскад реакций активации комплемента завершается образованием литического комплекса (лизируюший, или атакующий, мембрану комплекс, ЛМК) в результате ферментативного расщепления С5 — белка, гомологичного С3 и С4, но нe содержащего внутренней тиоэфирной связи.
Прежде чем подвергнуться расщеплению С5-конвертазой, С5 избирательно связывается с С3b в ее составе. С5-конвертаза классического пути — это трехмолекулярный комплекс, ![]() в котором С3b, ковалентно присоединенный к С4b, обладает более высокой константой связывания с С5, чем С3b, связанный с другими молекулами клеточной поверхности. С5-конвертаза альтернативного пути представляет собой также трехмолекулярный комплекс —
в котором С3b, ковалентно присоединенный к С4b, обладает более высокой константой связывания с С5, чем С3b, связанный с другими молекулами клеточной поверхности. С5-конвертаза альтернативного пути представляет собой также трехмолекулярный комплекс — ![]() в котором один С3b ковалентно связан с другим. При расщеплении С5 высвобождается небольшой пептидный фрагмент С5а — высокоактивный анафилатоксин.
в котором один С3b ковалентно связан с другим. При расщеплении С5 высвобождается небольшой пептидный фрагмент С5а — высокоактивный анафилатоксин.
Лизирующий мембрану комплекс образуется путем неферментативной сборки С56-9. Последующее формирование ЛМК происходит без участия ферментов. Компонент С5b связывается с C6 с образованием С5b6, который взаимодействует с С7, образуя комплекс С5b67 (рис. 4.13). В результате связывания С7 гидрофильный С5b6 превращается в гидрофобный комплекс С5b67, способный преимущественно встраиваться в липидный бислой. К этому комплексу присоединяется С8 и затем последовательно до 14 мономеров С9. В результате формируется литический «зонд», или порообразующая молекула, первые электронные микрофотографии которой получили Хамфри и Дурмашкин (рис. 4.13). Хотя после присоединения С8 к С5b67 комплекс уже проявляет незначительную литическую активность, полное ее развитие зависит от полимеризованного С9. (Отметим, что комплекс С5b6789 обычно обозначают аббревиатурой С5b-9; подобным же образом могут обозначаться и предшествующие продукты сборки, например, С5b-8.)
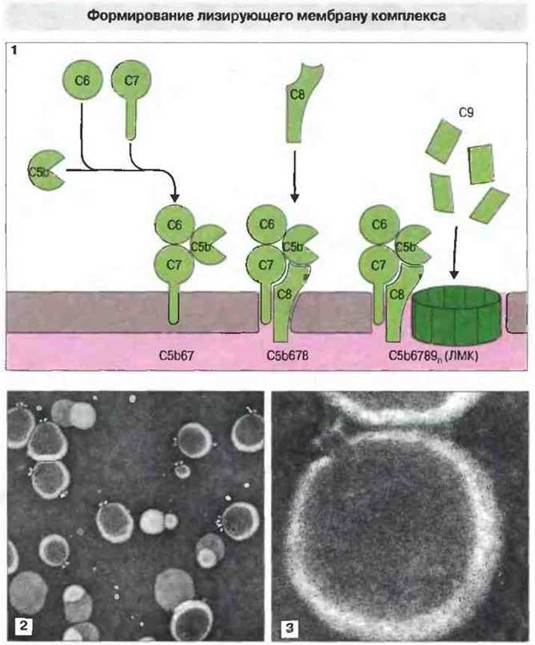
Рис. 4.13. 1. Компонент С5b связывает С6 и С7 с образованием гидрофобного комплекса С5b67, особый участок которого фиксируется на плазматической мембране вблизи локуса активации комплемента. Затем к комплексу присоединяется С8, который проникает через мембрану. После этого в нее встраивается и полимеризуется ряд молекул С9, завершая образование лизирующего мембрану комплекса (ЛМК). 2 и 3. Электронные микрофотографии лизирующего мембрану комплекса. Похожий на воронку канал (3) влецитиновой липосомной мембране, возникший в результате встраивания в нее комплекса С5b-9 человека, х 234 000. (Фото любезно предоставлены проф. J. Tranum-Jensen и д-ром S. Bhakdi.)
Полимеризация гидрофобных молекул для образования пор в мембране — это обычный механизм клеточной цитотоксичности. Т-лимфоциты поражают клетки-мишени, погружая в их мембрану порообразуюшие молекулы, названные перфоринами (см. гл. 9). Перфорины структурно гомологичны С9; подобные же молекулы найдены в гранулах эозинофилов (катионные белки эозинофилов). Некоторые бактериальные токсины, например стрептолизин О, также представляют собой порообразуюшие молекулы.
Образование лизирующего мембрану комплекса регулируется для сдерживания «реактивного лизиса»
Сформированный гидрофобный комплекс С5b67 способен самопроизвольно внедряться в мембраны других клеток, расположенных вблизи от клеточной поверхности, где происходит первичная активация комплемента. Этот процесс «реактивного лизиса» в отсутствие регуляции способен принести вред собственным тканям организма.
Комплекс С5b67 может быть инактивирован а жидкой фазе. Ряд белков может угнетать «реактивный лизис» путем связывания с С5b67 в жидкой фазе, прежде чем произойдет его фиксация на мембранах собственных клеток организма. Из таких белков в плазме крови в наибольшей концентрации содержится S-белок, или витронектин. Образуемый им комплекс SC5667 лишен способности внедряться в двойной липидный слой; такая способность отсутствует также и у комплекса С5b678, поскольку он связывается с липопротеинами низкой плотности (ЛПНП), если присоединение С8 к С5b67 происходит в жидкой фазе.
Мембрана клеток организма-хозяина содержит белки, защищающие ее от лизиса под действием ЛМК. Эритроциты, как в свое время было установлено, легко лизируются гетерологичным комплементом и труднее — гомологичным. Основа такой видовой рестрикции стала понятной после открытия особых мембранных белков, которые защищают клетки собственного организма от лизиса под действием ЛМК. Два таких белка уже подробно изучены.
Первый из них — это CD59, заякоренный гликофосфолипидной «ножкой» в мембранах многих клеток белок. Он связывается с С8 в составе комплекса С5b-8 и подавляет погружение и развертывание С9 в клеточной мембране (рис. 4.14).
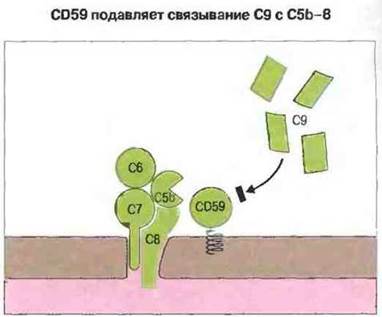
Рис. 4.14. Белок CD59, связываясь с С8 в составе комплекса С5b-8, блокирует присоединение С9 и тем самым - формирование ЛМК.
Второй белок — фактор гомологичной рестрикции (ФГР), проявляющий ту же активность, что и CD59, но при этом более слабый ингибитор внедрения в мембрану С9. ФГР (мол. масса 65 кДа) также связан с мембраной гликофосфолипидом; его аминокислотная последовательность пока не установлена.
Примечательно, что клетки, имеющие ядро, в частности клетки собственной иммунной системы организма, более эритроцитов устойчивы к комплемент-зависимому лизису благодаря способности активно удалять ЛМК путем эндоцитоза и экзоцитоза тех фрагментов мембраны, в которые он проник.