ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 4. Комплемент
РЕЦЕПТОРЫ КОМПЛЕМЕНТА
Многие образующиеся в процессе активации фрагменты белков комплемента взаимодействуют со специфическими рецепторами на поверхности клеток иммунной системы. Благодаря этому реализуются физиологические эффекты комплемента, в том числе фагоцитоз опсонизированных им частиц и активация обладающих такими рецепторами клеток.
Известно четыре типа рецепторов, ковалентно связывающих фрагменты СЗ
Три субкомпонента С3 (иногда называемых оп- сонизирующими фрагментами) — С3b, iC3b и C3dg - связываются с мембранами клеток-мишеней. Для них на поверхности клеток имеется четыре типа рецепторов, названных рецепторами комплемента 1, 2, 3 и 4 типов (CR1, CR2, CR3 и CR4); их клеточное распределение и лиганды представлены на рис. 4.15.

Рис. 4.15. Клеточные рецепторы для фрагментов С3. Рецептор CR1 связывает С3b прочнее, чем iC3b. Эти рецепторы позволяют клеткам поглощать частицы или иммунные комплексы, предварительно связавшиеся с соответствующим фрагментом С3.
CR1 в качестве рецептора для С3b и iС3b физиологически многофункционален. Первой реакцией, классифицированной как комплемент-зависимое клеточное связывание, был феномен, названный позже иммуноадгезией. В этой реакции трипаносомы или другие микробы, опсонизированные антителами и комплементом, прилипают к тромбоцитам грызунов или к эритроцитам приматов.
Иммуноадгезия происходит при участии CR1 (называемого также рецептором иммуноадгезии, рецептором С3b/С4b или CD35). Предполагается, что он предназначен для выполнения следующих четырех физиологических функций:
✵ участие в эндоцитозе или фагоцитозе в качестве рецептора (к опсонизирующим фрагментам С3) на нейтрофилах, моноцитах и макрофагах, примированных (подготовленных) соответствующим образом (рис. 4.16);
✵ участие в качестве кофактора в расщеплении С3b и iC3b фактором I до С3с и C3dg; при расщеплении С3b до iC3b фактор Н как кофактор, видимо, важнее CR1, но последний, вероятно, служит единственным кофактором дальнейшего расщепления iC3b и в этой своей роли защищает собственные клетки организма от лизиса комплементом;
✵ «вылавливание» из плазмы опсонизированных комплементом иммунных комплексов или бактерий и доставка их к фиксированным мононуклеарным фагоцитам (рис. 4.17); для выполнения этой функции CR1 экспрессирован на эритроцитах или тромбоцитах (в зависимости от вида);
✵ участие в качестве рецептора вместе с CR2 в активации комплементом В-лимфоцитов.
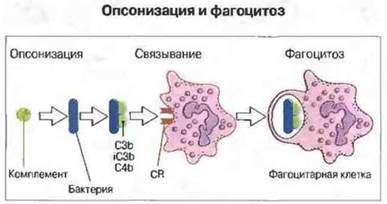
Рис. 4.16. Этапы поглощения частицы на примере микробной клетки, опсонизированной С3b или С4b.
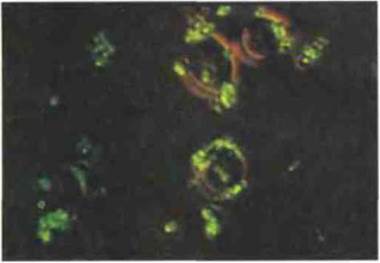
Рис. 4.17. Иммуноадгезия. На этой микрофотографии видны опсонизированные антителами и комплементом бактерии (окраска флуоресцеином) на поверхности эритроцитов человека. Адгезия обусловлена связыванием фиксированных на бактериях С3b, iC3b и С4b с эритроцитарным CR1. (Фото любезно предоставлено проф. G.D. Ross.)
Рецептор CR2 участвует в активации В-лимфоцитов, а также связывает вирус Эпштейна-Барр. Рецептор CR2 (CD21), экспрессируемый В-лимфоцитами, фолликулярными ветвистыми (дендритными) клетками и эпителиальными клетками определенного типа, связывает iC3b, C3dg, ИФа и вирус Эпштейна-Барр (ВЭБ). На В-клетках CR2, по-видимому, функционирует как вспомогательный рецептор при специфическом иммунном ответе. Связывание с ним iC3b или C3dg снижает порог сигнала для активации В-клеток, происходящей в результате связывания антигена с их антигенеcпецифичными рецепторами (мембраносвязанные антитела). Иммунные комплексы, в которых антитела и субкомпоненты комплемента образуют перекрестные связи с антигеном, гораздо эффективнее активируют В-клетки, чем сам по себе антиген.
Главная физиологическая активность CR2, связанная с цитопатоло1ией, состоит в том, что он служит рецептором для ВЭБ. Распределение вируса по тканям in vivo соответствует локализации клеток, несущих CR2; вероятно, ВЭБ проникает в клетки, связываясь с CR2 без участия комплемента.
CR3 и CR4 относятся к суперсемейству лейкоцитарных β2-интегринов - молекул межклеточной адгезии. Лейкоцитарные ннтегрины — это гетеродимеры, образованные общей β-цепью (CD18) и одной из трех различных α-цепей (CD11a, CD11b или CD11с). Интегрин CD18/11a известен как LFA-1 - функциональный лимфоцитарный антиген 1 типа, интегрин CD18/11b называют также CR3, а CD18/11с - CR4 (он известен и как р150, 95).
Интегрины, к которым относятся три указанные молекулы, образуют суперсемейство структурно родственных, локализованных на клеточной поверхности рецепторов и молекул адгезии. В него входят, например, рецепторы к фиброиектину и витронектину (S-белку), а также тромбоцитарный рецептор для фибриногена. Связывание этих рецепторов с их лигандами зависит от кальция.
CR3 (CD18/11b) - присутствует на клетках миелоидного ряда и служит важным рецептором и молекулой межклеточной адгезии. Этот белок опосредует фагоцитоз частиц, опсонизированных iC3b. и функционирует, кроме того, как лектин, способный связывать некоторые углеводы. Ряд видов дрожжей, включая Saccharomyces cerevisiae, непосредственно связывается с CR3 без участия комплемента, как и другие микробы, например Staphilococcus epidermidis и Histoplasma capsulatum. Другими лигандами для CR3 служат фибриноген, гемокоагуляционный фактор X и молекула межклеточной адгезии I.
CR4(p150-95, CD18/11c) — наименее изученный рецептор данной группы. Установлено, однако, что в присутствии Са2+ он связывает iC3b. Кроме того, известно, что этот интегрин связывается с фибриногеном и участвует в прилипании моноцитов и нейтрофилов к эндотелию. Он присутствует на клетках как миелоидного, так и лимфоидного ряда и обильно экспрессирован на поверхности тканевых макрофагов, где функционирует, по-видимому, как необходимый рецептор для частиц. опсонизированных iC3b.
Клеточные рецепторы для субкомпонентов С3а и С5а относятся к родопсиновому суперсемейству рецепторов, связывающих G-белок
Мелкие фрагменты белков комплемента. С3а и С5а, называемые анафилатоксинами, способны запускать дегрануляиию тучных клеток. Они действуют, связываясь со специфическими рецепторами, которые имеются на всех клетках миелоидного ряда (нейтрофилах, эозинофилах, базофилах и тучных клетках, моноцитах и макрофагах).
Рецепторы к С3а и С5а входят в родопсиновое суперсемейство рецепторов, связывающих G-белки. Для этих рецепторов характерна извитая структура с семью гидрофобными трансмембранными доменами, гомологичная структуре некоторых рецепторов, опосредующих хемотаксические сигналы, в том числе N-формилметионинового рецептора (f-met-Ieu-phe), связывающего бактериальные пептиды, и рецепторов для хемокинов - ИЛ-8 и RANTES1.
Связанный с рецептором С5а подвергается поглощению клеткой и расщеплению на неактивные пептидные фрагменты; в этом состоит важный механизм регуляции и ограничения активности анафилатоксина.
Другие рецепторы комплемента связываются с коллектинами
Среди клеточных рецепторов идентифицирован мембранный белок с мол. массой 70 кДа, связывающий коллагеноподобную часть молекулы C1q (рис. 4.4) и другие молекулы из семейства коллектинов, например маннан-связываюший лектин (МСЛ). Этот рецептор обнаружен на полиморфноядерных гранулоцитах, моноцитах, макрофагах, В-клетках, тромбоцитах и эндотелии. Его физиологическая функция неясна, но, по всей вероятности, он может способствовать поглощению иммунных комплексов, опсонизированных C1q, или бактерий, нагруженных МСЛ.
1RANTES — Regulated on Activation, Normal T-cell Expressed and Secreted - хемокин, выделяемый неимунными T-клетка ми при активации; мол. масса 7,8-8.7 кДа; хемоаттрактант для моноцитов и Т- клеток фенотипа CD4+/CD45RO+. — Прим, перев.