ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 5. Миграция клеток и воспаление
ВОСПАЛЕНИЕ
Воспаление это реакция организма на внедрение инфицирующего агента, введение антигена или физическое повреждение тканей. Помимо усиления клеточной миграции, описанного выше, воспаление вызывает приток различных растворимых молекул из плазмы крови. В противоположность лейкоцитам, которые мигрируют через эндотелий венул, молекулы плазмы крови попадают в воспалительный экссудат главным образом из капилляров, где кровяное давление выше. Этот процесс обеспечивается двумя механизмами:
✵ усилением кровенаполнения капилляров в области воспаления и
✵ увеличением проницаемости капилляров.
Проницаемость капилляров повышается вследствие втягивания (ретракции) клеток эндотелия и, возможно, также усиления транспорта везикул сквозь эндотелий. Это обеспечивает поступление в очаг воспаления более крупных молекул, чем те, которые обычно могут проникать сквозь эпителий. Таким образом в очаг воспаления поступают антитела, компоненты комплемента и другие ферментные системы плазмы крови.
Воспаление регулируется хемокинами, ферментными системами плазмы, цитокинами, а также продуктами метаболизма тучных клеток, тромбоцитов и лейкоцитов
Развитие воспалительного процесса происходит при участии 1) хемокинов, 2) продуктов активации ферментных систем плазмы и 3) вазоактивных медиаторов, выделяемых лейкоцитами (рис. 5.13). Воспалительные реакции разного типа регулируются различными медиаторами. Немедленный ответ зависит от быстродействующих вазоактивных аминов и продуктов кининовой системы (см. ниже). Позднее привлечение и активация лейкоцитов происходят под действием вновь синтезированных медиаторов, таких как лейкотриены.
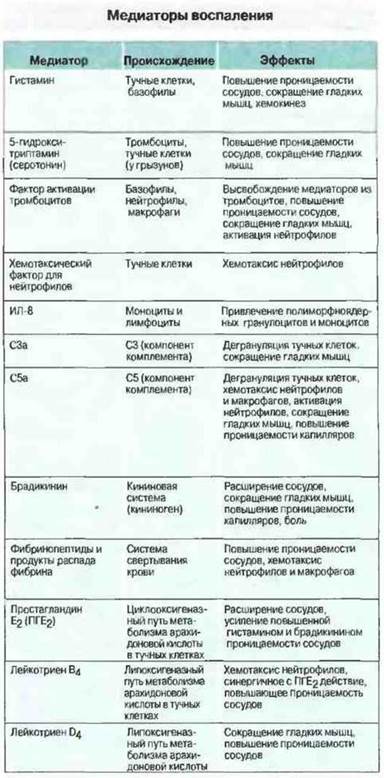
Рис. 5.13. Основные медиаторы воспаления, регулирующие кровенаполнение и проницаемость сосудов или миграцию лейкоцитов.
Достигая очага инфекции или воспаления, лейкоциты ранней волны миграции выделяют медиаторы, которые обеспечивают дальнейшее накопление и активацию клеток. Однако роль главного регулятора воспалительных реакций, инициированных иммунной системой, как и иммунного ответа вообще, принадлежит самому антигену. Поэтому очаг хронической инфекции или аутоиммунных реакций (где антиген не удается устранить окончательно) существенно отличается по клеточному составу инфильтрата от очагов воспаления, быстро освобождаемых от антигена.
Ферментные системы плазмы. Существенная роль в гемостазе и регуляции воспаления принадлежит четырем главным ферментным системам плазмы крови: системе свертывания, системе фибринолиза (плазминовая система), системе кининов и системе комплемента. Система комплемента опосредует многообразные взаимодействия между иммунным ответом и воспалением (см. гл. 4). К хининовой системе относятся медиаторы брадикинин и лизилбрадикинин (каллидин). Брадикинин — это функционально весьма сильный вазоактивный нонапептид, вызывающий увеличение просвета венул и сосудистой проницаемости, а также сокращение гладких мышц. Он образуется в результате активации фактора Хагемана (XII), относящегося к системе свертывания крови, тогда как для образования каллидина необходимы активация плазминовой системы или участие ферментов, выделяемых поврежденными тканями.
Вспомогательные клетки воспаления. К ним относятся тучные клетки, базофилы и тромбоциты; все эти клетки служат важным источником вазоактивных медиаторов - гистамина и 5-гидрокситринтамина (серотонина), вызывающих вазодилатацию и увеличение проницаемости сосудов. Многие из провоспалительных эффектов С3а и С5а обусловлены их способностью вызывать высвобождение содержимого гранул из тучных клеток. Об этом свидетельствует факт подавления данных эффектов антигистамимными препаратами. Кроме того, тучные клетки и базофилы могут стать непосредственной причиной воспаления, вызванного специфическим иммунным ответом, так как IgE сенсибилизирует их для дегрануляции при встрече с антигеном. Взаимодействие между механизмами приобретенного иммунитета и воспаления схематично представлено на рис. 5.14. Тучные клетки служат также важным источником медленнореагирующих медиаторов воспаления, в том числе лейкотриенов, простагландинов и тромбоксанов (см. гл. 23). Тромбоциты, как и тучные клетки, могут быть активированы продуктами иммунной системы иммунными комплексами или фактором активации тромбоцитов, выделяемым нейтрофилами, базофилами и макрофагами. Предполагается, что этот механизм важен в реакциях гиперчувствительности II и III типов.
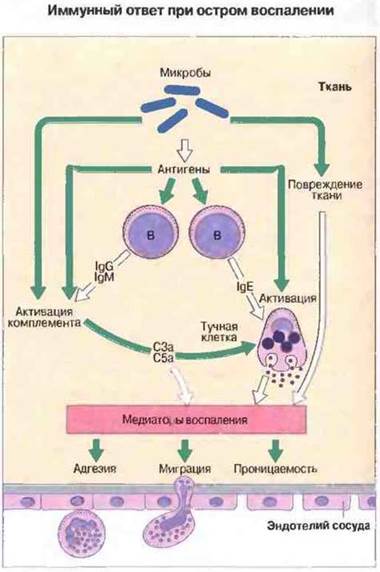
Рис. 5.14. Приобретенный иммунитет влияет на воспалительные процессы через систему комплемента. Антигены (например, микробного происхождения) стимулируют В-клетки для продукции антител, в том числе IgE, связывающихся с тучными клетками, а также IgG и IgM, активирующих комплемент. Кроме того, комплемент может активироваться и без участия антител (в частности, микробами) по альтернативному пути. Сенсибилизированные антителами тучные клетки, встретившись с антигеном, выделяют из своих гранул медиаторы и эйкозаноиды (продукты метаболизма арахидоновой кислоты, такие как простатландины и лейкотриены). Вместе с комплементом (который непосредственно своими субкомпонентами С3а и С5а может вызывать дегрануляцию тучных клеток) эти медиаторы индуцируют ограниченный очаг воспаления, способствуя накоплению в нем лейкоцитов и продуктов активации ферментных систем плазмы.
Цитокины. Подобно другим медиаторам, цитокины служат для межклеточной сигнализации при развитии воспалительного процесса. На его начальных стадиях местные тканевые клетки могут выделять такие цитокины, как ИЛ-1 и ИЛ-6. Как только в очаге воспаления появляются лимфоциты и мононуклеарные фагоциты, они могут, активируясь под действием антигена, выделять свои собственные цитокины (ИЛ-1, ФНО, ИЛ-4, ИФγ), которые, воздействуя на эндотелий местных сосудов, дополнительно усиливают клеточную миграцию. Другие цитокины, например ИЛ-8, могут оказывать хемотаксическое или активирующее действие на прибывающие клетки.
Вопросы для размышления
■ Если бы вы смогли удалить из генома лабораторной мыши ген, кодирующий VCAM-1, какое действие это оказало бы на миграцию лимфоцитов и нейтрофилов?
■ Если в пластырную основу добавить очищенный С5а, как это повлияет на циркуляцию лейкоцитов, кровоток и сосудистую проницаемость в месте наложения такого пластыря? Каков будет механизм вызванных эффектов?
■ Лекарственное средство индометацин подавляет образование простагландинов и лейкотриенов. Какое, по-вашему, действие оно оказывает на воспалительный процесс и за счет какого механизма?
■ Вы исследуете процессы хронического отторжения почечных аллотрансплантатов. Какие из следующих молекул адгезии целесообразно выявлять на клетках эндотелия: Р-селектин, Е-селектин, VLA-4, ICAM-1, ICAM-2, LFA-1, MAdCAM-1, и почему?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Baggiolini М , Dewald Р., Moser В. 1977. Human chemokines: ал update. Annu. Rev. Immunol. 15: 675-705
Davies P., Bailey P.J., Goldenberg M.M. et al. 1984. The role of arachidonic acid oxygenation products in pain and inflammation. Annu. Rev Immunol. 2. 335-358.
Ebnet K., Kaldjian E.P., Anderson A.О et al. 1996. Orchestrated information transfer underlying leukocyte endothelial interactions. Annu. Rev. Immunol. 14: 155-177.
Hemler M.E. 1990. VLA proteins in the integnn family: structures, functions and their role on leucocytes. Annu. Rev. Immunol. 8: 365-400.
Hynes R.O. 1992. Integrins: versatility, modulation and signalling in cell adhesioin. Cell 69: 11-25.
Lub M., van Kooyk Y., Figdor C.G. 1996. Ins and outs of LFA-1. Immunol. Today 16: 479-483.
Male D К. 1996. Cell traffic and inflammation. In: Male D.K., Cooke A., Owen M., Trowsdale J., Champion B.R. (eds). Advanced Immunology. 3rd edn. London: Mosby.
Proud D., Kaplan A P 1988. Kinin formatiion: mechanism and role in inflammatory disorders. Annu. Ref. Immunol. 6: 49-83.
Shimizu Y., Newman W., Gopal T.V. etal. 1991. Four molecular pathways of T cell adhesion to endothelial cells. Roles of LFA-1, VCAM-1 and ELAM-1 and changes of pathway hierarchy under different activatiion conditions. J. Cell. Biol. 113: 1203-1212.
Springer T.A. 1990. Adhesion receptors in the immune system. Nature 346: 425-434.
Springer T.A. 1994. Traffic signals for lymphocyte recirculation and leycocyte emigration: the multistep paradigm. Cell 76: 301-314.